【考点突破】第二章第1课时 活泼的金属单质——钠-2024~2025学年高一化学同步课件(共28张PPT)(人教版2019必修第一册)
文档属性
| 名称 | 【考点突破】第二章第1课时 活泼的金属单质——钠-2024~2025学年高一化学同步课件(共28张PPT)(人教版2019必修第一册) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-22 00:00:00 | ||
图片预览







文档简介
(共28张PPT)
第一节 钠及其化合物
第二章 海水中的重要元素——钠和氯
第1课时 活泼的金属单质——钠
钠的性质
01
课堂练习
02
巩固提升
03
考点 · 突破
Exam Points
Breakthrough
EPB
考点突破
01
钠的性质
【问题探究】
【情境】
1.实验探究钠与氧气的反应
实验操作
实验现象 新切开的钠的切面具有银白色金属光泽,切面很快变 钠先 ,然后 ,火焰呈 ,最后生成 固体
实验结论 常温下钠易与氧气反应生成白色的 加热或点燃条件下,钠与氧气反应生成
化学方程式 4Na+O2===2Na2O 2Na+O2 Na2O2
暗
熔化为光亮的小球
剧烈燃烧
黄色
淡黄色
氧化钠
过氧化钠
(1)上述金属钠与氧气反应的探究过程,用到的研究方法是__________、__________、__________。
【答案】 观察法 实验法 比较法
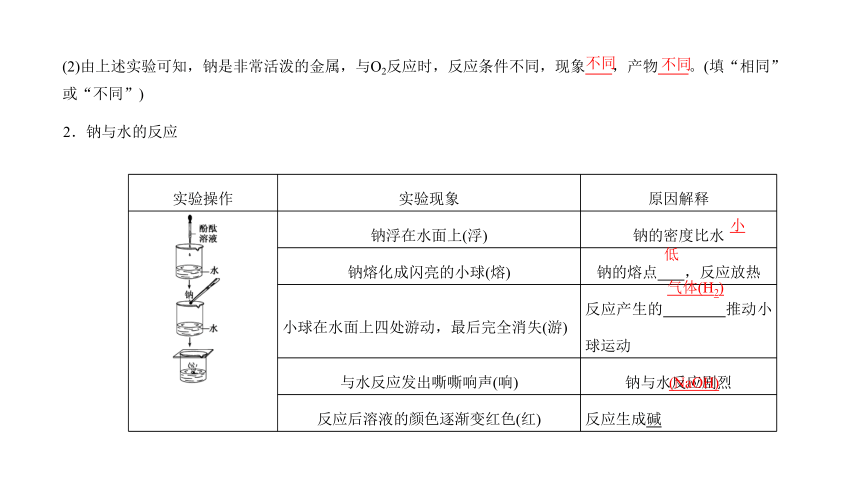
(2)由上述实验可知,钠是非常活泼的金属,与O2反应时,反应条件不同,现象 ,产物 。(填“相同”或“不同”)
不同
不同
2.钠与水的反应
实验操作 实验现象 原因解释
钠浮在水面上(浮) 钠的密度比水
钠熔化成闪亮的小球(熔) 钠的熔点 ,反应放热
小球在水面上四处游动,最后完全消失(游) 反应产生的 推动小球运动
与水反应发出嘶嘶响声(响) 钠与水反应剧烈
反应后溶液的颜色逐渐变红色(红) 反应生成碱
小
低
气体(H2)
(NaOH)
实验结论:
(1)钠与水剧烈反应生成NaOH和H2,反应中氧化剂是 ,还原剂是 ,反应的实质是钠与水电离出的H+反应。
H2O
Na
(2)反应方程式
①化学方程式: ;
②离子方程式: 。
2Na+2H2O===2NaOH+H2↑
2Na+2H2O===2Na++2OH-+H2↑
【问题探究】
1.实验室里,为什么要把钠保存在石蜡油或煤油中?钠着火时,能否用水灭火?若不能,应用什么灭火?
【解析】用煤油或石蜡油隔绝空气,防止钠与空气中的O2、H2O反应;不能用水灭火,原因是钠与水反应产生H2,用水灭火易发生爆炸,应用干燥的沙土盖灭。
2.钠能否从CuSO4溶液中置换出单质铜?写出钠与CuSO4溶液反应的化学方程式。
【解析】不能;因为Na先与溶液中的水反应生成NaOH和H2,生成的NaOH再与CuSO4反应生成Cu(OH)2沉淀,反应的化学方程式为2Na+CuSO4+2H2O===Cu(OH)2↓+Na2SO4+H2↑。
归纳总结
3.钠极易与O2、H2O等发生反应,表现出很强的还原性,试从原子结构的角度加以解释。
【解析】Na的原子结构示意图为 ,最外层只有1个电子,在化学反应中该电子很容易失去,形成的Na+最外层有8个电子是稳定结构,故Na表现出很强的还原性。
1.钠与非金属单质的反应
2.钠与水、酸及盐溶液的反应规律
(1)钠与水的反应
离子方程式:2Na+2H2O===2Na++2OH-+H2↑,还原剂:Na,氧化剂:H2O。
(2)钠与酸溶液的反应
(3)钠与盐溶液的反应
在没有H2O存在时,在一定条件下,Na与盐反应也可以置换出某些盐;在无水时,
4Na+TiCl4 Ti+4NaCl。
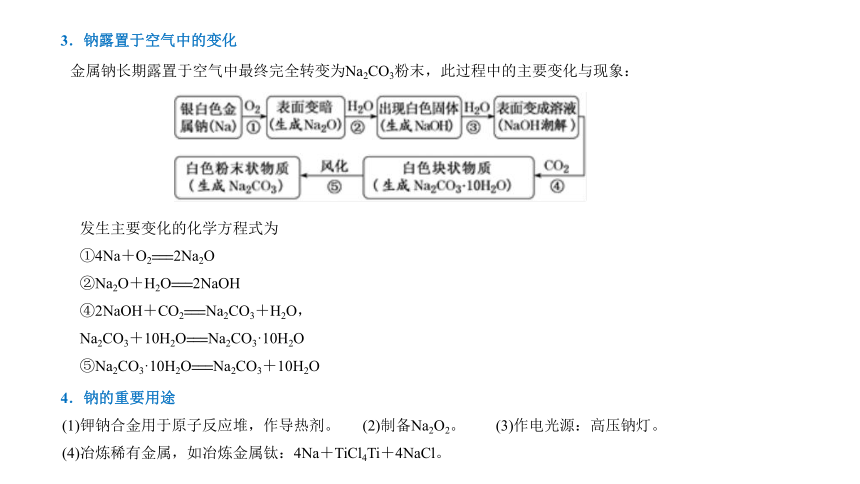
3.钠露置于空气中的变化
金属钠长期露置于空气中最终完全转变为Na2CO3粉末,此过程中的主要变化与现象:
发生主要变化的化学方程式为
①4Na+O2===2Na2O
②Na2O+H2O===2NaOH
④2NaOH+CO2===Na2CO3+H2O,
Na2CO3+10H2O===Na2CO3·10H2O
⑤Na2CO3·10H2O===Na2CO3+10H2O
4.钠的重要用途
(1)钾钠合金用于原子反应堆,作导热剂。 (2)制备Na2O2。 (3)作电光源:高压钠灯。
(4)冶炼稀有金属,如冶炼金属钛:4Na+TiCl4Ti+4NaCl。
课堂练习
1.英国化学家汉弗里·戴维在十九世纪初通过电解的方式获得金属钠的单质。下面关于金属钠的描述正确的是
A.少量钠应保存在水中
B.钠离子性质很活泼
C.钠很软,在新材料领域没有用途
D.钠的化学性质很活泼,在自然界里不能以游离态存在
【答案】D
【解析】A.钠很活泼能与氧气和水反应,所以少量钠应保存在煤油中,故A错误;
B.钠原子最外层一个电子,易失去,所以钠原子具有较强的还原性,而钠离子只能得电子,具有弱氧化性,故B错误;
C.钠的导电和导热性较好,在新材料领域有用途,故C错误;
D.钠与氧气、水等都能发生剧烈反应,性质活泼,在自然界里不能以游离态存在,故D正确;
故答案选D。
2.下列变化属于物理变化的是
A.将金属钠和金属钾混合研磨得到液体
B.刚切开的金属钠放置在空气中变暗
C.刚切开的金属钠放置在空气中加热变成淡黄色
D.一小块钠投入水中熔成光亮的小球
【答案】A
【解析】
A.将金属钠和金属钾混合研磨得到液体,过程为物理变化,A正确;
B.刚切开的金属钠放置在空气中变暗,是因为钠和氧气反应生成氧化钠,属于化学变化,B错误;
C.刚切开的金属钠放置在空气中加热变成淡黄色固体,是钠和氧气反应生成过氧化钠,属于化学变化,C错误;
D.一小块钠投入到水中熔成闪亮的小球,是钠和水反应过程中放热导致钠熔成液态小球,属于化学变化,D错误;
故选A。
A.Na在石灰水与苯的界面处反应,并上下跳动
B.Na燃烧,最终消失
C.澄清石灰水变浑浊
D.苯层可观察到有气泡产生
【答案】B
【分析】Na与澄清石灰水反应的实质是与氢氧化钙溶液中的水反应,据此分析。
【解析】A.由于密度ρ(苯)<ρ(Na)<ρ(澄清石灰水),所以金属Na在澄清石灰水与苯的界面处与溶液中的水反应产生H2,氢气气体使Na受到的浮力增大,钠块上升,后又下落界面处的石灰水溶液中进一步与水反应,钠块上下跳动直至消失,A正确;
B.由于苯隔离空气,因此Na不会燃烧,B错误;
C.由于Na与水反应放热,氢氧化钙溶解度随温度升高而降低,因此澄清石灰水变浑浊,C正确;
D.根据B选项,可知D正确;
故选B。
EPB
考点突破
02
巩固提升
01
练习与应用
1.下列关于钠的叙述中不正确的是
A.密度比水小 B.保存在煤油中
C.具有氧化性 D.钠与水反应放热且钠的熔点低
【答案】C
【解析】A.钠密度比水小,故A正确;
B.钠易与O2和H2O反应,应保存在煤油中,故B正确;
C.钠只具有还原性,不具有氧化性,故C错误;
D.钠与水反应放热且钠的熔点低,故D正确;
故选C。
练习与应用
02
2.下表中,对陈述Ⅰ、Ⅱ 的正确性及两者间是否具有因果关系的判断都正确的是
选项 陈述Ⅰ 陈述Ⅱ 判断
A 钠与水接触,熔成小球 钠与水反应是放热反应, 钠的熔点较低 Ⅰ对,Ⅱ对,有
B 钠放入水中,浮在液面上 钠与水反应生成气体 Ⅰ对,Ⅱ错,无
C 金属钠具有强还原性 高压钠灯产生透雾性强的黄光 Ⅰ对,Ⅱ对,有
D 金属钠质软可以用刀切 钠钾合金可以做原子反应堆的导热剂 Ⅰ对,Ⅱ对,有
练习与应用
02
【答案】A
【解析】A.钠与水反应是放热反应,钠的熔点较低,所以钠与水接触,熔成小球,故选A;
B.钠放入水中,浮在液面上,是因为钠的密度比水小,故不选B;
C.高压钠灯产生透雾性强的黄光,是因为钠的焰色为黄色,与金属钠具有强还原性无关,故不选C;
D.钠钾合金可以做原子反应堆的导热剂,与金属钠质软可以用刀切无关,故不选D;
选A。
03
练习与应用
03
练习与应用
【答案】C
【解析】在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成,说明熔融的钠将硫酸铜中的铜置换出来并且放出热量,属于置换反应,钠作还原剂,硫酸铜作氧化剂;
A.根据以上分析,熔融的钠将硫酸铜中的铜置换出来并且放出热量,属于置换反应,故A正确;
B.钠稍稍加热即熔化,说明金属钠的熔点较低,故B正确;
C.上述反应中,钠作还原剂,硫酸铜作氧化剂;故C错误;
D.根据以上分析,在无水条件下,Na可以与CuSO4反应并生成Cu,故D正确;
答案选C。
练习与应用
04
4.将绿豆大的钠块投入如图所示的烧杯中,可能出现的现象是
练习与应用
04
【答案】D
【解析】钠密度大于煤油的密度,小于水和四氯化碳的密度,钠与水反应生成氢气和氢氧化钠,放出大量的热,所以将绿豆大的钠块投入如图所示的烧杯中,钠块会熔化,产生的氢气使钠块在水层和煤油层界面处游动并上下跳动四处游动并上下跳动,故选:D。
答案选D。
练习与应用
05
【答案】D
【分析】钠露置于空气中,首先与空气中的氧气反应生成氧化钠,氧化钠与水反应生成氢氧化钠,氢氧化钠与二氧化碳作用生成碳酸钠。
【解析】A.银白色变暗是因为钠与空气中的氧气反应生成了氧化钠,A不正确;
B.过程④中氢氧化钠与二氧化碳反应生成碳酸钠,后来发生晶体的风化,发生了化学变化, B不正确;
C.最后得到的白色固体是Na2CO3, C不正确;
D.出现液滴是因为NaOH发生潮解,在其表面形成溶液,D正确;
故选D。
练习与应用
06
6.将金属钠放入盛有下列溶液的小烧杯中,既有气体,又有白色沉淀产生的是
①MgSO4溶液 ②H2SO4溶液 ③Na2SO4溶液 ④饱和澄清石灰水 ⑤Ca(HCO3)2溶液 ⑥CuSO4溶液 ⑦饱和NaCl溶液
A.①②④⑤ B.①④⑤⑦ C.①④⑤ D.①④⑤⑥⑦
07
练习与应用
7.金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年实现了电解氯化钠制钠的工业方法,其反应原理是2NaCl(熔融)2Na+Cl2↑。回答下列问题:
(1)保存金属钠的正确方法是________(填字母)。
A.放在棕色瓶中 B.放在细沙中
C.放在水中 D.放在煤油中
(2)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应(如图所示),请写出该反应的化学方程式:____________________________,生成物的颜色为________。
(3)Na、NaOH久置在空气中最终都是变为________(填化学式)。
(4)将一小块金属钠投入CuCl2溶液中,发生反应的化学方程式为_____________________________________________。
07
练习与应用
THANK YOU
第一节 钠及其化合物
第二章 海水中的重要元素——钠和氯
第1课时 活泼的金属单质——钠
钠的性质
01
课堂练习
02
巩固提升
03
考点 · 突破
Exam Points
Breakthrough
EPB
考点突破
01
钠的性质
【问题探究】
【情境】
1.实验探究钠与氧气的反应
实验操作
实验现象 新切开的钠的切面具有银白色金属光泽,切面很快变 钠先 ,然后 ,火焰呈 ,最后生成 固体
实验结论 常温下钠易与氧气反应生成白色的 加热或点燃条件下,钠与氧气反应生成
化学方程式 4Na+O2===2Na2O 2Na+O2 Na2O2
暗
熔化为光亮的小球
剧烈燃烧
黄色
淡黄色
氧化钠
过氧化钠
(1)上述金属钠与氧气反应的探究过程,用到的研究方法是__________、__________、__________。
【答案】 观察法 实验法 比较法
(2)由上述实验可知,钠是非常活泼的金属,与O2反应时,反应条件不同,现象 ,产物 。(填“相同”或“不同”)
不同
不同
2.钠与水的反应
实验操作 实验现象 原因解释
钠浮在水面上(浮) 钠的密度比水
钠熔化成闪亮的小球(熔) 钠的熔点 ,反应放热
小球在水面上四处游动,最后完全消失(游) 反应产生的 推动小球运动
与水反应发出嘶嘶响声(响) 钠与水反应剧烈
反应后溶液的颜色逐渐变红色(红) 反应生成碱
小
低
气体(H2)
(NaOH)
实验结论:
(1)钠与水剧烈反应生成NaOH和H2,反应中氧化剂是 ,还原剂是 ,反应的实质是钠与水电离出的H+反应。
H2O
Na
(2)反应方程式
①化学方程式: ;
②离子方程式: 。
2Na+2H2O===2NaOH+H2↑
2Na+2H2O===2Na++2OH-+H2↑
【问题探究】
1.实验室里,为什么要把钠保存在石蜡油或煤油中?钠着火时,能否用水灭火?若不能,应用什么灭火?
【解析】用煤油或石蜡油隔绝空气,防止钠与空气中的O2、H2O反应;不能用水灭火,原因是钠与水反应产生H2,用水灭火易发生爆炸,应用干燥的沙土盖灭。
2.钠能否从CuSO4溶液中置换出单质铜?写出钠与CuSO4溶液反应的化学方程式。
【解析】不能;因为Na先与溶液中的水反应生成NaOH和H2,生成的NaOH再与CuSO4反应生成Cu(OH)2沉淀,反应的化学方程式为2Na+CuSO4+2H2O===Cu(OH)2↓+Na2SO4+H2↑。
归纳总结
3.钠极易与O2、H2O等发生反应,表现出很强的还原性,试从原子结构的角度加以解释。
【解析】Na的原子结构示意图为 ,最外层只有1个电子,在化学反应中该电子很容易失去,形成的Na+最外层有8个电子是稳定结构,故Na表现出很强的还原性。
1.钠与非金属单质的反应
2.钠与水、酸及盐溶液的反应规律
(1)钠与水的反应
离子方程式:2Na+2H2O===2Na++2OH-+H2↑,还原剂:Na,氧化剂:H2O。
(2)钠与酸溶液的反应
(3)钠与盐溶液的反应
在没有H2O存在时,在一定条件下,Na与盐反应也可以置换出某些盐;在无水时,
4Na+TiCl4 Ti+4NaCl。
3.钠露置于空气中的变化
金属钠长期露置于空气中最终完全转变为Na2CO3粉末,此过程中的主要变化与现象:
发生主要变化的化学方程式为
①4Na+O2===2Na2O
②Na2O+H2O===2NaOH
④2NaOH+CO2===Na2CO3+H2O,
Na2CO3+10H2O===Na2CO3·10H2O
⑤Na2CO3·10H2O===Na2CO3+10H2O
4.钠的重要用途
(1)钾钠合金用于原子反应堆,作导热剂。 (2)制备Na2O2。 (3)作电光源:高压钠灯。
(4)冶炼稀有金属,如冶炼金属钛:4Na+TiCl4Ti+4NaCl。
课堂练习
1.英国化学家汉弗里·戴维在十九世纪初通过电解的方式获得金属钠的单质。下面关于金属钠的描述正确的是
A.少量钠应保存在水中
B.钠离子性质很活泼
C.钠很软,在新材料领域没有用途
D.钠的化学性质很活泼,在自然界里不能以游离态存在
【答案】D
【解析】A.钠很活泼能与氧气和水反应,所以少量钠应保存在煤油中,故A错误;
B.钠原子最外层一个电子,易失去,所以钠原子具有较强的还原性,而钠离子只能得电子,具有弱氧化性,故B错误;
C.钠的导电和导热性较好,在新材料领域有用途,故C错误;
D.钠与氧气、水等都能发生剧烈反应,性质活泼,在自然界里不能以游离态存在,故D正确;
故答案选D。
2.下列变化属于物理变化的是
A.将金属钠和金属钾混合研磨得到液体
B.刚切开的金属钠放置在空气中变暗
C.刚切开的金属钠放置在空气中加热变成淡黄色
D.一小块钠投入水中熔成光亮的小球
【答案】A
【解析】
A.将金属钠和金属钾混合研磨得到液体,过程为物理变化,A正确;
B.刚切开的金属钠放置在空气中变暗,是因为钠和氧气反应生成氧化钠,属于化学变化,B错误;
C.刚切开的金属钠放置在空气中加热变成淡黄色固体,是钠和氧气反应生成过氧化钠,属于化学变化,C错误;
D.一小块钠投入到水中熔成闪亮的小球,是钠和水反应过程中放热导致钠熔成液态小球,属于化学变化,D错误;
故选A。
A.Na在石灰水与苯的界面处反应,并上下跳动
B.Na燃烧,最终消失
C.澄清石灰水变浑浊
D.苯层可观察到有气泡产生
【答案】B
【分析】Na与澄清石灰水反应的实质是与氢氧化钙溶液中的水反应,据此分析。
【解析】A.由于密度ρ(苯)<ρ(Na)<ρ(澄清石灰水),所以金属Na在澄清石灰水与苯的界面处与溶液中的水反应产生H2,氢气气体使Na受到的浮力增大,钠块上升,后又下落界面处的石灰水溶液中进一步与水反应,钠块上下跳动直至消失,A正确;
B.由于苯隔离空气,因此Na不会燃烧,B错误;
C.由于Na与水反应放热,氢氧化钙溶解度随温度升高而降低,因此澄清石灰水变浑浊,C正确;
D.根据B选项,可知D正确;
故选B。
EPB
考点突破
02
巩固提升
01
练习与应用
1.下列关于钠的叙述中不正确的是
A.密度比水小 B.保存在煤油中
C.具有氧化性 D.钠与水反应放热且钠的熔点低
【答案】C
【解析】A.钠密度比水小,故A正确;
B.钠易与O2和H2O反应,应保存在煤油中,故B正确;
C.钠只具有还原性,不具有氧化性,故C错误;
D.钠与水反应放热且钠的熔点低,故D正确;
故选C。
练习与应用
02
2.下表中,对陈述Ⅰ、Ⅱ 的正确性及两者间是否具有因果关系的判断都正确的是
选项 陈述Ⅰ 陈述Ⅱ 判断
A 钠与水接触,熔成小球 钠与水反应是放热反应, 钠的熔点较低 Ⅰ对,Ⅱ对,有
B 钠放入水中,浮在液面上 钠与水反应生成气体 Ⅰ对,Ⅱ错,无
C 金属钠具有强还原性 高压钠灯产生透雾性强的黄光 Ⅰ对,Ⅱ对,有
D 金属钠质软可以用刀切 钠钾合金可以做原子反应堆的导热剂 Ⅰ对,Ⅱ对,有
练习与应用
02
【答案】A
【解析】A.钠与水反应是放热反应,钠的熔点较低,所以钠与水接触,熔成小球,故选A;
B.钠放入水中,浮在液面上,是因为钠的密度比水小,故不选B;
C.高压钠灯产生透雾性强的黄光,是因为钠的焰色为黄色,与金属钠具有强还原性无关,故不选C;
D.钠钾合金可以做原子反应堆的导热剂,与金属钠质软可以用刀切无关,故不选D;
选A。
03
练习与应用
03
练习与应用
【答案】C
【解析】在蒸发皿中放一小块钠,加热至熔化时,用玻璃棒蘸取少量无水CuSO4与熔化的钠接触,瞬间产生耀眼的火花,同时有红色物质生成,说明熔融的钠将硫酸铜中的铜置换出来并且放出热量,属于置换反应,钠作还原剂,硫酸铜作氧化剂;
A.根据以上分析,熔融的钠将硫酸铜中的铜置换出来并且放出热量,属于置换反应,故A正确;
B.钠稍稍加热即熔化,说明金属钠的熔点较低,故B正确;
C.上述反应中,钠作还原剂,硫酸铜作氧化剂;故C错误;
D.根据以上分析,在无水条件下,Na可以与CuSO4反应并生成Cu,故D正确;
答案选C。
练习与应用
04
4.将绿豆大的钠块投入如图所示的烧杯中,可能出现的现象是
练习与应用
04
【答案】D
【解析】钠密度大于煤油的密度,小于水和四氯化碳的密度,钠与水反应生成氢气和氢氧化钠,放出大量的热,所以将绿豆大的钠块投入如图所示的烧杯中,钠块会熔化,产生的氢气使钠块在水层和煤油层界面处游动并上下跳动四处游动并上下跳动,故选:D。
答案选D。
练习与应用
05
【答案】D
【分析】钠露置于空气中,首先与空气中的氧气反应生成氧化钠,氧化钠与水反应生成氢氧化钠,氢氧化钠与二氧化碳作用生成碳酸钠。
【解析】A.银白色变暗是因为钠与空气中的氧气反应生成了氧化钠,A不正确;
B.过程④中氢氧化钠与二氧化碳反应生成碳酸钠,后来发生晶体的风化,发生了化学变化, B不正确;
C.最后得到的白色固体是Na2CO3, C不正确;
D.出现液滴是因为NaOH发生潮解,在其表面形成溶液,D正确;
故选D。
练习与应用
06
6.将金属钠放入盛有下列溶液的小烧杯中,既有气体,又有白色沉淀产生的是
①MgSO4溶液 ②H2SO4溶液 ③Na2SO4溶液 ④饱和澄清石灰水 ⑤Ca(HCO3)2溶液 ⑥CuSO4溶液 ⑦饱和NaCl溶液
A.①②④⑤ B.①④⑤⑦ C.①④⑤ D.①④⑤⑥⑦
07
练习与应用
7.金属钠是在1807年通过电解氢氧化钠制得的,这个原理应用于工业生产,约在1891年才获得成功。1921年实现了电解氯化钠制钠的工业方法,其反应原理是2NaCl(熔融)2Na+Cl2↑。回答下列问题:
(1)保存金属钠的正确方法是________(填字母)。
A.放在棕色瓶中 B.放在细沙中
C.放在水中 D.放在煤油中
(2)将一小块钠放在水平放置的试管中部,用酒精灯加热充分反应(如图所示),请写出该反应的化学方程式:____________________________,生成物的颜色为________。
(3)Na、NaOH久置在空气中最终都是变为________(填化学式)。
(4)将一小块金属钠投入CuCl2溶液中,发生反应的化学方程式为_____________________________________________。
07
练习与应用
THANK YOU
