【考点突破】第二章第2课时 钠的几种化合物(共53张PPT)-2024~2025学年高一化学同步课件(人教版2019必修第一册)
文档属性
| 名称 | 【考点突破】第二章第2课时 钠的几种化合物(共53张PPT)-2024~2025学年高一化学同步课件(人教版2019必修第一册) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-22 18:44:47 | ||
图片预览









文档简介
(共53张PPT)
第一节 钠及其化合物
第二章 海水中的重要元素——钠和氯
第1课时 钠的几种化合物
氧化钠和过氧化钠
01
碳酸钠和碳酸氢钠
02
焰色试验
03
巩固提升
04
考点 · 突破
Exam Points
Breakthrough
05
碳酸钠与碳酸氢钠的鉴别与除杂
EPB
考点突破
01
氧化钠和过氧化钠
【问题探究】
【情境】
1.某同学设计了一个“滴水点火,水火相容”的魔术实验,他用脱脂棉包住一些过氧化钠粉末放在石棉网上,向脱脂棉上滴几滴蒸馏水,结果脱脂棉竟然剧烈燃烧起来。
(1)该实验的反应原理是什么?写出化学方程式。
(2)脱脂棉剧烈燃烧的原因是什么?
(3)若向用脱脂棉包住一些Na2O2粉末中用导管吹气,脱脂棉也燃烧,涉及的反应原理是什么?写出化学方程式。
【答案】 (1)2Na2O2+2H2O===4NaOH+O2↑
(2)反应放热并生成O2,使脱脂棉在O2中达到着火点而燃烧
(3)2Na2O2+2CO2===2Na2CO3+O2
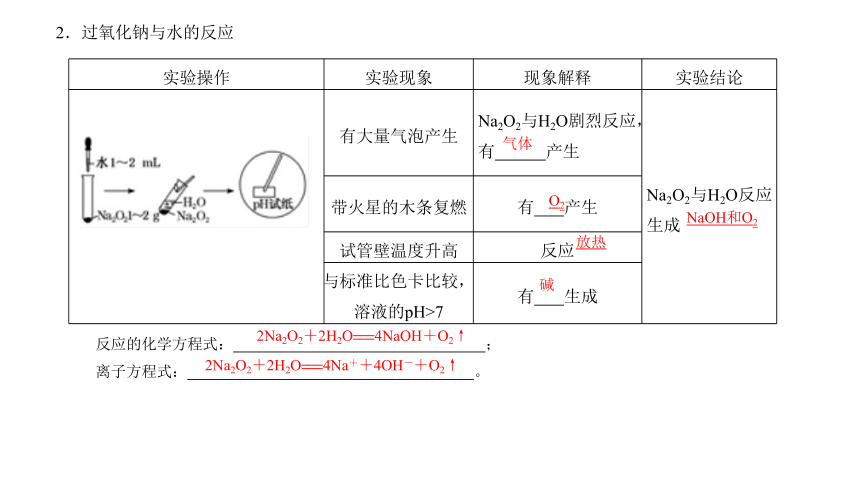
2.过氧化钠与水的反应
实验操作 实验现象 现象解释 实验结论
有大量气泡产生 Na2O2与H2O剧烈反应,有 产生 Na2O2与H2O反应生成
带火星的木条复燃 有 产生
试管壁温度升高 反应
与标准比色卡比较,溶液的pH>7 有 生成
气体
反应的化学方程式: ;
离子方程式: 。
O2
放热
碱
NaOH和O2
2Na2O2+2H2O===4NaOH+O2↑
2Na2O2+2H2O===4Na++4OH-+O2↑
【问题探究】
(1)上述反应是氧化还原反应吗?若是,指出反应的氧化剂和还原剂。
【解析】因反应前后有氧元素化合价的变化,属于氧化还原反应;反应中Na2O2既是氧化剂,又是还原剂。
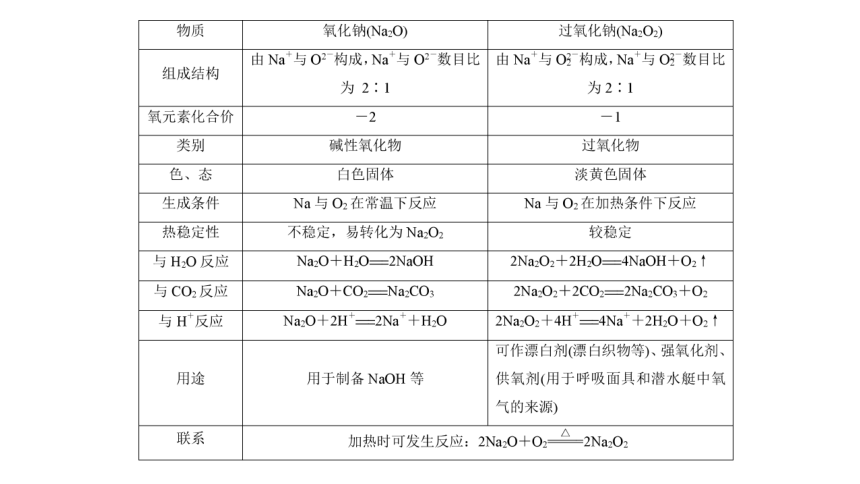
(2)从物质分类的角度看,Na2O和Na2O2都是氧化物,它们都属于碱性氧化物吗?
【解析】Na2O属于碱性氧化物,但Na2O2不属于碱性氧化物。
(3)呼吸面具和潜水艇里常用过氧化钠作供氧剂,写出相关反应的化学方程式。
【解析】2Na2O2+2H2O===4NaOH+O2↑,2Na2O2+2CO2===2Na2CO3+O2。
归纳总结
氧化钠和过氧化钠的比较
【知识拓展】
Na2O2与水反应的实质
Na2O2与水的反应是比较特殊的氧化还原反应,实质上可以分成两个过程:
①Na2O2+2H2O===2NaOH+H2O2
②2H2O2===2H2O+O2↑
①×2+②得
所以Na2O2与H2O反应时,Na2O2在反应中既作氧化剂,又作还原剂,且二者个数之比为1∶1;NaOH既不是氧化产物,也不是还原产物;反应过程中有H2O2生成,H2O2有强氧化性。
课堂练习
【解析】选B Na2O与H2O水或CO2反应不能产生氧气,不能用于呼吸面具作为O2来源,A错误;Na2O2与H2O或CO2反应能产生氧气,能用于呼吸面具作为O2来源,B正确;NaCl、NaOH不能产生氧气,C错误;Na2CO3与H2O、CO2反应不能产生氧气,不能用于呼吸面具作为O2来源,D错误。
解析:选C 由于发生反应:2Na2O2+2H2O===4NaOH+O2↑,产生O2使气球膨胀,该反应放出大量热量,使广口瓶中空气受热膨胀而出现U形管中水位d>c。
EPB
考点突破
02
碳酸钠和碳酸氢钠
【情境】
[实验1] 探究Na2CO3和NaHCO3的溶解性及其水溶液的酸碱性
盐 1 g Na2CO3 1 g NaHCO3
(1)观察Na2CO3和NaHCO3的外观并进行描述 白色粉末 细小的白色晶体
(2)向两支分别装有Na2CO3、NaHCO3的试管中分别滴入几滴水,振荡,观察现象;将温度计分别插入其中,温度计的示数有何变化 加水结块,变成晶体,温度计示数上升,说明有放热现象 加水部分溶解,温度计示数下降,说明有吸热现象
(3)继续向(2)的试管中分别加入5 mL水,用力振荡,有何现象 完全溶解 固体量减少,部分溶解
(4)分别向(3)所得溶液中滴入1~2滴酚酞溶液,有何现象 溶液呈红色 溶液呈浅红色
初步结论 Na2CO3加少量水变成 ; Na2CO3、NaHCO3都能溶于水, 溶解度较大; Na2CO3溶解 ,NaHCO3溶解 ; Na2CO3、NaHCO3溶液都呈碱性, 溶液的碱性稍强
碳酸钠晶体(Na2CO3·xH2O)
Na2CO3
放热
吸热
Na2CO3
[实验2] 探究Na2CO3和NaHCO3的热稳定性
实验操作 实验现象 实验结论
澄清石灰水不变浑浊 Na2CO3 ,受热 发生分解
澄清石灰水变 NaHCO3 ,受热容易分解,反应的化学方程式:
很稳定
不易
不稳定
浑浊
2NaHCO3 Na2CO3+CO2↑+H2O
【问题探究】
用套管实验装置可以更好地比较Na2CO3和NaHCO3的热稳定性,其中小试管内有沾有无水硫酸铜粉末的棉花球,实验装置如图。
(1)实验时,小试管内棉花球上的无水硫酸铜由白色变为蓝色,说明NaHCO3受热分解生成了 ,烧杯B中澄清石灰水变浑浊,说明NaHCO3受热分解生成了 。
(2)实验时,烧杯A中澄清石灰水不变浑浊,而烧杯B中澄清石灰水变浑浊,由此可得热稳定性Na2CO3 (填“>”或“<”)NaHCO3。
(3)若将大小试管中的Na2CO3和NaHCO3位置互换,能否得出相同的实验结论?
【解析】不能;大试管中加热温度高,而小试管中温度低,如若对换NaHCO3受热分解的原因也可能是温度高造成的。
(4)如何除去Na2CO3固体中混有的少量NaHCO3
H2O
CO2
>
【解析】将固体加热至不再有气体产生,即可除去Na2CO3中混有的NaHCO3。
【问题探究】
[实验3] 探究Na2CO3和NaHCO3与稀盐酸的反应
实验 步骤 在两支试管中分别加入等浓度的3 mL稀盐酸,将两个分别装有0.3 g Na2CO3和0.3 g NaHCO3固体的小气球套在两支试管口,将气球内固体同时倒入试管中,观察现象
实验 操作
实验 现象 两支试管中都产生无色气泡,气球膨胀,加入碳酸氢钠的试管中产生气泡的速率更快,气球膨胀得更大
(1)向稀盐酸中加入Na2CO3,反应的化学方程式: ,离子方程式为
(2)向稀盐酸中加入NaHCO3,反应的化学方程式: ,离子方程式为
Na2CO3+2HCl=== 2NaCl+H2O+CO2↑
NaHCO3+HCl=== NaCl+H2O+CO2↑
(3)Na2CO3、NaHCO3都能和稀盐酸反应产生CO2,但反应速率Na2CO3 (填“>”“<”或“=”)NaHCO3。
(4)能否用稀盐酸鉴别等浓度的Na2CO3和NaHCO3溶液?
【解析】能用稀盐酸鉴别区分二者。向等浓度的Na2CO3和NaHCO3溶液中分别滴加等浓度的稀盐酸,立即有大量气泡产生的是NaHCO3溶液,开始阶段无气泡,过一会儿才产生气泡的是Na2CO3溶液。向Na2CO3溶液中逐滴加入稀盐酸,反应分为两个阶段:Na2CO3+HCl===NaHCO3+NaCl、NaHCO3+HCl===NaCl+H2O+CO2↑。
归纳总结
Na2CO3与NaHCO3性质的比较
碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3)
俗名 纯碱或苏打 小苏打
色、态 白色粉末(Na2CO3·10H2O为晶体) 细小、白色粉末
<
溶解性 易溶于水 在水中溶解度比Na2CO3小
溶液的酸碱性 显碱性 显碱性
热稳定性 稳定,受热难分解;但结晶碳酸钠(Na2CO3·10H2O)易风化 不稳定,受热易分解:2NaHCO3 Na2CO3+H2O+CO2↑
与酸反应(与HCl) Na2CO3+2HCl===2NaCl+H2O+CO2↑ NaHCO3+HCl===NaCl+H2O+CO2↑(反应速率比Na2CO3快)
与碱反应[与Ca(OH)2、NaOH] Na2CO3+Ca(OH)2===CaCO3↓+2NaOH(Na2CO3与NaOH不反应) 2NaHCO3+Ca(OH)2===CaCO3↓+Na2CO3+2H2O
NaHCO3+NaOH===Na2CO3+H2O
与可溶性钙盐、钡盐反应(与CaCl2、BaCl2) Na2CO3+CaCl2===CaCO3↓+2NaCl Na2CO3+BaCl2===BaCO3↓+2NaCl 不反应
相互转化
用途 用于玻璃、肥皂、洗涤剂、造纸、纺织等工业 制发酵剂、灭火器、医疗上用于治疗胃酸过多
易错点
(1)Na2CO3、NaHCO3均易溶于水,但相同温度下,NaHCO3的溶解度比Na2CO3小很多,故向饱和Na2CO3溶液中通入CO2有NaHCO3晶体析出,反应的化学方程式为Na2CO3+H2O+CO2===2NaHCO3↓。
(2)Na2CO3粉末遇水生成碳酸钠晶体(Na2CO3·xH2O);碳酸钠晶体在干燥空气里逐渐失去结晶水变成Na2CO3粉末。
(3)CO结合H+放出CO2的化学反应分两步进行:CO+H+===HCO;HCO+H+===CO2↑+H2O。而HCO直接结合H+放出CO2;且Na2CO3的相对分子质量大于NaHCO3的。因此,相同质量的Na2CO3和NaHCO3分别与足量盐酸反应时,后者放出CO2的速度快且量多。
【知识拓展】纯碱的生产历史
1.路布兰制碱法——首次实现了碳酸钠的工业生产
(1)原料:食盐、焦炭和石灰石等。
2.索尔维制碱法(氨碱法)
(1)原料:食盐、氨、二氧化碳等。
(3)生产原理流程
(4)索尔维制碱法具有原料易获取,价格便宜,损失少,实现了连续性生产等优点。
3.侯氏(联合)制碱法
(1)原料:氨、氯化钠。
(3)生产原理流程
(4)优点:①提高了食盐的转化率;②缩短了生产流程;③减少了对环境的污染等。
易错点
侯氏制碱法常用下列三步反应表示:
(1)NH3+H2O+CO2===NH4HCO3(先通入NH3,再通入CO2);
(2)NH4HCO3+NaCl===NH4Cl+NaHCO3↓(NaHCO3的溶解度较小,结晶析出);
(3)2NaHCO3 Na2CO3+CO2↑+H2O(NaHCO3的热稳定性差,受热易分解)。
低温时NH4Cl的溶解度比NaCl的小,可以在低温状态下向(2)中的溶液加入NaCl,则NH4Cl析出,得到化肥,提高了NaCl的利用率。
课堂练习
1.下列关于碳酸氢钠的说法中,不正确的是
A.白色固体 B.受热易分解 C.能与盐酸反应 D.不能与NaOH溶液反应
【答案】D
【解析】A.NaHCO3为白色固体,A正确;
B.NaHCO3加热分解为碳酸钠、水、二氧化碳,B正确;
C.NaHCO3能够和酸反应生成二氧化碳,C正确;
D.NaHCO3与氢氧化钠反应生成碳酸钠和水,D错误;
故选D。
2.下列关于碳酸钠和碳酸氢钠的叙述正确的是
A.相同条件下,在水中的溶解性:碳酸钠<碳酸氢钠
B.相同条件下,溶液的碱性:碳酸钠>碳酸氢钠
C.相同条件下,与酸反应产生二氧化碳气体的速率:碳酸钠>碳酸氢钠
D.碳酸钠溶液和碳酸氢钠溶液可以用澄清石灰水来区别
【答案】B
【解析】A.碳酸钠和碳酸氢钠都易溶于水,但在相同条件下,在水中的溶解性:碳酸钠>碳酸氢钠,A不正确;
B.相同温度下,相同浓度的碳酸钠的碱性更强,所以溶液的碱性:碳酸钠>碳酸氢钠,B正确;
C.相同条件下,碳酸钠与酸反应时,先生成碳酸氢钠,再与酸反应才生成二氧化碳气体,所以与酸反应产生二氧化碳气体的速率:碳酸钠<碳酸氢钠,C不正确;
D.碳酸钠溶液和碳酸氢钠溶液都能与澄清石灰水反应,从而生成碳酸钙沉淀,所以不能用澄清石灰水区分碳酸钠与碳酸氢钠,D不正确;
故选B。
EPB
考点突破
03
焰色试验
【问题探究】
【情境】
重大节日,人们会燃放五彩缤纷的烟花。
漂亮的烟花是如何产生的?淡蓝色的灶火遇到食盐水时,火焰会变黄色,其中的道理是什么?
【解析】烟花的火药中含有一些金属元素,灼烧中火焰呈现不同颜色即焰色试验。
食盐水中含有钠元素,灼烧时呈现黄色火焰。
归纳总结
1.焰色试验
根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验。
2.操作步骤
3.几种常见金属元素的焰色
金属元素 锂 钠 钾 钙 锶 钡 铜
颜色 紫红色 黄色 紫色(透过蓝色钴玻璃) 砖红色 洋红色 黄绿色 绿色
4.应用
(1)检验金属元素的存在,如鉴别NaCl和KCl溶液。
(2)利用焰色试验制节日烟火。
易错点
(1)焰色试验可用来鉴别一些金属元素,这种鉴别物质的方法属于物理方法,而不是化学方法。
(2)清洗铂丝时不能用稀硫酸代替盐酸,因为硫酸的熔沸点较高,难挥发。
(3)观察钾的焰色试验时,要透过蓝色钴玻璃观察,这样做的目的是滤去黄光,避免少量钠元素对鉴别钾元素的干扰。
课堂练习
【答案】A
【解析】在焰色试验中,可使火焰呈黄色的是Na元素,故选A。
【答案】A
【解析】A.过氧化钠为粉末,多孔隔板不起作用,A错误;
B.氯化氢能和碳酸氢钠反应生成二氧化碳,二氧化碳不与碳酸氢钠反应也不溶于碳酸氢钠溶液,故该实验能达到实验目的,B正确;
C.钾元素的焰色通过蓝色钴玻璃能观察到,故该实验能达到实验目的,C正确;
D.制取Fe(OH)3红褐色胶体应该向煮沸的蒸馏水中滴加饱和氯化铁溶液至溶液变红褐色,D正确;
故选A。
3.2023年国庆节,南昌以天空为幕,以烟花为笔,举办了一场盛大的“风景这边独好”国庆烟花晚会。璀敁的焰火点亮了南昌的夜空,惊艳了无数国人。这与高中化学中“焰色试验”知识相关,下列说法中正确的是
A.焰色试验是化学变化 B.利用焰色试验可区分NaCl与Na2CO3固体
C.焰色试验均应透过蓝色钴玻璃观察 D.用稀盐酸清洗做焰色试验的铂丝
【答案】D
【解析】A.焰色试验是物质原子内部电子能级的改变,不涉及物质结构和化学性质的改变,是物理变化,A错误;
B.NaCl与Na2CO3的焰色都是黄色,不能通过焰色试验区分二者,B错误;
C.由于钾元素的焰色易被黄色的火焰覆盖遮挡,不易观察,则观察钾元素的焰色试验时应透过蓝色钴玻璃观察,C错误;
D.做完焰色试验之后会有杂质残留在铂丝上面,会干扰实验现象,用盐酸洗涤这些物质,形成对应的金属氯化物熔沸点较低,在火焰上烧的时候可以将这些物质分解挥发,无残留,不会干扰实验现象,D正确。
故选D。
EPB
考点突破
04
碳酸钠和碳酸氢钠的鉴别与除杂
【情境】
有两个无标签的试剂瓶分别装有Na2CO3和NaHCO3固体,有四位同学为鉴别它们设计了以下四种不同的方法,请逐一评价每种方法的可行性。
甲同学:取等量少量两试剂瓶中的固体,加蒸馏水分别配成溶液,再分别加入稀CaCl2溶液,观察现象。
乙同学:取等量少量两试剂瓶中的固体,加蒸馏水分别配成溶液,再分别滴加澄清石灰水,观察现象。
丙同学:取等量少量两试剂瓶中的固体,分别加热,再检验是否有能使澄清石灰水变浑浊的气体产生。
丁同学:取等量少量两试剂瓶中的固体,加蒸馏水分别配成溶液,再分别逐滴加入相同的盐酸,观察产生气泡的先后顺序。
【方案评价】
甲同学:Na2CO3溶液与CaCl2溶液反应产生白色沉淀,化学方程式为CaCl2+Na2CO3===CaCO3↓+2NaCl;NaHCO3溶液与稀CaCl2溶液不反应,二者实验现象不同,可以鉴别,该方法可行。
乙同学:澄清石灰水与Na2CO3溶液、NaHCO3溶液均反应产生白色沉淀,化学方程式分别为Na2CO3+Ca(OH)2===CaCO3↓+2NaOH;2NaHCO3+Ca(OH)2===CaCO3↓+Na2CO3+2H2O,二者实验现象相同,不能鉴别,该方法不可行。
丙同学:NaHCO3固体受热分解产生能使澄清石灰水变浑浊的气体,化学方程式为2NaHCO3 Na2CO3+H2O+CO2↑,而Na2CO3加热不分解,二者实验现象不同,可以鉴别,该方法可行。
丁同学:向Na2CO3溶液中逐滴加入稀盐酸,反应分两个阶段,①Na2CO3+HCl===NaHCO3+NaCl,该反应过程无气泡产生;②NaHCO3+HCl===NaCl+H2O+CO2↑,该反应过程有大量气泡产生,即滴加盐酸开始阶段不产生气泡,一定时间后才产生气泡;向NaHCO3溶液中逐滴加入稀盐酸,发生上述反应②,立即有大量气泡产生,二者实验现象不同,可以鉴别,该方法可行。
【问题探究】
除以上同学鉴别Na2CO3和NaHCO3的方法外,请你再设计一种鉴别二者的方法。
【解析】方法一:分别取等量固体溶于水,测两溶液的pH,pH大的是Na2CO3,pH小的是NaHCO3。或分别向两溶液中滴加几滴无色酚酞溶液,红色较深的是Na2CO3,红色较浅的是NaHCO3。
方法二:向两支分别装有Na2CO3和NaHCO3固体的试管中,分别滴入几滴水振荡,并把温度计分别插入其中,Na2CO3固体溶于水放热,温度升高,NaHCO3固体溶于水吸热,温度降低。
归纳总结
1.Na2CO3和NaHCO3的鉴别方法
(1)利用热稳定性不同
(2)利用和酸反应生成气体的速率不同(相同条件下)
(3)利用和BaCl2(或CaCl2)溶液混合时现象不同
(4)利用两溶液的碱性不同
2.利用互滴法鉴别Na2CO3溶液和盐酸
Na2CO3溶液与盐酸作用时,滴加方式不同,现象不同,可以此作为区别Na2CO3溶液与盐酸的依据。
(1)将Na2CO3溶液逐滴滴入盐酸中,开始时盐酸相对过量,发生反应Na2CO3+2HCl===2NaCl+CO2↑+H2O,即一开始就有气体放出。
(2)将盐酸逐滴滴入Na2CO3溶液中,开始时Na2CO3相对过量,发生反应Na2CO3+HCl===NaHCO3+NaCl,当Na2CO3完全转化为NaHCO3后,继续滴加盐酸发生反应NaHCO3+HCl===NaCl+CO2↑+H2O,即开始阶段无明显现象,一段时间后才产生气体。
因此,滴加时若立刻产生气体,说明是将Na2CO3溶液滴入盐酸中;如果开始阶段无明显现象,过一会儿才有气体产生,说明是将盐酸滴入Na2CO3溶液中。
3.Na2CO3与NaHCO3的提纯
混合物(括号内的为杂质) 除杂方法及试剂
Na2CO3固体(NaHCO3) 加热
NaHCO3溶液(Na2CO3) 通入足量CO2气体
Na2CO3溶液(NaHCO3) 加入适量NaOH溶液
课堂练习
【答案】A
【解析】A.碳酸钠和碳酸氢钠溶液中分别加入Ca(OH)2溶液,都会产生白色沉淀,无法鉴别,A错误;
B.碳酸钠固体溶于水放热,碳酸氢钠溶于水吸热,故用温度计测量温度变化,升温的是碳酸钠,B正确;
C.碳酸钠溶液和少量盐酸反应生成碳酸氢钠,而碳酸氢钠溶液和少量盐酸反应会立即产生二氧化碳,C正确;
D.相同条件下碳酸钠溶解度大于碳酸氢钠,D正确;
故选A。
1.两种固体,分别是碳酸钠和碳酸氢钠,下列鉴别方法不合理的是
A.取两种固体溶于水,分别加入Ca(OH)2溶液,产生白色沉淀的是碳酸钠
B.取两种固体分别滴入少量水,用温度计测量温度变化,升温的是碳酸钠
C.取两种固体溶于水,分别加入少量稀盐酸,立即产生气体的是碳酸氢钠
D.取两种固体做溶解性实验,相同条件下溶解度大的是碳酸钠
【答案】D
【分析】本题通过四组实验讨论了两种主要钠盐的热稳定性、碱性,与酸溶液、与碱溶液反应的区别,应结合两种钠盐性质进行分析。
【解析】A.通过装置甲探究 Na CO 和 NaHCO 的热稳定性,应将 NaHCO 置于小试管中,A 正确;
B.通过装置乙探究同浓度 Na CO 和 NaHCO 溶液的碱性强弱,Na CO 溶液红色较深,B 项正确;
C.通过装置丙探究 Na CO 和 NaHCO 与盐酸反应的剧烈程度,NaHCO 与稀盐酸反应速率快,C正确;
D.不能用 澄 清 石 灰 水 鉴 别 Na CO 和NaHCO 溶液,因为两溶液中均产生白色沉淀,D项错误;
故选 D。
EPB
考点突破
05
巩固提升
01
练习与应用
01
练习与应用
【答案】C
【解析】①Na2O和水反应生成碱,反应类型是化合反应,而与Na2O2与水反应除产生碱以外,还有O2因此,因此该反应不是化合反应,①错误;
②Na2O2能与二氧化碳反应生成碳酸钠和氧气,而Na2O与二氧化碳和水反应不会产生氧气,所以Na2O2可作供氧剂,而Na2O不行,②正确;
③Na2O2、Na2O在空气中都会与CO2反应生成Na2CO3粉末,③正确;
④Na2O与Na2O2都是离子化合物,二者电离产生的阴、阳离子个数比都是1:2,④错误;
⑤向酚酞溶液中加入Na2O2粉末,Na2O2与水反应产生的NaOH使溶液变为红色;Na2O2同时具有强氧化性,会将红色物质再氧化变为无色,因此看到溶液先变红后褪色,反应过程中会产生氧气,因此会看到气泡生成,⑤正确;
综上所述②③⑤正确,故C符合;
故选:C。
练习与应用
02
练习与应用
02
【答案】D
【解析】A.过氧化钠与水反应生成氢氧化钠和氧气,A正确;
B.过氧化钠与水反应生成了氢氧化钠,氢氧化钠是强碱,遇到酚酞,溶液变成红色,B正确;
C.过氧化钠与水反应可能生成了过氧化氢,过氧化氢具有强氧化性,能够使溶液褪色,C正确;
D.生成的过氧化氢在二氧化锰作催化剂时发生了分解,因此放出大量气泡,但是不能说明降低了水中溶解的氧气的溶解度,D错误;
故选D。
03
练习与应用
03
练习与应用
练习与应用
04
4.将少量Na2O2分别放入盛有下列溶液的小烧杯中,最终不会有白色沉淀产生的是
A.MgSO4溶液 B.FeCl2溶液 C.Ca(HCO3)2溶液 D.饱和澄清石灰水
【答案】B
【分析】将少量Na2O2分别放入盛有液的小烧杯中,首先与溶液的水发生反应:2Na2O2+2H2O=4NaOH+ O2↑,然后看溶质是否与反应产生的NaOH发生反应。
【解析】A.MgSO4溶液与NaOH会发生反应:MgSO4+2NaOH=Mg(OH)2↓+Na2SO4,反应产生了白色沉淀,A不符合题意;
B.Na2O2具有强氧化性,与FeCl2溶液反应最终生成氢氧化铁为红褐色沉淀,B符合题意;
C.Ca(HCO3)2溶液中加入Na2O2,会发生反应:Ca(HCO3)2+2NaOH=CaCO3↓+Na2CO3+2H2O,反应产生白色沉淀,C不符合题意;
D.饱和澄清石灰水加入Na2O2固体,由于水发生反应消耗,溶质Ca(OH)2不能被溶解而析出,因此会形成白色沉淀,D不符合题意;
故答案为:B。
练习与应用
05
5.下列有关碳酸钠和碳酸氢钠说法不正确的是
A.向碳酸氢钠中加少量水,伴随着吸热现象 B.侯德榜制碱法最终产品是碳酸氢钠
C.碳酸钠溶液呈碱性 D.碳酸钠比碳酸氢钠稳定
【答案】B
【解析】A.向碳酸钠中加入少量水后,碳酸钠结块变成晶体,并伴随着放热现象;而向碳酸氢钠中加入少量水后,碳酸氢钠能溶解,并伴随着吸热现象,A正确;
B.侯德榜制碱法最终产品是碳酸钠,B错误;
C.碳酸钠和碳酸氢钠的水溶液均显碱性,故都可用作食用碱或工业用碱,C正确;
D.碳酸钠稳定,加热时不会发生分解反应产生气体;碳酸氢钠加热产生二氧化碳气体,可使澄清石灰水变浑浊,故可用加热法来比较碳酸钠和碳酸氢钠的热稳定性大小,D正确;
故选B。
练习与应用
06
【答案】C
【解析】碳酸氢钠固体受热分解生成碳酸钠,所以直接加热即可除去。答案选C。
07
练习与应用
07
练习与应用
【答案】C
【分析】先向饱和食盐水中通入氨气,使溶液呈碱性,然后再通入足量的CO2,由于碳酸氢钠的溶解度较小,碳酸氢钠会析出,经加热分解得到纯碱,母液中含有NH4Cl等,经系列操作可以得到NH4Cl,据此回答。
【解析】A.加热灼烧固体应在坩埚中进行,A错误;
B.由以上分析可知,该反应利用了 NaHCO3溶解度小的特点,B正确;
C.先向饱和食盐水中通入氨气,使溶液呈碱性,然后再通入足量的CO2,C错误;
D.向含有NH4Cl的NaHCO3固体中加入稀硝酸,NaHCO3和硝酸反应生成二氧化碳,再加入硝酸银溶液,通过观察是否生成白色沉淀,检验NaHCO3 固体中是否混有NH4Cl,D正确;
故选C。
THANK YOU
第一节 钠及其化合物
第二章 海水中的重要元素——钠和氯
第1课时 钠的几种化合物
氧化钠和过氧化钠
01
碳酸钠和碳酸氢钠
02
焰色试验
03
巩固提升
04
考点 · 突破
Exam Points
Breakthrough
05
碳酸钠与碳酸氢钠的鉴别与除杂
EPB
考点突破
01
氧化钠和过氧化钠
【问题探究】
【情境】
1.某同学设计了一个“滴水点火,水火相容”的魔术实验,他用脱脂棉包住一些过氧化钠粉末放在石棉网上,向脱脂棉上滴几滴蒸馏水,结果脱脂棉竟然剧烈燃烧起来。
(1)该实验的反应原理是什么?写出化学方程式。
(2)脱脂棉剧烈燃烧的原因是什么?
(3)若向用脱脂棉包住一些Na2O2粉末中用导管吹气,脱脂棉也燃烧,涉及的反应原理是什么?写出化学方程式。
【答案】 (1)2Na2O2+2H2O===4NaOH+O2↑
(2)反应放热并生成O2,使脱脂棉在O2中达到着火点而燃烧
(3)2Na2O2+2CO2===2Na2CO3+O2
2.过氧化钠与水的反应
实验操作 实验现象 现象解释 实验结论
有大量气泡产生 Na2O2与H2O剧烈反应,有 产生 Na2O2与H2O反应生成
带火星的木条复燃 有 产生
试管壁温度升高 反应
与标准比色卡比较,溶液的pH>7 有 生成
气体
反应的化学方程式: ;
离子方程式: 。
O2
放热
碱
NaOH和O2
2Na2O2+2H2O===4NaOH+O2↑
2Na2O2+2H2O===4Na++4OH-+O2↑
【问题探究】
(1)上述反应是氧化还原反应吗?若是,指出反应的氧化剂和还原剂。
【解析】因反应前后有氧元素化合价的变化,属于氧化还原反应;反应中Na2O2既是氧化剂,又是还原剂。
(2)从物质分类的角度看,Na2O和Na2O2都是氧化物,它们都属于碱性氧化物吗?
【解析】Na2O属于碱性氧化物,但Na2O2不属于碱性氧化物。
(3)呼吸面具和潜水艇里常用过氧化钠作供氧剂,写出相关反应的化学方程式。
【解析】2Na2O2+2H2O===4NaOH+O2↑,2Na2O2+2CO2===2Na2CO3+O2。
归纳总结
氧化钠和过氧化钠的比较
【知识拓展】
Na2O2与水反应的实质
Na2O2与水的反应是比较特殊的氧化还原反应,实质上可以分成两个过程:
①Na2O2+2H2O===2NaOH+H2O2
②2H2O2===2H2O+O2↑
①×2+②得
所以Na2O2与H2O反应时,Na2O2在反应中既作氧化剂,又作还原剂,且二者个数之比为1∶1;NaOH既不是氧化产物,也不是还原产物;反应过程中有H2O2生成,H2O2有强氧化性。
课堂练习
【解析】选B Na2O与H2O水或CO2反应不能产生氧气,不能用于呼吸面具作为O2来源,A错误;Na2O2与H2O或CO2反应能产生氧气,能用于呼吸面具作为O2来源,B正确;NaCl、NaOH不能产生氧气,C错误;Na2CO3与H2O、CO2反应不能产生氧气,不能用于呼吸面具作为O2来源,D错误。
解析:选C 由于发生反应:2Na2O2+2H2O===4NaOH+O2↑,产生O2使气球膨胀,该反应放出大量热量,使广口瓶中空气受热膨胀而出现U形管中水位d>c。
EPB
考点突破
02
碳酸钠和碳酸氢钠
【情境】
[实验1] 探究Na2CO3和NaHCO3的溶解性及其水溶液的酸碱性
盐 1 g Na2CO3 1 g NaHCO3
(1)观察Na2CO3和NaHCO3的外观并进行描述 白色粉末 细小的白色晶体
(2)向两支分别装有Na2CO3、NaHCO3的试管中分别滴入几滴水,振荡,观察现象;将温度计分别插入其中,温度计的示数有何变化 加水结块,变成晶体,温度计示数上升,说明有放热现象 加水部分溶解,温度计示数下降,说明有吸热现象
(3)继续向(2)的试管中分别加入5 mL水,用力振荡,有何现象 完全溶解 固体量减少,部分溶解
(4)分别向(3)所得溶液中滴入1~2滴酚酞溶液,有何现象 溶液呈红色 溶液呈浅红色
初步结论 Na2CO3加少量水变成 ; Na2CO3、NaHCO3都能溶于水, 溶解度较大; Na2CO3溶解 ,NaHCO3溶解 ; Na2CO3、NaHCO3溶液都呈碱性, 溶液的碱性稍强
碳酸钠晶体(Na2CO3·xH2O)
Na2CO3
放热
吸热
Na2CO3
[实验2] 探究Na2CO3和NaHCO3的热稳定性
实验操作 实验现象 实验结论
澄清石灰水不变浑浊 Na2CO3 ,受热 发生分解
澄清石灰水变 NaHCO3 ,受热容易分解,反应的化学方程式:
很稳定
不易
不稳定
浑浊
2NaHCO3 Na2CO3+CO2↑+H2O
【问题探究】
用套管实验装置可以更好地比较Na2CO3和NaHCO3的热稳定性,其中小试管内有沾有无水硫酸铜粉末的棉花球,实验装置如图。
(1)实验时,小试管内棉花球上的无水硫酸铜由白色变为蓝色,说明NaHCO3受热分解生成了 ,烧杯B中澄清石灰水变浑浊,说明NaHCO3受热分解生成了 。
(2)实验时,烧杯A中澄清石灰水不变浑浊,而烧杯B中澄清石灰水变浑浊,由此可得热稳定性Na2CO3 (填“>”或“<”)NaHCO3。
(3)若将大小试管中的Na2CO3和NaHCO3位置互换,能否得出相同的实验结论?
【解析】不能;大试管中加热温度高,而小试管中温度低,如若对换NaHCO3受热分解的原因也可能是温度高造成的。
(4)如何除去Na2CO3固体中混有的少量NaHCO3
H2O
CO2
>
【解析】将固体加热至不再有气体产生,即可除去Na2CO3中混有的NaHCO3。
【问题探究】
[实验3] 探究Na2CO3和NaHCO3与稀盐酸的反应
实验 步骤 在两支试管中分别加入等浓度的3 mL稀盐酸,将两个分别装有0.3 g Na2CO3和0.3 g NaHCO3固体的小气球套在两支试管口,将气球内固体同时倒入试管中,观察现象
实验 操作
实验 现象 两支试管中都产生无色气泡,气球膨胀,加入碳酸氢钠的试管中产生气泡的速率更快,气球膨胀得更大
(1)向稀盐酸中加入Na2CO3,反应的化学方程式: ,离子方程式为
(2)向稀盐酸中加入NaHCO3,反应的化学方程式: ,离子方程式为
Na2CO3+2HCl=== 2NaCl+H2O+CO2↑
NaHCO3+HCl=== NaCl+H2O+CO2↑
(3)Na2CO3、NaHCO3都能和稀盐酸反应产生CO2,但反应速率Na2CO3 (填“>”“<”或“=”)NaHCO3。
(4)能否用稀盐酸鉴别等浓度的Na2CO3和NaHCO3溶液?
【解析】能用稀盐酸鉴别区分二者。向等浓度的Na2CO3和NaHCO3溶液中分别滴加等浓度的稀盐酸,立即有大量气泡产生的是NaHCO3溶液,开始阶段无气泡,过一会儿才产生气泡的是Na2CO3溶液。向Na2CO3溶液中逐滴加入稀盐酸,反应分为两个阶段:Na2CO3+HCl===NaHCO3+NaCl、NaHCO3+HCl===NaCl+H2O+CO2↑。
归纳总结
Na2CO3与NaHCO3性质的比较
碳酸钠(Na2CO3) 碳酸氢钠(NaHCO3)
俗名 纯碱或苏打 小苏打
色、态 白色粉末(Na2CO3·10H2O为晶体) 细小、白色粉末
<
溶解性 易溶于水 在水中溶解度比Na2CO3小
溶液的酸碱性 显碱性 显碱性
热稳定性 稳定,受热难分解;但结晶碳酸钠(Na2CO3·10H2O)易风化 不稳定,受热易分解:2NaHCO3 Na2CO3+H2O+CO2↑
与酸反应(与HCl) Na2CO3+2HCl===2NaCl+H2O+CO2↑ NaHCO3+HCl===NaCl+H2O+CO2↑(反应速率比Na2CO3快)
与碱反应[与Ca(OH)2、NaOH] Na2CO3+Ca(OH)2===CaCO3↓+2NaOH(Na2CO3与NaOH不反应) 2NaHCO3+Ca(OH)2===CaCO3↓+Na2CO3+2H2O
NaHCO3+NaOH===Na2CO3+H2O
与可溶性钙盐、钡盐反应(与CaCl2、BaCl2) Na2CO3+CaCl2===CaCO3↓+2NaCl Na2CO3+BaCl2===BaCO3↓+2NaCl 不反应
相互转化
用途 用于玻璃、肥皂、洗涤剂、造纸、纺织等工业 制发酵剂、灭火器、医疗上用于治疗胃酸过多
易错点
(1)Na2CO3、NaHCO3均易溶于水,但相同温度下,NaHCO3的溶解度比Na2CO3小很多,故向饱和Na2CO3溶液中通入CO2有NaHCO3晶体析出,反应的化学方程式为Na2CO3+H2O+CO2===2NaHCO3↓。
(2)Na2CO3粉末遇水生成碳酸钠晶体(Na2CO3·xH2O);碳酸钠晶体在干燥空气里逐渐失去结晶水变成Na2CO3粉末。
(3)CO结合H+放出CO2的化学反应分两步进行:CO+H+===HCO;HCO+H+===CO2↑+H2O。而HCO直接结合H+放出CO2;且Na2CO3的相对分子质量大于NaHCO3的。因此,相同质量的Na2CO3和NaHCO3分别与足量盐酸反应时,后者放出CO2的速度快且量多。
【知识拓展】纯碱的生产历史
1.路布兰制碱法——首次实现了碳酸钠的工业生产
(1)原料:食盐、焦炭和石灰石等。
2.索尔维制碱法(氨碱法)
(1)原料:食盐、氨、二氧化碳等。
(3)生产原理流程
(4)索尔维制碱法具有原料易获取,价格便宜,损失少,实现了连续性生产等优点。
3.侯氏(联合)制碱法
(1)原料:氨、氯化钠。
(3)生产原理流程
(4)优点:①提高了食盐的转化率;②缩短了生产流程;③减少了对环境的污染等。
易错点
侯氏制碱法常用下列三步反应表示:
(1)NH3+H2O+CO2===NH4HCO3(先通入NH3,再通入CO2);
(2)NH4HCO3+NaCl===NH4Cl+NaHCO3↓(NaHCO3的溶解度较小,结晶析出);
(3)2NaHCO3 Na2CO3+CO2↑+H2O(NaHCO3的热稳定性差,受热易分解)。
低温时NH4Cl的溶解度比NaCl的小,可以在低温状态下向(2)中的溶液加入NaCl,则NH4Cl析出,得到化肥,提高了NaCl的利用率。
课堂练习
1.下列关于碳酸氢钠的说法中,不正确的是
A.白色固体 B.受热易分解 C.能与盐酸反应 D.不能与NaOH溶液反应
【答案】D
【解析】A.NaHCO3为白色固体,A正确;
B.NaHCO3加热分解为碳酸钠、水、二氧化碳,B正确;
C.NaHCO3能够和酸反应生成二氧化碳,C正确;
D.NaHCO3与氢氧化钠反应生成碳酸钠和水,D错误;
故选D。
2.下列关于碳酸钠和碳酸氢钠的叙述正确的是
A.相同条件下,在水中的溶解性:碳酸钠<碳酸氢钠
B.相同条件下,溶液的碱性:碳酸钠>碳酸氢钠
C.相同条件下,与酸反应产生二氧化碳气体的速率:碳酸钠>碳酸氢钠
D.碳酸钠溶液和碳酸氢钠溶液可以用澄清石灰水来区别
【答案】B
【解析】A.碳酸钠和碳酸氢钠都易溶于水,但在相同条件下,在水中的溶解性:碳酸钠>碳酸氢钠,A不正确;
B.相同温度下,相同浓度的碳酸钠的碱性更强,所以溶液的碱性:碳酸钠>碳酸氢钠,B正确;
C.相同条件下,碳酸钠与酸反应时,先生成碳酸氢钠,再与酸反应才生成二氧化碳气体,所以与酸反应产生二氧化碳气体的速率:碳酸钠<碳酸氢钠,C不正确;
D.碳酸钠溶液和碳酸氢钠溶液都能与澄清石灰水反应,从而生成碳酸钙沉淀,所以不能用澄清石灰水区分碳酸钠与碳酸氢钠,D不正确;
故选B。
EPB
考点突破
03
焰色试验
【问题探究】
【情境】
重大节日,人们会燃放五彩缤纷的烟花。
漂亮的烟花是如何产生的?淡蓝色的灶火遇到食盐水时,火焰会变黄色,其中的道理是什么?
【解析】烟花的火药中含有一些金属元素,灼烧中火焰呈现不同颜色即焰色试验。
食盐水中含有钠元素,灼烧时呈现黄色火焰。
归纳总结
1.焰色试验
根据火焰呈现的特征颜色,可以判断试样所含的金属元素,化学上把这样的定性分析操作称为焰色试验。
2.操作步骤
3.几种常见金属元素的焰色
金属元素 锂 钠 钾 钙 锶 钡 铜
颜色 紫红色 黄色 紫色(透过蓝色钴玻璃) 砖红色 洋红色 黄绿色 绿色
4.应用
(1)检验金属元素的存在,如鉴别NaCl和KCl溶液。
(2)利用焰色试验制节日烟火。
易错点
(1)焰色试验可用来鉴别一些金属元素,这种鉴别物质的方法属于物理方法,而不是化学方法。
(2)清洗铂丝时不能用稀硫酸代替盐酸,因为硫酸的熔沸点较高,难挥发。
(3)观察钾的焰色试验时,要透过蓝色钴玻璃观察,这样做的目的是滤去黄光,避免少量钠元素对鉴别钾元素的干扰。
课堂练习
【答案】A
【解析】在焰色试验中,可使火焰呈黄色的是Na元素,故选A。
【答案】A
【解析】A.过氧化钠为粉末,多孔隔板不起作用,A错误;
B.氯化氢能和碳酸氢钠反应生成二氧化碳,二氧化碳不与碳酸氢钠反应也不溶于碳酸氢钠溶液,故该实验能达到实验目的,B正确;
C.钾元素的焰色通过蓝色钴玻璃能观察到,故该实验能达到实验目的,C正确;
D.制取Fe(OH)3红褐色胶体应该向煮沸的蒸馏水中滴加饱和氯化铁溶液至溶液变红褐色,D正确;
故选A。
3.2023年国庆节,南昌以天空为幕,以烟花为笔,举办了一场盛大的“风景这边独好”国庆烟花晚会。璀敁的焰火点亮了南昌的夜空,惊艳了无数国人。这与高中化学中“焰色试验”知识相关,下列说法中正确的是
A.焰色试验是化学变化 B.利用焰色试验可区分NaCl与Na2CO3固体
C.焰色试验均应透过蓝色钴玻璃观察 D.用稀盐酸清洗做焰色试验的铂丝
【答案】D
【解析】A.焰色试验是物质原子内部电子能级的改变,不涉及物质结构和化学性质的改变,是物理变化,A错误;
B.NaCl与Na2CO3的焰色都是黄色,不能通过焰色试验区分二者,B错误;
C.由于钾元素的焰色易被黄色的火焰覆盖遮挡,不易观察,则观察钾元素的焰色试验时应透过蓝色钴玻璃观察,C错误;
D.做完焰色试验之后会有杂质残留在铂丝上面,会干扰实验现象,用盐酸洗涤这些物质,形成对应的金属氯化物熔沸点较低,在火焰上烧的时候可以将这些物质分解挥发,无残留,不会干扰实验现象,D正确。
故选D。
EPB
考点突破
04
碳酸钠和碳酸氢钠的鉴别与除杂
【情境】
有两个无标签的试剂瓶分别装有Na2CO3和NaHCO3固体,有四位同学为鉴别它们设计了以下四种不同的方法,请逐一评价每种方法的可行性。
甲同学:取等量少量两试剂瓶中的固体,加蒸馏水分别配成溶液,再分别加入稀CaCl2溶液,观察现象。
乙同学:取等量少量两试剂瓶中的固体,加蒸馏水分别配成溶液,再分别滴加澄清石灰水,观察现象。
丙同学:取等量少量两试剂瓶中的固体,分别加热,再检验是否有能使澄清石灰水变浑浊的气体产生。
丁同学:取等量少量两试剂瓶中的固体,加蒸馏水分别配成溶液,再分别逐滴加入相同的盐酸,观察产生气泡的先后顺序。
【方案评价】
甲同学:Na2CO3溶液与CaCl2溶液反应产生白色沉淀,化学方程式为CaCl2+Na2CO3===CaCO3↓+2NaCl;NaHCO3溶液与稀CaCl2溶液不反应,二者实验现象不同,可以鉴别,该方法可行。
乙同学:澄清石灰水与Na2CO3溶液、NaHCO3溶液均反应产生白色沉淀,化学方程式分别为Na2CO3+Ca(OH)2===CaCO3↓+2NaOH;2NaHCO3+Ca(OH)2===CaCO3↓+Na2CO3+2H2O,二者实验现象相同,不能鉴别,该方法不可行。
丙同学:NaHCO3固体受热分解产生能使澄清石灰水变浑浊的气体,化学方程式为2NaHCO3 Na2CO3+H2O+CO2↑,而Na2CO3加热不分解,二者实验现象不同,可以鉴别,该方法可行。
丁同学:向Na2CO3溶液中逐滴加入稀盐酸,反应分两个阶段,①Na2CO3+HCl===NaHCO3+NaCl,该反应过程无气泡产生;②NaHCO3+HCl===NaCl+H2O+CO2↑,该反应过程有大量气泡产生,即滴加盐酸开始阶段不产生气泡,一定时间后才产生气泡;向NaHCO3溶液中逐滴加入稀盐酸,发生上述反应②,立即有大量气泡产生,二者实验现象不同,可以鉴别,该方法可行。
【问题探究】
除以上同学鉴别Na2CO3和NaHCO3的方法外,请你再设计一种鉴别二者的方法。
【解析】方法一:分别取等量固体溶于水,测两溶液的pH,pH大的是Na2CO3,pH小的是NaHCO3。或分别向两溶液中滴加几滴无色酚酞溶液,红色较深的是Na2CO3,红色较浅的是NaHCO3。
方法二:向两支分别装有Na2CO3和NaHCO3固体的试管中,分别滴入几滴水振荡,并把温度计分别插入其中,Na2CO3固体溶于水放热,温度升高,NaHCO3固体溶于水吸热,温度降低。
归纳总结
1.Na2CO3和NaHCO3的鉴别方法
(1)利用热稳定性不同
(2)利用和酸反应生成气体的速率不同(相同条件下)
(3)利用和BaCl2(或CaCl2)溶液混合时现象不同
(4)利用两溶液的碱性不同
2.利用互滴法鉴别Na2CO3溶液和盐酸
Na2CO3溶液与盐酸作用时,滴加方式不同,现象不同,可以此作为区别Na2CO3溶液与盐酸的依据。
(1)将Na2CO3溶液逐滴滴入盐酸中,开始时盐酸相对过量,发生反应Na2CO3+2HCl===2NaCl+CO2↑+H2O,即一开始就有气体放出。
(2)将盐酸逐滴滴入Na2CO3溶液中,开始时Na2CO3相对过量,发生反应Na2CO3+HCl===NaHCO3+NaCl,当Na2CO3完全转化为NaHCO3后,继续滴加盐酸发生反应NaHCO3+HCl===NaCl+CO2↑+H2O,即开始阶段无明显现象,一段时间后才产生气体。
因此,滴加时若立刻产生气体,说明是将Na2CO3溶液滴入盐酸中;如果开始阶段无明显现象,过一会儿才有气体产生,说明是将盐酸滴入Na2CO3溶液中。
3.Na2CO3与NaHCO3的提纯
混合物(括号内的为杂质) 除杂方法及试剂
Na2CO3固体(NaHCO3) 加热
NaHCO3溶液(Na2CO3) 通入足量CO2气体
Na2CO3溶液(NaHCO3) 加入适量NaOH溶液
课堂练习
【答案】A
【解析】A.碳酸钠和碳酸氢钠溶液中分别加入Ca(OH)2溶液,都会产生白色沉淀,无法鉴别,A错误;
B.碳酸钠固体溶于水放热,碳酸氢钠溶于水吸热,故用温度计测量温度变化,升温的是碳酸钠,B正确;
C.碳酸钠溶液和少量盐酸反应生成碳酸氢钠,而碳酸氢钠溶液和少量盐酸反应会立即产生二氧化碳,C正确;
D.相同条件下碳酸钠溶解度大于碳酸氢钠,D正确;
故选A。
1.两种固体,分别是碳酸钠和碳酸氢钠,下列鉴别方法不合理的是
A.取两种固体溶于水,分别加入Ca(OH)2溶液,产生白色沉淀的是碳酸钠
B.取两种固体分别滴入少量水,用温度计测量温度变化,升温的是碳酸钠
C.取两种固体溶于水,分别加入少量稀盐酸,立即产生气体的是碳酸氢钠
D.取两种固体做溶解性实验,相同条件下溶解度大的是碳酸钠
【答案】D
【分析】本题通过四组实验讨论了两种主要钠盐的热稳定性、碱性,与酸溶液、与碱溶液反应的区别,应结合两种钠盐性质进行分析。
【解析】A.通过装置甲探究 Na CO 和 NaHCO 的热稳定性,应将 NaHCO 置于小试管中,A 正确;
B.通过装置乙探究同浓度 Na CO 和 NaHCO 溶液的碱性强弱,Na CO 溶液红色较深,B 项正确;
C.通过装置丙探究 Na CO 和 NaHCO 与盐酸反应的剧烈程度,NaHCO 与稀盐酸反应速率快,C正确;
D.不能用 澄 清 石 灰 水 鉴 别 Na CO 和NaHCO 溶液,因为两溶液中均产生白色沉淀,D项错误;
故选 D。
EPB
考点突破
05
巩固提升
01
练习与应用
01
练习与应用
【答案】C
【解析】①Na2O和水反应生成碱,反应类型是化合反应,而与Na2O2与水反应除产生碱以外,还有O2因此,因此该反应不是化合反应,①错误;
②Na2O2能与二氧化碳反应生成碳酸钠和氧气,而Na2O与二氧化碳和水反应不会产生氧气,所以Na2O2可作供氧剂,而Na2O不行,②正确;
③Na2O2、Na2O在空气中都会与CO2反应生成Na2CO3粉末,③正确;
④Na2O与Na2O2都是离子化合物,二者电离产生的阴、阳离子个数比都是1:2,④错误;
⑤向酚酞溶液中加入Na2O2粉末,Na2O2与水反应产生的NaOH使溶液变为红色;Na2O2同时具有强氧化性,会将红色物质再氧化变为无色,因此看到溶液先变红后褪色,反应过程中会产生氧气,因此会看到气泡生成,⑤正确;
综上所述②③⑤正确,故C符合;
故选:C。
练习与应用
02
练习与应用
02
【答案】D
【解析】A.过氧化钠与水反应生成氢氧化钠和氧气,A正确;
B.过氧化钠与水反应生成了氢氧化钠,氢氧化钠是强碱,遇到酚酞,溶液变成红色,B正确;
C.过氧化钠与水反应可能生成了过氧化氢,过氧化氢具有强氧化性,能够使溶液褪色,C正确;
D.生成的过氧化氢在二氧化锰作催化剂时发生了分解,因此放出大量气泡,但是不能说明降低了水中溶解的氧气的溶解度,D错误;
故选D。
03
练习与应用
03
练习与应用
练习与应用
04
4.将少量Na2O2分别放入盛有下列溶液的小烧杯中,最终不会有白色沉淀产生的是
A.MgSO4溶液 B.FeCl2溶液 C.Ca(HCO3)2溶液 D.饱和澄清石灰水
【答案】B
【分析】将少量Na2O2分别放入盛有液的小烧杯中,首先与溶液的水发生反应:2Na2O2+2H2O=4NaOH+ O2↑,然后看溶质是否与反应产生的NaOH发生反应。
【解析】A.MgSO4溶液与NaOH会发生反应:MgSO4+2NaOH=Mg(OH)2↓+Na2SO4,反应产生了白色沉淀,A不符合题意;
B.Na2O2具有强氧化性,与FeCl2溶液反应最终生成氢氧化铁为红褐色沉淀,B符合题意;
C.Ca(HCO3)2溶液中加入Na2O2,会发生反应:Ca(HCO3)2+2NaOH=CaCO3↓+Na2CO3+2H2O,反应产生白色沉淀,C不符合题意;
D.饱和澄清石灰水加入Na2O2固体,由于水发生反应消耗,溶质Ca(OH)2不能被溶解而析出,因此会形成白色沉淀,D不符合题意;
故答案为:B。
练习与应用
05
5.下列有关碳酸钠和碳酸氢钠说法不正确的是
A.向碳酸氢钠中加少量水,伴随着吸热现象 B.侯德榜制碱法最终产品是碳酸氢钠
C.碳酸钠溶液呈碱性 D.碳酸钠比碳酸氢钠稳定
【答案】B
【解析】A.向碳酸钠中加入少量水后,碳酸钠结块变成晶体,并伴随着放热现象;而向碳酸氢钠中加入少量水后,碳酸氢钠能溶解,并伴随着吸热现象,A正确;
B.侯德榜制碱法最终产品是碳酸钠,B错误;
C.碳酸钠和碳酸氢钠的水溶液均显碱性,故都可用作食用碱或工业用碱,C正确;
D.碳酸钠稳定,加热时不会发生分解反应产生气体;碳酸氢钠加热产生二氧化碳气体,可使澄清石灰水变浑浊,故可用加热法来比较碳酸钠和碳酸氢钠的热稳定性大小,D正确;
故选B。
练习与应用
06
【答案】C
【解析】碳酸氢钠固体受热分解生成碳酸钠,所以直接加热即可除去。答案选C。
07
练习与应用
07
练习与应用
【答案】C
【分析】先向饱和食盐水中通入氨气,使溶液呈碱性,然后再通入足量的CO2,由于碳酸氢钠的溶解度较小,碳酸氢钠会析出,经加热分解得到纯碱,母液中含有NH4Cl等,经系列操作可以得到NH4Cl,据此回答。
【解析】A.加热灼烧固体应在坩埚中进行,A错误;
B.由以上分析可知,该反应利用了 NaHCO3溶解度小的特点,B正确;
C.先向饱和食盐水中通入氨气,使溶液呈碱性,然后再通入足量的CO2,C错误;
D.向含有NH4Cl的NaHCO3固体中加入稀硝酸,NaHCO3和硝酸反应生成二氧化碳,再加入硝酸银溶液,通过观察是否生成白色沉淀,检验NaHCO3 固体中是否混有NH4Cl,D正确;
故选C。
THANK YOU
