【考点突破】第二章第3课时 氯气的性质-2024~2025学年高一化学同步课件(共53张PPT)(人教版2019必修第一册)
文档属性
| 名称 | 【考点突破】第二章第3课时 氯气的性质-2024~2025学年高一化学同步课件(共53张PPT)(人教版2019必修第一册) |  | |
| 格式 | pptx | ||
| 文件大小 | 6.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-22 18:45:31 | ||
图片预览










文档简介
(共53张PPT)
第二节 氯及其化合物
第二章 海水中的重要元素——钠和氯
第3课时 氯气的性质
认识黄绿色的气体——氯气
01
氯气与金属、非金属单质的反应
02
氯气与水、碱的反应
03
巩固提升
04
考点 · 突破
Exam Points
Breakthrough
05
探究氯水的成分与性质
EPB
考点突破
01
认识黄绿色的气体——氯气
【问题探究】
【情境】
1.氯气的发现
18世纪70年代,瑞典化学家舍勒(K.W.Scheele,1742—1786)将软锰矿(主要成分是MnO2)与浓盐酸混合加热,产生了一种能溶于水的黄绿色、有刺激性气味的气体。受当时流行学说的影响,舍勒未能确认这种气体。
2.氯气的命名
1810年,英国化学家戴维(S.H.DaVy,1778—1829)以大量事实为依据,确认这种黄绿色气体是一种新元素组成的单质,并将这种元素命名为chlorine。这一名称来自希腊文,有“绿色”的意思。中文译名曾为“绿气”,后改为“氯气”。
氯气性质的相关数据:
相对分子量:71 熔 点:-101℃ 沸 点: -34 ℃ 密 度:3.21kg/m (0℃)
1.依据上述信息中提供的氯气的性质,你如何收集一瓶这种黄绿色气体?
【解析】因Cl2的密度大于空气的密度,故可用向上排空气法收集,但不能用排水法收集。
2.氯气有毒,若遇到氯气泄漏,你应如何处理?
【解析】逆风向高处撤离并报警。
3.从氯气的发现到氯被确认为一种新元素,时间长达三十多年,其间经历了数位科学家的不懈探索。你从这一史实中得到什么启示?
【解析】①科学研究需要有正确的理论做指导,错误的理论只能浪费时间和精力;②科学研究需要以大量事实为依据,只有大量事实才能推翻错误的理论,建立正确的理论或推动科学理论的发展;③科学研究需要有热爱科学的思想和奉献科学的精神。
归纳总结
2.氯的原子结构
氯的原子结构示意图为 ,氯原子的最外层上有7个电子,在化学反应中很容易得到1个电子,使最外层达到8个电子的稳定结构。因此,氯气是很活泼的非金属单质,具有强氧化性。
3.氯气的物理性质
状态 颜色 气味 溶解性 密度
气态 黄绿色 刺激性 能溶于水 大于空气
易错点
(1)闻气体时的操作方法如右图所示。用手轻轻在集气瓶口扇动,使极少量的气体飘进鼻孔。
(2)低温和加压的条件下,氯气(Cl2)可转变为液态(称为液氯)和固态,二者都是纯净物。
(3)氯气有毒,人吸入少量氯气会使鼻和喉头的黏膜受到刺激,引起咳嗽和胸部疼痛,吸入
大量氯气会中毒致死。因此做氯气相关实验时要注意安全。
课堂练习
1.下列关于氯气或氯元素的叙述中,正确的是
A.Cl2以液态形式存在时可称作氯水 B.氯气有毒,氯离子无毒
C.氯离子和氯气均有刺激性气味 D.液氯中含有大量的氯离子
【答案】B
【解析】A.Cl2的水溶液可称作氯水,Cl2以液态形式存在时可称作液氯,故A错误;
B.氯气有毒,氯离子无毒,故B正确;C.氯离子无味、氯气有刺激性气味 ,故C错误;
D.液氯中只含有大量的氯气分子,故D错误; 选B。
2.将氯气通过软管灌入田鼠洞中可用于消灭田鼠,这是利用了Cl2的哪些性质( )
①黄绿色 ②密度比空气大 ③有毒 ④容易液化
A.①② B.②③ C.③④ D.①④
【解析】选B 氯气可以用来消灭田鼠利用了它的毒性,使田鼠中毒死亡;将氯气通过软管灌入田鼠洞中,氯气的密度比空气的大,与空气混合时,在混合气体的下部,所以能够被田鼠吸入,从而达到灭鼠的目的。
3.Cl2是有毒气体,遇到少量Cl2泄漏时,下列措施或解释不合理的是
A.用浸有浓NaOH溶液的毛巾捂住口鼻,因为NaOH能吸收Cl2
B.人群向逆风方向疏散,利用风吹动气体移动,使人群脱离Cl2气流
C.人群向高处疏散,因为Cl2密度比空气大,低处浓度高,高处浓度小
D.向泄露地点洒石灰,因为Cl2能与Ca(OH)2反应,可降低危害
【答案】A
【解析】A.氯气溶于水,且也能与碱或碱性溶液反应,氯气泄漏时,用浸有水或弱碱性溶液的毛巾捂住口鼻,但NaOH有较强的腐蚀性,不能用浓NaOH溶液的毛巾捂住口鼻,A不合理;
B.氯气朝顺风扩散较快,为避免中毒,人群朝逆风向疏散,B合理;
C.氯气密度大于空气,有少量氯气泄露时,氯气向下沉,人群应向高处疏散,C合理;
D.氯气与石灰(CaO)反应而被吸收,故D合理;
故答案选A。
EPB
考点突破
02
氯气与金属、非金属单质的反应
【情境】
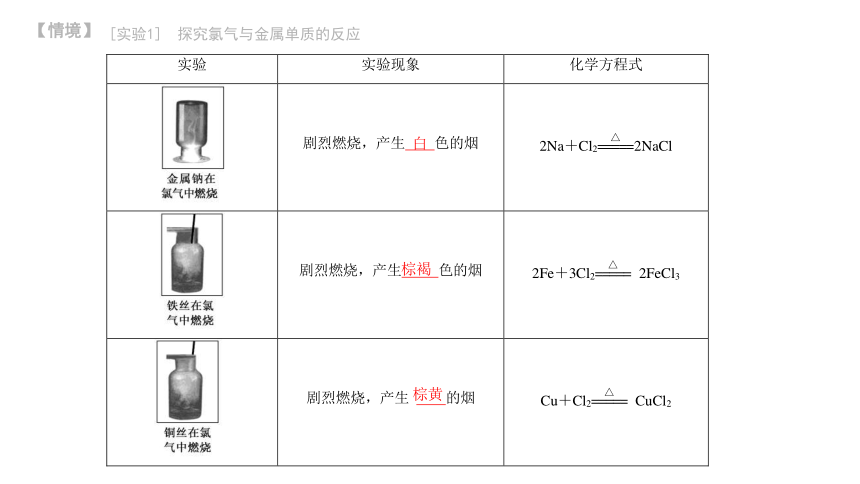
[实验1] 探究氯气与金属单质的反应
白
棕褐
棕黄
【问题探究】
(1)能否通过两种单质直接化合的方法制取FeCl2?说明理由。
【解析】不能;因为Fe与Cl2化合生成的是FeCl3而不是FeCl2。
(2)常温下,能不能用钢瓶储运液氯?说明理由。
【解析】能;原因是常温下,干燥的Cl2与Fe不反应。
[实验2] 探究氯气与非金属单质(如H2)的反应
苍白
白雾
【问题探究】
(1)在点燃氢气前,需要进行的实验操作是什么?
【解析】检验氢气的纯度。
(2)通过H2在Cl2中的燃烧,你对燃烧的条件及其本质有什么新的认识?
【解析】H2在O2中可以燃烧,在Cl2中也可以燃烧,由此可知燃烧不一定有O2参加,燃烧的本质是氧化还原反应,所有的发光、发热的剧烈的氧化还原反应都称为燃烧。
归纳总结
氯气与单质的反应
易错点
(1)Cl2是具有强氧化性的非金属单质,与变价金属反应时,生成高价态的金属氯化物,如与Fe反应生成FeCl3而不是FeCl2,Cu与Cl2反应生成的是CuCl2而不是CuCl(氯化亚铜)。
(2)任何发光、发热的剧烈的氧化还原反应都称为燃烧。
(3)描述现象时,固体小颗粒分散在空气中形成“烟”,液体小液滴分散在空气中形成“雾”。
课堂练习
1.下列氯化物既可以由氯气与金属反应制得,又可以由金属与盐酸反应制得的是
A.FeCl2 B.NaCl C.AgCl D.CuCl2
【答案】B
【解析】A.氯气与铁共热发生化合反应只能生成氯化铁,不能生成氯化亚铁,故A错误;
B.钠在氯气中燃烧生成氯化钠,钠与盐酸反应生成氯化钠和氢气,故B正确;
C.银是不活泼金属,不能与盐酸反应生成氯化银,故C错误;
D.铜是不活泼金属,不能与盐酸反应生成氯化银,故D错误;
故选B。
【答案】C
【解析】A.鲜花中含有水分,氯气可能先溶解在鲜花内的水中,与水反应的产物使鲜花褪色,所以不能证明氯气有漂白作用,A正确;
B.除去氯气中的少量HCl,试剂X应具有吸收HCl但不吸收Cl2的性质,所以可选用饱和食盐水,B正确;
C.氢气在氯气中剧烈燃烧,生成的HCl在瓶口遇到水蒸气,从而产生白雾,C不正确;
D.氯气具有强氧化性,铁丝在氯气中燃烧生成氯化铁,D正确;
故选C。
3.下列实验现象描述中,正确的是
A.硫在纯净氧气中燃烧,发出淡蓝色的火焰
B.铁丝在氯气中燃烧,火星四射,生成黑色固体颗粒
C.氢气在氯气中燃烧的火焰为苍白色,瓶口有白色的烟生成
D.铜丝在氯气中燃烧产生棕黄色的烟,产物溶于少量水中呈蓝绿色溶液
【答案】D
【解析】A.硫在纯净氧气中燃烧,发出蓝紫色火焰,A错误;
B.铁丝在氯气中燃烧,产生红棕色烟,B错误;
C.氢气在氯气中燃烧,发出苍白色火焰,瓶口上方有白雾,C错误;
D.铜在氯气中燃烧,产生棕黄色烟,产物溶于水,氯化铜溶液呈蓝绿色,D正确;
答案选D。
4.下列关于对燃烧现象的认识中,不正确的是( )
A.燃烧一定是氧化还原反应
B.燃烧一定发光放热
C.燃烧一定是化学反应
D.燃烧一定有氧气参与
【解析】选D 燃烧是剧烈的发光、发热的氧化还原反应,故A、B、C正确;但燃烧不一定有氧气参与,如铁在氯气中燃烧生成氯化铁,故D错误。
EPB
考点突破
03
氯气与水、碱的反应
【问题探究】
【情境】
(一)氯气与水的反应
探究氯水的漂白性
1.为什么干燥的Cl2无漂白性,湿润的Cl2有漂白性?
【解析】湿润的Cl2有漂白性的原因是Cl2与水反应生成了HClO,HClO具有强氧化性,能漂白有色物质。
不褪色
褪色
褪色
无
有
有
2.能否用pH试纸测定氯水的pH?为什么?
【解析】不能;因为氯水中含有HClO,能将pH试纸漂白,不能测得溶液的pH。
3.Cl2与H2O的反应是氧化还原反应吗?若是,写出反应的化学方程式并分析氧化剂、还原剂分别是什么物质?
【解析】Cl2与H2O的反应中存在元素化合价的变化,是氧化还原反应,发生化合价升高和降低的都是氯元素,故Cl2既是氧化剂又是还原剂。化学方程式为Cl2+H2O===HCl+HClO。
【情境】
(二)氯气与碱的反应
【问题探究】
1.84消毒液的有效成分是 ,工业制取该漂白液的化学方程式为Cl2+2NaOH===NaCl+NaClO+H2O。
2.漂白粉的成分是 ,有效成分是 ,工业制取漂白粉的化学方程式为2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O。
NaClO
CaCl2、Ca(ClO)2
Ca(ClO)2
3.漂白粉应密封并置于阴凉处保存的原因是什么?
【解析】Ca(ClO)2与空气中的CO2和水反应生成不稳定的HClO而变质失效。
4.工业上制取漂白粉是将Cl2通入澄清石灰水还是石灰乳中?为什么?
【解析】将Cl2通入石灰乳中;原因是Ca(OH)2微溶于水,澄清石灰水中Ca(OH)2的量少,不适合工业大规模生产。
归纳总结
1. 氯气与H2O的反应
(2)氯水的性质
2.氯气与碱溶液的反应
(1)与NaOH溶液的反应:Cl2+2NaOH===NaCl+NaClO+H2O,利用此反应原理可以吸收尾气中的有毒气体Cl2,也可以制取漂白液,这种液体的主要成分是NaCl和NaClO,有效成分是NaClO。
(2)与石灰乳反应:2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O,利用此反应原理可以制取漂白粉,其主要成分是CaCl2和Ca(ClO)2,有效成分是Ca(ClO)2。如果Cl2与Ca(OH)2反应充分,并使Ca(ClO)2成为主要成分,则得到漂粉精。
3.漂白液和漂白粉的漂白原理及保存
(1)均利用“强酸制弱酸”的反应原理使其有效成分NaClO或Ca(ClO)2与较强的酸反应转化为HClO来进行漂白或消毒,如Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO,Ca(ClO)2+2HCl===CaCl2+2HClO。
(2)由于漂白液和漂白粉中的有效成分NaClO或Ca(ClO)2能够与空气中的CO2和H2O反应生成不稳定的HClO,漂白液和漂白粉应密封、避光并置于阴凉干燥处保存。
4.氯气的用途
(1)用于工业制盐酸;
(2)制漂白液、漂白粉和漂粉精;
(3)用于自来水的杀菌、消毒;
(4)用作制取其他含氯工业产品的原料。
易错点
(1)实验室中氯水需现用现配。保存氯水时,应避免光照、受热,实验室通常将氯水置于棕色试剂瓶中密封保存。
(2)光照氯水,浅黄绿色逐渐褪去,溶液的pH逐渐减小(HClO能转化为强酸HCl):2HClO2HCl+O2↑。
(3)Cl2可使湿润的蓝色石蕊试纸先变红后褪色,其原因是Cl2与水反应生成的HCl使蓝色石蕊试纸变红,具有强氧化性的HClO又将变色后的石蕊试纸氧化褪色(漂白)。
(4)在Cl2与碱溶液的反应中,Cl2既是氧化剂又是还原剂。
(5)漂白液、漂白粉和漂粉精既可作漂白棉麻、纸张的漂白剂,又可用作游泳池等场所的消毒剂。
课堂练习
1.下列关于氯气、液氯、氯水叙述正确的是
A.干燥氯气能使干燥有色纸花褪色 B.液氯为混合物
C.新制氯水中只存在2种分子 D.新制氯水长期放置在空气中,酸性增强
2.在新制氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象和结论一致且正确的是
A.新制氯水呈浅黄绿色,且有刺激性气味,说明溶液中有HCl分子存在
B.用强光照射新制氯水一段时间后,溶液pH增大,说明溶液中有HCl存在
C.将铁片加入新制氯水中,有无色气泡产生,说明溶液中有HCl存在
D.Na2S溶液中滴加新制氯水,生成淡黄色的单质硫沉淀,说明新制氯水中有HClO存在
EPB
考点突破
04
探究氯水的成分与性质
【情境】
【问题探究】
1.2 mL新制氯水呈黄绿色,说明氯水中含有什么物质?
【解析】Cl2呈黄绿色,说明新制氯水中含有Cl2。
2.实验一中产生气泡的成分是什么?由实验一中的现象,说明氯水中含有的微粒是什么?写出该反应的离子方程式。
3.由实验二中的现象,说明氯水有哪些性质?
【解析】氯水能使紫色石蕊溶液变红,说明氯水具有酸性,一段时间后红色褪去,说明氯水具有漂白性。
4.实验三中2 mL新制氯水在太阳光下放置发生的反应是什么?实验中“红色不褪去”的原因是什么?
【解析】氯水中的HClO光照发生分解,反应的化学方程式为2HClO 2HCl+O2↑;长时间放置氯水中无HClO,失去漂白性,故红色不褪去。
5.由实验四中的现象,说明氯水中含有的微粒是什么?写出反应的离子方程式。
【解析】Cl-,Ag++Cl-===AgCl↓。
归纳总结
1.新制氯水的性质
在不同的反应中,新制氯水中起作用的成分不同
2.次氯酸的漂白作用
3.液氯、新制氯水和久置氯水的比较
易错点
课堂练习
EPB
考点突破
05
巩固提升
01
练习与应用
1.下列关于氯气的说法中,不正确的是
A.常温常压下是黄绿色气体 B.能溶解于水且与水发生反应
C.相同条件下,密度比空气小 D.有刺激性气味,有毒
【答案】C
【解析】A.常温常压下氯气是黄绿色气体,A正确;
B.氯气能溶于水,并能与水反应生成盐酸和次氯酸,B正确;
C.相同条件下氯气的密度比空气大,C错误;
D.氯气是一种有刺激性气味的黄绿色有毒气体,D正确;
故选C。
练习与应用
02
2.下列物质中,不能由单质直接化合生成的是
A.CuCl2 B.FeCl2 C.HCl D.AlCl3
【答案】B
【解析】A.单质Cu与单质Cl2在加热条件下能直接化合成CuCl2,A项不符合题意;
B.单质Fe与单质Cl2在加热条件下能直接化合生成FeCl3,不能化合成FeCl2,B项符合题意;
C.单质H2和单质Cl2在点燃或光照下能直接化合成HCl,C项不符合题意;
D.单质Al和单质Cl2在加热条件下能直接化合成AlCl3,D项不符合题意;
答案选B。
03
练习与应用
03
练习与应用
【答案】C
【分析】从A处通入新制备的Cl2,关闭B阀时,C处的干燥红色布条看不到明显现象;当打开B阀后,C处的红色布条逐渐褪色,可知D中溶液可干燥氯气或与氯气反应,以此来解答。
【解析】①浓硫酸可干燥氯气,关闭B阀时,C处的干燥红色布条看不到明显现象,故①正确;
②NaOH溶液与氯气反应,关闭B阀时,C处的干燥红色布条看不到明显现象,故②正确;
③水与氯气反应生成次氯酸,具有漂白性,关闭B阀时,c处的干燥红色布条褪色,故③错误;
④饱和NaCl溶液与氯气不反应,且氯气与水反应生成的HClO具有漂白性,关闭B阀时,C处的干燥红色布褪色,故④错误;
故选:C。
练习与应用
04
练习与应用
04
练习与应用
05
【答案】C
【解析】能使干燥的蓝色石蕊试纸先变红后褪色,说明该物质具有酸性和漂白性,
①氯气不是酸性气体,也不具有漂白性,不能使干燥的蓝色石蕊试纸先变红后褪色;
②液氯为液态的氯气,没有酸性,也不具有漂白性,不能使干燥的蓝色石蕊试纸先变红后褪色;
③新制氯水中含有盐酸和次氯酸,次氯酸具有漂白性,则能使干燥的蓝色石蕊试纸先变红后褪色;
④NaClO溶液是碱性的,不能使干燥的蓝色石蕊试纸变红,溶液中含有HClO具有漂白性,能使干燥的蓝色石蕊试纸褪色;
⑤盐酸具有酸性,但没有漂白性,只能使干燥的蓝色石蕊试纸变红,不能褪色;
⑥盐酸与少量漂白粉的混合溶液显酸性,漂白粉的有效成分是次氯酸钙,可与氢离子结合形成次氯酸,次氯酸具有漂白性,则能使干燥的蓝色石蕊试纸先变红后褪色;
综上分析,能使干燥的蓝色石蕊试纸先变红后褪色的是③⑥,答案选C。
练习与应用
06
练习与应用
06
【答案】A
【解析】A.无水氯化钙主要是干燥氯气,碱石灰会与氯气反应,因此脱脂棉中的无水氯化钙不能用碱石灰代替,故A错误;
B.从左边出来的干燥氯气,先与干燥品红接触,品红不褪色,说明干燥的氯气没有漂白作用,故B正确;
C.由于HCl易挥发,因此挥发的HC l使湿润石蕊试纸先变红,因此不能说明生成了酸性物质,故C正确;
D.淀粉碘化钾试纸先变蓝,是碘离子被氯气氧化为单质碘,单质碘遇淀粉变蓝,说明氯气将I-氧化,故D正确;
综上所述,答案为A。
07
练习与应用
07
练习与应用
07
练习与应用
①结合化学方程式解释新制氯水光照一段时间后,pH减小的原因 。
②Ⅰ中白色沉淀为AgCl,试剂a为 。
③对比实验Ⅱ、Ⅲ、Ⅳ,可以得到的结论是 。
(7)根据(6)的结论,设计提高P中所得产物漂白效果的方案: 。
07
练习与应用
07
练习与应用
07
练习与应用
(7)由分析可知,P中所得溶液为氯化钠和次氯酸钠的混合溶液,由(6)的结论可知次氯酸具有漂白性,由次氯酸的酸性弱于碳酸可知,可向向P中所得溶液中通入过量的二氧化碳,将溶液中的次氯酸钠转化为次氯酸,使溶液的漂白性增强,由于次氯酸钠具有强氧化性,能与盐酸反应生成氯气,所以不能向P中所得溶液中加入盐酸将次氯酸钠转化为次氯酸,故答案为:向P中所得溶液中通入过量CO2。
THANK YOU
第二节 氯及其化合物
第二章 海水中的重要元素——钠和氯
第3课时 氯气的性质
认识黄绿色的气体——氯气
01
氯气与金属、非金属单质的反应
02
氯气与水、碱的反应
03
巩固提升
04
考点 · 突破
Exam Points
Breakthrough
05
探究氯水的成分与性质
EPB
考点突破
01
认识黄绿色的气体——氯气
【问题探究】
【情境】
1.氯气的发现
18世纪70年代,瑞典化学家舍勒(K.W.Scheele,1742—1786)将软锰矿(主要成分是MnO2)与浓盐酸混合加热,产生了一种能溶于水的黄绿色、有刺激性气味的气体。受当时流行学说的影响,舍勒未能确认这种气体。
2.氯气的命名
1810年,英国化学家戴维(S.H.DaVy,1778—1829)以大量事实为依据,确认这种黄绿色气体是一种新元素组成的单质,并将这种元素命名为chlorine。这一名称来自希腊文,有“绿色”的意思。中文译名曾为“绿气”,后改为“氯气”。
氯气性质的相关数据:
相对分子量:71 熔 点:-101℃ 沸 点: -34 ℃ 密 度:3.21kg/m (0℃)
1.依据上述信息中提供的氯气的性质,你如何收集一瓶这种黄绿色气体?
【解析】因Cl2的密度大于空气的密度,故可用向上排空气法收集,但不能用排水法收集。
2.氯气有毒,若遇到氯气泄漏,你应如何处理?
【解析】逆风向高处撤离并报警。
3.从氯气的发现到氯被确认为一种新元素,时间长达三十多年,其间经历了数位科学家的不懈探索。你从这一史实中得到什么启示?
【解析】①科学研究需要有正确的理论做指导,错误的理论只能浪费时间和精力;②科学研究需要以大量事实为依据,只有大量事实才能推翻错误的理论,建立正确的理论或推动科学理论的发展;③科学研究需要有热爱科学的思想和奉献科学的精神。
归纳总结
2.氯的原子结构
氯的原子结构示意图为 ,氯原子的最外层上有7个电子,在化学反应中很容易得到1个电子,使最外层达到8个电子的稳定结构。因此,氯气是很活泼的非金属单质,具有强氧化性。
3.氯气的物理性质
状态 颜色 气味 溶解性 密度
气态 黄绿色 刺激性 能溶于水 大于空气
易错点
(1)闻气体时的操作方法如右图所示。用手轻轻在集气瓶口扇动,使极少量的气体飘进鼻孔。
(2)低温和加压的条件下,氯气(Cl2)可转变为液态(称为液氯)和固态,二者都是纯净物。
(3)氯气有毒,人吸入少量氯气会使鼻和喉头的黏膜受到刺激,引起咳嗽和胸部疼痛,吸入
大量氯气会中毒致死。因此做氯气相关实验时要注意安全。
课堂练习
1.下列关于氯气或氯元素的叙述中,正确的是
A.Cl2以液态形式存在时可称作氯水 B.氯气有毒,氯离子无毒
C.氯离子和氯气均有刺激性气味 D.液氯中含有大量的氯离子
【答案】B
【解析】A.Cl2的水溶液可称作氯水,Cl2以液态形式存在时可称作液氯,故A错误;
B.氯气有毒,氯离子无毒,故B正确;C.氯离子无味、氯气有刺激性气味 ,故C错误;
D.液氯中只含有大量的氯气分子,故D错误; 选B。
2.将氯气通过软管灌入田鼠洞中可用于消灭田鼠,这是利用了Cl2的哪些性质( )
①黄绿色 ②密度比空气大 ③有毒 ④容易液化
A.①② B.②③ C.③④ D.①④
【解析】选B 氯气可以用来消灭田鼠利用了它的毒性,使田鼠中毒死亡;将氯气通过软管灌入田鼠洞中,氯气的密度比空气的大,与空气混合时,在混合气体的下部,所以能够被田鼠吸入,从而达到灭鼠的目的。
3.Cl2是有毒气体,遇到少量Cl2泄漏时,下列措施或解释不合理的是
A.用浸有浓NaOH溶液的毛巾捂住口鼻,因为NaOH能吸收Cl2
B.人群向逆风方向疏散,利用风吹动气体移动,使人群脱离Cl2气流
C.人群向高处疏散,因为Cl2密度比空气大,低处浓度高,高处浓度小
D.向泄露地点洒石灰,因为Cl2能与Ca(OH)2反应,可降低危害
【答案】A
【解析】A.氯气溶于水,且也能与碱或碱性溶液反应,氯气泄漏时,用浸有水或弱碱性溶液的毛巾捂住口鼻,但NaOH有较强的腐蚀性,不能用浓NaOH溶液的毛巾捂住口鼻,A不合理;
B.氯气朝顺风扩散较快,为避免中毒,人群朝逆风向疏散,B合理;
C.氯气密度大于空气,有少量氯气泄露时,氯气向下沉,人群应向高处疏散,C合理;
D.氯气与石灰(CaO)反应而被吸收,故D合理;
故答案选A。
EPB
考点突破
02
氯气与金属、非金属单质的反应
【情境】
[实验1] 探究氯气与金属单质的反应
白
棕褐
棕黄
【问题探究】
(1)能否通过两种单质直接化合的方法制取FeCl2?说明理由。
【解析】不能;因为Fe与Cl2化合生成的是FeCl3而不是FeCl2。
(2)常温下,能不能用钢瓶储运液氯?说明理由。
【解析】能;原因是常温下,干燥的Cl2与Fe不反应。
[实验2] 探究氯气与非金属单质(如H2)的反应
苍白
白雾
【问题探究】
(1)在点燃氢气前,需要进行的实验操作是什么?
【解析】检验氢气的纯度。
(2)通过H2在Cl2中的燃烧,你对燃烧的条件及其本质有什么新的认识?
【解析】H2在O2中可以燃烧,在Cl2中也可以燃烧,由此可知燃烧不一定有O2参加,燃烧的本质是氧化还原反应,所有的发光、发热的剧烈的氧化还原反应都称为燃烧。
归纳总结
氯气与单质的反应
易错点
(1)Cl2是具有强氧化性的非金属单质,与变价金属反应时,生成高价态的金属氯化物,如与Fe反应生成FeCl3而不是FeCl2,Cu与Cl2反应生成的是CuCl2而不是CuCl(氯化亚铜)。
(2)任何发光、发热的剧烈的氧化还原反应都称为燃烧。
(3)描述现象时,固体小颗粒分散在空气中形成“烟”,液体小液滴分散在空气中形成“雾”。
课堂练习
1.下列氯化物既可以由氯气与金属反应制得,又可以由金属与盐酸反应制得的是
A.FeCl2 B.NaCl C.AgCl D.CuCl2
【答案】B
【解析】A.氯气与铁共热发生化合反应只能生成氯化铁,不能生成氯化亚铁,故A错误;
B.钠在氯气中燃烧生成氯化钠,钠与盐酸反应生成氯化钠和氢气,故B正确;
C.银是不活泼金属,不能与盐酸反应生成氯化银,故C错误;
D.铜是不活泼金属,不能与盐酸反应生成氯化银,故D错误;
故选B。
【答案】C
【解析】A.鲜花中含有水分,氯气可能先溶解在鲜花内的水中,与水反应的产物使鲜花褪色,所以不能证明氯气有漂白作用,A正确;
B.除去氯气中的少量HCl,试剂X应具有吸收HCl但不吸收Cl2的性质,所以可选用饱和食盐水,B正确;
C.氢气在氯气中剧烈燃烧,生成的HCl在瓶口遇到水蒸气,从而产生白雾,C不正确;
D.氯气具有强氧化性,铁丝在氯气中燃烧生成氯化铁,D正确;
故选C。
3.下列实验现象描述中,正确的是
A.硫在纯净氧气中燃烧,发出淡蓝色的火焰
B.铁丝在氯气中燃烧,火星四射,生成黑色固体颗粒
C.氢气在氯气中燃烧的火焰为苍白色,瓶口有白色的烟生成
D.铜丝在氯气中燃烧产生棕黄色的烟,产物溶于少量水中呈蓝绿色溶液
【答案】D
【解析】A.硫在纯净氧气中燃烧,发出蓝紫色火焰,A错误;
B.铁丝在氯气中燃烧,产生红棕色烟,B错误;
C.氢气在氯气中燃烧,发出苍白色火焰,瓶口上方有白雾,C错误;
D.铜在氯气中燃烧,产生棕黄色烟,产物溶于水,氯化铜溶液呈蓝绿色,D正确;
答案选D。
4.下列关于对燃烧现象的认识中,不正确的是( )
A.燃烧一定是氧化还原反应
B.燃烧一定发光放热
C.燃烧一定是化学反应
D.燃烧一定有氧气参与
【解析】选D 燃烧是剧烈的发光、发热的氧化还原反应,故A、B、C正确;但燃烧不一定有氧气参与,如铁在氯气中燃烧生成氯化铁,故D错误。
EPB
考点突破
03
氯气与水、碱的反应
【问题探究】
【情境】
(一)氯气与水的反应
探究氯水的漂白性
1.为什么干燥的Cl2无漂白性,湿润的Cl2有漂白性?
【解析】湿润的Cl2有漂白性的原因是Cl2与水反应生成了HClO,HClO具有强氧化性,能漂白有色物质。
不褪色
褪色
褪色
无
有
有
2.能否用pH试纸测定氯水的pH?为什么?
【解析】不能;因为氯水中含有HClO,能将pH试纸漂白,不能测得溶液的pH。
3.Cl2与H2O的反应是氧化还原反应吗?若是,写出反应的化学方程式并分析氧化剂、还原剂分别是什么物质?
【解析】Cl2与H2O的反应中存在元素化合价的变化,是氧化还原反应,发生化合价升高和降低的都是氯元素,故Cl2既是氧化剂又是还原剂。化学方程式为Cl2+H2O===HCl+HClO。
【情境】
(二)氯气与碱的反应
【问题探究】
1.84消毒液的有效成分是 ,工业制取该漂白液的化学方程式为Cl2+2NaOH===NaCl+NaClO+H2O。
2.漂白粉的成分是 ,有效成分是 ,工业制取漂白粉的化学方程式为2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O。
NaClO
CaCl2、Ca(ClO)2
Ca(ClO)2
3.漂白粉应密封并置于阴凉处保存的原因是什么?
【解析】Ca(ClO)2与空气中的CO2和水反应生成不稳定的HClO而变质失效。
4.工业上制取漂白粉是将Cl2通入澄清石灰水还是石灰乳中?为什么?
【解析】将Cl2通入石灰乳中;原因是Ca(OH)2微溶于水,澄清石灰水中Ca(OH)2的量少,不适合工业大规模生产。
归纳总结
1. 氯气与H2O的反应
(2)氯水的性质
2.氯气与碱溶液的反应
(1)与NaOH溶液的反应:Cl2+2NaOH===NaCl+NaClO+H2O,利用此反应原理可以吸收尾气中的有毒气体Cl2,也可以制取漂白液,这种液体的主要成分是NaCl和NaClO,有效成分是NaClO。
(2)与石灰乳反应:2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O,利用此反应原理可以制取漂白粉,其主要成分是CaCl2和Ca(ClO)2,有效成分是Ca(ClO)2。如果Cl2与Ca(OH)2反应充分,并使Ca(ClO)2成为主要成分,则得到漂粉精。
3.漂白液和漂白粉的漂白原理及保存
(1)均利用“强酸制弱酸”的反应原理使其有效成分NaClO或Ca(ClO)2与较强的酸反应转化为HClO来进行漂白或消毒,如Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO,Ca(ClO)2+2HCl===CaCl2+2HClO。
(2)由于漂白液和漂白粉中的有效成分NaClO或Ca(ClO)2能够与空气中的CO2和H2O反应生成不稳定的HClO,漂白液和漂白粉应密封、避光并置于阴凉干燥处保存。
4.氯气的用途
(1)用于工业制盐酸;
(2)制漂白液、漂白粉和漂粉精;
(3)用于自来水的杀菌、消毒;
(4)用作制取其他含氯工业产品的原料。
易错点
(1)实验室中氯水需现用现配。保存氯水时,应避免光照、受热,实验室通常将氯水置于棕色试剂瓶中密封保存。
(2)光照氯水,浅黄绿色逐渐褪去,溶液的pH逐渐减小(HClO能转化为强酸HCl):2HClO2HCl+O2↑。
(3)Cl2可使湿润的蓝色石蕊试纸先变红后褪色,其原因是Cl2与水反应生成的HCl使蓝色石蕊试纸变红,具有强氧化性的HClO又将变色后的石蕊试纸氧化褪色(漂白)。
(4)在Cl2与碱溶液的反应中,Cl2既是氧化剂又是还原剂。
(5)漂白液、漂白粉和漂粉精既可作漂白棉麻、纸张的漂白剂,又可用作游泳池等场所的消毒剂。
课堂练习
1.下列关于氯气、液氯、氯水叙述正确的是
A.干燥氯气能使干燥有色纸花褪色 B.液氯为混合物
C.新制氯水中只存在2种分子 D.新制氯水长期放置在空气中,酸性增强
2.在新制氯水中存在多种分子和离子,它们在不同的反应中表现出各自的性质。下列实验现象和结论一致且正确的是
A.新制氯水呈浅黄绿色,且有刺激性气味,说明溶液中有HCl分子存在
B.用强光照射新制氯水一段时间后,溶液pH增大,说明溶液中有HCl存在
C.将铁片加入新制氯水中,有无色气泡产生,说明溶液中有HCl存在
D.Na2S溶液中滴加新制氯水,生成淡黄色的单质硫沉淀,说明新制氯水中有HClO存在
EPB
考点突破
04
探究氯水的成分与性质
【情境】
【问题探究】
1.2 mL新制氯水呈黄绿色,说明氯水中含有什么物质?
【解析】Cl2呈黄绿色,说明新制氯水中含有Cl2。
2.实验一中产生气泡的成分是什么?由实验一中的现象,说明氯水中含有的微粒是什么?写出该反应的离子方程式。
3.由实验二中的现象,说明氯水有哪些性质?
【解析】氯水能使紫色石蕊溶液变红,说明氯水具有酸性,一段时间后红色褪去,说明氯水具有漂白性。
4.实验三中2 mL新制氯水在太阳光下放置发生的反应是什么?实验中“红色不褪去”的原因是什么?
【解析】氯水中的HClO光照发生分解,反应的化学方程式为2HClO 2HCl+O2↑;长时间放置氯水中无HClO,失去漂白性,故红色不褪去。
5.由实验四中的现象,说明氯水中含有的微粒是什么?写出反应的离子方程式。
【解析】Cl-,Ag++Cl-===AgCl↓。
归纳总结
1.新制氯水的性质
在不同的反应中,新制氯水中起作用的成分不同
2.次氯酸的漂白作用
3.液氯、新制氯水和久置氯水的比较
易错点
课堂练习
EPB
考点突破
05
巩固提升
01
练习与应用
1.下列关于氯气的说法中,不正确的是
A.常温常压下是黄绿色气体 B.能溶解于水且与水发生反应
C.相同条件下,密度比空气小 D.有刺激性气味,有毒
【答案】C
【解析】A.常温常压下氯气是黄绿色气体,A正确;
B.氯气能溶于水,并能与水反应生成盐酸和次氯酸,B正确;
C.相同条件下氯气的密度比空气大,C错误;
D.氯气是一种有刺激性气味的黄绿色有毒气体,D正确;
故选C。
练习与应用
02
2.下列物质中,不能由单质直接化合生成的是
A.CuCl2 B.FeCl2 C.HCl D.AlCl3
【答案】B
【解析】A.单质Cu与单质Cl2在加热条件下能直接化合成CuCl2,A项不符合题意;
B.单质Fe与单质Cl2在加热条件下能直接化合生成FeCl3,不能化合成FeCl2,B项符合题意;
C.单质H2和单质Cl2在点燃或光照下能直接化合成HCl,C项不符合题意;
D.单质Al和单质Cl2在加热条件下能直接化合成AlCl3,D项不符合题意;
答案选B。
03
练习与应用
03
练习与应用
【答案】C
【分析】从A处通入新制备的Cl2,关闭B阀时,C处的干燥红色布条看不到明显现象;当打开B阀后,C处的红色布条逐渐褪色,可知D中溶液可干燥氯气或与氯气反应,以此来解答。
【解析】①浓硫酸可干燥氯气,关闭B阀时,C处的干燥红色布条看不到明显现象,故①正确;
②NaOH溶液与氯气反应,关闭B阀时,C处的干燥红色布条看不到明显现象,故②正确;
③水与氯气反应生成次氯酸,具有漂白性,关闭B阀时,c处的干燥红色布条褪色,故③错误;
④饱和NaCl溶液与氯气不反应,且氯气与水反应生成的HClO具有漂白性,关闭B阀时,C处的干燥红色布褪色,故④错误;
故选:C。
练习与应用
04
练习与应用
04
练习与应用
05
【答案】C
【解析】能使干燥的蓝色石蕊试纸先变红后褪色,说明该物质具有酸性和漂白性,
①氯气不是酸性气体,也不具有漂白性,不能使干燥的蓝色石蕊试纸先变红后褪色;
②液氯为液态的氯气,没有酸性,也不具有漂白性,不能使干燥的蓝色石蕊试纸先变红后褪色;
③新制氯水中含有盐酸和次氯酸,次氯酸具有漂白性,则能使干燥的蓝色石蕊试纸先变红后褪色;
④NaClO溶液是碱性的,不能使干燥的蓝色石蕊试纸变红,溶液中含有HClO具有漂白性,能使干燥的蓝色石蕊试纸褪色;
⑤盐酸具有酸性,但没有漂白性,只能使干燥的蓝色石蕊试纸变红,不能褪色;
⑥盐酸与少量漂白粉的混合溶液显酸性,漂白粉的有效成分是次氯酸钙,可与氢离子结合形成次氯酸,次氯酸具有漂白性,则能使干燥的蓝色石蕊试纸先变红后褪色;
综上分析,能使干燥的蓝色石蕊试纸先变红后褪色的是③⑥,答案选C。
练习与应用
06
练习与应用
06
【答案】A
【解析】A.无水氯化钙主要是干燥氯气,碱石灰会与氯气反应,因此脱脂棉中的无水氯化钙不能用碱石灰代替,故A错误;
B.从左边出来的干燥氯气,先与干燥品红接触,品红不褪色,说明干燥的氯气没有漂白作用,故B正确;
C.由于HCl易挥发,因此挥发的HC l使湿润石蕊试纸先变红,因此不能说明生成了酸性物质,故C正确;
D.淀粉碘化钾试纸先变蓝,是碘离子被氯气氧化为单质碘,单质碘遇淀粉变蓝,说明氯气将I-氧化,故D正确;
综上所述,答案为A。
07
练习与应用
07
练习与应用
07
练习与应用
①结合化学方程式解释新制氯水光照一段时间后,pH减小的原因 。
②Ⅰ中白色沉淀为AgCl,试剂a为 。
③对比实验Ⅱ、Ⅲ、Ⅳ,可以得到的结论是 。
(7)根据(6)的结论,设计提高P中所得产物漂白效果的方案: 。
07
练习与应用
07
练习与应用
07
练习与应用
(7)由分析可知,P中所得溶液为氯化钠和次氯酸钠的混合溶液,由(6)的结论可知次氯酸具有漂白性,由次氯酸的酸性弱于碳酸可知,可向向P中所得溶液中通入过量的二氧化碳,将溶液中的次氯酸钠转化为次氯酸,使溶液的漂白性增强,由于次氯酸钠具有强氧化性,能与盐酸反应生成氯气,所以不能向P中所得溶液中加入盐酸将次氯酸钠转化为次氯酸,故答案为:向P中所得溶液中通入过量CO2。
THANK YOU
