【考点突破】第二章第4课时 氯气的实验室制法氯离子的检验-2024~2025学年高一化学同步课件(共34张PPT)(人教版2019必修第一册)
文档属性
| 名称 | 【考点突破】第二章第4课时 氯气的实验室制法氯离子的检验-2024~2025学年高一化学同步课件(共34张PPT)(人教版2019必修第一册) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-22 18:46:32 | ||
图片预览






文档简介
(共34张PPT)
第二节 氯及其化合物
第二章 海水中的重要元素——钠和氯
第3课时 氯气的实验室制法 氯离子的检验
氯气的实验室制法
01
氯离子的检验
02
巩固提升
03
考点 · 突破
Exam Points
Breakthrough
EPB
考点突破
01
氯气的实验室制法
【问题探究】
【情境】
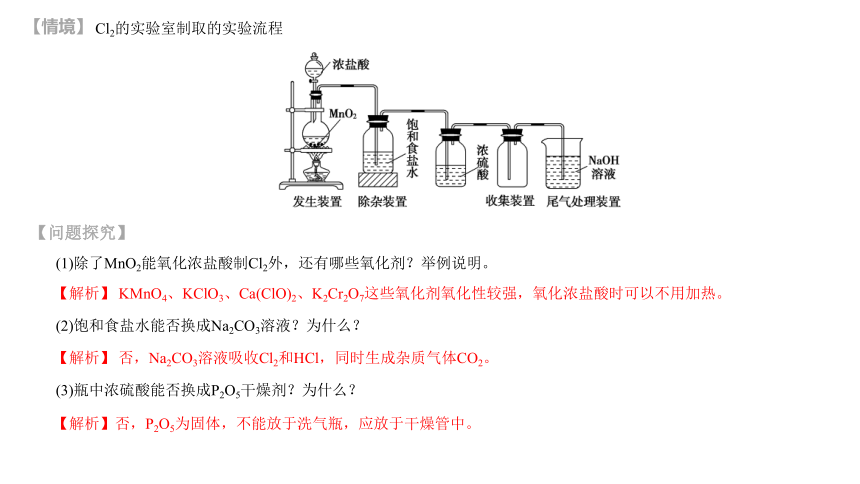
Cl2的实验室制取的实验流程
(1)除了MnO2能氧化浓盐酸制Cl2外,还有哪些氧化剂?举例说明。
【解析】 KMnO4、KClO3、Ca(ClO)2、K2Cr2O7这些氧化剂氧化性较强,氧化浓盐酸时可以不用加热。
(2)饱和食盐水能否换成Na2CO3溶液?为什么?
【解析】 否,Na2CO3溶液吸收Cl2和HCl,同时生成杂质气体CO2。
(3)瓶中浓硫酸能否换成P2O5干燥剂?为什么?
【解析】否,P2O5为固体,不能放于洗气瓶,应放于干燥管中。
(4)上述两个除杂装置能否颠倒?为什么?
【解析】 否,若颠倒收集不到干燥的Cl2。
(5)收集Cl2除了用向上排空气法外还可用什么法?
【解析】 排饱和食盐水法。
(6)若MnO2足量,浓盐酸能完全反应吗?为什么?
【解析】 不能,当浓盐酸变稀时,反应可能停止。
(7)某同学认为可以用澄清石灰水代替氢氧化钠溶液进行尾气处理,同时还可以制得漂白粉,你认为该同学的想法是否合理?
【解析】 不合理。澄清石灰水的浓度很小,不能确保氯气被完全吸收,制备漂白粉应该利用氯气与石灰乳反应。
(8)如何检验Cl2
【解析】 使湿润的淀粉KI试纸放于管口,试纸变蓝或使湿润的蓝色石蕊试纸放于管口,试纸先变红后褪色。
归纳总结
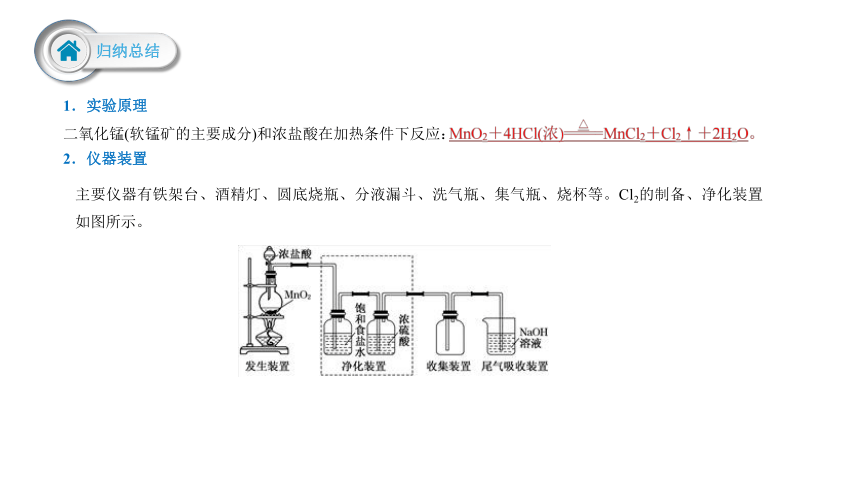
1.实验原理
二氧化锰(软锰矿的主要成分)和浓盐酸在加热条件下反应:
2.仪器装置
主要仪器有铁架台、酒精灯、圆底烧瓶、分液漏斗、洗气瓶、集气瓶、烧杯等。Cl2的制备、净化装置如图所示。
发生装置 固体(液体)+液体 气体
净化装置 (洗气瓶) 先通过饱和食盐水除去 ,再通过浓H2SO4除去
收集装置 用 排空气法收集
验满方法 Ⅰ.观察法(黄绿色);Ⅱ.湿润的淀粉 KI试纸,其原理是Cl2+2KI===2KCl+I2,置换出的I2遇淀粉变蓝色;Ⅲ.湿润的蓝色石蕊试纸(先变红后褪色)
尾气吸收装置 盛有NaOH溶液的烧杯
HCl
水蒸气
向上
易错点
(1)实验室用MnO2和盐酸制Cl2,盐酸必须为浓盐酸,随着反应的进行,盐酸的浓度逐渐减小,变成稀盐酸时,反应停止。
(2)在MnO2和浓盐酸的反应中,浓盐酸既起还原剂的作用,又起酸的作用,体现了还原性和酸性。
(3)一般不用澄清石灰水来吸收Cl2,原因是Ca(OH)2在水中的溶解度很小,不能将Cl2吸收完全。
【方法技巧】
有气体参加的探究实验模板
【知识拓展】
实验室制取氯气的其他方法
用KMnO4、KClO3、Ca(ClO)2、K2Cr2O7等氧化剂代替MnO2制取氯气,反应不需加热且反应速率较快,如:①2KMnO4+16HCl(浓)===2MnCl2+2KCl+5Cl2↑+8H2O
②KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
③Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O
④K2Cr2O7+14HCl(浓)===2CrCl3+2KCl+3Cl2↑+7H2O
注意:上述反应中,浓盐酸均表现出还原性和酸性。①和④反应中,Cl2是氧化产物;②和③反应中,Cl2既是氧化产物,又是还原产物。
课堂练习
【答案】D
【解析】A.二氧化锰与浓盐酸共热反应生成氯化锰、氯气和水,则题给装置无法达到制取氯气的实验目的,故A错误;
B.混合气体先后通过盛有浓硫酸、饱和食盐水的洗气瓶得到的氯气中混有水蒸气,则题给装置无法达到除去氯气中混有的少量氯化氢和水蒸气的实验目的,故B错误;
C.氯气与水反应生成盐酸和次氯酸的反应是可逆反应,可逆反应不可能完全反应,所以不能用水吸收氯气,则题给装置无法达到吸收多余氯气,防止污染空气的实验目的,故C错误;
D.二氧化锰难溶于水,氯化锰溶于水,则题给装置能达到分离出二氧化锰固体的实验目的,故D正确;
故选D。
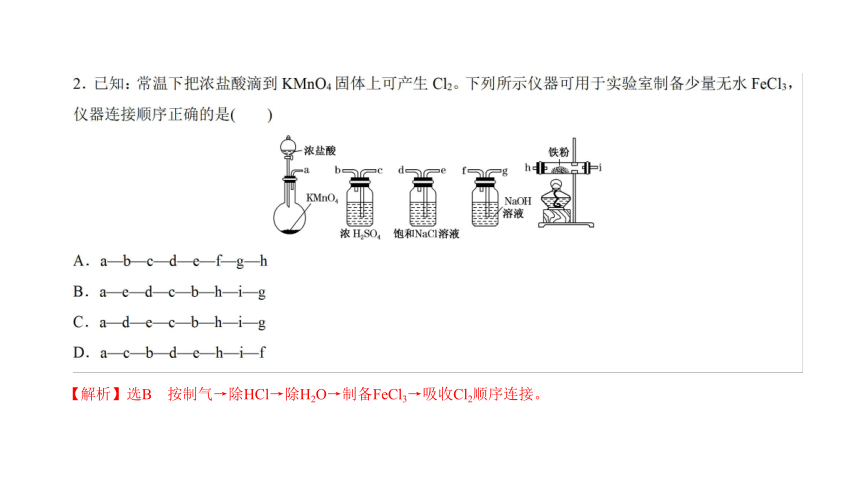
【解析】选B 按制气→除HCl→除H2O→制备FeCl3→吸收Cl2顺序连接。
EPB
考点突破
02
氯离子的检验
【情境】
试管 试剂 实验现象
加入AgNO3溶液 加入稀硝酸
Ⅰ 稀盐酸 白色沉淀 沉淀不溶解
Ⅱ NaCl溶液 白色沉淀 沉淀不溶解
Ⅲ Na2CO3溶液 白色沉淀 沉淀溶解
Ⅳ 蒸馏水 无明显现象 无明显现象
在Ⅰ~Ⅳ四支试管中分别加入2~3 mL稀盐酸、NaCl溶液、Na2CO3溶液、蒸馏水,然后各滴入几滴AgNO3溶液,观察现象,再分别加入少量稀硝酸,观察现象。
(1)试管Ⅰ、试管Ⅱ中均产生了不溶于稀硝酸的白色沉淀,说明反应生成了 ;反应的离子方程式为
。
AgCl
Ag++Cl-===AgCl↓
(2)试管Ⅲ中产生的白色沉淀是 ,写出该沉淀溶于稀硝酸的离子方程式:Ag2CO3+2H+===2Ag++H2O+CO2↑。
Ag2CO3
【问题探究】
1.检验Cl-时,能否用稀盐酸进行酸化?
【解析】不能;因为盐酸中含有Cl-,会影响到Cl-的检验。
2.检验Cl-时,加入稀硝酸的目的是什么?
【解析】排除CO32—造成的干扰,因Ag2CO3也是一种不溶于水的白色沉淀,但Ag2CO3能溶于稀硝酸,故先向待测液中加入稀硝酸,再加入AgNO3溶液检验Cl-。
3.若溶液中同时含有SO42—和Cl-,如何设计实验检验Cl-的存在?
【解析】先加入足量的Ba(NO3)2溶液,过滤后取滤液(或静置后取上层清液),再加入稀硝酸酸化,最后加入AgNO3溶液,若生成白色沉淀,说明含有Cl-。
归纳总结
氯离子的检验及答题规范
易错点
课堂练习
【答案】D
【解析】A.取样,滴加AgNO3溶液,生成的白色沉淀可能是碳酸银,故A错误;
B.取样,先加盐酸酸化,再加入AgNO3溶液,生成的白色沉淀可能是由盐酸引入的氯离子和硝酸银反应生成的氯化银,不能证明原来是否有氯离子,故B错误;
C.取样,加入少量AgNO3溶液,生成的白色沉淀可能是碳酸银,再加稀盐酸,碳酸银转化为氯化银,白色沉淀也不消失,不能证明原来是否有氯离子,故C错误;
D.取样,先加稀硝酸酸化,再加入AgNO3溶液,此时若生成白色沉淀,只能是由银离子生成的不溶于稀硝酸的氯化银,即能证明原溶液是否存在氯离子,故D正确;
故答案为:D。
3.检验溶液中的氯离子时加入稀硝酸的目的是
A.加速沉淀反应的进行 B.排除杂质离子的干扰 C.增加沉淀的生成量 D.减少沉淀的生成量
【答案】B
【解析】检验Cl-,常利用其与AgNO3溶液反应生成白色沉淀来检验,但与AgNO3溶液反应生成白色沉淀的离子还含有碳酸根离子,所以一般要用硝酸酸化的AgNO3溶液,以除去碳酸根离子的干扰。
故选B。
EPB
考点突破
03
巩固提升
01
练习与应用
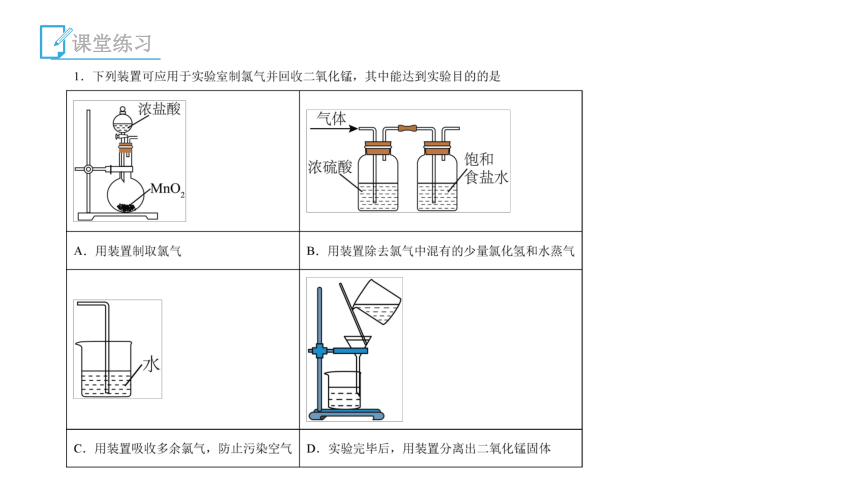
1.下列关于实验室用MnO2制取Cl2的叙述中,不正确的是( )
A.MnO2与浓盐酸共热
B.缓慢加热反应
C.用向下排空气法收集Cl2
D.多余氯气常用较浓的碱液吸收
【解析】选C 由于浓盐酸易挥发,故必须缓慢加热以减少HCl的挥发;Cl2的密度比空气的密度大,故应用向上排空气法收集Cl2;Cl2极易与碱反应:Cl2+2NaOH===NaCl+NaClO+H2O,故应用较浓的碱液吸收多余的Cl2。
练习与应用
02
练习与应用
02
【答案】D
【解析】A.二氧化锰与浓盐酸共热反应生成氯化锰、氯气和水,则题给装置无法达到制取氯气的实验目的,故A错误;
B.混合气体先后通过盛有浓硫酸、饱和食盐水的洗气瓶得到的氯气中混有水蒸气,则题给装置无法达到除去氯气中混有的少量氯化氢和水蒸气的实验目的,故B错误;
C.氯气与水反应生成盐酸和次氯酸的反应是可逆反应,可逆反应不可能完全反应,所以不能用水吸收氯气,则题给装置无法达到吸收多余氯气,防止污染空气的实验目的,故C错误;
D.二氧化锰难溶于水,氯化锰溶于水,则题给装置能达到分离出二氧化锰固体的实验目的,故D正确;
故选D。
03
练习与应用
03
练习与应用
【答案】B
【分析】“84消毒液”(主要成分是NaClO)制备氯气发生:ClO-+Cl-+2H+=Cl2↑+H2O;氯气氧化碘离子生成碘单质遇碘变蓝,氯气能氧化溴离子生成溴单质,最后氯气和氢氧化钠反应生成次氯酸钠、氯化钠和水。
【解析】A.a处变为蓝色,说明氯气和KI反应生成氯化钾和I2,b处变为橙色,说明氯气与KBr反应生成KCl和Br2,说明Cl2具有氧化性,不能说明氧化性:Cl2>Br2>I2,故A错误;
B.试管内产生的氯气中含有HCl气体,c处高锰酸钾褪色,是因为高锰酸钾被HCl还原,体现浓盐酸的挥发性和还原性,故B正确;
C.氯气和氢氧化钠反应生成氯化钠和次氯酸钠,d处褪色,可能因酚酞被氧化而引起,也可能是氢氧化钠被消耗而引起,故C错误;
D.为防止尾气污染空气,应使用氢氧化钠溶液吸收尾气,故D错误;
故选B。
练习与应用
04
练习与应用
04
练习与应用
05
5.检验某未知溶液中是否含有氯离子(Cl-),正确的操作是( )
A.向未知溶液中加入AgNO3溶液,有白色沉淀产生
B.向未知溶液中加入AgNO3溶液,有白色沉淀产生,加入盐酸,沉淀不消失
C.向未知溶液中加入稀硝酸酸化后,再加入AgNO3溶液,有白色沉淀产生
D.向未知溶液中加入稀盐酸酸化后,再加入AgNO3溶液,有白色沉淀产生
练习与应用
06
练习与应用
06
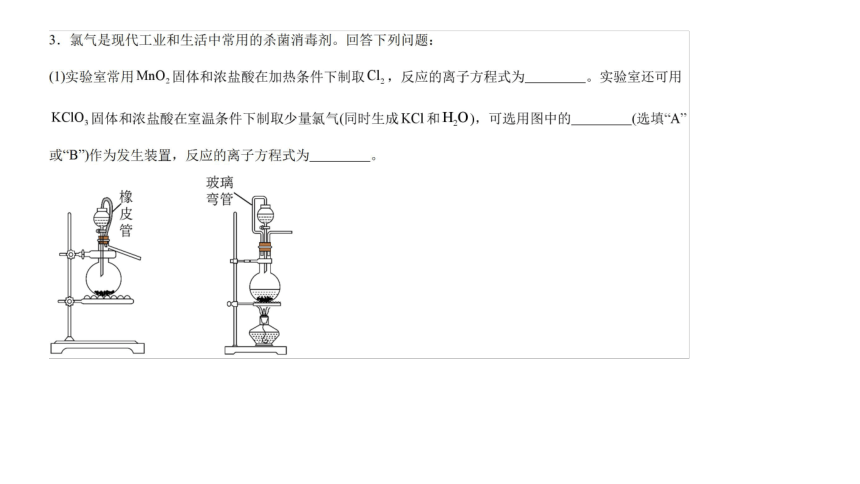
【解析】 (1)按照制备气体的“反应装置→净化装置→收集装置→尾气处理装置”的顺序可确定仪器连接的正确顺序。(2)装置中饱和食盐水的作用是除去Cl2中HCl杂质;浓硫酸的作用是除去Cl2中的水蒸气;NaOH溶液的作用是吸收过量的Cl2。(3)湿润的淀粉 KI试纸遇Cl2时发生反应:Cl2+2KI===2KCl+I2,I2遇淀粉变蓝色。
【答案】 (1)E C D A B H G F
(2)除去氯气中的HCl杂质 吸收过量的氯气
(3)试纸变蓝 2KI+Cl2===2KCl+I2
(4)①MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
②2NaOH+Cl2===NaCl+NaClO+H2O
07
练习与应用
07
练习与应用
THANK YOU
第二节 氯及其化合物
第二章 海水中的重要元素——钠和氯
第3课时 氯气的实验室制法 氯离子的检验
氯气的实验室制法
01
氯离子的检验
02
巩固提升
03
考点 · 突破
Exam Points
Breakthrough
EPB
考点突破
01
氯气的实验室制法
【问题探究】
【情境】
Cl2的实验室制取的实验流程
(1)除了MnO2能氧化浓盐酸制Cl2外,还有哪些氧化剂?举例说明。
【解析】 KMnO4、KClO3、Ca(ClO)2、K2Cr2O7这些氧化剂氧化性较强,氧化浓盐酸时可以不用加热。
(2)饱和食盐水能否换成Na2CO3溶液?为什么?
【解析】 否,Na2CO3溶液吸收Cl2和HCl,同时生成杂质气体CO2。
(3)瓶中浓硫酸能否换成P2O5干燥剂?为什么?
【解析】否,P2O5为固体,不能放于洗气瓶,应放于干燥管中。
(4)上述两个除杂装置能否颠倒?为什么?
【解析】 否,若颠倒收集不到干燥的Cl2。
(5)收集Cl2除了用向上排空气法外还可用什么法?
【解析】 排饱和食盐水法。
(6)若MnO2足量,浓盐酸能完全反应吗?为什么?
【解析】 不能,当浓盐酸变稀时,反应可能停止。
(7)某同学认为可以用澄清石灰水代替氢氧化钠溶液进行尾气处理,同时还可以制得漂白粉,你认为该同学的想法是否合理?
【解析】 不合理。澄清石灰水的浓度很小,不能确保氯气被完全吸收,制备漂白粉应该利用氯气与石灰乳反应。
(8)如何检验Cl2
【解析】 使湿润的淀粉KI试纸放于管口,试纸变蓝或使湿润的蓝色石蕊试纸放于管口,试纸先变红后褪色。
归纳总结
1.实验原理
二氧化锰(软锰矿的主要成分)和浓盐酸在加热条件下反应:
2.仪器装置
主要仪器有铁架台、酒精灯、圆底烧瓶、分液漏斗、洗气瓶、集气瓶、烧杯等。Cl2的制备、净化装置如图所示。
发生装置 固体(液体)+液体 气体
净化装置 (洗气瓶) 先通过饱和食盐水除去 ,再通过浓H2SO4除去
收集装置 用 排空气法收集
验满方法 Ⅰ.观察法(黄绿色);Ⅱ.湿润的淀粉 KI试纸,其原理是Cl2+2KI===2KCl+I2,置换出的I2遇淀粉变蓝色;Ⅲ.湿润的蓝色石蕊试纸(先变红后褪色)
尾气吸收装置 盛有NaOH溶液的烧杯
HCl
水蒸气
向上
易错点
(1)实验室用MnO2和盐酸制Cl2,盐酸必须为浓盐酸,随着反应的进行,盐酸的浓度逐渐减小,变成稀盐酸时,反应停止。
(2)在MnO2和浓盐酸的反应中,浓盐酸既起还原剂的作用,又起酸的作用,体现了还原性和酸性。
(3)一般不用澄清石灰水来吸收Cl2,原因是Ca(OH)2在水中的溶解度很小,不能将Cl2吸收完全。
【方法技巧】
有气体参加的探究实验模板
【知识拓展】
实验室制取氯气的其他方法
用KMnO4、KClO3、Ca(ClO)2、K2Cr2O7等氧化剂代替MnO2制取氯气,反应不需加热且反应速率较快,如:①2KMnO4+16HCl(浓)===2MnCl2+2KCl+5Cl2↑+8H2O
②KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O
③Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O
④K2Cr2O7+14HCl(浓)===2CrCl3+2KCl+3Cl2↑+7H2O
注意:上述反应中,浓盐酸均表现出还原性和酸性。①和④反应中,Cl2是氧化产物;②和③反应中,Cl2既是氧化产物,又是还原产物。
课堂练习
【答案】D
【解析】A.二氧化锰与浓盐酸共热反应生成氯化锰、氯气和水,则题给装置无法达到制取氯气的实验目的,故A错误;
B.混合气体先后通过盛有浓硫酸、饱和食盐水的洗气瓶得到的氯气中混有水蒸气,则题给装置无法达到除去氯气中混有的少量氯化氢和水蒸气的实验目的,故B错误;
C.氯气与水反应生成盐酸和次氯酸的反应是可逆反应,可逆反应不可能完全反应,所以不能用水吸收氯气,则题给装置无法达到吸收多余氯气,防止污染空气的实验目的,故C错误;
D.二氧化锰难溶于水,氯化锰溶于水,则题给装置能达到分离出二氧化锰固体的实验目的,故D正确;
故选D。
【解析】选B 按制气→除HCl→除H2O→制备FeCl3→吸收Cl2顺序连接。
EPB
考点突破
02
氯离子的检验
【情境】
试管 试剂 实验现象
加入AgNO3溶液 加入稀硝酸
Ⅰ 稀盐酸 白色沉淀 沉淀不溶解
Ⅱ NaCl溶液 白色沉淀 沉淀不溶解
Ⅲ Na2CO3溶液 白色沉淀 沉淀溶解
Ⅳ 蒸馏水 无明显现象 无明显现象
在Ⅰ~Ⅳ四支试管中分别加入2~3 mL稀盐酸、NaCl溶液、Na2CO3溶液、蒸馏水,然后各滴入几滴AgNO3溶液,观察现象,再分别加入少量稀硝酸,观察现象。
(1)试管Ⅰ、试管Ⅱ中均产生了不溶于稀硝酸的白色沉淀,说明反应生成了 ;反应的离子方程式为
。
AgCl
Ag++Cl-===AgCl↓
(2)试管Ⅲ中产生的白色沉淀是 ,写出该沉淀溶于稀硝酸的离子方程式:Ag2CO3+2H+===2Ag++H2O+CO2↑。
Ag2CO3
【问题探究】
1.检验Cl-时,能否用稀盐酸进行酸化?
【解析】不能;因为盐酸中含有Cl-,会影响到Cl-的检验。
2.检验Cl-时,加入稀硝酸的目的是什么?
【解析】排除CO32—造成的干扰,因Ag2CO3也是一种不溶于水的白色沉淀,但Ag2CO3能溶于稀硝酸,故先向待测液中加入稀硝酸,再加入AgNO3溶液检验Cl-。
3.若溶液中同时含有SO42—和Cl-,如何设计实验检验Cl-的存在?
【解析】先加入足量的Ba(NO3)2溶液,过滤后取滤液(或静置后取上层清液),再加入稀硝酸酸化,最后加入AgNO3溶液,若生成白色沉淀,说明含有Cl-。
归纳总结
氯离子的检验及答题规范
易错点
课堂练习
【答案】D
【解析】A.取样,滴加AgNO3溶液,生成的白色沉淀可能是碳酸银,故A错误;
B.取样,先加盐酸酸化,再加入AgNO3溶液,生成的白色沉淀可能是由盐酸引入的氯离子和硝酸银反应生成的氯化银,不能证明原来是否有氯离子,故B错误;
C.取样,加入少量AgNO3溶液,生成的白色沉淀可能是碳酸银,再加稀盐酸,碳酸银转化为氯化银,白色沉淀也不消失,不能证明原来是否有氯离子,故C错误;
D.取样,先加稀硝酸酸化,再加入AgNO3溶液,此时若生成白色沉淀,只能是由银离子生成的不溶于稀硝酸的氯化银,即能证明原溶液是否存在氯离子,故D正确;
故答案为:D。
3.检验溶液中的氯离子时加入稀硝酸的目的是
A.加速沉淀反应的进行 B.排除杂质离子的干扰 C.增加沉淀的生成量 D.减少沉淀的生成量
【答案】B
【解析】检验Cl-,常利用其与AgNO3溶液反应生成白色沉淀来检验,但与AgNO3溶液反应生成白色沉淀的离子还含有碳酸根离子,所以一般要用硝酸酸化的AgNO3溶液,以除去碳酸根离子的干扰。
故选B。
EPB
考点突破
03
巩固提升
01
练习与应用
1.下列关于实验室用MnO2制取Cl2的叙述中,不正确的是( )
A.MnO2与浓盐酸共热
B.缓慢加热反应
C.用向下排空气法收集Cl2
D.多余氯气常用较浓的碱液吸收
【解析】选C 由于浓盐酸易挥发,故必须缓慢加热以减少HCl的挥发;Cl2的密度比空气的密度大,故应用向上排空气法收集Cl2;Cl2极易与碱反应:Cl2+2NaOH===NaCl+NaClO+H2O,故应用较浓的碱液吸收多余的Cl2。
练习与应用
02
练习与应用
02
【答案】D
【解析】A.二氧化锰与浓盐酸共热反应生成氯化锰、氯气和水,则题给装置无法达到制取氯气的实验目的,故A错误;
B.混合气体先后通过盛有浓硫酸、饱和食盐水的洗气瓶得到的氯气中混有水蒸气,则题给装置无法达到除去氯气中混有的少量氯化氢和水蒸气的实验目的,故B错误;
C.氯气与水反应生成盐酸和次氯酸的反应是可逆反应,可逆反应不可能完全反应,所以不能用水吸收氯气,则题给装置无法达到吸收多余氯气,防止污染空气的实验目的,故C错误;
D.二氧化锰难溶于水,氯化锰溶于水,则题给装置能达到分离出二氧化锰固体的实验目的,故D正确;
故选D。
03
练习与应用
03
练习与应用
【答案】B
【分析】“84消毒液”(主要成分是NaClO)制备氯气发生:ClO-+Cl-+2H+=Cl2↑+H2O;氯气氧化碘离子生成碘单质遇碘变蓝,氯气能氧化溴离子生成溴单质,最后氯气和氢氧化钠反应生成次氯酸钠、氯化钠和水。
【解析】A.a处变为蓝色,说明氯气和KI反应生成氯化钾和I2,b处变为橙色,说明氯气与KBr反应生成KCl和Br2,说明Cl2具有氧化性,不能说明氧化性:Cl2>Br2>I2,故A错误;
B.试管内产生的氯气中含有HCl气体,c处高锰酸钾褪色,是因为高锰酸钾被HCl还原,体现浓盐酸的挥发性和还原性,故B正确;
C.氯气和氢氧化钠反应生成氯化钠和次氯酸钠,d处褪色,可能因酚酞被氧化而引起,也可能是氢氧化钠被消耗而引起,故C错误;
D.为防止尾气污染空气,应使用氢氧化钠溶液吸收尾气,故D错误;
故选B。
练习与应用
04
练习与应用
04
练习与应用
05
5.检验某未知溶液中是否含有氯离子(Cl-),正确的操作是( )
A.向未知溶液中加入AgNO3溶液,有白色沉淀产生
B.向未知溶液中加入AgNO3溶液,有白色沉淀产生,加入盐酸,沉淀不消失
C.向未知溶液中加入稀硝酸酸化后,再加入AgNO3溶液,有白色沉淀产生
D.向未知溶液中加入稀盐酸酸化后,再加入AgNO3溶液,有白色沉淀产生
练习与应用
06
练习与应用
06
【解析】 (1)按照制备气体的“反应装置→净化装置→收集装置→尾气处理装置”的顺序可确定仪器连接的正确顺序。(2)装置中饱和食盐水的作用是除去Cl2中HCl杂质;浓硫酸的作用是除去Cl2中的水蒸气;NaOH溶液的作用是吸收过量的Cl2。(3)湿润的淀粉 KI试纸遇Cl2时发生反应:Cl2+2KI===2KCl+I2,I2遇淀粉变蓝色。
【答案】 (1)E C D A B H G F
(2)除去氯气中的HCl杂质 吸收过量的氯气
(3)试纸变蓝 2KI+Cl2===2KCl+I2
(4)①MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
②2NaOH+Cl2===NaCl+NaClO+H2O
07
练习与应用
07
练习与应用
THANK YOU
