【考点突破】第一章第6课时 氧化剂和还原剂-2024~2025学年高一化学同步课件(共46张PPT)(人教版2019必修第一册)
文档属性
| 名称 | 【考点突破】第一章第6课时 氧化剂和还原剂-2024~2025学年高一化学同步课件(共46张PPT)(人教版2019必修第一册) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-22 00:00:00 | ||
图片预览










文档简介
(共46张PPT)
第一节 物质的分类与转化
第一章 物质及其变化
第6课时 氧化剂和还原剂
氧化剂和还原剂
01
氧化还原反应的应用
02
氧化性、还原性强弱的判断
03
课堂练习与巩固提升
04
考点 · 突破
Exam Points
Breakthrough
05
氧化还原反应方程式的配平
EPB
考点突破
01
氧化剂和还原剂
【问题探究】
【情境】
1.通过阅读月饼盒中小包装袋的文字说明,分析月饼盒中为什么要放小包装袋。
【解析】脱氧剂中的铁粉与袋内O2发生反应,减缓油脂的氧化作用,延长月饼的保质期。
2.根据脱氧剂发生的反应,分析元素化合价的变化,并指出物质在反应中起到的作用。
【解析】(1)反应中,铁单质的化合价为 价,处于铁元素的最低价态,所以Fe具有 ,作 剂,铁元素被 。
(2)反应中,氧元素的化合价由 价降低到 价,O2得到电子作 ,O2具有 性,氧元素被 。
0
还原性
还原
氧化
0
-2
氧化剂
氧化
还原
归纳总结
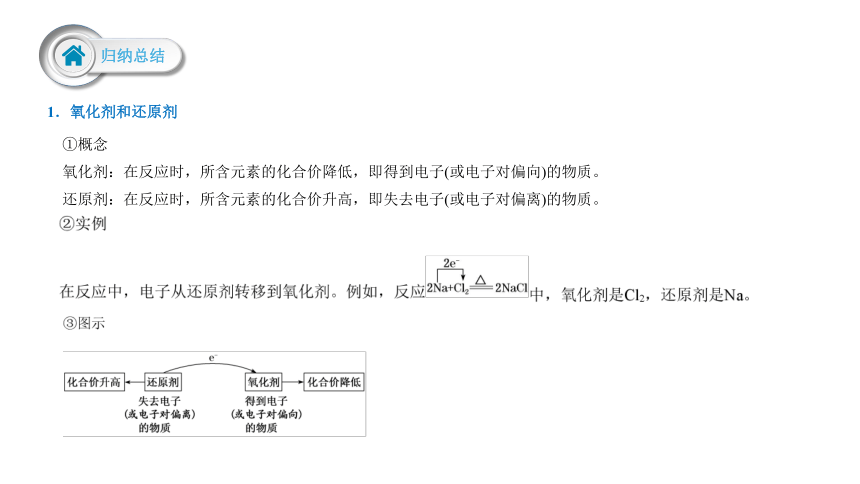
1.氧化剂和还原剂
①概念
氧化剂:在反应时,所含元素的化合价降低,即得到电子(或电子对偏向)的物质。
还原剂:在反应时,所含元素的化合价升高,即失去电子(或电子对偏离)的物质。
2.氧化产物和还原产物
氧化产物:还原剂发生氧化反应后的生成物,即化合价升高的元素的产物。
还原产物:氧化剂发生还原反应后的生成物,即化合价降低的元素的产物。
3.氧化性和还原性
氧化性:即得到电子的能力。
在氧化还原反应中,氧化剂具有氧化性。
还原性:即失去电子的能力。
在氧化还原反应中,还原剂具有还原性。
4.氧化性、还原性和元素化合价之间的关系
5.常见的氧化剂和还原剂
物质种类 常见物质
氧化剂 部分非金属单质 O2、Cl2等
含有高价态元素的化合物 浓硫酸、HNO3、KMnO4、MnO2、KClO3、K2Cr2O7等
某些金属活动性较弱的元素对应的高价态离子 Fe3+、Ag+、Pb4+、Cu2+等
过氧化物 Na2O2、H2O2等
还原剂 活泼的金属单质 Al、Zn等
某些非金属单质 C、H2等
非金属阴离子和氢化物 Cl-、Br-、I-、S2-、HI、NH3、H2S等
含有较低价态元素的化合物 CO、SO2、H2SO3、Na2SO3、FeSO4等
易错点
(1)在一个氧化还原反应中,氧化剂和还原剂同时存在,它们可以是不同的物质,也可以是同一物质。例如,在反应Cl2+2NaOH===NaCl+NaClO+H2O中,Cl2既是氧化剂,又是还原剂。
(2)物质氧化性、还原性的强弱与得失电子的难易程度有关,而与得失电子的多少无关。例如,1 个钠原子失电子数小于1个铝原子,但还原性Na>Al。
(3)某元素由化合态变为游离态时,不一定被还原,因为元素处于化合态时,其化合价可能为正值,也可能为负值。如在反应2H2O2H2↑+O2↑中,氢元素被还原,而氧元素被氧化。
课堂练习
【答案】C
【解析】由方程式可知,反应中氮元素的化合价由0价降为-3价,N2被还原,氮气是反应的氧化剂,故选C。
4.在下列反应中,水作还原剂的是
A.2F2+2H2O=4HF+O2
B.2Na+2H2O=2NaOH+H2↑
C.Cl2+H2O=HCl+HClO
D.CO2+H2O=H2CO3
【答案】A
【解析】A.F元素的化合价降低,水中O元素的化合价升高,则水为还原剂,A正确;
B.没有元素的化合价变化,不发生氧化还原反应,B错误;
C.水中H元素的化合价降低,则水为氧化剂,C错误;
D.只有Cl元素的化合价变化,水既不是氧化剂也不是还原剂,D错误;
故选A。
EPB
考点突破
02
氧化还原反应的应用
【问题探究】
【情境】
汽车尾气系统中安装了催化转化器(见图),在催化转化器中,汽车尾气中的CO和NO在催化剂的作用下转化成了无毒的CO2和N2。涉及的化学反应分别是:
1.反应①②是否都是氧化还原反应?若是,请指出反应中的氧化剂和还原剂。
【解析】都是氧化还原反应;反应①中的氧化剂是NO,还原剂是CO;反应②中氧化剂是O2,还原剂是NO。
归纳总结
2.反应①②中的反应物都有NO,NO在两反应中具有的性质相同吗?
【解析】不相同;反应①中NO具有氧化性,反应②中NO具有还原性。
3.催化转化器中发生的反应对减少汽车尾气污染有何作用?
【解析】减少汽车尾气中有害气体(NO、CO)的排放。
氧化还原反应的应用
(2)在生产、生活中所需的各种金属大多是通过氧化还原反应从矿石中冶炼出来的;同样,金属的腐蚀一般也是氧化还原反应。
(3)许多化工产品的制备,如合成氨、合成硝酸、制硫酸、电解法制烧碱等,主要反应都是氧化还原反应。
(4)农业生产中,植物的光合作用、呼吸作用都是复杂的氧化还原反应。
(5)日常生活中,食物的腐败就是氧化还原反应。因此袋装食品中加入脱氧剂可延长食品的保质期。
课堂练习
1.下列生活中的化学现象与氧化还原反应无关的是
A.铁门生锈 B.炒菜时油锅着火
C.稀盐酸洒在大理石台面上产生大量气泡 D.削过皮的苹果表面迅速变成褐色
【答案】C
【解析】A.铁门生锈,铁被氧化为氧化铁,发生氧化还原反应,A项不符合题意;
B.炒菜时油锅着火,有机物燃烧,与氧化还原反应有关,B项不符合题意;
C.稀盐酸与大理石反应的化学方程式为2HCl+CaCO3=CaCl2+CO2↑+H2O,没有电子的转移,不属于氧化还原反应,C项符合题意;
D.削过皮的苹果表面,某些有机物迅速被空气中的氧气氧化,变成褐色,与氧化还原反应有关,D项不符合题意;
故选C。
2.目前汽车安全气囊的气体发生剂主要由叠氮化钠、三氧化二铁、硝酸铵等物质组成,下列说法正确的是
A.安全气囊打开时,产生的气体只有氮气
B.硝酸铵的作用只是吸收叠氮化钠分解产生的热量
C.三氧化二铁的作用是与金属钠反应,防止钠造成二次伤害
D.硝酸铵性质很稳定
【答案】C
【解析】A.根据分析,产生的气体为N2、N2O和水蒸气,A错误;
B.硝酸铵的作用是吸收叠氮化钠分解产生的热量,同时分解产生气体,B错误;
C.三氧化二铁的作用是与金属钠反应,生成铁和较为安全的氧化钠,防止钠造成二次伤害,C正确;
D.硝酸铵受热或撞击时发生分解,性质不稳定,D错误;
故选C。
3.在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。某厂废水中含KCN,其浓度为650 mg/L。现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2===KOCN+2KCl+H2O。
(1)KCN中碳元素的化合价为________,KOCN中碳元素的化合价为________。
(2)反应中的氧化剂是________,还原剂是________。
(3)用双线桥法标出电子转移的方向和数目。
EPB
考点突破
03
氧化性、还原性强弱的判断
【问题探究】
【情境】
1.对于MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O反应。
(1)氧化剂是________,表现______性,还原剂是______,表现________性。
(2)氧化性:MnO2和Cl2谁较强?______________________。
【答案】 (1)MnO2 氧化 HCl 还原性
(2)MnO2的氧化性较强
2.已知:①MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
②Cl2+2HBr===Br2+2HCl
③Br2+2HI===I2+2HBr
【情境】
(1)MnO2、Cl2、Br2、I2的氧化性由弱到强的顺序为________________。
(2)HCl、HBr、HI、MnCl2的还原性由弱到强的顺序为________________。
【问题探究】
【答案】 (1)I2<Br2<Cl2<MnO2 (2)MnCl2<HCl<HBr<HI
归纳总结
1.氧化还原反应中反应产物的判断
(1)常见氧化剂及还原产物
(2)常见还原剂及氧化产物
2.物质氧化性、还原性强弱的判断方法
3.研究物质氧化性或还原性的方法
(1)根据物质中所含元素化合价升或降的可能性,预测物质可能具有还原性或氧化性。若所含某元素的化合价有升高的趋势,说明该物质可能具有还原性;反之,若所含某元素的化合价有降低的趋势,说明该物质可能具有氧化性。
(2)如果预测某物质具有氧化性,就需要寻找具有还原性的另一物质,通过实验检验两者能否发生氧化还原反应验证预测。相应地,如果预测某物质具有还原性,就需要寻找具有氧化性的另一物质,通过实验来验证预测。
易错点
(1)具有氧化性的物质不一定是氧化剂,具有还原性的物质不一定是还原剂,应视具体反应而定。
(2)对同一元素而言,一般价态越高,氧化性越强,如Fe3+>Fe2+>Fe。
【拓展应用】
判断氧化还原反应能否发生的方法——假设法
已知物质的氧化性或还原性的强弱关系,判断某一氧化还原反应能否发生时可采用假设法。
①先假设反应成立;
②然后根据氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物,列出假设反应中的上述关系;
③结合题干信息判断该结论是否符合事实,若符合事实,则反应成立;反之,则不成立。
课堂练习
【答案】A
【分析】氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性。
【解析】①反应Fe+Cu2+=Fe2++Cu中铜离子是氧化剂,亚铁离子是氧化产物,铁是还原剂,铜是还原产物,则还原性Fe>Cu,氧化性为Cu2+>Fe2+;
②反应2Fe3++Cu=Cu2++2Fe2+中铁离子是氧化剂,铜离子是氧化产物,铜是还原剂,亚铁离子是还原产物,则还原性Cu>Fe2+,氧化性为Fe3+>Cu2+;
③反应2Fe2++Cl2=2Fe3++2Cl-中氯气是氧化剂,铁离子是氧化产物,亚铁离子是还原剂,氯离子是还原产物,则还原性Fe2+>Cl-,氧化性为Cl2>Fe3+;
④反应HClO+H++Cl-=Cl2↑+H2O中次氯酸是氧化剂,氯气是氧化产物,氯离子是还原剂,氯气是还原产物,则还原性Cl->Cl2,氧化性为HClO>Cl2;
由此可以判断出各微粒的氧化性由强到弱的顺序正确的是HClO>Cl2>Fe3+>Cu2+>Fe2+,还原性由强到弱的顺序正确的是Fe>Cu>Fe2+>Cl->Cl2;
故本题选A。
课堂练习
课堂练习
课堂练习
EPB
考点突破
04
氧化还原反应方程式的配平
【问题探究】
【情境】
某同学查阅资料后设计生产NaClO2的主要流程如图所示(部分产品未标出)。
(1)Ⅰ、Ⅱ中发生反应的氧化剂分别是______、________。
(2)Ⅰ中反应的还原产物是________。
(3)流程中气体a是________。
(4)ClO2是一种高效水处理剂。Ⅰ中的化学方程式为_______________________________。
(5)Ⅱ中生成NaClO2的离子方程式为______________________________________________。
(6)研究表明:在上述过程中会发生副反应NaClO2+4HCl===NaCl+2Cl2↑+2H2O,若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大。请推测其原因:_____________________。
归纳总结
1.配平原则
2.配平步骤
3.配平示例
课堂练习
【答案】(1)1;4;1;2;2
(2)3;1;2;1
【解析】(1)Cu→Cu(NO3)2,Cu元素化合价升高,失去2个电子,HNO3→NO2,N元素化合价降低,得到1个电子,所以得失电子的最小公倍数为2,所以Cu的计量数为1,Cu(NO3)2的计量数为1,NO2的计量数为2,由于硝酸部分被还原,根据原子守恒,HNO3的计量数为4,H2O计量数为2,故答案为1;4;1;2;2;
(2)NO2→HNO3,N元素化合价升高,失去1个电子,NO2→NO,N元素化合价降低,得到2个电子,所以得失电子的最小公倍数为2,所以HNO3的计量数为2,NO的计量数为1,NO2的计量数为3,H2O的计量数为1,故答案为3;1;2;1。
2.某反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3(不溶于水)、H2O、H2O2,已知该反应中H2O2只发生如下过程H2O2→O2.
(1)写出该反应的化学方程式: 。
(2)该反应中氧化剂是 ,氧化产物是 。
(3)产生1个O2,转移的电子的个数为 个。
(4)用单线桥标出该反应中电子转移情况: 。
【分析】已知该反应中H2O2只发生如下过程:H2O2→O2,即双氧水被氧化,作还原剂,氧化产物为O2,则该反应的氧化剂是H2CrO4,Cr元素化合价从+6价降低到+3价,得到3e-,双氧水中氧元素化合价从-1价升高到0价,失去1e-,每个H2O2反应转移2个电子,为根据电子得失守恒、质量守恒定律,该反应的化学方程式为3H2O2+2H2CrO4=3O2↑+2Cr(OH)3+2H2O;
EPB
考点突破
05
课堂练习与巩固提升
01
练习与应用
【答案】A
【解析】A.碳酸钾与铵盐发生相互促进的水解反应,反应过程中不存在化合价变化,不涉及氧化还原反应,A项正确;
B.放电过程中氮气与氧气反应生成一氧化氮,氮、氧元素化合价发生变化,属于氧化还原反应,B项错误;
C.酸性高锰酸钾溶液通入 SO2气体后褪色,发生反应生成硫酸锰、硫酸钾,Mn元素化合价降低,S元素化合价升高,属于氧化还原反应,C项错误;
D.由二氧化硅制晶体硅,硅的化合价降低,涉及氧化还原反应,D项错误;
答案选A。
1.下列不涉及氧化还原反应的是
A.灰肥相混损肥分——灰中含有碳酸钾,肥中含有铵盐 B.雷雨肥庄稼——自然固氮
C.酸性高锰酸钾溶液通入SO2气体后褪色 D.从沙滩到用户——由二氧化硅制晶体硅
练习与应用
02
练习与应用
02
03
练习与应用
【答案】C
【解析】A.SO2的漂白性是利用二氧化硫与有色物质结合生成无色物质,并未涉及氧化还原反应,选项A错误;
B.食品包装袋中常放入小袋的生石灰吸水反应生成氢氧化钙,没有发生氧化还原反应,选项B错误;
C.铁粉作食品袋内的脱氧剂,防止食品被氧化,是因为铁粉自身作为还原剂被氧气氧化从而避免了食品被氧化,起还原作用,选项C正确;
D.84消毒液作消毒剂,氯元素的化合价降低,作氧化剂,选项D错误;
答案选C。
练习与应用
04
练习与应用
05
【答案】B
【分析】根据反应方程式进行比较:氧化剂+还原剂=还原产物+氧化产物;氧化性为氧化剂>氧化产物,还原性为还原剂>还原产物,据此判断。
【解析】根据①I2+H2S═2HI+S反应可知氧化剂为I2、氧化产物为S,所以氧化性:I2>S,根据②2FeCl2+Cl2═2FeCl3可知,氧化剂Cl2、氧化产物为FeCl3,所以氧化性:Cl2>FeCl3,根据③2FeCl3+2KI═2FeCl2+2KCl+I2可知,氧化剂FeCl3、氧化产物为I2,所以氧化性:FeCl3>I2,故氧化性顺序为:Cl2>FeCl3>I2>S,故答案为:B。
练习与应用
06
6.从化合价角度认识物质的氧化性和还原性,是化学学习的重要方法:“高价氧、低价还、中间价态两相兼”。下列物质中的硫元素只有氧化性的是
A.Na2S B.S C.SO2 D.H2SO4
【答案】D
【解析】A.硫为-2价,只有还原性,故A不符合题意;
B.硫为0价,有还原性还有氧化性,故B不符合题意;
C.硫为+4价,有还原性还有氧化性,故C不符合题意;
D.硫为+6价,只有氧化性,故D符合题意;
答案选D。
07
练习与应用
7.某反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3(不溶于水)、H2O、H2O2,已知该反应中H2O2只发生如下过程H2O2→O2.
(1)写出该反应的化学方程式: 。
(2)该反应中氧化剂是 ,氧化产物是 。
(3)产生1个O2,转移的电子的个数为 个。
(4)用单线桥标出该反应中电子转移情况: 。
07
练习与应用
THANK YOU
第一节 物质的分类与转化
第一章 物质及其变化
第6课时 氧化剂和还原剂
氧化剂和还原剂
01
氧化还原反应的应用
02
氧化性、还原性强弱的判断
03
课堂练习与巩固提升
04
考点 · 突破
Exam Points
Breakthrough
05
氧化还原反应方程式的配平
EPB
考点突破
01
氧化剂和还原剂
【问题探究】
【情境】
1.通过阅读月饼盒中小包装袋的文字说明,分析月饼盒中为什么要放小包装袋。
【解析】脱氧剂中的铁粉与袋内O2发生反应,减缓油脂的氧化作用,延长月饼的保质期。
2.根据脱氧剂发生的反应,分析元素化合价的变化,并指出物质在反应中起到的作用。
【解析】(1)反应中,铁单质的化合价为 价,处于铁元素的最低价态,所以Fe具有 ,作 剂,铁元素被 。
(2)反应中,氧元素的化合价由 价降低到 价,O2得到电子作 ,O2具有 性,氧元素被 。
0
还原性
还原
氧化
0
-2
氧化剂
氧化
还原
归纳总结
1.氧化剂和还原剂
①概念
氧化剂:在反应时,所含元素的化合价降低,即得到电子(或电子对偏向)的物质。
还原剂:在反应时,所含元素的化合价升高,即失去电子(或电子对偏离)的物质。
2.氧化产物和还原产物
氧化产物:还原剂发生氧化反应后的生成物,即化合价升高的元素的产物。
还原产物:氧化剂发生还原反应后的生成物,即化合价降低的元素的产物。
3.氧化性和还原性
氧化性:即得到电子的能力。
在氧化还原反应中,氧化剂具有氧化性。
还原性:即失去电子的能力。
在氧化还原反应中,还原剂具有还原性。
4.氧化性、还原性和元素化合价之间的关系
5.常见的氧化剂和还原剂
物质种类 常见物质
氧化剂 部分非金属单质 O2、Cl2等
含有高价态元素的化合物 浓硫酸、HNO3、KMnO4、MnO2、KClO3、K2Cr2O7等
某些金属活动性较弱的元素对应的高价态离子 Fe3+、Ag+、Pb4+、Cu2+等
过氧化物 Na2O2、H2O2等
还原剂 活泼的金属单质 Al、Zn等
某些非金属单质 C、H2等
非金属阴离子和氢化物 Cl-、Br-、I-、S2-、HI、NH3、H2S等
含有较低价态元素的化合物 CO、SO2、H2SO3、Na2SO3、FeSO4等
易错点
(1)在一个氧化还原反应中,氧化剂和还原剂同时存在,它们可以是不同的物质,也可以是同一物质。例如,在反应Cl2+2NaOH===NaCl+NaClO+H2O中,Cl2既是氧化剂,又是还原剂。
(2)物质氧化性、还原性的强弱与得失电子的难易程度有关,而与得失电子的多少无关。例如,1 个钠原子失电子数小于1个铝原子,但还原性Na>Al。
(3)某元素由化合态变为游离态时,不一定被还原,因为元素处于化合态时,其化合价可能为正值,也可能为负值。如在反应2H2O2H2↑+O2↑中,氢元素被还原,而氧元素被氧化。
课堂练习
【答案】C
【解析】由方程式可知,反应中氮元素的化合价由0价降为-3价,N2被还原,氮气是反应的氧化剂,故选C。
4.在下列反应中,水作还原剂的是
A.2F2+2H2O=4HF+O2
B.2Na+2H2O=2NaOH+H2↑
C.Cl2+H2O=HCl+HClO
D.CO2+H2O=H2CO3
【答案】A
【解析】A.F元素的化合价降低,水中O元素的化合价升高,则水为还原剂,A正确;
B.没有元素的化合价变化,不发生氧化还原反应,B错误;
C.水中H元素的化合价降低,则水为氧化剂,C错误;
D.只有Cl元素的化合价变化,水既不是氧化剂也不是还原剂,D错误;
故选A。
EPB
考点突破
02
氧化还原反应的应用
【问题探究】
【情境】
汽车尾气系统中安装了催化转化器(见图),在催化转化器中,汽车尾气中的CO和NO在催化剂的作用下转化成了无毒的CO2和N2。涉及的化学反应分别是:
1.反应①②是否都是氧化还原反应?若是,请指出反应中的氧化剂和还原剂。
【解析】都是氧化还原反应;反应①中的氧化剂是NO,还原剂是CO;反应②中氧化剂是O2,还原剂是NO。
归纳总结
2.反应①②中的反应物都有NO,NO在两反应中具有的性质相同吗?
【解析】不相同;反应①中NO具有氧化性,反应②中NO具有还原性。
3.催化转化器中发生的反应对减少汽车尾气污染有何作用?
【解析】减少汽车尾气中有害气体(NO、CO)的排放。
氧化还原反应的应用
(2)在生产、生活中所需的各种金属大多是通过氧化还原反应从矿石中冶炼出来的;同样,金属的腐蚀一般也是氧化还原反应。
(3)许多化工产品的制备,如合成氨、合成硝酸、制硫酸、电解法制烧碱等,主要反应都是氧化还原反应。
(4)农业生产中,植物的光合作用、呼吸作用都是复杂的氧化还原反应。
(5)日常生活中,食物的腐败就是氧化还原反应。因此袋装食品中加入脱氧剂可延长食品的保质期。
课堂练习
1.下列生活中的化学现象与氧化还原反应无关的是
A.铁门生锈 B.炒菜时油锅着火
C.稀盐酸洒在大理石台面上产生大量气泡 D.削过皮的苹果表面迅速变成褐色
【答案】C
【解析】A.铁门生锈,铁被氧化为氧化铁,发生氧化还原反应,A项不符合题意;
B.炒菜时油锅着火,有机物燃烧,与氧化还原反应有关,B项不符合题意;
C.稀盐酸与大理石反应的化学方程式为2HCl+CaCO3=CaCl2+CO2↑+H2O,没有电子的转移,不属于氧化还原反应,C项符合题意;
D.削过皮的苹果表面,某些有机物迅速被空气中的氧气氧化,变成褐色,与氧化还原反应有关,D项不符合题意;
故选C。
2.目前汽车安全气囊的气体发生剂主要由叠氮化钠、三氧化二铁、硝酸铵等物质组成,下列说法正确的是
A.安全气囊打开时,产生的气体只有氮气
B.硝酸铵的作用只是吸收叠氮化钠分解产生的热量
C.三氧化二铁的作用是与金属钠反应,防止钠造成二次伤害
D.硝酸铵性质很稳定
【答案】C
【解析】A.根据分析,产生的气体为N2、N2O和水蒸气,A错误;
B.硝酸铵的作用是吸收叠氮化钠分解产生的热量,同时分解产生气体,B错误;
C.三氧化二铁的作用是与金属钠反应,生成铁和较为安全的氧化钠,防止钠造成二次伤害,C正确;
D.硝酸铵受热或撞击时发生分解,性质不稳定,D错误;
故选C。
3.在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。某厂废水中含KCN,其浓度为650 mg/L。现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2===KOCN+2KCl+H2O。
(1)KCN中碳元素的化合价为________,KOCN中碳元素的化合价为________。
(2)反应中的氧化剂是________,还原剂是________。
(3)用双线桥法标出电子转移的方向和数目。
EPB
考点突破
03
氧化性、还原性强弱的判断
【问题探究】
【情境】
1.对于MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O反应。
(1)氧化剂是________,表现______性,还原剂是______,表现________性。
(2)氧化性:MnO2和Cl2谁较强?______________________。
【答案】 (1)MnO2 氧化 HCl 还原性
(2)MnO2的氧化性较强
2.已知:①MnO2+4HCl(浓)MnCl2+Cl2↑+2H2O
②Cl2+2HBr===Br2+2HCl
③Br2+2HI===I2+2HBr
【情境】
(1)MnO2、Cl2、Br2、I2的氧化性由弱到强的顺序为________________。
(2)HCl、HBr、HI、MnCl2的还原性由弱到强的顺序为________________。
【问题探究】
【答案】 (1)I2<Br2<Cl2<MnO2 (2)MnCl2<HCl<HBr<HI
归纳总结
1.氧化还原反应中反应产物的判断
(1)常见氧化剂及还原产物
(2)常见还原剂及氧化产物
2.物质氧化性、还原性强弱的判断方法
3.研究物质氧化性或还原性的方法
(1)根据物质中所含元素化合价升或降的可能性,预测物质可能具有还原性或氧化性。若所含某元素的化合价有升高的趋势,说明该物质可能具有还原性;反之,若所含某元素的化合价有降低的趋势,说明该物质可能具有氧化性。
(2)如果预测某物质具有氧化性,就需要寻找具有还原性的另一物质,通过实验检验两者能否发生氧化还原反应验证预测。相应地,如果预测某物质具有还原性,就需要寻找具有氧化性的另一物质,通过实验来验证预测。
易错点
(1)具有氧化性的物质不一定是氧化剂,具有还原性的物质不一定是还原剂,应视具体反应而定。
(2)对同一元素而言,一般价态越高,氧化性越强,如Fe3+>Fe2+>Fe。
【拓展应用】
判断氧化还原反应能否发生的方法——假设法
已知物质的氧化性或还原性的强弱关系,判断某一氧化还原反应能否发生时可采用假设法。
①先假设反应成立;
②然后根据氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物,列出假设反应中的上述关系;
③结合题干信息判断该结论是否符合事实,若符合事实,则反应成立;反之,则不成立。
课堂练习
【答案】A
【分析】氧化剂的氧化性大于氧化产物的氧化性,还原剂的还原性大于还原产物的还原性。
【解析】①反应Fe+Cu2+=Fe2++Cu中铜离子是氧化剂,亚铁离子是氧化产物,铁是还原剂,铜是还原产物,则还原性Fe>Cu,氧化性为Cu2+>Fe2+;
②反应2Fe3++Cu=Cu2++2Fe2+中铁离子是氧化剂,铜离子是氧化产物,铜是还原剂,亚铁离子是还原产物,则还原性Cu>Fe2+,氧化性为Fe3+>Cu2+;
③反应2Fe2++Cl2=2Fe3++2Cl-中氯气是氧化剂,铁离子是氧化产物,亚铁离子是还原剂,氯离子是还原产物,则还原性Fe2+>Cl-,氧化性为Cl2>Fe3+;
④反应HClO+H++Cl-=Cl2↑+H2O中次氯酸是氧化剂,氯气是氧化产物,氯离子是还原剂,氯气是还原产物,则还原性Cl->Cl2,氧化性为HClO>Cl2;
由此可以判断出各微粒的氧化性由强到弱的顺序正确的是HClO>Cl2>Fe3+>Cu2+>Fe2+,还原性由强到弱的顺序正确的是Fe>Cu>Fe2+>Cl->Cl2;
故本题选A。
课堂练习
课堂练习
课堂练习
EPB
考点突破
04
氧化还原反应方程式的配平
【问题探究】
【情境】
某同学查阅资料后设计生产NaClO2的主要流程如图所示(部分产品未标出)。
(1)Ⅰ、Ⅱ中发生反应的氧化剂分别是______、________。
(2)Ⅰ中反应的还原产物是________。
(3)流程中气体a是________。
(4)ClO2是一种高效水处理剂。Ⅰ中的化学方程式为_______________________________。
(5)Ⅱ中生成NaClO2的离子方程式为______________________________________________。
(6)研究表明:在上述过程中会发生副反应NaClO2+4HCl===NaCl+2Cl2↑+2H2O,若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大。请推测其原因:_____________________。
归纳总结
1.配平原则
2.配平步骤
3.配平示例
课堂练习
【答案】(1)1;4;1;2;2
(2)3;1;2;1
【解析】(1)Cu→Cu(NO3)2,Cu元素化合价升高,失去2个电子,HNO3→NO2,N元素化合价降低,得到1个电子,所以得失电子的最小公倍数为2,所以Cu的计量数为1,Cu(NO3)2的计量数为1,NO2的计量数为2,由于硝酸部分被还原,根据原子守恒,HNO3的计量数为4,H2O计量数为2,故答案为1;4;1;2;2;
(2)NO2→HNO3,N元素化合价升高,失去1个电子,NO2→NO,N元素化合价降低,得到2个电子,所以得失电子的最小公倍数为2,所以HNO3的计量数为2,NO的计量数为1,NO2的计量数为3,H2O的计量数为1,故答案为3;1;2;1。
2.某反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3(不溶于水)、H2O、H2O2,已知该反应中H2O2只发生如下过程H2O2→O2.
(1)写出该反应的化学方程式: 。
(2)该反应中氧化剂是 ,氧化产物是 。
(3)产生1个O2,转移的电子的个数为 个。
(4)用单线桥标出该反应中电子转移情况: 。
【分析】已知该反应中H2O2只发生如下过程:H2O2→O2,即双氧水被氧化,作还原剂,氧化产物为O2,则该反应的氧化剂是H2CrO4,Cr元素化合价从+6价降低到+3价,得到3e-,双氧水中氧元素化合价从-1价升高到0价,失去1e-,每个H2O2反应转移2个电子,为根据电子得失守恒、质量守恒定律,该反应的化学方程式为3H2O2+2H2CrO4=3O2↑+2Cr(OH)3+2H2O;
EPB
考点突破
05
课堂练习与巩固提升
01
练习与应用
【答案】A
【解析】A.碳酸钾与铵盐发生相互促进的水解反应,反应过程中不存在化合价变化,不涉及氧化还原反应,A项正确;
B.放电过程中氮气与氧气反应生成一氧化氮,氮、氧元素化合价发生变化,属于氧化还原反应,B项错误;
C.酸性高锰酸钾溶液通入 SO2气体后褪色,发生反应生成硫酸锰、硫酸钾,Mn元素化合价降低,S元素化合价升高,属于氧化还原反应,C项错误;
D.由二氧化硅制晶体硅,硅的化合价降低,涉及氧化还原反应,D项错误;
答案选A。
1.下列不涉及氧化还原反应的是
A.灰肥相混损肥分——灰中含有碳酸钾,肥中含有铵盐 B.雷雨肥庄稼——自然固氮
C.酸性高锰酸钾溶液通入SO2气体后褪色 D.从沙滩到用户——由二氧化硅制晶体硅
练习与应用
02
练习与应用
02
03
练习与应用
【答案】C
【解析】A.SO2的漂白性是利用二氧化硫与有色物质结合生成无色物质,并未涉及氧化还原反应,选项A错误;
B.食品包装袋中常放入小袋的生石灰吸水反应生成氢氧化钙,没有发生氧化还原反应,选项B错误;
C.铁粉作食品袋内的脱氧剂,防止食品被氧化,是因为铁粉自身作为还原剂被氧气氧化从而避免了食品被氧化,起还原作用,选项C正确;
D.84消毒液作消毒剂,氯元素的化合价降低,作氧化剂,选项D错误;
答案选C。
练习与应用
04
练习与应用
05
【答案】B
【分析】根据反应方程式进行比较:氧化剂+还原剂=还原产物+氧化产物;氧化性为氧化剂>氧化产物,还原性为还原剂>还原产物,据此判断。
【解析】根据①I2+H2S═2HI+S反应可知氧化剂为I2、氧化产物为S,所以氧化性:I2>S,根据②2FeCl2+Cl2═2FeCl3可知,氧化剂Cl2、氧化产物为FeCl3,所以氧化性:Cl2>FeCl3,根据③2FeCl3+2KI═2FeCl2+2KCl+I2可知,氧化剂FeCl3、氧化产物为I2,所以氧化性:FeCl3>I2,故氧化性顺序为:Cl2>FeCl3>I2>S,故答案为:B。
练习与应用
06
6.从化合价角度认识物质的氧化性和还原性,是化学学习的重要方法:“高价氧、低价还、中间价态两相兼”。下列物质中的硫元素只有氧化性的是
A.Na2S B.S C.SO2 D.H2SO4
【答案】D
【解析】A.硫为-2价,只有还原性,故A不符合题意;
B.硫为0价,有还原性还有氧化性,故B不符合题意;
C.硫为+4价,有还原性还有氧化性,故C不符合题意;
D.硫为+6价,只有氧化性,故D符合题意;
答案选D。
07
练习与应用
7.某反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3(不溶于水)、H2O、H2O2,已知该反应中H2O2只发生如下过程H2O2→O2.
(1)写出该反应的化学方程式: 。
(2)该反应中氧化剂是 ,氧化产物是 。
(3)产生1个O2,转移的电子的个数为 个。
(4)用单线桥标出该反应中电子转移情况: 。
07
练习与应用
THANK YOU
