【考点突破】第一章第5课时 氧化还原反应-2024~2025学年高一化学同步课件(共38张PPT)(人教版2019必修第一册)
文档属性
| 名称 | 【考点突破】第一章第5课时 氧化还原反应-2024~2025学年高一化学同步课件(共38张PPT)(人教版2019必修第一册) |  | |
| 格式 | pptx | ||
| 文件大小 | 7.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-22 18:48:16 | ||
图片预览









文档简介
(共38张PPT)
第一节 物质的分类与转化
第一章 物质及其变化
第5课时 氧化还原反应
多角度认识氧化还原反应
01
氧化还原反应中电子转移的表示方法
02
氧化还原反应与四种基本反应类型的关系
03
巩固提升
04
考点 · 突破
Exam Points
Breakthrough
05
课堂练习
EPB
考点突破
01
多角度认识氧化还原反应
【问题探究】
【情境】
从三角度剖析氧化还原反应
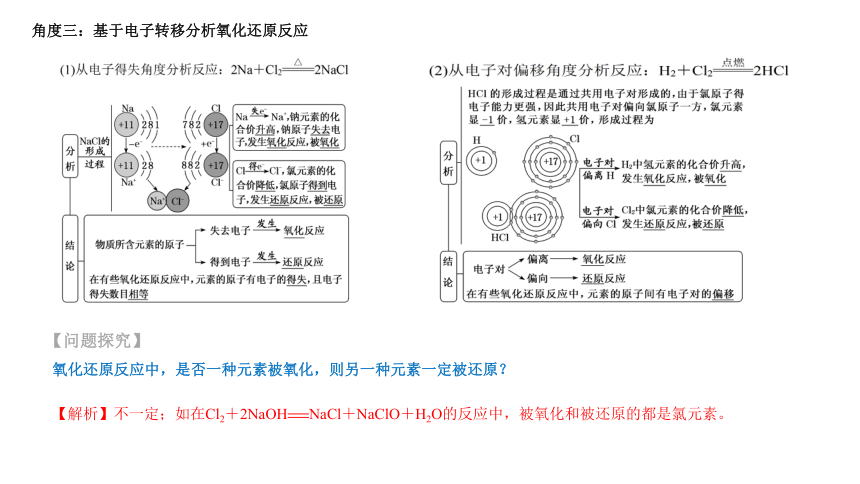
角度一:基于氧的得失分析氧化还原反应
没有“氧”参加的反应是否一定不是氧化还原反应?
【解析】不一定;如H2与Cl2的反应没有“氧”参加,但该反应是氧化还原反应。因此,从得氧、失氧的角度认识氧化还原反应具有片面性和局限性。
角度二:基于元素化合价变化分析氧化还原反应
【问题探究】
氧化还原反应中是否所有元素的化合价都发生变化?
【解析】不一定;如Zn+H2SO4===ZnSO4+H2↑的反应中,Zn、H两种元素的化合价发生了变化,而S、O两种元素的化合价没有发生变化。
角度三:基于电子转移分析氧化还原反应
【问题探究】
氧化还原反应中,是否一种元素被氧化,则另一种元素一定被还原?
【解析】不一定;如在Cl2+2NaOH===NaCl+NaClO+H2O的反应中,被氧化和被还原的都是氯元素。
归纳总结
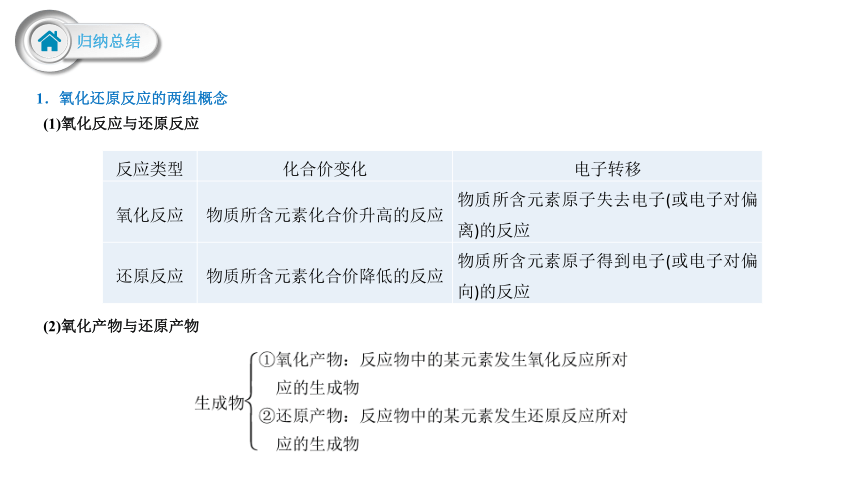
1.氧化还原反应的两组概念
(1)氧化反应与还原反应
反应类型 化合价变化 电子转移
氧化反应 物质所含元素化合价升高的反应 物质所含元素原子失去电子(或电子对偏离)的反应
还原反应 物质所含元素化合价降低的反应 物质所含元素原子得到电子(或电子对偏向)的反应
(2)氧化产物与还原产物
2.氧化还原反应概念间的关系
3.氧化还原反应的本质
(1)氧化反应:物质中有元素的原子失去电子(或电子对偏离)的反应。
(2)还原反应:物质中有元素的原子得到电子(或电子对偏向)的反应。
(3)氧化还原反应的本质:有电子转移(电子得失或电子对偏移)的反应。
4.元素化合价的判断
(1)代数和法:先标出熟悉元素的化合价,再根据化合物中各元素正、负化合价的代数和为0,求解其他元素的化合价。例如,有机物中碳元素化合价(设为x)的确定方法:有机物中氧元素的化合价为-2价,氢元素的化合价为+1价,利用化合物中各元素正、负化合价代数和为0的原则确定碳元素的化合价,乙酸(C2H4O2)中各元素化合价满足2x+(+1)×4+(-2)×2=0,则x=0。
(2)记忆法:常见元素的化合价可以借助化合价口诀来记忆,一价氢、氯、钾、钠、银;二价氧、钙、镁、钡、锌;三价铝、四价硅、五价磷;说变价也不难,二三价铁、三四价碳、二四六价硫都齐全;铜汞二价最常见。
易错点
(1)一种元素被氧化,不一定有另一种元素被还原。如C2+H2O===H+中,被氧化和被还原的元素都是氯元素。
(2)一种反应物不一定只表现出一种性质。如反应2KMnO4K2MnO4+MnO2+O2↑中,参加反应的KMnO4既表现了还原性,又表现了氧化性。
(3)有单质参加或生成的反应不一定是氧化还原反应。如同素异形体之间的相互转化不属于氧化还原反应。
(4)某种物质由化合态变为游离态,不一定是被还原,如HCl→Cl2是被氧化。
课堂练习
【答案】A
【解析】A.柴火烤肉涉及燃料燃烧,氧元素化合价发生变化,属于氧化还原反应,故A正确;
B.椰雕制作是物理变化,不涉及氧化还原反应,故B错误;
C.铁杵磨针是物理变化,不涉及氧化还原反应,故C错误;
D.钟乳石的形成是碳酸钙和碳酸氢钙之间的互相转化,无元素化合价变化,不涉及氧化还原反应,故D错误;
故选:A。
课堂练习
【答案】B
【解析】A.O2中氧元素化合价由0价降低到-2价,得到电子,所以O2是氧化剂,故A正确;
B.NH3中氮元素由-3价升高到+2价,失去电子,所以NH3是还原剂,被氧化,故B错误;
C.氧元素化合价降低,得到电子,所以O2被还原,故C正确;
D.氮元素化合价升高,失去电子,所以NH3发生氧化反应,故D正确;
故答案为B。
课堂练习
EPB
考点突破
02
氧化还原反应中电子转移的表示方法
【情境】
素材1 楼房有的是用红砖砌成的,有的则是青砖砌成的,可曾想过为什么同样的砖坯有的能烧成红砖,有的能烧成青砖呢?原来烧制砖瓦的黏土中含有二价铁盐,黏土做成砖坯,送到窑内大火烘烧,然后熄灭,自然冷却。此时窑内空气流畅,氧气充足,二价铁盐被氧化成三氧化二铁(Fe2O3),由于三氧化二铁是红色,所以得到的就是红砖瓦。待砖坯烧透后,从窑顶向下不断淋水,当水遇到红热砖瓦变成水蒸气后,碳与水蒸气反应生成氢气和一氧化碳。这些还原性气体能把砖瓦中红色的氧化铁还原成黑色氧化亚铁或四氧化三铁。
素材2 高铁酸钠(Na2FeO4)是一种新型净水剂和消毒剂,主要用于饮用水处理。工业上制备高铁酸钠的方法之一为3NaClO+2Fe(OH)3+4NaOH===2Na2FeO4+3NaCl+5H2O。
【问题探究】
1.根据素材1探究问题:
红砖转化为青砖(含FeO)的反应有哪些?
请写出化学方程式,并标出发生氧化反应和还原反应的物质。
2.根据素材2,探究问题:
归纳总结
1.双线桥法
表示反应前后 由反应物转化为生成物时电子转移的情况。
(1)基本步骤
同一元素
(2)注意事项
(3)巧记口诀
先标化合价,再看价变化;起止同元素,桥上标变化。
示例 用双线桥法标出CO还原Fe2O3反应中电子转移的方向与数目:
2.单线桥法
表示反应过程中 原子间的电子转移情况。
(1)基本步骤
(2)注意事项
①不需要标明“得到”或“失去”,只标明电子转移数目;
②要用箭头标明电子转移的方向;
③箭头由反应物中失电子元素原子指向得电子元素原子。
(3)巧记口诀
先确定变价元素,再计算价态变化;
桥上标明电子数,箭头还原到氧化。
示例 用单线桥法标出CO还原Fe2O3反应中电子转移的方向与数目:
不同元素
课堂练习
1.下列反应中电子转移的表示方法正确的是
EPB
考点突破
03
氧化还原反应与四种基本反应类型的关系
【问题探究】
【情境】
(1)从四种基本反应类型来看,①②④的反应类型分别为①____________,②____________,④____________。
(2)反应③中,________发生氧化反应,________发生还原反应。
(3)用双线桥法表示反应②的电子转移方向与数目________________________。
【解析】 在反应③中碳元素的化合价由+2价升高为+4价,CO发生氧化反应,铜元素的化合价由+2价降低为0价,CuO发生还原反应。
【答案】 (1)分解反应 置换反应 化合反应
(2)CO CuO
【问题探究】
2.有单质参加或生成的化学反应一定是氧化还原反应吗?举例说明。
【解析】不是,反应物中没有单质。
归纳总结
1.图示关系
2.文字表述
(1)置换反应 是氧化还原反应。(填“一定”“不一定”或“一定不”,下同)
(2)复分解反应 是氧化还原反应。
(3)化合反应和分解反应 是氧化还原反应。
①有单质参加的化合反应 是氧化还原反应。
②有单质生成的分解反应 是氧化还原反应。
易错点
(1)四种基本反应类型不能包含所有的化学反应,如反应Cl2+2NaOH===NaCl+NaClO+H2O不属于四种基本反应类型中的任何一种,但它有元素化合价的升降,属于氧化还原反应。
(2)有单质参加或生成的反应不一定是氧化还原反应。如同素异形体之间的相互转化(3O22O3)不属于氧化还原反应。
一定
一定不
不一定
一定
一定
课堂练习
1.氧化还原反应与四种基本反应类型的关系如图所示.下列化学反应属于阴影部分的是
【答案】C
【详解】A.反应属于分解反应,且不是氧化还原反应,A不符合题意;
B.是氧化还原反应,反应属于化合反应,B不符合题意;
C.反应中存在元素化合价改变,是氧化还原反应,但是不属于化合反应、不属于分解反应、不是置换反应,不是复分解反应,C符合题意;
D.反应属于置换反应,是氧化还原反应,D不符合题意;
故选C。
课堂练习
【答案】(1)①化合反应 ②化合反应 ③分解反应
④分解反应 ⑤置换反应 ⑥置换反应 ⑦复分解反应 ⑧复分解反应
(2)①④⑤⑥
EPB
考点突破
05
巩固提升
01
练习与应用
【答案】A
【解析】A.雪天道路上撒盐融雪,是因为雪遇到盐而使其熔点降低并熔化,该过程中没有任何一种元素的化合价发生变化,因此没有涉及到氧化还原反应,A符合题意;
B.暖贴中的铁粉遇空气放热,是铁和氧气发生化学变化生成铁的氧化物,放出热能,该过程中铁元素和氧元素的化合价发生变化,因此,该过程涉及到氧化还原反应, B不符合题意;
C.维生素C可用作水果罐头的抗氧化剂,是利用了维生素C的还原性,涉及氧化还原反应,C不符合题意;
D.臭氧具有强氧化性,能杀灭病菌,涉及氧化还原反应,D不符合题意;
故选A。
练习与应用
02
2.氧化还原反应是从元素化合价是否有变化的角度对化学反应进行分类的结果。下列叙述中,正确的是
A.氧化还原反应的实质是电子得失
B.具有氧化性的物质在化学反应中一定做氧化剂
C.氧化剂氧化其他物质时,本身被还原
D.还原剂在反应中本身被还原
【答案】C
【解析】A.氧化还原反应的实质是电子的转移,包含电子的得失或偏转,故A正确;
B.具有氧化性的物质在反应中不一定作氧化剂,如:浓硝酸与碱的中和反应,浓硝酸虽然具有强氧化性,但发生的为非氧化还原反应,故B错误;
C.反应中氧化剂得电子被还原,故C正确;
D.还原剂失电子化合价升高,被氧化,故D错误;
故答案为:C;
03
练习与应用
3.下列叙述正确的是
A.有一种元素被氧化,同时一定有另一种元素被还原
B.非金属元素由化合态变为游离态一定发生了氧化反应
C.氧化还原反应中所有元素的化合价都发生变化
D.金刚石和石墨互为同素异形体,物理性质不同
【答案】D
【解析】A.有一种元素被氧化,同时不一定有另一种元素被还原,如氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水的反应是氯元素即被氧化又被还原的歧化反应,故A错误;
B.非金属元素由化合态变为游离态不一定发生了氧化反应,如二氧化硫与氢硫酸溶液反应生成硫和水的归中反应中二氧化硫中的硫元素化合价由化合态变为游离态,但二氧化硫发生还原反应,故B错误;
C.氧化还原反应中所有元素的化合价不一定都发生变化,如氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水的反应中钠元素、氢元素和氧元素的化合价没有发生变化,故C错误;
D.金刚石和石墨是碳元素形成的不同种单质,互为同素异形体,两者的结构不同,物理性质不同,故D正确;
故选D。
练习与应用
04
4.黑火药是中国古代四大发明之一,其爆炸反应为2KNO3+S+3C=K2S+N2↑+3CO2↑。下列说法正确的是
A.黑火药中含有两种单质 B.反应中C作为氧化剂
C.反应中S作还原剂 D.反应为置换反应
【答案】A
【解析】A.黑火药中含有硫、碳两种单质,故A正确;
B.C元素化合价升高,所以还原剂是C,故B错误;
C.反应中N和S元素化合价降低,被还原,C元素化合价升高,所以还原剂是C、氧化剂是S和KNO3,故C错误;
D.该反应中反应物和生成物都是三种,则不是置换反应,故D错误;
故选:A。
练习与应用
05
练习与应用
06
【答案】D
【解析】A.过氧化氢在催化剂作用下能分解生成氧气和水,则过氧化氢转化为氧气的过程不需要加入还原剂就能实现,故A不符合题意;
B.四羟基合铝酸根离子转化为氢氧化铝时,铝元素没有发生化合价变化,不需要加入还原剂就能实现,故B不符合题意;
C.亚砷酸根离子转化为砷酸根离子时,砷元素的化合价升高被氧化,需要加入氧化剂就才实现,故C不符合题意;
D.二氧化锰转化为锰离子时,锰元素的化合价降低被还原,需要加入还原剂才能实现,故D符合题意;
故选D。
07
练习与应用
7.下列用单、双线桥法表示电子转移的方向和数目错误的是
07
练习与应用
练习与应用
08
练习与应用
08
(4)上述反应中,既是溶液中的离子反应,又是氧化还原反应的是________。
(5)根据你的理解,氧化还原反应的实质是________。
A.分子中的原子重新组合
B.氧元素的得失
C.电子的得失或共用电子对的偏移
D.化合价的改变
【解析】基本反应类型中,复分解反应不是氧化还原反应;置换反应一定是氧化还原反应;化合反应和分解反应,若元素化合价有变化则是氧化还原反应,若元素化合价无变化则是非氧化还原反应。离子反应是否属于氧化还原反应也要根据元素的化合价在反应前后是否发生变化来判断。
【答案】(1)①④⑧ ⑤ (2)②⑧ (3)⑦ (4)③ (5)C
THANK YOU
第一节 物质的分类与转化
第一章 物质及其变化
第5课时 氧化还原反应
多角度认识氧化还原反应
01
氧化还原反应中电子转移的表示方法
02
氧化还原反应与四种基本反应类型的关系
03
巩固提升
04
考点 · 突破
Exam Points
Breakthrough
05
课堂练习
EPB
考点突破
01
多角度认识氧化还原反应
【问题探究】
【情境】
从三角度剖析氧化还原反应
角度一:基于氧的得失分析氧化还原反应
没有“氧”参加的反应是否一定不是氧化还原反应?
【解析】不一定;如H2与Cl2的反应没有“氧”参加,但该反应是氧化还原反应。因此,从得氧、失氧的角度认识氧化还原反应具有片面性和局限性。
角度二:基于元素化合价变化分析氧化还原反应
【问题探究】
氧化还原反应中是否所有元素的化合价都发生变化?
【解析】不一定;如Zn+H2SO4===ZnSO4+H2↑的反应中,Zn、H两种元素的化合价发生了变化,而S、O两种元素的化合价没有发生变化。
角度三:基于电子转移分析氧化还原反应
【问题探究】
氧化还原反应中,是否一种元素被氧化,则另一种元素一定被还原?
【解析】不一定;如在Cl2+2NaOH===NaCl+NaClO+H2O的反应中,被氧化和被还原的都是氯元素。
归纳总结
1.氧化还原反应的两组概念
(1)氧化反应与还原反应
反应类型 化合价变化 电子转移
氧化反应 物质所含元素化合价升高的反应 物质所含元素原子失去电子(或电子对偏离)的反应
还原反应 物质所含元素化合价降低的反应 物质所含元素原子得到电子(或电子对偏向)的反应
(2)氧化产物与还原产物
2.氧化还原反应概念间的关系
3.氧化还原反应的本质
(1)氧化反应:物质中有元素的原子失去电子(或电子对偏离)的反应。
(2)还原反应:物质中有元素的原子得到电子(或电子对偏向)的反应。
(3)氧化还原反应的本质:有电子转移(电子得失或电子对偏移)的反应。
4.元素化合价的判断
(1)代数和法:先标出熟悉元素的化合价,再根据化合物中各元素正、负化合价的代数和为0,求解其他元素的化合价。例如,有机物中碳元素化合价(设为x)的确定方法:有机物中氧元素的化合价为-2价,氢元素的化合价为+1价,利用化合物中各元素正、负化合价代数和为0的原则确定碳元素的化合价,乙酸(C2H4O2)中各元素化合价满足2x+(+1)×4+(-2)×2=0,则x=0。
(2)记忆法:常见元素的化合价可以借助化合价口诀来记忆,一价氢、氯、钾、钠、银;二价氧、钙、镁、钡、锌;三价铝、四价硅、五价磷;说变价也不难,二三价铁、三四价碳、二四六价硫都齐全;铜汞二价最常见。
易错点
(1)一种元素被氧化,不一定有另一种元素被还原。如C2+H2O===H+中,被氧化和被还原的元素都是氯元素。
(2)一种反应物不一定只表现出一种性质。如反应2KMnO4K2MnO4+MnO2+O2↑中,参加反应的KMnO4既表现了还原性,又表现了氧化性。
(3)有单质参加或生成的反应不一定是氧化还原反应。如同素异形体之间的相互转化不属于氧化还原反应。
(4)某种物质由化合态变为游离态,不一定是被还原,如HCl→Cl2是被氧化。
课堂练习
【答案】A
【解析】A.柴火烤肉涉及燃料燃烧,氧元素化合价发生变化,属于氧化还原反应,故A正确;
B.椰雕制作是物理变化,不涉及氧化还原反应,故B错误;
C.铁杵磨针是物理变化,不涉及氧化还原反应,故C错误;
D.钟乳石的形成是碳酸钙和碳酸氢钙之间的互相转化,无元素化合价变化,不涉及氧化还原反应,故D错误;
故选:A。
课堂练习
【答案】B
【解析】A.O2中氧元素化合价由0价降低到-2价,得到电子,所以O2是氧化剂,故A正确;
B.NH3中氮元素由-3价升高到+2价,失去电子,所以NH3是还原剂,被氧化,故B错误;
C.氧元素化合价降低,得到电子,所以O2被还原,故C正确;
D.氮元素化合价升高,失去电子,所以NH3发生氧化反应,故D正确;
故答案为B。
课堂练习
EPB
考点突破
02
氧化还原反应中电子转移的表示方法
【情境】
素材1 楼房有的是用红砖砌成的,有的则是青砖砌成的,可曾想过为什么同样的砖坯有的能烧成红砖,有的能烧成青砖呢?原来烧制砖瓦的黏土中含有二价铁盐,黏土做成砖坯,送到窑内大火烘烧,然后熄灭,自然冷却。此时窑内空气流畅,氧气充足,二价铁盐被氧化成三氧化二铁(Fe2O3),由于三氧化二铁是红色,所以得到的就是红砖瓦。待砖坯烧透后,从窑顶向下不断淋水,当水遇到红热砖瓦变成水蒸气后,碳与水蒸气反应生成氢气和一氧化碳。这些还原性气体能把砖瓦中红色的氧化铁还原成黑色氧化亚铁或四氧化三铁。
素材2 高铁酸钠(Na2FeO4)是一种新型净水剂和消毒剂,主要用于饮用水处理。工业上制备高铁酸钠的方法之一为3NaClO+2Fe(OH)3+4NaOH===2Na2FeO4+3NaCl+5H2O。
【问题探究】
1.根据素材1探究问题:
红砖转化为青砖(含FeO)的反应有哪些?
请写出化学方程式,并标出发生氧化反应和还原反应的物质。
2.根据素材2,探究问题:
归纳总结
1.双线桥法
表示反应前后 由反应物转化为生成物时电子转移的情况。
(1)基本步骤
同一元素
(2)注意事项
(3)巧记口诀
先标化合价,再看价变化;起止同元素,桥上标变化。
示例 用双线桥法标出CO还原Fe2O3反应中电子转移的方向与数目:
2.单线桥法
表示反应过程中 原子间的电子转移情况。
(1)基本步骤
(2)注意事项
①不需要标明“得到”或“失去”,只标明电子转移数目;
②要用箭头标明电子转移的方向;
③箭头由反应物中失电子元素原子指向得电子元素原子。
(3)巧记口诀
先确定变价元素,再计算价态变化;
桥上标明电子数,箭头还原到氧化。
示例 用单线桥法标出CO还原Fe2O3反应中电子转移的方向与数目:
不同元素
课堂练习
1.下列反应中电子转移的表示方法正确的是
EPB
考点突破
03
氧化还原反应与四种基本反应类型的关系
【问题探究】
【情境】
(1)从四种基本反应类型来看,①②④的反应类型分别为①____________,②____________,④____________。
(2)反应③中,________发生氧化反应,________发生还原反应。
(3)用双线桥法表示反应②的电子转移方向与数目________________________。
【解析】 在反应③中碳元素的化合价由+2价升高为+4价,CO发生氧化反应,铜元素的化合价由+2价降低为0价,CuO发生还原反应。
【答案】 (1)分解反应 置换反应 化合反应
(2)CO CuO
【问题探究】
2.有单质参加或生成的化学反应一定是氧化还原反应吗?举例说明。
【解析】不是,反应物中没有单质。
归纳总结
1.图示关系
2.文字表述
(1)置换反应 是氧化还原反应。(填“一定”“不一定”或“一定不”,下同)
(2)复分解反应 是氧化还原反应。
(3)化合反应和分解反应 是氧化还原反应。
①有单质参加的化合反应 是氧化还原反应。
②有单质生成的分解反应 是氧化还原反应。
易错点
(1)四种基本反应类型不能包含所有的化学反应,如反应Cl2+2NaOH===NaCl+NaClO+H2O不属于四种基本反应类型中的任何一种,但它有元素化合价的升降,属于氧化还原反应。
(2)有单质参加或生成的反应不一定是氧化还原反应。如同素异形体之间的相互转化(3O22O3)不属于氧化还原反应。
一定
一定不
不一定
一定
一定
课堂练习
1.氧化还原反应与四种基本反应类型的关系如图所示.下列化学反应属于阴影部分的是
【答案】C
【详解】A.反应属于分解反应,且不是氧化还原反应,A不符合题意;
B.是氧化还原反应,反应属于化合反应,B不符合题意;
C.反应中存在元素化合价改变,是氧化还原反应,但是不属于化合反应、不属于分解反应、不是置换反应,不是复分解反应,C符合题意;
D.反应属于置换反应,是氧化还原反应,D不符合题意;
故选C。
课堂练习
【答案】(1)①化合反应 ②化合反应 ③分解反应
④分解反应 ⑤置换反应 ⑥置换反应 ⑦复分解反应 ⑧复分解反应
(2)①④⑤⑥
EPB
考点突破
05
巩固提升
01
练习与应用
【答案】A
【解析】A.雪天道路上撒盐融雪,是因为雪遇到盐而使其熔点降低并熔化,该过程中没有任何一种元素的化合价发生变化,因此没有涉及到氧化还原反应,A符合题意;
B.暖贴中的铁粉遇空气放热,是铁和氧气发生化学变化生成铁的氧化物,放出热能,该过程中铁元素和氧元素的化合价发生变化,因此,该过程涉及到氧化还原反应, B不符合题意;
C.维生素C可用作水果罐头的抗氧化剂,是利用了维生素C的还原性,涉及氧化还原反应,C不符合题意;
D.臭氧具有强氧化性,能杀灭病菌,涉及氧化还原反应,D不符合题意;
故选A。
练习与应用
02
2.氧化还原反应是从元素化合价是否有变化的角度对化学反应进行分类的结果。下列叙述中,正确的是
A.氧化还原反应的实质是电子得失
B.具有氧化性的物质在化学反应中一定做氧化剂
C.氧化剂氧化其他物质时,本身被还原
D.还原剂在反应中本身被还原
【答案】C
【解析】A.氧化还原反应的实质是电子的转移,包含电子的得失或偏转,故A正确;
B.具有氧化性的物质在反应中不一定作氧化剂,如:浓硝酸与碱的中和反应,浓硝酸虽然具有强氧化性,但发生的为非氧化还原反应,故B错误;
C.反应中氧化剂得电子被还原,故C正确;
D.还原剂失电子化合价升高,被氧化,故D错误;
故答案为:C;
03
练习与应用
3.下列叙述正确的是
A.有一种元素被氧化,同时一定有另一种元素被还原
B.非金属元素由化合态变为游离态一定发生了氧化反应
C.氧化还原反应中所有元素的化合价都发生变化
D.金刚石和石墨互为同素异形体,物理性质不同
【答案】D
【解析】A.有一种元素被氧化,同时不一定有另一种元素被还原,如氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水的反应是氯元素即被氧化又被还原的歧化反应,故A错误;
B.非金属元素由化合态变为游离态不一定发生了氧化反应,如二氧化硫与氢硫酸溶液反应生成硫和水的归中反应中二氧化硫中的硫元素化合价由化合态变为游离态,但二氧化硫发生还原反应,故B错误;
C.氧化还原反应中所有元素的化合价不一定都发生变化,如氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水的反应中钠元素、氢元素和氧元素的化合价没有发生变化,故C错误;
D.金刚石和石墨是碳元素形成的不同种单质,互为同素异形体,两者的结构不同,物理性质不同,故D正确;
故选D。
练习与应用
04
4.黑火药是中国古代四大发明之一,其爆炸反应为2KNO3+S+3C=K2S+N2↑+3CO2↑。下列说法正确的是
A.黑火药中含有两种单质 B.反应中C作为氧化剂
C.反应中S作还原剂 D.反应为置换反应
【答案】A
【解析】A.黑火药中含有硫、碳两种单质,故A正确;
B.C元素化合价升高,所以还原剂是C,故B错误;
C.反应中N和S元素化合价降低,被还原,C元素化合价升高,所以还原剂是C、氧化剂是S和KNO3,故C错误;
D.该反应中反应物和生成物都是三种,则不是置换反应,故D错误;
故选:A。
练习与应用
05
练习与应用
06
【答案】D
【解析】A.过氧化氢在催化剂作用下能分解生成氧气和水,则过氧化氢转化为氧气的过程不需要加入还原剂就能实现,故A不符合题意;
B.四羟基合铝酸根离子转化为氢氧化铝时,铝元素没有发生化合价变化,不需要加入还原剂就能实现,故B不符合题意;
C.亚砷酸根离子转化为砷酸根离子时,砷元素的化合价升高被氧化,需要加入氧化剂就才实现,故C不符合题意;
D.二氧化锰转化为锰离子时,锰元素的化合价降低被还原,需要加入还原剂才能实现,故D符合题意;
故选D。
07
练习与应用
7.下列用单、双线桥法表示电子转移的方向和数目错误的是
07
练习与应用
练习与应用
08
练习与应用
08
(4)上述反应中,既是溶液中的离子反应,又是氧化还原反应的是________。
(5)根据你的理解,氧化还原反应的实质是________。
A.分子中的原子重新组合
B.氧元素的得失
C.电子的得失或共用电子对的偏移
D.化合价的改变
【解析】基本反应类型中,复分解反应不是氧化还原反应;置换反应一定是氧化还原反应;化合反应和分解反应,若元素化合价有变化则是氧化还原反应,若元素化合价无变化则是非氧化还原反应。离子反应是否属于氧化还原反应也要根据元素的化合价在反应前后是否发生变化来判断。
【答案】(1)①④⑧ ⑤ (2)②⑧ (3)⑦ (4)③ (5)C
THANK YOU
