2.1.1 共价键的类型与特征——高二化学人教版(2019)选修二课时优化训练(含答案)
文档属性
| 名称 | 2.1.1 共价键的类型与特征——高二化学人教版(2019)选修二课时优化训练(含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 413.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-20 22:28:16 | ||
图片预览



文档简介
2.1.1 共价键的类型与特征——高二化学人教版(2019)选修二课时优化训练
1.下列关于共价键的说法正确的是( )
A.共价键只存在于共价化合物中
B.只含有共价键的物质一定是共价化合物
C.非金属元素的原子只能通过共价键形成共价分子
D.离子化合物中既可能含有极性键也可能含有非极性键
2.H2O分子中每个O原子结合2个H原子的根本原因是( )
A.共价键的方向性
B.共价键的键长
C.共价键的键角
D.共价键的饱和性
3.下列分子中,只有σ键没有π键的是( )
A.CH4 B.N2
C.CH2CH2 D.CH≡CH
4.下列分子的结构式与共价键的饱和性不相符的是( )
A.
B.:
C.:
D.:
5.下列分子中既含键,又含键的是( )
A B C D
水 乙醇 氨 乙醛
A.A
B.B
C.C
D.D
6.下列化学反应所断裂的共价键中,仅断裂键的是( )
A. B.
C. D.
7.(双选)设为阿伏加德罗常数的值,下列常见分子中键、键判断正确的是( )
A.中含有的键数目为2
B.CO与结构相似,CO分子中键与键数目之比为2:1
C.与结构相似,分子中键与键数目之比为1:1
D.已知反应,若该反应中有4molN—H键断裂,则形成的键数目为
8.根据氢原子和氟原子的核外电子排布,对和HF分子中形成的共价键描述正确的是( )
A.两者都为键
B.两者都为键
C.前者为键,后者为键
D.前者为键,后者为键
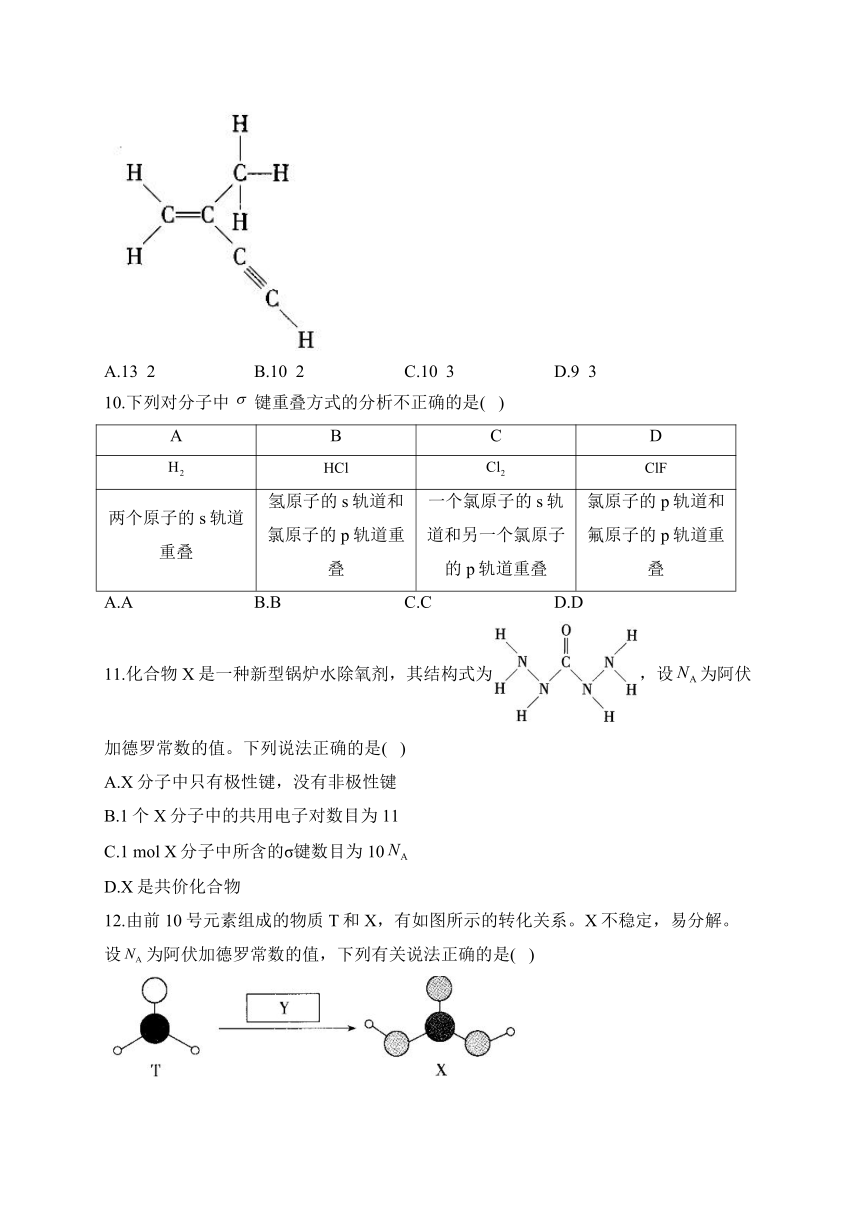
9.如图所示的分子中含有键和键的数目分别为( )
A.13 2 B.10 2 C.10 3 D.9 3
10.下列对分子中键重叠方式的分析不正确的是( )
A B C D
两个原子的s轨道重叠 氢原子的s轨道和氯原子的p轨道重叠 一个氯原子的s轨道和另一个氯原子的p轨道重叠 氯原子的p轨道和氟原子的p轨道重叠
A.A B.B C.C D.D
11.化合物X是一种新型锅炉水除氧剂,其结构式为,设为阿伏加德罗常数的值。下列说法正确的是( )
A.X分子中只有极性键,没有非极性键
B.1个X分子中的共用电子对数目为11
C.1 mol X分子中所含的σ键数目为10
D.X是共价化合物
12.由前10号元素组成的物质T和X,有如图所示的转化关系。X不稳定,易分解。设为阿伏加德罗常数的值,下列有关说法正确的是( )
A.为使该转化成功进行,Y可以是酸性溶液
B.等物质的量的T、X分子中含有键的数目均为
C.X分子中含有的键个数是T分子中含有的键个数的2倍
D.T分子中只含有极性键,X分子中既含有极性键又含有非极性键
13.有三种物质,在常温下分别为气体、固体和液体。元素A的最高正价和最低负价的绝对值相等;元素B的单质能在C的气态单质中剧烈燃烧,火焰呈黄色,并生成淡黄色固体;元素D的负一价阴离子的电子层结构与氩原子相同。则:
(1)A、B、C、D元素的名称分别为________、________、________、________。
(2)分子中含有的键类型为________(填“s-s”“s-p”或“p-p”)键。
(3)D的负一价阴离子的电子排布式为________,属于________(填“离子”或“共价”)化合物。
14.回答下列问题:
(1)有以下物质:
A.
B.
C.
D.
E.
F.
G.
H.
I.
J.
K.
①既含有极性键,又含有非极性键的是______(填序号,下同);
②既含有键,又含有键的是______;
③含有由一个原子的s轨道与另一个原子的p轨道重叠形成的键的是______;
④水分子是而不是,是因为共价键具有______性;水分子的键角为105°,是因为共价键具有______。
(2)C、H元素形成的化合物分子中共有16个电子,该分子中键与键的个数比为______。
(3)1mol乙醛分子中含键的数目为______,1个分子中含有键的个数为______。
(4)分子中共价键的极性由强到弱的顺序是______。
(5)C、Si为同主族的元素,和的化学式相似,但结构和性质有很大不同。中C与O原子间形成键和键,中Si与O原子间不能形成上述键。从原子半径大小的角度分析,为何C、O原子间能形成T键,而Si、O原子间不能形成上述键?______。
15.现有四种短周期元素A、B、C、D,已知:①C、D在同一周期,A、B在同一主族;②它们可以组成化合物、、、等;③B的简单阳离子与C的简单阴离子的核外电子排布相同;④与或反应都生成气体,单质B与反应生成气体,与气体按体积比2:1混合后点燃发生爆炸,其产物是一种常温下常见的无色无味的液体。
请回答下列问题:
(1)写出元素符号:A____________、B____________、C____________、D____________。
(2)在、、和中,同时含有离子键和非极性共价键的化合物的电子式为____________,按原子轨道重叠方式,其非极性键的类型是____________。化合物的结构式为____________。
(3)分子的电子式为____________,按原子轨道重叠方式,其共价键的类型是____________。是平面形分子,其分子中含有____________个键,____________个键。
答案以及解析
1.答案:D
2.答案:D
解析:O原子最外层有6个电子,可得到2个电子形成8电子稳定结构;H原子最外层有1个电子,只能形成2电子稳定结构,则每个O原子结合2个H原子与共价键的饱和性有关。
3.答案:A
4.答案:A
解析:由共价键的饱和性可知:C、Si均形成4个共价键,H、Cl均形成1个共价键,N形成3个共价键,O、S均形成2个共价键。A项中O原子间是双键,且每个氧原子与1个氢原子形成1个单键,则每个氧原子形成3个共价键,与其饱和性不相符。
5.答案:D
解析:水分子中只有单键,全部是键,A不符合;乙醇分子中只有单键,全部是键,B不符合;氨气分子中只有单键,全部是键,C不符合;乙醛分子中含有单键和碳氧双键,既含键,又含键,D符合。
6.答案:C
解析:中含键,反应中1个键和2个键均断裂,A项错误;中含键,反应中1个键和2个键均断裂,B项错误;H—H键、C—Cl键均为单键,反应中仅断裂键,C项正确;中含C==C键,反应中键断裂,D项错误。
7.答案:AD
解析:1个中含有1个OO键,因此中含有个键,故A正确;CO与结构相似,1个中含有个N≡N键,则1个CO中含有一个C≡O键,分子中键与键数目之比为1:2,故B错误;与结构相似,1个分子中含有一个C=C键和一个C≡N键,因此分子中含有6个键和3个键,键与键的数目之比为2:1,故C错误;若该反应中有4molN—H键断裂,即有参与反应,则生成1.5mol氮气,氮气中含有N≡N键,形成键的数目是,故D正确。
8.答案:C
解析:氢原子的核外电子排布式为,氟原子的核外电子排布式为,p轨道上有1个未成对的p电子。中的共价键是由两个氟原子禾成对的p电子重叠形成的p-p键,HF中的共价键是由氢原子中的s轨道与氟原子中的p轨道形成的s-p键,C正确。
9.答案:C
解析:题述分子中含有6个C—H键、2个C—C键、1个C==C键、1个键,单键中只含有键,双键中含有1个键和1个键,三键中含有1个键和2个键,故该分子中共有10个键和3个键,故C项正确。
10.答案:C
解析:A项,H分子中键重叠方式是两个原子的ls轨道重叠,正确;B项,HCl分子中键重叠方式是氢原子的1s轨道和氯原子的3p轨道重叠,正确;C项,分子中键重叠方式是两个氯原子的3p轨道重叠,错误;D项,ClF分子中键重叠方式是氯原子的3p轨道和氟原子的2p轨道重叠,正确。
11.答案:D
解析:N—N键是非极性键,A项不正确;1个X分子中存在12对共用电子对、11个σ键,B、C项均不正确;X分子中只有共价键,故X是共价化合物,D项正确。
12.答案:A
解析:由题图可知,T为HCHO,X不稳定,易分解,则X为,Y为氧化剂,可以选择酸性溶液,A项正确;等物质的量并不一定是1mol,B项错误;1个X分子中含有的键个数为5,1个T分子中含有的键个数为3,C项错误;T、X分子中均只含有极性键,无非极性键,D项错误。
13.答案:(1)碳;钠;氧;氯
(2)p-p
(3);离子
解析:(1)火焰呈黄色,说明有钠元素,则淡黄色固体为,所以元素B为Na,元素C为O。由“元素D的负一价阴离子的电子层结构与氩原子相同”知,D为Cl。由“元素A的最高正价和最低负价的绝对值相等”,可知A为ⅣA族元素,又由于常温下是气体,是液体,所以是二氧化碳(ⅣA族元素中Si及其以下元素形成的氧化物常温下均为固体),是,即A是C(碳)。
(2)中只有键,且其类型为p-p键。
14.答案:(1)①EFH;②DEIJK;③ACEFHIK;④饱和;方向
(2)5:1
(3)(或);7
(4)
(5)C原子半径较小,C、O原子能充分接近,p-p轨道“肩并肩”重叠程度较大,能形成较稳定的键;而Si原子半径较大,Si、O原子间距离较大,p-p轨道“肩并肩”重叠程度较小,不能形成稳定的键
解析:(1)HF只含极性键,且只含键;只含非极性键,且只含键;只含极性键,且只含键;只含非极性键,且含有键和键;含有极性键、非极性键,且含有键和键;含有极性键、非极性键,且只含键;只含非极性键,且只含键;含有极性键、非极性键,且只含键;只含极性键,且含有键和键;含有极性键,且含有键和键;HCHO含有极性键,且含有键和键。①综上所述,既含有极性键,又含有非极性键的是EFH。②综上所述,既含有键,又含有键的是DEIK。③含有由一个原子的s轨道与另一个原子的p轨道重叠形成的键是指由H原子与其他含p电子的原子形成的共价键,则符合条件的是 ACEFHIK。④水分子是而不是,是因为共价键具有饱和性;水分子的键角为105°,是因为共价键具有方向性。
(2)设该化合物的分子式为,则,结合,得,即分子式为,结构式为,单键为键,双键有1个键和1个键,所以一个分子中共含有5个键和1个键,该分子中键和键的个数比为5:1。
(3)乙醛的结构简式为,1个乙醛分子中含6个键,故1mol乙醛分子中含有6mol键,即个,的结构简式为,1个分子中含有7个键。
(4)两个成键原子的电负性差值越大,它们形成共价键的极性就越强(或从非金属性强弱上来判断),由于电负性:F>O>N>C,因此四种分子中共价键的极性:。
(5)C、O原子间能形成键,而Si、O原子间不能形成上述键的原因是C原子半径较小,C、O原子能充分接近,p-p轨道“肩并肩”重叠程度较大,能形成较稳定的键;而Si原子半径较大,Si、O原子间距离较大,p-p轨道“肩并肩”重叠程度较小,不能形成稳定的键。
15.答案:(1)H Na O C
(2)
键 O==C==O
(3) 键 5 1
解析:由与气体按体积比2:1混合后点燃发生爆炸,其产物是一种常温下常见的无色无味的液体,可知该液体是,A是H元素,C是O元素;结合其他信息可推出B是Na元素,D是C元素。
1.下列关于共价键的说法正确的是( )
A.共价键只存在于共价化合物中
B.只含有共价键的物质一定是共价化合物
C.非金属元素的原子只能通过共价键形成共价分子
D.离子化合物中既可能含有极性键也可能含有非极性键
2.H2O分子中每个O原子结合2个H原子的根本原因是( )
A.共价键的方向性
B.共价键的键长
C.共价键的键角
D.共价键的饱和性
3.下列分子中,只有σ键没有π键的是( )
A.CH4 B.N2
C.CH2CH2 D.CH≡CH
4.下列分子的结构式与共价键的饱和性不相符的是( )
A.
B.:
C.:
D.:
5.下列分子中既含键,又含键的是( )
A B C D
水 乙醇 氨 乙醛
A.A
B.B
C.C
D.D
6.下列化学反应所断裂的共价键中,仅断裂键的是( )
A. B.
C. D.
7.(双选)设为阿伏加德罗常数的值,下列常见分子中键、键判断正确的是( )
A.中含有的键数目为2
B.CO与结构相似,CO分子中键与键数目之比为2:1
C.与结构相似,分子中键与键数目之比为1:1
D.已知反应,若该反应中有4molN—H键断裂,则形成的键数目为
8.根据氢原子和氟原子的核外电子排布,对和HF分子中形成的共价键描述正确的是( )
A.两者都为键
B.两者都为键
C.前者为键,后者为键
D.前者为键,后者为键
9.如图所示的分子中含有键和键的数目分别为( )
A.13 2 B.10 2 C.10 3 D.9 3
10.下列对分子中键重叠方式的分析不正确的是( )
A B C D
两个原子的s轨道重叠 氢原子的s轨道和氯原子的p轨道重叠 一个氯原子的s轨道和另一个氯原子的p轨道重叠 氯原子的p轨道和氟原子的p轨道重叠
A.A B.B C.C D.D
11.化合物X是一种新型锅炉水除氧剂,其结构式为,设为阿伏加德罗常数的值。下列说法正确的是( )
A.X分子中只有极性键,没有非极性键
B.1个X分子中的共用电子对数目为11
C.1 mol X分子中所含的σ键数目为10
D.X是共价化合物
12.由前10号元素组成的物质T和X,有如图所示的转化关系。X不稳定,易分解。设为阿伏加德罗常数的值,下列有关说法正确的是( )
A.为使该转化成功进行,Y可以是酸性溶液
B.等物质的量的T、X分子中含有键的数目均为
C.X分子中含有的键个数是T分子中含有的键个数的2倍
D.T分子中只含有极性键,X分子中既含有极性键又含有非极性键
13.有三种物质,在常温下分别为气体、固体和液体。元素A的最高正价和最低负价的绝对值相等;元素B的单质能在C的气态单质中剧烈燃烧,火焰呈黄色,并生成淡黄色固体;元素D的负一价阴离子的电子层结构与氩原子相同。则:
(1)A、B、C、D元素的名称分别为________、________、________、________。
(2)分子中含有的键类型为________(填“s-s”“s-p”或“p-p”)键。
(3)D的负一价阴离子的电子排布式为________,属于________(填“离子”或“共价”)化合物。
14.回答下列问题:
(1)有以下物质:
A.
B.
C.
D.
E.
F.
G.
H.
I.
J.
K.
①既含有极性键,又含有非极性键的是______(填序号,下同);
②既含有键,又含有键的是______;
③含有由一个原子的s轨道与另一个原子的p轨道重叠形成的键的是______;
④水分子是而不是,是因为共价键具有______性;水分子的键角为105°,是因为共价键具有______。
(2)C、H元素形成的化合物分子中共有16个电子,该分子中键与键的个数比为______。
(3)1mol乙醛分子中含键的数目为______,1个分子中含有键的个数为______。
(4)分子中共价键的极性由强到弱的顺序是______。
(5)C、Si为同主族的元素,和的化学式相似,但结构和性质有很大不同。中C与O原子间形成键和键,中Si与O原子间不能形成上述键。从原子半径大小的角度分析,为何C、O原子间能形成T键,而Si、O原子间不能形成上述键?______。
15.现有四种短周期元素A、B、C、D,已知:①C、D在同一周期,A、B在同一主族;②它们可以组成化合物、、、等;③B的简单阳离子与C的简单阴离子的核外电子排布相同;④与或反应都生成气体,单质B与反应生成气体,与气体按体积比2:1混合后点燃发生爆炸,其产物是一种常温下常见的无色无味的液体。
请回答下列问题:
(1)写出元素符号:A____________、B____________、C____________、D____________。
(2)在、、和中,同时含有离子键和非极性共价键的化合物的电子式为____________,按原子轨道重叠方式,其非极性键的类型是____________。化合物的结构式为____________。
(3)分子的电子式为____________,按原子轨道重叠方式,其共价键的类型是____________。是平面形分子,其分子中含有____________个键,____________个键。
答案以及解析
1.答案:D
2.答案:D
解析:O原子最外层有6个电子,可得到2个电子形成8电子稳定结构;H原子最外层有1个电子,只能形成2电子稳定结构,则每个O原子结合2个H原子与共价键的饱和性有关。
3.答案:A
4.答案:A
解析:由共价键的饱和性可知:C、Si均形成4个共价键,H、Cl均形成1个共价键,N形成3个共价键,O、S均形成2个共价键。A项中O原子间是双键,且每个氧原子与1个氢原子形成1个单键,则每个氧原子形成3个共价键,与其饱和性不相符。
5.答案:D
解析:水分子中只有单键,全部是键,A不符合;乙醇分子中只有单键,全部是键,B不符合;氨气分子中只有单键,全部是键,C不符合;乙醛分子中含有单键和碳氧双键,既含键,又含键,D符合。
6.答案:C
解析:中含键,反应中1个键和2个键均断裂,A项错误;中含键,反应中1个键和2个键均断裂,B项错误;H—H键、C—Cl键均为单键,反应中仅断裂键,C项正确;中含C==C键,反应中键断裂,D项错误。
7.答案:AD
解析:1个中含有1个OO键,因此中含有个键,故A正确;CO与结构相似,1个中含有个N≡N键,则1个CO中含有一个C≡O键,分子中键与键数目之比为1:2,故B错误;与结构相似,1个分子中含有一个C=C键和一个C≡N键,因此分子中含有6个键和3个键,键与键的数目之比为2:1,故C错误;若该反应中有4molN—H键断裂,即有参与反应,则生成1.5mol氮气,氮气中含有N≡N键,形成键的数目是,故D正确。
8.答案:C
解析:氢原子的核外电子排布式为,氟原子的核外电子排布式为,p轨道上有1个未成对的p电子。中的共价键是由两个氟原子禾成对的p电子重叠形成的p-p键,HF中的共价键是由氢原子中的s轨道与氟原子中的p轨道形成的s-p键,C正确。
9.答案:C
解析:题述分子中含有6个C—H键、2个C—C键、1个C==C键、1个键,单键中只含有键,双键中含有1个键和1个键,三键中含有1个键和2个键,故该分子中共有10个键和3个键,故C项正确。
10.答案:C
解析:A项,H分子中键重叠方式是两个原子的ls轨道重叠,正确;B项,HCl分子中键重叠方式是氢原子的1s轨道和氯原子的3p轨道重叠,正确;C项,分子中键重叠方式是两个氯原子的3p轨道重叠,错误;D项,ClF分子中键重叠方式是氯原子的3p轨道和氟原子的2p轨道重叠,正确。
11.答案:D
解析:N—N键是非极性键,A项不正确;1个X分子中存在12对共用电子对、11个σ键,B、C项均不正确;X分子中只有共价键,故X是共价化合物,D项正确。
12.答案:A
解析:由题图可知,T为HCHO,X不稳定,易分解,则X为,Y为氧化剂,可以选择酸性溶液,A项正确;等物质的量并不一定是1mol,B项错误;1个X分子中含有的键个数为5,1个T分子中含有的键个数为3,C项错误;T、X分子中均只含有极性键,无非极性键,D项错误。
13.答案:(1)碳;钠;氧;氯
(2)p-p
(3);离子
解析:(1)火焰呈黄色,说明有钠元素,则淡黄色固体为,所以元素B为Na,元素C为O。由“元素D的负一价阴离子的电子层结构与氩原子相同”知,D为Cl。由“元素A的最高正价和最低负价的绝对值相等”,可知A为ⅣA族元素,又由于常温下是气体,是液体,所以是二氧化碳(ⅣA族元素中Si及其以下元素形成的氧化物常温下均为固体),是,即A是C(碳)。
(2)中只有键,且其类型为p-p键。
14.答案:(1)①EFH;②DEIJK;③ACEFHIK;④饱和;方向
(2)5:1
(3)(或);7
(4)
(5)C原子半径较小,C、O原子能充分接近,p-p轨道“肩并肩”重叠程度较大,能形成较稳定的键;而Si原子半径较大,Si、O原子间距离较大,p-p轨道“肩并肩”重叠程度较小,不能形成稳定的键
解析:(1)HF只含极性键,且只含键;只含非极性键,且只含键;只含极性键,且只含键;只含非极性键,且含有键和键;含有极性键、非极性键,且含有键和键;含有极性键、非极性键,且只含键;只含非极性键,且只含键;含有极性键、非极性键,且只含键;只含极性键,且含有键和键;含有极性键,且含有键和键;HCHO含有极性键,且含有键和键。①综上所述,既含有极性键,又含有非极性键的是EFH。②综上所述,既含有键,又含有键的是DEIK。③含有由一个原子的s轨道与另一个原子的p轨道重叠形成的键是指由H原子与其他含p电子的原子形成的共价键,则符合条件的是 ACEFHIK。④水分子是而不是,是因为共价键具有饱和性;水分子的键角为105°,是因为共价键具有方向性。
(2)设该化合物的分子式为,则,结合,得,即分子式为,结构式为,单键为键,双键有1个键和1个键,所以一个分子中共含有5个键和1个键,该分子中键和键的个数比为5:1。
(3)乙醛的结构简式为,1个乙醛分子中含6个键,故1mol乙醛分子中含有6mol键,即个,的结构简式为,1个分子中含有7个键。
(4)两个成键原子的电负性差值越大,它们形成共价键的极性就越强(或从非金属性强弱上来判断),由于电负性:F>O>N>C,因此四种分子中共价键的极性:。
(5)C、O原子间能形成键,而Si、O原子间不能形成上述键的原因是C原子半径较小,C、O原子能充分接近,p-p轨道“肩并肩”重叠程度较大,能形成较稳定的键;而Si原子半径较大,Si、O原子间距离较大,p-p轨道“肩并肩”重叠程度较小,不能形成稳定的键。
15.答案:(1)H Na O C
(2)
键 O==C==O
(3) 键 5 1
解析:由与气体按体积比2:1混合后点燃发生爆炸,其产物是一种常温下常见的无色无味的液体,可知该液体是,A是H元素,C是O元素;结合其他信息可推出B是Na元素,D是C元素。
