2024届北京牛栏山一中高三9月月考化学(PDF版,无答案)
文档属性
| 名称 | 2024届北京牛栏山一中高三9月月考化学(PDF版,无答案) |  | |
| 格式 | |||
| 文件大小 | 800.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-21 08:52:12 | ||
图片预览



文档简介
2024北京牛栏山一中高三 9月月考
化 学
2024.09.14
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分 100 分,考试时间 90 分钟。所
有答案必须填涂或作答在答.题.卡.上,否则不得分。
可能用到的相对原子质量:H1 O16 C12 N14 Mg24 S32 Cl35.5 Mn55 Fe56 Cu64
第Ⅰ卷(选择题共 42 分)
本卷共 14 小题,每小题 3 分。在每小题列出的四个选项中,选出最符合题目答案的一项。
1.下列化学用语或图示表达正确的是( )
32
A.为中子数为 32,质子数为 27 的钴原子: 27 Co
B.SO2的空间结构示意图为
C.基态 Si 原子的价层电子的轨道表示式为
D.HF 分子中 σ 键的形成示意图为
2.下列方程式与所给事实相符的是( )
+ 3
A.常温下,0.1mol·L-1H3PO4液溶液 pH 约为 3.1:H3PO4 = 3H + PO4
18 + 18
B.向 H 182 O 中加入 Na2O2,产生无色气体:2H2 O + 2Na2O2 = 4Na + 4OHO + O2
2+ +
C.向 NaHCO3入溶液中加入 CaCl2产生白色沉淀:Ca +HCO3 = CaCO3 +H
高温
D.还原铁粉与水蒸气反应有可燃性气体产生:3Fe+ 4H2O(g) Fe3O 4 + 4H2
3.下列对事实的分析正确的是( )
选项 事实 分析
A 沸点:CO>N2 CO 为极性分子,N2为非极性分子
B 第一电离能:P>S 原子半径:P>S
C 键角:CH4>NH3>H2O 电负性:CD 热稳定性:HF>HCl HF 中存在氢键,HCl 中不存在氢键
4.下列说法不.正.确.的是( )
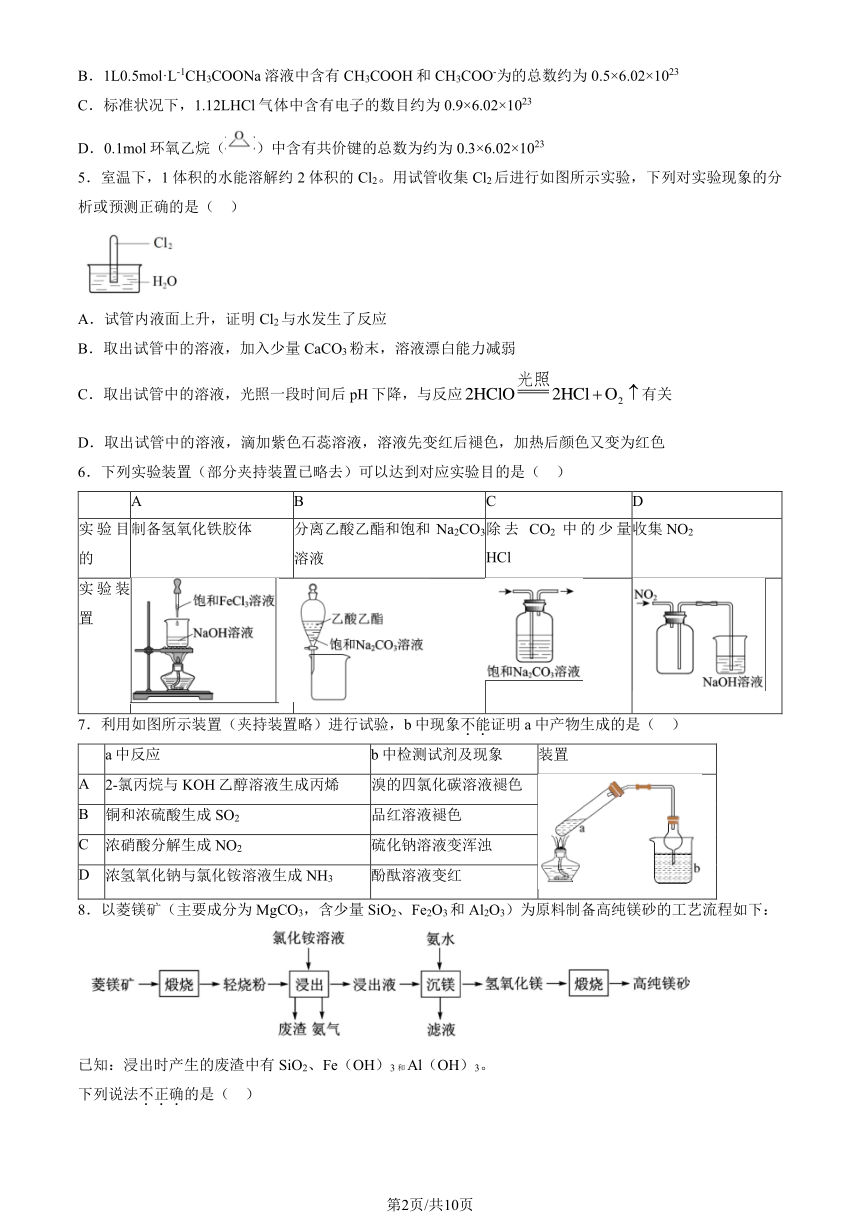
A.常温常压下,3.2gO2和 O3的混合气体中含有氧原子的数目约为 0.2×6.02×1023
第1页/共10页
B.1L0.5mol·L-1CH3COONa 溶液中含有 CH3COOH 和 CH3COO-为的总数约为 0.5×6.02×1023
C.标准状况下,1.12LHCl 气体中含有电子的数目约为 0.9×6.02×1023
D.0.1mol 环氧乙烷( )中含有共价键的总数为约为 0.3×6.02×1023
5.室温下,1 体积的水能溶解约 2 体积的 Cl2。用试管收集 Cl2后进行如图所示实验,下列对实验现象的分
析或预测正确的是( )
A.试管内液面上升,证明 Cl2与水发生了反应
B.取出试管中的溶液,加入少量 CaCO3粉末,溶液漂白能力减弱
光照
C.取出试管中的溶液,光照一段时间后 pH 下降,与反应2HClO 2HCl+O 有关 2
D.取出试管中的溶液,滴加紫色石蕊溶液,溶液先变红后褪色,加热后颜色又变为红色
6.下列实验装置(部分夹持装置已略去)可以达到对应实验目的是( )
A B C D
实验目制备氢氧化铁胶体 分离乙酸乙酯和饱和 Na2CO3除去 CO2 中的少量收集 NO2
的 溶液 HCl
实验装
置
7.利用如图所示装置(夹持装置略)进行试验,b 中现象不.能.证明 a 中产物生成的是( )
a 中反应 b 中检测试剂及现象 装置
A 2-氯丙烷与 KOH 乙醇溶液生成丙烯 溴的四氯化碳溶液褪色
B 铜和浓硫酸生成 SO2 品红溶液褪色
C 浓硝酸分解生成 NO2 硫化钠溶液变浑浊
D 浓氢氧化钠与氯化铵溶液生成 NH3 酚酞溶液变红
8.以菱镁矿(主要成分为 MgCO3,含少量 SiO2、Fe2O3和 Al2O3)为原料制备高纯镁砂的工艺流程如下:
已知:浸出时产生的废渣中有 SiO2、Fe(OH)3 和 Al(OH)3。
下列说法不.正.确.的是( )
第2页/共10页
A.浸出镁的反应为 MgO+2NH4Cl=MgCl2+2NH3↑+H2O
B.浸出和沉镁的操作均应在较高温度下进行
C.流程中可循环使用的物质有 NH3、NH4Cl
D.分离 Mg2+与 Al3+、Fe3+是利用了它们氢氧化物 Ksp的不同
9.由柠檬烯制备生物可降解塑料(Y)的过程如下。其中 X→Y 为原子利用率为 100%。
下列说法不.正.确.的是( )
A.柠檬烯→X 过程中 H2O2作氧化剂
B.试剂 a 为 CO2
C.一定条件下,Y 可从线型结构变为网状结构
D.柠檬烯的分子式为 C10H18
10.科学家发展出一种近中性条件下高效无膜电解水过程,原理如图所示,其中溴化物在电解池甲中被氧
化为溴酸盐。下列说法正确的是( )
A.极电极 A 为阳极
B.电解一段时间后,甲中液溶液 pH 升高
催化剂
C.乙中发生的反应为: 2BrO 3 2Br
+3O 2
D.当甲中有 1mol BrO
3 生成时,理论上有 44.8LH2生成(标准状况下)
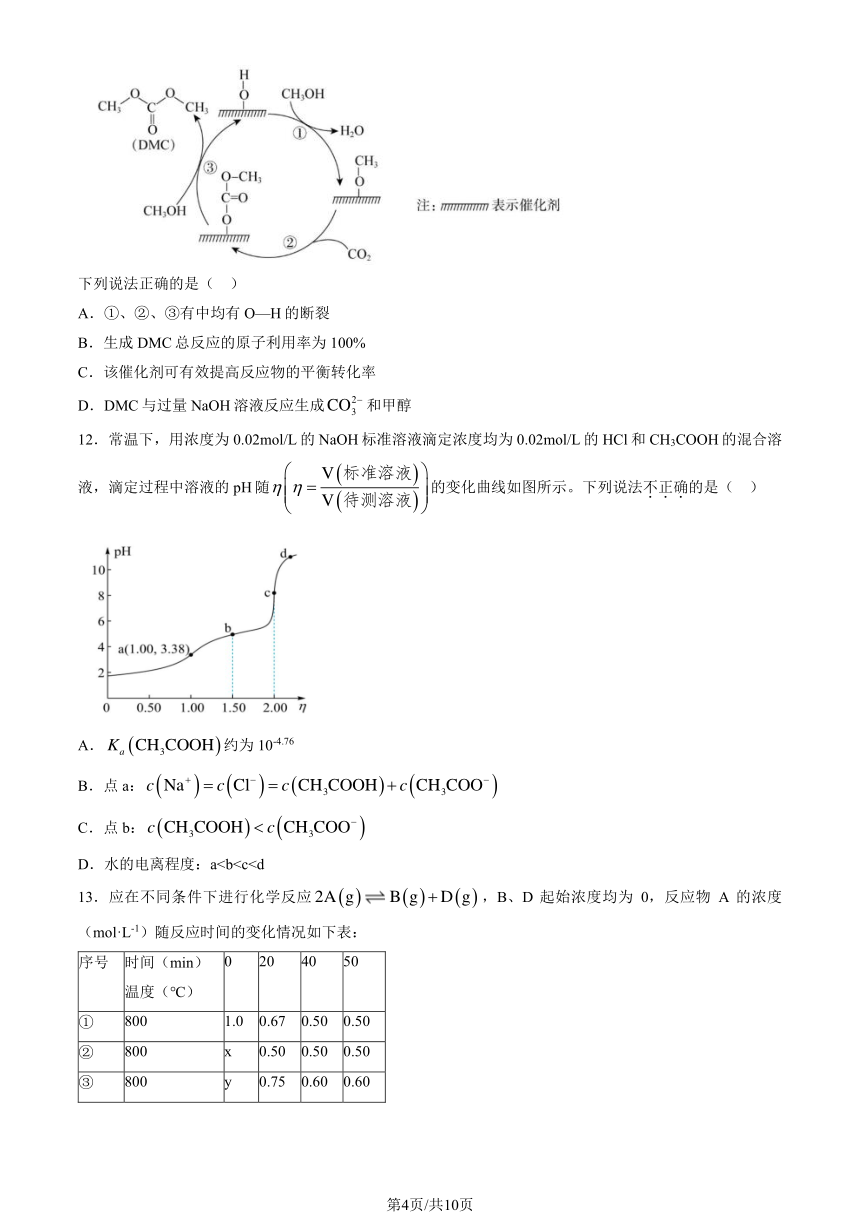
11.科研人员提出 CeO2成催化合成 DMC 需经历三步反应,示意图如下:
第3页/共10页
下列说法正确的是( )
A.①、②、③有中均有 O—H 的断裂
B.生成 DMC 总反应的原子利用率为 100%
C.该催化剂可有效提高反应物的平衡转化率
2
D.DMC 与过量 NaOH 溶液反应生成CO3 和甲醇
12.常温下,用浓度为 0.02mol/L 的 NaOH 标准溶液滴定浓度均为 0.02mol/L 的 HCl 和 CH3COOH 的混合溶
V (标准溶液)
液,滴定过程中溶液的 pH 随 = 的变化曲线如图所示。下列说法不.正.确.的是( )
V (待测溶液)
A. K (CH COOH)约为 10-4.76a 3
+
B.点 a:c (Na ) = c (Cl ) = c (CH3COOH)+ c (CH3COO )
C.点 b:c (CH3COOH) c (CH3COO )
D.水的电离程度:a13.应在不同条件下进行化学反应 2A (g) B(g)+D (g),B、D 起始浓度均为 0,反应物 A 的浓度
(mol·L-1)随反应时间的变化情况如下表:
序号 时间(min) 0 20 40 50
温度(℃)
① 800 1.0 0.67 0.50 0.50
② 800 x 0.50 0.50 0.50
③ 800 y 0.75 0.60 0.60
第4页/共10页
④ 820 1.0 0.25 0.20 0.20
下列说法不.正.确.的是( )
A.①中 B 在 0~20min 平均反应速率为 8.25×10-3mol·L-1·min-1
B.②中 K=0.25,可能使用了催化剂
C.③中 y=1.4mol·L-1
D.比较①、④可知,该反应为吸热反应
14.向 FeCl3溶液中加入 Na2SO3溶液,测定混合后溶液 pH随混合前中溶液中 c (SO 2 3 ) / c (Fe3+ )变化的曲
线如下图所示。实验发现:
i.a 点溶液透明澄清,向其中滴加 NaOH 溶液后,立即产生灰白色沉淀,滴入 KSCN 溶液显红色;
ii.c 点和 d 点溶液中产生红褐色沉淀,无气体逸出。取其上层清液滴加 NaOH 溶液后无明显现象,滴加
KSCN 溶液显红色。
下列分析合理的是( )
A.向 a 点溶液中滴加 BaCl2溶液,无明显现象
3+ 2 2+ 2 +
B.b 点较 a 点溶液 pH 升高的主要原因:2Fe +SO3 +H2O = 2Fe +SO4 + 2H
3+ 2
C.c 点溶液中发生的主要反应:2Fe +3SO3 + 6H2O 2Fe (OH) +3H SO 3 2 3
D.向 d 点上层清液中滴加 KSCN 溶液,溶液变红;再滴加 NaOH 溶液,红色加深
第 II 卷题(非选择题 共 58 分)
15.(11 分)铁元素在人体健康和新材料研发中有重要的应用。
(1)基态 Fe 原子核外电子排布式为_________。
(2)邻二氮菲(phen)与 Fe2+生成稳定的橙红色邻二氮菲亚铁离子[Fe(phen) ]2+3 ,可用于补铁剂中 Fe2+
的测定,邻二氮菲的结构简式如图所示。
①邻二氮菲的一氯代物有_________种。
②补铁剂中的 Fe2+易被氧化变质,请从结构角度解释其原因:_________。
③用邻二氮菲测定 Fe2+浓度时应控制 pH 为 5~6 的适宜范围,请解释原因:_________。
第5页/共10页
(3)邻二氮菲结构中包含吡啶环( ),含有类似结构的物质通常具有一定的碱性,已知碱性强弱:
。请解释原因:_________。
(4)氢气的安全贮存和运输是氢能应用的关键,铁镁合金是目前已发现的储氢密度最高的储氢材料之一,
其晶胞结构如图所示。
①距离 Mg 原子最近的 Fe 原子个数是_________。
②铁镁合金的化学式为_________。
③若该晶胞的晶胞边长为 dnm,阿伏加德罗常数为 NA ,则该合金的密度为_________g cm
-3(1nm=1×10-
7cm,列出计算式即可)。
④若该晶体储氢时,H2 分子在晶胞的体心和棱心位置,则含 Mg48g 的该储氢合金可储存标准状况下 H2 的
体积约为_________L。
16.(11 分)Na2S2O3应用广泛,水处理中常用作还原剂、冶金中常用作络合剂。
(1)Na2S2O3的实验室制法:装置图如下(加热和夹持装置略):
△
已知:2Na2S+3SO2=2Na2SO3+3S↓、 Na2SO3 +S Na2S2O3
①甲中发生反应的化学方程式为______。
②实验过程中,乙中的澄清溶液先变浑浊,后变澄清时生成大量的 Na2S2O3。一段时间后,乙中再次出现
少量浑浊,此时须立刻停止通入 SO2。结合离子方程式解释此时必须立刻停止通入 SO2的原因:______。
③丙中,NaOH 溶液吸收的气体可能有______。
(2)实际工业生产中制得的 Na2S2O3 溶液中常混有少量 Na2SO3,结合溶解度曲线(如图),获得
第6页/共10页
Na2S2O3·5H2O 的方法是______。
(3)Na2S2O3的用途:氨性硫代硫酸盐加热浸金是一种环境友好的黄金(Au)浸取工艺。
2+
已知:I.Cu (NH3 ) Cu
2+ + 4NH ;
4 3
2+
II.浸金过程Cu (NH3 ) 起到催化剂的作用 4
III.Cu2+成在碱性较强时受热会生成 CuO 沉淀。
2+
①将金矿石浸泡在 Na2S2O3、Cu (NH3 ) 的混合溶液中,并通入 O2。浸金反应的原理分为两步: 4
2+
Cu (NH 2
+ 3
i. 3 ) +Au + 2S2O3 Cu (NH3 ) +Au (S2O3 ) + 2NH3 4 2 2
ii._________(写出该步反应)
②一定温度下,相同时间金的浸出率随体系 pH变化曲线如图,解释 pH>10.5时,金的浸出率降低的可能原
因_________。(写出 2 点即可)
17.(15 分)疗度鲁特韦可以用于治疗 HIV-1 感染,M 是合成度鲁特韦的一种中间体。成合成 M 的路线如
下:(部分反应条件或试剂略去)
第7页/共10页
已知:
O R 2 OH R 2
Ⅰ. || | | |
R CH +CH C = CHR 特 殊 溶剂1 3 3 →R1 CH CH2 C = CHR3
NaIO
Ⅱ.R1CH = CHR 2
4→R1COOH +R 2COOH RuCl3
O R 2 OH R 2
Ⅲ. || | | |
R1 C H +H N R3 → R1 CH N R3
(1)麦芽酚中含有官能团的名称是羰基、醚键、______和______。
(2)A 是苯的同系物,A→B 的反应类型是______。
(3)B→C 的反应条件是______。
(4)C→D 的化学方程式是______。
(5)E 不能与金属 Na 反应生成氢气,麦芽酚生成 E 的化学方程式是______。
(6)G 的结构简式是______。
(7)X 的分子式为 C3H9O2N,X 的结构简式是______。
(8)Y 的分子式为 C4H11ON,Y 与 X 具有相同种类的官能团,下列说法正确的是______。
a.Y 与 X 互为同系物
b.Y 能与羧酸发生酯化反应
c.Y 在浓硫酸、加热的条件下能发生消去反应
(9)K→M 转化的一种路线如下图,中间产物 2 的结构简式是______。
18.(11分)无水氯化锰(MnCl2)在电子技术和精细化工领域有重要应用。一种由粗锰粉(主要杂质为 Fe、
Ni、Pb 等金属单质)制备无水氯化锰的工艺如下(部分操作和条件略)。
I.向粗锰粉中加入盐酸,控制溶液的pH约为5,测定离子的初始浓度。静置一段时间后锰粉仍略有剩余,
过滤;
第8页/共10页
II.向 I的滤液中加入一定量盐酸,再加入 H2O2溶液,充分反应后加入 MnCO3固体调节溶液的 pH约为 5,
过滤;
III.向 II 的滤液中通入 H2S 气体,待充分反应后加热一段时间,冷却后过滤;
IV.浓缩、结晶、过滤、洗涤、脱水得到无水 MnCl2。
各步骤中对杂质离子的去除情况
Fe2+ Ni2+ Pb2+
初始浓度/mg·L-1 21.02 4.95 5.86
步骤 I 后/mg·L-1 12.85 3.80 3.39
步骤 II 后/mg·L-1 0.25 3.76 3.38
步骤 III 后/mg·L-1 0.10(达标) 3.19(未达标) 0.12(达标)
已知:金属活动性 Mn>Fe>Ni>Pb
(1)锰和盐酸反应的化学方程式是_______。
(2)步骤 I 中:
①Fe2+在浓度降低,滤渣中存在 Fe(OH)3。结合离子方程式解释原因:_______。
②Pb2+骤浓度降低,分析步骤 I 中发生的反应为:Pb+2H+=Pb2++H2↑、_______。
(3)步骤 II 中:
①H2O2酸性溶液的作用:_______。
②结合离子方程式说明 MnCO3的作用:_______。
(4)骤步骤 III 通入 H2S 后,Ni2+不达标而 Pb2+达标。推测溶解度:PbS_____NiS(填“>”或“<”)。
(5)测定无水 MnCl2 的含量:将 ag 样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量 NH4NO3,使
Mn2+氧化为 Mn3+。待充分反应后持续加热一段时间,冷却后用 bmol/L硫酸亚铁铵[(NH4)2Fe(SO4)2]滴
定 Mn3+耗,消耗 cmL 硫酸亚铁铵。
(已知:滴定过程中发生的反应为:Fe2++Mn3+=Fe3++Mn2+)
①样品中 MnCl2的质量分数是_____(已知:MnCl2的摩尔质量是 126g·mol-1,列出计算式即可)。
②“持续加热”的目的是使过量的 NH4NO3 分解。若不加热,测定结果会______(填“偏高”、“偏低”或“无影
响”)。
19.(10 分)化学小组探究铜与硝酸反应的快慢及产物。
(1)实验甲:将铜片放入盛有稀 HNO3的试管中,开始无明显现象,渐有小气泡生成,该气体是______。
液面上方出现浅红棕色气体,溶液呈蓝色。
(2)实验乙:铜与浓 HNO3反应,装置、现象如下:
实验装置 实验现象
第9页/共10页
A 中:最初反应较慢,随后加快,反应剧烈;产生红棕色气体;溶液呈绿
色。
B 中:溶液呈淡蓝色。
①A 中铜与浓 HNO3产生红棕色气体的化学方程式是______。
②实验现象“最初反应较慢,随后加快”的原因可能是______。
(3)有文献记载:铜与浓 HNO3的反应一旦发生就变快,是因为开始生成的 NO2溶于水形成 HNO2和(弱
酸,不稳定),它再和 Cu 反应,反应就加快。实验探究如下:
Ⅰ:向 1mL 浓硝酸中加入几滴 30%H2O2溶液、铜片,反应较慢,溶液呈蓝色。
Ⅱ:向 1mL 浓硝酸中加入几滴 30%H2O2溶液,无明显变化。
①Ⅰ中反应变慢的原因是______。
②NO2与 H2O 反应生成 HNO2和______。
③对生成 HNO2后反应变快的原因进行实验探究。
序号 实验操作 实验现象
Ⅲ 取 B 中溶液,加入一定量______固体,再加入铜片 立即产生无色气体;液面上方呈红棕色
Ⅳ 取 B 中溶液,放置一段时间,溶液变为无色后,再加入产生无色气体,较Ⅲ慢;液面上方呈浅红
铜片 棕色
a.Ⅲ中加入的固体为______。
b.Ⅳ中“放置一段时间”的目的是______。
实验Ⅲ、IV 可以说明,HNO2氧化 Cu 的反应速率比 HNO3氧化 Cu 的反应快。
(4)化学小组同学结合实验甲、中乙中 HNO3 被还原后的气体产物以及实验Ⅲ的产物,综合上述实验,分
析判断甲中反应慢的原因,除了硝酸起始浓度小、反应过程中温度较低外,另一个重要原因是______。
第10页/共10页
化 学
2024.09.14
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分 100 分,考试时间 90 分钟。所
有答案必须填涂或作答在答.题.卡.上,否则不得分。
可能用到的相对原子质量:H1 O16 C12 N14 Mg24 S32 Cl35.5 Mn55 Fe56 Cu64
第Ⅰ卷(选择题共 42 分)
本卷共 14 小题,每小题 3 分。在每小题列出的四个选项中,选出最符合题目答案的一项。
1.下列化学用语或图示表达正确的是( )
32
A.为中子数为 32,质子数为 27 的钴原子: 27 Co
B.SO2的空间结构示意图为
C.基态 Si 原子的价层电子的轨道表示式为
D.HF 分子中 σ 键的形成示意图为
2.下列方程式与所给事实相符的是( )
+ 3
A.常温下,0.1mol·L-1H3PO4液溶液 pH 约为 3.1:H3PO4 = 3H + PO4
18 + 18
B.向 H 182 O 中加入 Na2O2,产生无色气体:2H2 O + 2Na2O2 = 4Na + 4OHO + O2
2+ +
C.向 NaHCO3入溶液中加入 CaCl2产生白色沉淀:Ca +HCO3 = CaCO3 +H
高温
D.还原铁粉与水蒸气反应有可燃性气体产生:3Fe+ 4H2O(g) Fe3O 4 + 4H2
3.下列对事实的分析正确的是( )
选项 事实 分析
A 沸点:CO>N2 CO 为极性分子,N2为非极性分子
B 第一电离能:P>S 原子半径:P>S
C 键角:CH4>NH3>H2O 电负性:C
4.下列说法不.正.确.的是( )
A.常温常压下,3.2gO2和 O3的混合气体中含有氧原子的数目约为 0.2×6.02×1023
第1页/共10页
B.1L0.5mol·L-1CH3COONa 溶液中含有 CH3COOH 和 CH3COO-为的总数约为 0.5×6.02×1023
C.标准状况下,1.12LHCl 气体中含有电子的数目约为 0.9×6.02×1023
D.0.1mol 环氧乙烷( )中含有共价键的总数为约为 0.3×6.02×1023
5.室温下,1 体积的水能溶解约 2 体积的 Cl2。用试管收集 Cl2后进行如图所示实验,下列对实验现象的分
析或预测正确的是( )
A.试管内液面上升,证明 Cl2与水发生了反应
B.取出试管中的溶液,加入少量 CaCO3粉末,溶液漂白能力减弱
光照
C.取出试管中的溶液,光照一段时间后 pH 下降,与反应2HClO 2HCl+O 有关 2
D.取出试管中的溶液,滴加紫色石蕊溶液,溶液先变红后褪色,加热后颜色又变为红色
6.下列实验装置(部分夹持装置已略去)可以达到对应实验目的是( )
A B C D
实验目制备氢氧化铁胶体 分离乙酸乙酯和饱和 Na2CO3除去 CO2 中的少量收集 NO2
的 溶液 HCl
实验装
置
7.利用如图所示装置(夹持装置略)进行试验,b 中现象不.能.证明 a 中产物生成的是( )
a 中反应 b 中检测试剂及现象 装置
A 2-氯丙烷与 KOH 乙醇溶液生成丙烯 溴的四氯化碳溶液褪色
B 铜和浓硫酸生成 SO2 品红溶液褪色
C 浓硝酸分解生成 NO2 硫化钠溶液变浑浊
D 浓氢氧化钠与氯化铵溶液生成 NH3 酚酞溶液变红
8.以菱镁矿(主要成分为 MgCO3,含少量 SiO2、Fe2O3和 Al2O3)为原料制备高纯镁砂的工艺流程如下:
已知:浸出时产生的废渣中有 SiO2、Fe(OH)3 和 Al(OH)3。
下列说法不.正.确.的是( )
第2页/共10页
A.浸出镁的反应为 MgO+2NH4Cl=MgCl2+2NH3↑+H2O
B.浸出和沉镁的操作均应在较高温度下进行
C.流程中可循环使用的物质有 NH3、NH4Cl
D.分离 Mg2+与 Al3+、Fe3+是利用了它们氢氧化物 Ksp的不同
9.由柠檬烯制备生物可降解塑料(Y)的过程如下。其中 X→Y 为原子利用率为 100%。
下列说法不.正.确.的是( )
A.柠檬烯→X 过程中 H2O2作氧化剂
B.试剂 a 为 CO2
C.一定条件下,Y 可从线型结构变为网状结构
D.柠檬烯的分子式为 C10H18
10.科学家发展出一种近中性条件下高效无膜电解水过程,原理如图所示,其中溴化物在电解池甲中被氧
化为溴酸盐。下列说法正确的是( )
A.极电极 A 为阳极
B.电解一段时间后,甲中液溶液 pH 升高
催化剂
C.乙中发生的反应为: 2BrO 3 2Br
+3O 2
D.当甲中有 1mol BrO
3 生成时,理论上有 44.8LH2生成(标准状况下)
11.科研人员提出 CeO2成催化合成 DMC 需经历三步反应,示意图如下:
第3页/共10页
下列说法正确的是( )
A.①、②、③有中均有 O—H 的断裂
B.生成 DMC 总反应的原子利用率为 100%
C.该催化剂可有效提高反应物的平衡转化率
2
D.DMC 与过量 NaOH 溶液反应生成CO3 和甲醇
12.常温下,用浓度为 0.02mol/L 的 NaOH 标准溶液滴定浓度均为 0.02mol/L 的 HCl 和 CH3COOH 的混合溶
V (标准溶液)
液,滴定过程中溶液的 pH 随 = 的变化曲线如图所示。下列说法不.正.确.的是( )
V (待测溶液)
A. K (CH COOH)约为 10-4.76a 3
+
B.点 a:c (Na ) = c (Cl ) = c (CH3COOH)+ c (CH3COO )
C.点 b:c (CH3COOH) c (CH3COO )
D.水的电离程度:a
(mol·L-1)随反应时间的变化情况如下表:
序号 时间(min) 0 20 40 50
温度(℃)
① 800 1.0 0.67 0.50 0.50
② 800 x 0.50 0.50 0.50
③ 800 y 0.75 0.60 0.60
第4页/共10页
④ 820 1.0 0.25 0.20 0.20
下列说法不.正.确.的是( )
A.①中 B 在 0~20min 平均反应速率为 8.25×10-3mol·L-1·min-1
B.②中 K=0.25,可能使用了催化剂
C.③中 y=1.4mol·L-1
D.比较①、④可知,该反应为吸热反应
14.向 FeCl3溶液中加入 Na2SO3溶液,测定混合后溶液 pH随混合前中溶液中 c (SO 2 3 ) / c (Fe3+ )变化的曲
线如下图所示。实验发现:
i.a 点溶液透明澄清,向其中滴加 NaOH 溶液后,立即产生灰白色沉淀,滴入 KSCN 溶液显红色;
ii.c 点和 d 点溶液中产生红褐色沉淀,无气体逸出。取其上层清液滴加 NaOH 溶液后无明显现象,滴加
KSCN 溶液显红色。
下列分析合理的是( )
A.向 a 点溶液中滴加 BaCl2溶液,无明显现象
3+ 2 2+ 2 +
B.b 点较 a 点溶液 pH 升高的主要原因:2Fe +SO3 +H2O = 2Fe +SO4 + 2H
3+ 2
C.c 点溶液中发生的主要反应:2Fe +3SO3 + 6H2O 2Fe (OH) +3H SO 3 2 3
D.向 d 点上层清液中滴加 KSCN 溶液,溶液变红;再滴加 NaOH 溶液,红色加深
第 II 卷题(非选择题 共 58 分)
15.(11 分)铁元素在人体健康和新材料研发中有重要的应用。
(1)基态 Fe 原子核外电子排布式为_________。
(2)邻二氮菲(phen)与 Fe2+生成稳定的橙红色邻二氮菲亚铁离子[Fe(phen) ]2+3 ,可用于补铁剂中 Fe2+
的测定,邻二氮菲的结构简式如图所示。
①邻二氮菲的一氯代物有_________种。
②补铁剂中的 Fe2+易被氧化变质,请从结构角度解释其原因:_________。
③用邻二氮菲测定 Fe2+浓度时应控制 pH 为 5~6 的适宜范围,请解释原因:_________。
第5页/共10页
(3)邻二氮菲结构中包含吡啶环( ),含有类似结构的物质通常具有一定的碱性,已知碱性强弱:
。请解释原因:_________。
(4)氢气的安全贮存和运输是氢能应用的关键,铁镁合金是目前已发现的储氢密度最高的储氢材料之一,
其晶胞结构如图所示。
①距离 Mg 原子最近的 Fe 原子个数是_________。
②铁镁合金的化学式为_________。
③若该晶胞的晶胞边长为 dnm,阿伏加德罗常数为 NA ,则该合金的密度为_________g cm
-3(1nm=1×10-
7cm,列出计算式即可)。
④若该晶体储氢时,H2 分子在晶胞的体心和棱心位置,则含 Mg48g 的该储氢合金可储存标准状况下 H2 的
体积约为_________L。
16.(11 分)Na2S2O3应用广泛,水处理中常用作还原剂、冶金中常用作络合剂。
(1)Na2S2O3的实验室制法:装置图如下(加热和夹持装置略):
△
已知:2Na2S+3SO2=2Na2SO3+3S↓、 Na2SO3 +S Na2S2O3
①甲中发生反应的化学方程式为______。
②实验过程中,乙中的澄清溶液先变浑浊,后变澄清时生成大量的 Na2S2O3。一段时间后,乙中再次出现
少量浑浊,此时须立刻停止通入 SO2。结合离子方程式解释此时必须立刻停止通入 SO2的原因:______。
③丙中,NaOH 溶液吸收的气体可能有______。
(2)实际工业生产中制得的 Na2S2O3 溶液中常混有少量 Na2SO3,结合溶解度曲线(如图),获得
第6页/共10页
Na2S2O3·5H2O 的方法是______。
(3)Na2S2O3的用途:氨性硫代硫酸盐加热浸金是一种环境友好的黄金(Au)浸取工艺。
2+
已知:I.Cu (NH3 ) Cu
2+ + 4NH ;
4 3
2+
II.浸金过程Cu (NH3 ) 起到催化剂的作用 4
III.Cu2+成在碱性较强时受热会生成 CuO 沉淀。
2+
①将金矿石浸泡在 Na2S2O3、Cu (NH3 ) 的混合溶液中,并通入 O2。浸金反应的原理分为两步: 4
2+
Cu (NH 2
+ 3
i. 3 ) +Au + 2S2O3 Cu (NH3 ) +Au (S2O3 ) + 2NH3 4 2 2
ii._________(写出该步反应)
②一定温度下,相同时间金的浸出率随体系 pH变化曲线如图,解释 pH>10.5时,金的浸出率降低的可能原
因_________。(写出 2 点即可)
17.(15 分)疗度鲁特韦可以用于治疗 HIV-1 感染,M 是合成度鲁特韦的一种中间体。成合成 M 的路线如
下:(部分反应条件或试剂略去)
第7页/共10页
已知:
O R 2 OH R 2
Ⅰ. || | | |
R CH +CH C = CHR 特 殊 溶剂1 3 3 →R1 CH CH2 C = CHR3
NaIO
Ⅱ.R1CH = CHR 2
4→R1COOH +R 2COOH RuCl3
O R 2 OH R 2
Ⅲ. || | | |
R1 C H +H N R3 → R1 CH N R3
(1)麦芽酚中含有官能团的名称是羰基、醚键、______和______。
(2)A 是苯的同系物,A→B 的反应类型是______。
(3)B→C 的反应条件是______。
(4)C→D 的化学方程式是______。
(5)E 不能与金属 Na 反应生成氢气,麦芽酚生成 E 的化学方程式是______。
(6)G 的结构简式是______。
(7)X 的分子式为 C3H9O2N,X 的结构简式是______。
(8)Y 的分子式为 C4H11ON,Y 与 X 具有相同种类的官能团,下列说法正确的是______。
a.Y 与 X 互为同系物
b.Y 能与羧酸发生酯化反应
c.Y 在浓硫酸、加热的条件下能发生消去反应
(9)K→M 转化的一种路线如下图,中间产物 2 的结构简式是______。
18.(11分)无水氯化锰(MnCl2)在电子技术和精细化工领域有重要应用。一种由粗锰粉(主要杂质为 Fe、
Ni、Pb 等金属单质)制备无水氯化锰的工艺如下(部分操作和条件略)。
I.向粗锰粉中加入盐酸,控制溶液的pH约为5,测定离子的初始浓度。静置一段时间后锰粉仍略有剩余,
过滤;
第8页/共10页
II.向 I的滤液中加入一定量盐酸,再加入 H2O2溶液,充分反应后加入 MnCO3固体调节溶液的 pH约为 5,
过滤;
III.向 II 的滤液中通入 H2S 气体,待充分反应后加热一段时间,冷却后过滤;
IV.浓缩、结晶、过滤、洗涤、脱水得到无水 MnCl2。
各步骤中对杂质离子的去除情况
Fe2+ Ni2+ Pb2+
初始浓度/mg·L-1 21.02 4.95 5.86
步骤 I 后/mg·L-1 12.85 3.80 3.39
步骤 II 后/mg·L-1 0.25 3.76 3.38
步骤 III 后/mg·L-1 0.10(达标) 3.19(未达标) 0.12(达标)
已知:金属活动性 Mn>Fe>Ni>Pb
(1)锰和盐酸反应的化学方程式是_______。
(2)步骤 I 中:
①Fe2+在浓度降低,滤渣中存在 Fe(OH)3。结合离子方程式解释原因:_______。
②Pb2+骤浓度降低,分析步骤 I 中发生的反应为:Pb+2H+=Pb2++H2↑、_______。
(3)步骤 II 中:
①H2O2酸性溶液的作用:_______。
②结合离子方程式说明 MnCO3的作用:_______。
(4)骤步骤 III 通入 H2S 后,Ni2+不达标而 Pb2+达标。推测溶解度:PbS_____NiS(填“>”或“<”)。
(5)测定无水 MnCl2 的含量:将 ag 样品溶于一定量硫酸和磷酸的混合溶液中,加入稍过量 NH4NO3,使
Mn2+氧化为 Mn3+。待充分反应后持续加热一段时间,冷却后用 bmol/L硫酸亚铁铵[(NH4)2Fe(SO4)2]滴
定 Mn3+耗,消耗 cmL 硫酸亚铁铵。
(已知:滴定过程中发生的反应为:Fe2++Mn3+=Fe3++Mn2+)
①样品中 MnCl2的质量分数是_____(已知:MnCl2的摩尔质量是 126g·mol-1,列出计算式即可)。
②“持续加热”的目的是使过量的 NH4NO3 分解。若不加热,测定结果会______(填“偏高”、“偏低”或“无影
响”)。
19.(10 分)化学小组探究铜与硝酸反应的快慢及产物。
(1)实验甲:将铜片放入盛有稀 HNO3的试管中,开始无明显现象,渐有小气泡生成,该气体是______。
液面上方出现浅红棕色气体,溶液呈蓝色。
(2)实验乙:铜与浓 HNO3反应,装置、现象如下:
实验装置 实验现象
第9页/共10页
A 中:最初反应较慢,随后加快,反应剧烈;产生红棕色气体;溶液呈绿
色。
B 中:溶液呈淡蓝色。
①A 中铜与浓 HNO3产生红棕色气体的化学方程式是______。
②实验现象“最初反应较慢,随后加快”的原因可能是______。
(3)有文献记载:铜与浓 HNO3的反应一旦发生就变快,是因为开始生成的 NO2溶于水形成 HNO2和(弱
酸,不稳定),它再和 Cu 反应,反应就加快。实验探究如下:
Ⅰ:向 1mL 浓硝酸中加入几滴 30%H2O2溶液、铜片,反应较慢,溶液呈蓝色。
Ⅱ:向 1mL 浓硝酸中加入几滴 30%H2O2溶液,无明显变化。
①Ⅰ中反应变慢的原因是______。
②NO2与 H2O 反应生成 HNO2和______。
③对生成 HNO2后反应变快的原因进行实验探究。
序号 实验操作 实验现象
Ⅲ 取 B 中溶液,加入一定量______固体,再加入铜片 立即产生无色气体;液面上方呈红棕色
Ⅳ 取 B 中溶液,放置一段时间,溶液变为无色后,再加入产生无色气体,较Ⅲ慢;液面上方呈浅红
铜片 棕色
a.Ⅲ中加入的固体为______。
b.Ⅳ中“放置一段时间”的目的是______。
实验Ⅲ、IV 可以说明,HNO2氧化 Cu 的反应速率比 HNO3氧化 Cu 的反应快。
(4)化学小组同学结合实验甲、中乙中 HNO3 被还原后的气体产物以及实验Ⅲ的产物,综合上述实验,分
析判断甲中反应慢的原因,除了硝酸起始浓度小、反应过程中温度较低外,另一个重要原因是______。
第10页/共10页
同课章节目录
