2.3物质的量说课课件(共34张PPT) 2024-2025学年高一上学期化学人教版(2019)必修第一册
文档属性
| 名称 | 2.3物质的量说课课件(共34张PPT) 2024-2025学年高一上学期化学人教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 22.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-22 18:59:36 | ||
图片预览









文档简介
(共34张PPT)
人教版必修一第二章第三节
物质的量的单位
——摩尔
目录 | Contents
01
02
06
03
教材分析
作业设计
学情分析
教法学法
04
目标与重难点
05
教学过程
教材分析
01
01.教材分析
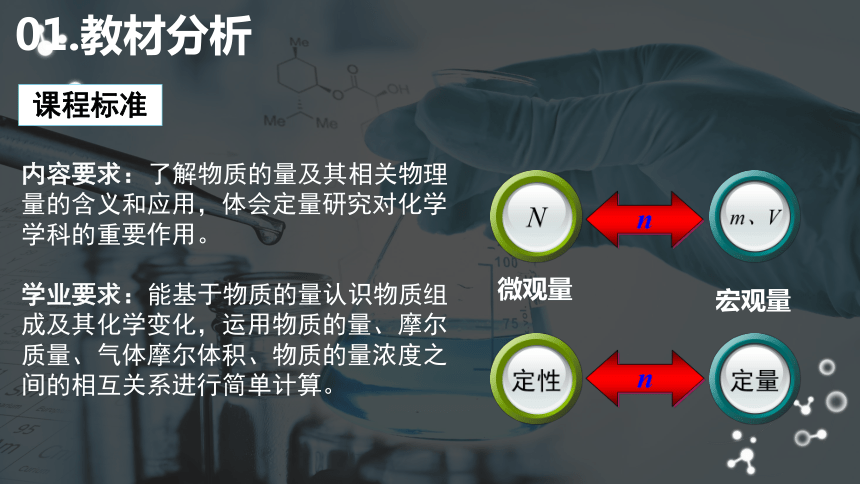
内容要求:了解物质的量及其相关物理量的含义和应用,体会定量研究对化学学科的重要作用。
学业要求:能基于物质的量认识物质组成及其化学变化,运用物质的量、摩尔质量、气体摩尔体积、物质的量浓度之间的相互关系进行简单计算。
课程标准
微观量
宏观量
将物质的量内容放在第二章第三节,置于“钠及其化合物”和“氯及其化合物”之后。人教版教材第一章内容为物质的分类及转化、离子反应和氧化还原反应,以初中内容为脚手架对新知识进行延展,较好地处理了初高中的衔接问题。化学方程式中的计算则放在金属材料的后面。
教材位置
在旧教材中“化学计量在实验中的应用”,将“物质的量”概念作为实验定量探索的工具。该版本在“金属的化学性质”的最后,编排了“物质的量”在化学方程式中的计算,让学生能够依托具体反应,在定性认识元素化合物的性质之后再从定量角度去认识,符合学生从定性到定量、从感知到理解的认知发展顺序。
学情分析
02
01
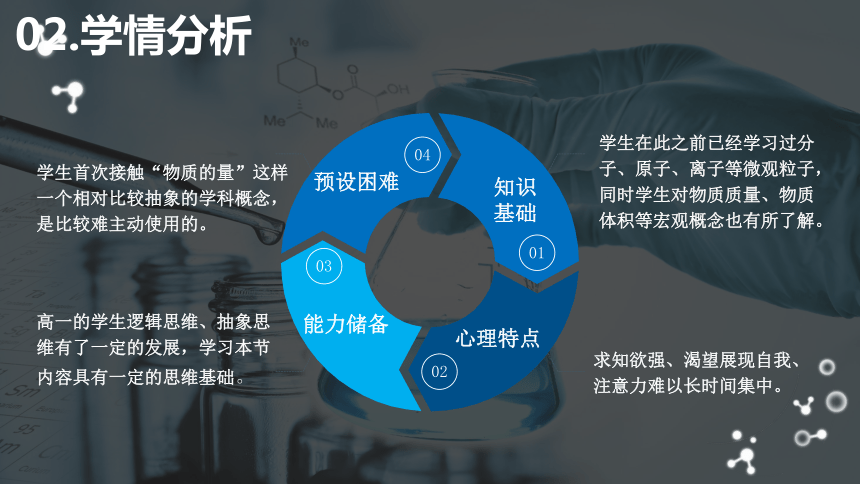
知识基础
02
心理特点
03
能力储备
04
预设困难
学生在此之前已经学习过分子、原子、离子等微观粒子,同时学生对物质质量、物质体积等宏观概念也有所了解。
求知欲强、渴望展现自我、注意力难以长时间集中。
高一的学生逻辑思维、抽象思维有了一定的发展,学习本节内容具有一定的思维基础。
学生首次接触“物质的量”这样一个相对比较抽象的学科概念,是比较难主动使用的。
02.学情分析
目标与重难点
03
03教学目标
01
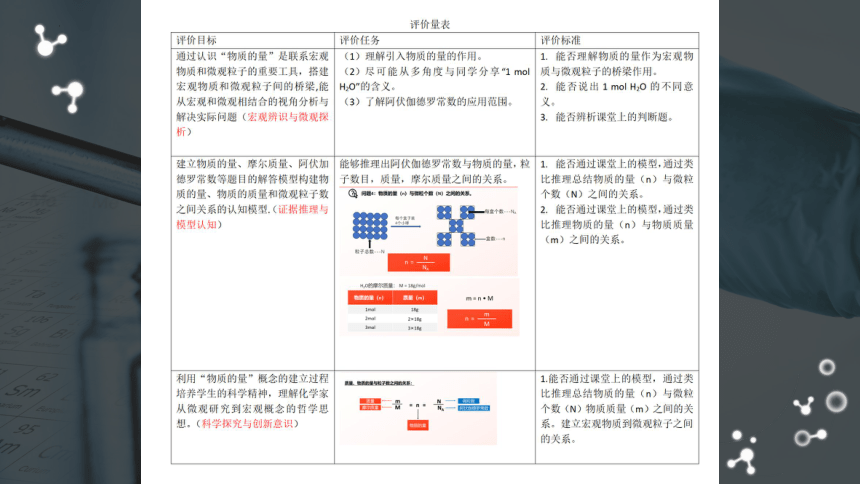
通过认识“物质的量”是联系宏观物质和微观粒子的重要工具,搭建宏观物质和微观粒子间的桥梁,能从宏观和微观相结合的视角分析与解决实际问题(宏观辨识与微观探析)
02
建立物质的量、摩尔质量、阿伏加德罗常数等题目的解答模型构建物质的量、物质的质量和微观粒子数之间关系的认知模型.(证据推理与模型认知)
03
利用“物质的量”概念的建立过程培养学生的科学精神,理解化学家从微观研究到宏观概念的哲学思想(科学探究与创新意识)。
03教学重难点
01
02
教学
难点
教学
重点
建立物质的量的概念,基于物质的量定量认识物质的组成及变化。
物质的量的概念理解,物质的量、阿伏加德罗常数、微粒数、摩尔质量之间的关系。构建起宏观物质到微观粒子的模型
教法学法
04
04.教法学法
教法学法
逐步引导
问题驱动
难点拆分
学练结合
归纳总结
类比探究
淡化概念
强化理解
构建模型
发展素养
顺理成章
循序渐进
教学过程
05
理解物质的量的概念,物质的量的单位-摩尔。
理解阿伏伽德罗常数、摩尔质量的含义。
构建物质的量与微观粒子数,阿伏伽德罗常数,质量之间的转化关系,感受宏观微观相结合的思想。
学习目标
问题1:按含水量60%算,体重60Kg的人体内有多少水分子?
质量
个数
宏观
微观
“女儿是水作的骨肉,男人是泥作的骨肉”------《红楼梦》
桥 梁
物质的量
【活动】
活动:在20秒内,谁能更快更准确的数出300粒米?
问题2:为什么两位同学在20秒之内数出米粒的数目差异大呢?
【任务1】认识计量微观粒子的物理量---物质的量
物质的量
物质的量是一个物理量,它表示含有一定数目粒子的集合体,符号为n。
单位:摩尔 (mol),简称摩。
国际单位制(SI)的7个基本单位
物理量 单位名称 单位符号
长度 米 m
质量 千克(公斤) kg
时间 秒 s
电流强度 安[培] A
热力学温度 开[尔文] K
物质的量 摩[尔] mol
发光强度 坎[德拉] cd
【知识背景】
800pcs
12支/盒
300支/包
问题3:生活中有那些集合体呢?
【任务1】认识计量微观粒子的物理量---物质的量
【资料卡片】
1971年第14届国际计量大会通过了以“物质的量”作为化学计量的基本物理量,规定其单位为摩尔( mol ); 2018年第26届国际计量大会对摩尔这个基本单位进行了重新定义,规定1 mol 任何粒子的粒子数为阿伏加德罗常数,以阿伏加德罗常数这一基本物理常数定义摩尔,可大大提高摩尔这一单位的稳定性和精确度。
NA ≈ 6.02×1023 mol-1
【任务1】认识计量微观粒子的物理量---物质的量
问题4:物质的量(n)与微粒个数(N)之间的关系。
每个盒子装4个小球
粒子总数---N
每盒个数---NA
盒数---n
n
=
N
NA
注意事项:
(1)专有化:物质的量是专有名词,不能增删改动
物质量 X 质量X
(2) 具体化:使用时必须指明具体微粒的名称、符号或化学式
lmol H、lmol H+、lmol H2、lmole-、 lmol质子、1mol中子
(3)微观化:物质的量只适用于微观粒子不能描述宏观物质
Q:100粒米约20g,一人一天约吃400g米,中国约14亿人,1mol米够全体中国人吃多少年
A:约5.89亿年,数据太大,没有实际意义
【任务1】认识计量微观粒子的物理量---物质的量
注意事项:
(4) 集体化:物质的量表示一定数目微粒的集合体,可以是整数,也可以是小数或分数
1mol、0.5mol......
(5) 物质的量是基本物理量,摩尔是其单位
(6) NA是准确值,6.02 x1023mol是近似值,且二者均有单位
1molO2中有2NA个O
约有1.204个x1024个O
【任务1】认识计量微观粒子的物理量---物质的量
【任务2】理解摩尔质量的涵义,建立物质的量与摩尔质量之间的关系
【思考交流】
问题5: 1 mol任何物质都约含有6.02×1023个粒子,那么如何在实际操作中精确地取出1mol物质?
固体
质量
液体
质量
体积
气体
体积
质量
质量
【任务2】理解摩尔质量的涵义,建立物质的量与摩尔质量之间的关系
【思考交流】
问题6:观察、比较下表中的数据,你能得到什么结论?
粒子符号 物质的相对分子(或原子)质量 每个粒子的质量/(g·个-1) 1 mol物质含有的粒子数/个 1 mol物质的质量
C 1.993×10-23 6.02×1023
Fe 9.302×10-23 6.02×1023
H2SO4 1.628×10-22 6.02×1023
H2O 2.990×10-23 6.02×1023
Na+ 3.821×10-23 6.02×1023
OH- 2.824×10-23 6.02×1023
12
12g
56
56g
98
98g
18
18g
23
23g
17
17g
【任务2】理解摩尔质量的涵义,建立物质的量与摩尔质量之间的关系
摩尔质量
单位物质的量的物质所具有的质量,叫做摩尔质量。
符号: M
单位: g/mol 或 g·mol-1
摩尔质量数值 = 相对原子(分子)质量
【任务2】理解摩尔质量的涵义,建立物质的量与摩尔质量之间的关系
【思考交流】
问题7:单位物质的量的物质所具有的质量,叫做摩尔质量,用M表示。请据此完成下表,并尝试总结物质的量(n)与物质质量(m)之间的关系。
H2O的摩尔质量: M = 18g/mol
物质的量(n) 质量(m)
1mol
2mol
3mol
18g
2×18g
3×18g
n
=
m
M
m = n M
【课堂小结】
质量、物质的量与粒子数之间的关系:
NA
N
M
m
n
=
=
物质的量
质量
摩尔质量
微粒数
阿伏伽德罗常数
问题1:按含水量60%算,体重60Kg的人体内有多少水分子?
理解物质的量的概念,物质的量的单位-摩尔。
理解阿伏伽德罗常数、摩尔质量的含义。
构建物质的量与微观粒子数,阿伏伽德罗常数,质量之间的转化关系,感受宏观微观相结合的思想。
学习目标
作业设计
06
Thank you
人教版必修一第二章第三节
物质的量的单位
——摩尔
目录 | Contents
01
02
06
03
教材分析
作业设计
学情分析
教法学法
04
目标与重难点
05
教学过程
教材分析
01
01.教材分析
内容要求:了解物质的量及其相关物理量的含义和应用,体会定量研究对化学学科的重要作用。
学业要求:能基于物质的量认识物质组成及其化学变化,运用物质的量、摩尔质量、气体摩尔体积、物质的量浓度之间的相互关系进行简单计算。
课程标准
微观量
宏观量
将物质的量内容放在第二章第三节,置于“钠及其化合物”和“氯及其化合物”之后。人教版教材第一章内容为物质的分类及转化、离子反应和氧化还原反应,以初中内容为脚手架对新知识进行延展,较好地处理了初高中的衔接问题。化学方程式中的计算则放在金属材料的后面。
教材位置
在旧教材中“化学计量在实验中的应用”,将“物质的量”概念作为实验定量探索的工具。该版本在“金属的化学性质”的最后,编排了“物质的量”在化学方程式中的计算,让学生能够依托具体反应,在定性认识元素化合物的性质之后再从定量角度去认识,符合学生从定性到定量、从感知到理解的认知发展顺序。
学情分析
02
01
知识基础
02
心理特点
03
能力储备
04
预设困难
学生在此之前已经学习过分子、原子、离子等微观粒子,同时学生对物质质量、物质体积等宏观概念也有所了解。
求知欲强、渴望展现自我、注意力难以长时间集中。
高一的学生逻辑思维、抽象思维有了一定的发展,学习本节内容具有一定的思维基础。
学生首次接触“物质的量”这样一个相对比较抽象的学科概念,是比较难主动使用的。
02.学情分析
目标与重难点
03
03教学目标
01
通过认识“物质的量”是联系宏观物质和微观粒子的重要工具,搭建宏观物质和微观粒子间的桥梁,能从宏观和微观相结合的视角分析与解决实际问题(宏观辨识与微观探析)
02
建立物质的量、摩尔质量、阿伏加德罗常数等题目的解答模型构建物质的量、物质的质量和微观粒子数之间关系的认知模型.(证据推理与模型认知)
03
利用“物质的量”概念的建立过程培养学生的科学精神,理解化学家从微观研究到宏观概念的哲学思想(科学探究与创新意识)。
03教学重难点
01
02
教学
难点
教学
重点
建立物质的量的概念,基于物质的量定量认识物质的组成及变化。
物质的量的概念理解,物质的量、阿伏加德罗常数、微粒数、摩尔质量之间的关系。构建起宏观物质到微观粒子的模型
教法学法
04
04.教法学法
教法学法
逐步引导
问题驱动
难点拆分
学练结合
归纳总结
类比探究
淡化概念
强化理解
构建模型
发展素养
顺理成章
循序渐进
教学过程
05
理解物质的量的概念,物质的量的单位-摩尔。
理解阿伏伽德罗常数、摩尔质量的含义。
构建物质的量与微观粒子数,阿伏伽德罗常数,质量之间的转化关系,感受宏观微观相结合的思想。
学习目标
问题1:按含水量60%算,体重60Kg的人体内有多少水分子?
质量
个数
宏观
微观
“女儿是水作的骨肉,男人是泥作的骨肉”------《红楼梦》
桥 梁
物质的量
【活动】
活动:在20秒内,谁能更快更准确的数出300粒米?
问题2:为什么两位同学在20秒之内数出米粒的数目差异大呢?
【任务1】认识计量微观粒子的物理量---物质的量
物质的量
物质的量是一个物理量,它表示含有一定数目粒子的集合体,符号为n。
单位:摩尔 (mol),简称摩。
国际单位制(SI)的7个基本单位
物理量 单位名称 单位符号
长度 米 m
质量 千克(公斤) kg
时间 秒 s
电流强度 安[培] A
热力学温度 开[尔文] K
物质的量 摩[尔] mol
发光强度 坎[德拉] cd
【知识背景】
800pcs
12支/盒
300支/包
问题3:生活中有那些集合体呢?
【任务1】认识计量微观粒子的物理量---物质的量
【资料卡片】
1971年第14届国际计量大会通过了以“物质的量”作为化学计量的基本物理量,规定其单位为摩尔( mol ); 2018年第26届国际计量大会对摩尔这个基本单位进行了重新定义,规定1 mol 任何粒子的粒子数为阿伏加德罗常数,以阿伏加德罗常数这一基本物理常数定义摩尔,可大大提高摩尔这一单位的稳定性和精确度。
NA ≈ 6.02×1023 mol-1
【任务1】认识计量微观粒子的物理量---物质的量
问题4:物质的量(n)与微粒个数(N)之间的关系。
每个盒子装4个小球
粒子总数---N
每盒个数---NA
盒数---n
n
=
N
NA
注意事项:
(1)专有化:物质的量是专有名词,不能增删改动
物质量 X 质量X
(2) 具体化:使用时必须指明具体微粒的名称、符号或化学式
lmol H、lmol H+、lmol H2、lmole-、 lmol质子、1mol中子
(3)微观化:物质的量只适用于微观粒子不能描述宏观物质
Q:100粒米约20g,一人一天约吃400g米,中国约14亿人,1mol米够全体中国人吃多少年
A:约5.89亿年,数据太大,没有实际意义
【任务1】认识计量微观粒子的物理量---物质的量
注意事项:
(4) 集体化:物质的量表示一定数目微粒的集合体,可以是整数,也可以是小数或分数
1mol、0.5mol......
(5) 物质的量是基本物理量,摩尔是其单位
(6) NA是准确值,6.02 x1023mol是近似值,且二者均有单位
1molO2中有2NA个O
约有1.204个x1024个O
【任务1】认识计量微观粒子的物理量---物质的量
【任务2】理解摩尔质量的涵义,建立物质的量与摩尔质量之间的关系
【思考交流】
问题5: 1 mol任何物质都约含有6.02×1023个粒子,那么如何在实际操作中精确地取出1mol物质?
固体
质量
液体
质量
体积
气体
体积
质量
质量
【任务2】理解摩尔质量的涵义,建立物质的量与摩尔质量之间的关系
【思考交流】
问题6:观察、比较下表中的数据,你能得到什么结论?
粒子符号 物质的相对分子(或原子)质量 每个粒子的质量/(g·个-1) 1 mol物质含有的粒子数/个 1 mol物质的质量
C 1.993×10-23 6.02×1023
Fe 9.302×10-23 6.02×1023
H2SO4 1.628×10-22 6.02×1023
H2O 2.990×10-23 6.02×1023
Na+ 3.821×10-23 6.02×1023
OH- 2.824×10-23 6.02×1023
12
12g
56
56g
98
98g
18
18g
23
23g
17
17g
【任务2】理解摩尔质量的涵义,建立物质的量与摩尔质量之间的关系
摩尔质量
单位物质的量的物质所具有的质量,叫做摩尔质量。
符号: M
单位: g/mol 或 g·mol-1
摩尔质量数值 = 相对原子(分子)质量
【任务2】理解摩尔质量的涵义,建立物质的量与摩尔质量之间的关系
【思考交流】
问题7:单位物质的量的物质所具有的质量,叫做摩尔质量,用M表示。请据此完成下表,并尝试总结物质的量(n)与物质质量(m)之间的关系。
H2O的摩尔质量: M = 18g/mol
物质的量(n) 质量(m)
1mol
2mol
3mol
18g
2×18g
3×18g
n
=
m
M
m = n M
【课堂小结】
质量、物质的量与粒子数之间的关系:
NA
N
M
m
n
=
=
物质的量
质量
摩尔质量
微粒数
阿伏伽德罗常数
问题1:按含水量60%算,体重60Kg的人体内有多少水分子?
理解物质的量的概念,物质的量的单位-摩尔。
理解阿伏伽德罗常数、摩尔质量的含义。
构建物质的量与微观粒子数,阿伏伽德罗常数,质量之间的转化关系,感受宏观微观相结合的思想。
学习目标
作业设计
06
Thank you
