第1节 第3课时 物质的转化(课件)共39张PPT)-2024-2025学年高一化学同步课堂(人教版2019必修第一册)
文档属性
| 名称 | 第1节 第3课时 物质的转化(课件)共39张PPT)-2024-2025学年高一化学同步课堂(人教版2019必修第一册) |

|
|
| 格式 | pptx | ||
| 文件大小 | 14.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-22 19:00:32 | ||
图片预览










文档简介
(共39张PPT)
第一节 物质的分类及转化
课时3 物质的转化
人教版2019必修第一册
第一章 物质及其变化
素养目标
宏观辨识与微观探析:
从宏观上复习物质的分类,理解同一类物质的化学性质的相似性;从微观上体会同一类别物质的化学性质的相似性是由其含有相同微观粒子决定的。
证据推理与模型认知:
根据同类物质具有相似的性质,探究在一定条件下各类物质之间相互转化的基本规律,提高分析问题和解决问题的能力。
科学探究与创新意识:
通过学习探究,先对物质进行分类,再统一研究同一类物质的化学性质的相似性,体会物质之间的转化规律,理解化学研究过程中的科学方法。
教学目标
本节重点
酸、碱、盐的主要性质和转化.
本节难点
根据酸、碱、盐及氧化物的性质理解各类物质间的转化关系。
通过对化学物质按组成和性质进行分类法的学习,进一步掌握酸、碱、盐、氧化物的概念及主要性质,会预测在一定条件下某种物质能发生的化学变化。
新课导入
请你描述!
下列的美丽景象是发生了什么变化?
美丽的溶洞、美丽的凤仙花,自然界中物质的转化
美丽的化学实验中物质的转化
物质的性质
壹
物质的转化
贰
物质制备模型和转化关系图
叁
知识导航
新课导入
你知道吗?
下列诗句中涉及了哪些化学物质和类别?
CaCO3
(石灰石)
CaO
(生灰石)
类别
盐
氧化物
依据类别共性
类比典型代表物
新课导入
基于物质类别研究物质性质的认知模型
课本P10
实验验证
预测物质性质
确认物质性质
分析物质组成
确定物质类别
分类研究
确认物质制备
制备方法
请你思考!
请思考如何制备Na2SO3?
课堂思考
寻找原料
资料:亚硫酸钠(Na2SO3)常用作织物的漂白剂,在食品工业上也是常见的疏松剂和抗氧化剂。但Na2SO3在空气中容易氧化,因此自然界中几乎没有稳定存在的Na2SO3,只能通过制备来获得。
01
物质的性质
课堂探究
一、物质的性质
探究学习
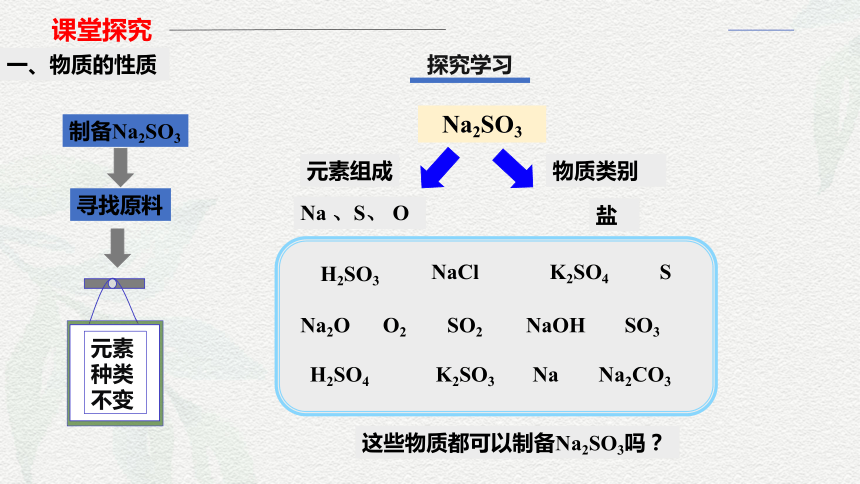
制备Na2SO3
寻找原料
元素
种类
不变
Na2SO3
元素组成
Na 、S、 O
物质类别
盐
Na
Na2O
NaOH
Na2CO3
S
SO2
H2SO3
K2SO3
SO3
K2SO4
H2SO4
NaCl
O2
这些物质都可以制备Na2SO3吗?
课堂探究
一、物质的性质
探究学习
制备Na2SO3
寻找原料
Na
Na2O
NaOH
Na2CO3
S
SO2
H2SO3
K2SO3
SO3
K2SO4
H2SO4
NaCl
O2
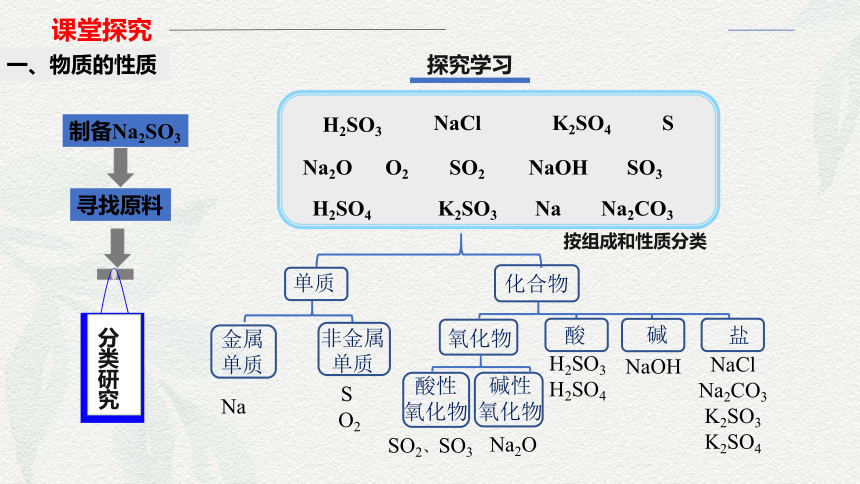
分类研究
氧化物
Na
单质
金属
单质
非金属
单质
Na2O
SO2、SO3
H2SO3
H2SO4
NaOH
NaCl
Na2CO3 K2SO3 K2SO4
酸性
氧化物
碱性
氧化物
酸
碱
盐
S
O2
化合物
按组成和性质分类
课堂探究
一、物质的性质
探究学习
制备Na2SO3
寻找原料
分类
思想
Na2CO3
Na
Na2O
NaOH
S
SO2
H2SO3
K2SO3
SO3
K2SO4
H2SO4
含Na物质
含
S
物质
金属单质
碱性氧化物
碱
盐
非金属单质
酸性氧化物
酸
盐
基于物质类别研究物质性质
课堂探究
一、物质的性质
1.基于物质类别研究单质的性质
Fe+CuSO4 FeSO4+Cu
Fe+2HCl FeCl2+H2↑
3Fe+2O2 Fe3O4
点燃
Fe
金属
单质
金属+氧气→金属氧化物
金属 + 酸 → 盐 + 氢气
金属 + 盐 → 新盐 + 新金属
如何认识Na的性质?
C
C+O2===CO2
点燃
非金属+氧气→非金属氧化物
如何认识S的性质?
非金属
单质
类推S和O2反应的方程式
CaO + H2O Ca(OH)2
课堂探究
一、物质的性质
如何类推SO2和Na2O的性质?
2.基于物质类别研究氧化物的性质
CO2
CO2+H2O H2CO3
CO2+Ca(OH)2 CaCO3↓+H2O
酸性
氧化物
酸性氧化物 + 水 → 酸
酸性氧化物 + 碱 → 盐 + 水
CaO
Fe2O3
Fe2O3 + 6HCl 2FeCl3 + 3H2O
碱性氧化物 + 水 → 碱
碱性氧化物 + 酸 → 盐 + 水
碱性
氧化物
酸性氧化物+碱性氧化物→盐
课堂探究
一、物质的性质
CO2 + 2NaOH Na2CO3 + H2O
SO2 + 2NaOH Na2SO3 + H2O
CaO + 2HCl CaCl2 + H2O
Fe2O3 + 6HCl 2FeCl3 + 3H2O
Na2O + 2HCl 2NaCl + H2O
碱性
氧化物
酸性
氧化物
凡能与酸反应生成盐和水的氧化物
凡能与碱反应生成盐和水的氧化物
类推SO2和Na2O的部分性质
典例精讲
【例1】预测陌生物质的性质——如何吸收烟气中的SO2?
SO2
依据酸性氧化物共性
酸性氧化物
类比CO2性质
预测SO2的性质
SO2+H2O H2SO3
SO2+CaO CaSO3
SO2+2NaOH Na2SO3 +H2O
课堂思考
请你思考!
如何认识H2SO3的性质?请同学们完成P10思考与讨论。
一、物质的性质
课堂探究
3.基于物质类别研究酸的性质
酸的主要化学性质 列举实例(写出反应方程式) 反应类型
指示剂
活泼金属
碱性氧化物
碱
某些盐
2HCl +Fe = FeCl2 +H2↑
使紫色石蕊试液变红色,无色酚酞试液不变色
CaO+2HCl===CaCl2+H2O
HCl +NaOH = NaCl +H2O
Na2CO3+2HCl===2NaCl+CO2↑+H2O
置换反应
复分解反应
复分解反应
复分解反应
酸+碱→盐+水
酸+碱性氧化物→盐+水
酸+盐→新盐+新酸
酸+金属→盐+氢气
酸溶液能使指示剂变色
一、物质的性质
课堂探究
4.基于物质类别研究碱的性质
碱的主要化学性质 列举实例(写出反应方程式) 反应类型
指示剂
酸
酸性氧化物
某些盐
使紫色石蕊试液变蓝色,无色酚酞试液变红色
Ca(OH)2+ H2SO4=CaSO4↓+2H2O
CO2+2NaOH =Na2CO3+H2O
2NaOH+CuSO4 =Cu(OH)2 ↓+Na2SO4
复分解反应
复分解反应
复分解反应
碱溶液能使指示剂变色
碱+盐→新盐+新碱
碱+酸→盐+水
碱+酸性氧化物→盐+水
一、物质的性质
课堂探究
5.基于物质类别研究盐的性质
盐的主要化学性质 列举实例(写出反应方程式) 反应类型
金属
酸
碱
盐
Fe +CuSO4 =Cu+FeSO4
置换反应
CaCO3+2HCl=CaCl2+H2O+CO2↑
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
NaCl+AgNO3=AgCl↓+NaNO3
复分解反应
复分解反应
复分解反应
盐 + 金属→ 新盐 + 新金属
盐 + 酸→ 新盐 + 新酸
盐 + 碱→ 新盐 + 新碱
盐 + 盐→ 新盐 + 新盐
典例精讲
(1)请推断它们的化学式分别为:①_______;②______;③_____;④_____;⑤_________。
(2)写出下列序号之间的化学方程式:
①和②:_______________________________________;
②和④:_______________________________________;
②和⑤:________________________________________;
③和④:_________________________________________。
【例2】在稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉9种物质间存在下面的相互关系,选择①~⑤中适当的物质,使有连线的两物质能发生反应。
单质①
氧化物③
酸②
氧化物④
盐⑤
Fe
H2SO4
CO2
CaO
Na2CO3
Fe+H2SO4===FeSO4+H2↑
CaO+H2SO4===CaSO4+H2O
Na2CO3+H2SO4===Na2SO4+CO2↑+H2O
CO2+CaO===CaCO3
课堂思考
请你思考!
根据物质的性质和分类,结合教材P11页“思考
与讨论”请设计出将金属和非金属单质转化为盐的基本流程。
02
物质的转化
二、物质的转化
课堂探究
探究学习
课堂探究
二、物质的转化
探究学习
1.完成下列物质的转化,写出化学方程式:
①_________________。
②_____________________。
③__________________________________。
2Ca+O2===2CaO
CaO+H2O===Ca(OH)2
Ca(OH)2+H2SO4===CaSO4↓+2H2O
④_______________。
⑤___________________。
⑥__________________________________。
点燃
====
C+O2 CO2
CO2+H2O===H2CO3
Ca(OH)2+H2CO3===CaCO3↓+2H2O
课堂探究
二、物质的转化
探究学习
2.物质转化的应用:
物质制备方法的确定依据:物质的___________、物质之间的_________。
组成和性质
转化关系
03
物质制备模型和转化关系图
方法指导
物质的分类
物质的性质
物质之间的转化关系
认识
认识
人类生活和生产所需要的新物质
制备
制备
原料
产物
核心元素的传递
物质类别
元素组成
元素组成
物质类别
物质类别的转化
元素种类不变反应规律
物质制备的一般思路
课堂探究
三、物质制备模型和转化关系图
制备Na2SO3
设计转化路径
反应和转化关系图
金属单质
碱性氧化物
碱
盐
非金属单质
酸性氧化物
酸
盐
盐
酸和盐
碱和盐
金属
和盐
盐和盐
盐和氢气
1.不同类别物质之间的反应和转化关系图
盐和水
课堂探究
三、物质制备模型和转化关系图
制备Na2SO3
设计转化路径
转化路径和方程式
Na
H2SO3
4Na + O2 2Na2O
第一步
第二步
NaOH
Na2O
第三步
2NaOH + H2SO3 Na2SO3 + 2H2O
Na2O + H2O 2NaOH
2.设计以Na为原料制备Na2SO3的转化路径
课堂思考
请你思考!
请你设计一个以Na为原料制备Na2SO3的转化路径。
Na
4Na + O2 2Na2O
第一步
第二步
Na2O + SO2 Na2SO3
Na2O
SO2
课堂思考
请你思考!
以硫、钠单质为例,归纳单质、氧化物、酸、碱、盐之间的转化关系。
Na
Na2O
NaOH
Na2CO3
S
SO2
H2SO4
CuSO4
SO3
课堂探究
三、物质制备模型和转化关系图
⑤2SO2+O2 2SO3
⑦Na2O+H2SO4=Na2SO4+H2O
1.单质→盐的转化关系:
Na
S
Na2O
NaOH
Na2CO3
SO2
SO3
H2SO4
Na2SO4
①
②
③
④
⑤
⑥
⑦
⑧
⑨
⑩
①4Na+O2=2Na2O
②Na2O+H2O=2NaOH
③2NaOH+CO2=Na2CO3+H2O
④S+O2 SO2
⑥SO3+H2O=H2SO4
箭头表示转化关系,连线表示相互反应。
三、物质制备模型和转化关系图
课堂探究
Na
S
Na2O
NaOH
Na2CO3
SO2
SO3
H2SO4
Na2SO4
①
②
③
④
⑤
⑥
⑦
⑧
⑨
⑩
箭头表示转化关系,连线表示相互反应。
2.八个相互反应的关系:
⑧2Na+S=Na2S
⑨Na2O+SO3=Na2SO4
⑩Na2O+H2SO4=Na2SO4+H2O
2NaOH+SO3=Na2SO4+H2O
2NaOH+H2SO4=Na2SO4+H2O
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
Na2CO3+CuSO4=CuCO3↓+Na2SO4
典例精讲
【例3】单质、氧化物、酸、碱和盐的相互关系,可以用下图简单表示,限选择铁、碳、氧气、盐酸、氧化钙、二氧化碳、水、氢氧化钙8种物质作为反应物,将图中指定序号的转变用化学方程式表示(所写化学方程式不得重复)。
②___________________________________;
③___________________________________;
④___________________________________;
⑤___________________________________;
⑥___________________________________;
⑦___________________________________。
CO2+H2O===H2CO3
CaO+H2O===Ca(OH)2
CO2+Ca(OH)2===CaCO3↓+H2O
Fe+2HCl===FeCl2+H2↑
CaO+2HCl===CaCl2+H2O
Ca(OH)2+2HCl===CaCl2+2H2O
课堂小结
物质的转化
酸的性质
物质的转化及其应用
物理变化和化学变化的判断方法
有无新物质产生
碱的性质
盐的性质
指示剂、金属、金属氧化物、碱、盐
指示剂、酸性氧化物、酸、盐
金属、酸、碱、盐
金属单质、氧化物的性质
物质的制备
随堂演练
1.下列有关氧化物的判断正确的是( )
A.凡是含氧的化合物均可称为氧化物
B.依据性质不同氧化物只能分为酸性氧化物和碱性氧化物
C.酸性氧化物都能与碱反应生成盐和水
D.金属氧化物一定是碱性氧化物
C
2.下列物质中,与酸、碱、盐均能反应的物质是( )
A.CuO B.CaCO3
C.Na2CO3 D.CO2
C
随堂演练
3.A、B、C、D、E中都含有同一种元素,它们之间的相互转化关系如图所示,其中所含的相同元素是 ( )
A.铜
B.碳
C.铁
D.钙
D
演示完毕 感谢聆听
分层作业见本课时word
第一节 物质的分类及转化
课时3 物质的转化
人教版2019必修第一册
第一章 物质及其变化
素养目标
宏观辨识与微观探析:
从宏观上复习物质的分类,理解同一类物质的化学性质的相似性;从微观上体会同一类别物质的化学性质的相似性是由其含有相同微观粒子决定的。
证据推理与模型认知:
根据同类物质具有相似的性质,探究在一定条件下各类物质之间相互转化的基本规律,提高分析问题和解决问题的能力。
科学探究与创新意识:
通过学习探究,先对物质进行分类,再统一研究同一类物质的化学性质的相似性,体会物质之间的转化规律,理解化学研究过程中的科学方法。
教学目标
本节重点
酸、碱、盐的主要性质和转化.
本节难点
根据酸、碱、盐及氧化物的性质理解各类物质间的转化关系。
通过对化学物质按组成和性质进行分类法的学习,进一步掌握酸、碱、盐、氧化物的概念及主要性质,会预测在一定条件下某种物质能发生的化学变化。
新课导入
请你描述!
下列的美丽景象是发生了什么变化?
美丽的溶洞、美丽的凤仙花,自然界中物质的转化
美丽的化学实验中物质的转化
物质的性质
壹
物质的转化
贰
物质制备模型和转化关系图
叁
知识导航
新课导入
你知道吗?
下列诗句中涉及了哪些化学物质和类别?
CaCO3
(石灰石)
CaO
(生灰石)
类别
盐
氧化物
依据类别共性
类比典型代表物
新课导入
基于物质类别研究物质性质的认知模型
课本P10
实验验证
预测物质性质
确认物质性质
分析物质组成
确定物质类别
分类研究
确认物质制备
制备方法
请你思考!
请思考如何制备Na2SO3?
课堂思考
寻找原料
资料:亚硫酸钠(Na2SO3)常用作织物的漂白剂,在食品工业上也是常见的疏松剂和抗氧化剂。但Na2SO3在空气中容易氧化,因此自然界中几乎没有稳定存在的Na2SO3,只能通过制备来获得。
01
物质的性质
课堂探究
一、物质的性质
探究学习
制备Na2SO3
寻找原料
元素
种类
不变
Na2SO3
元素组成
Na 、S、 O
物质类别
盐
Na
Na2O
NaOH
Na2CO3
S
SO2
H2SO3
K2SO3
SO3
K2SO4
H2SO4
NaCl
O2
这些物质都可以制备Na2SO3吗?
课堂探究
一、物质的性质
探究学习
制备Na2SO3
寻找原料
Na
Na2O
NaOH
Na2CO3
S
SO2
H2SO3
K2SO3
SO3
K2SO4
H2SO4
NaCl
O2
分类研究
氧化物
Na
单质
金属
单质
非金属
单质
Na2O
SO2、SO3
H2SO3
H2SO4
NaOH
NaCl
Na2CO3 K2SO3 K2SO4
酸性
氧化物
碱性
氧化物
酸
碱
盐
S
O2
化合物
按组成和性质分类
课堂探究
一、物质的性质
探究学习
制备Na2SO3
寻找原料
分类
思想
Na2CO3
Na
Na2O
NaOH
S
SO2
H2SO3
K2SO3
SO3
K2SO4
H2SO4
含Na物质
含
S
物质
金属单质
碱性氧化物
碱
盐
非金属单质
酸性氧化物
酸
盐
基于物质类别研究物质性质
课堂探究
一、物质的性质
1.基于物质类别研究单质的性质
Fe+CuSO4 FeSO4+Cu
Fe+2HCl FeCl2+H2↑
3Fe+2O2 Fe3O4
点燃
Fe
金属
单质
金属+氧气→金属氧化物
金属 + 酸 → 盐 + 氢气
金属 + 盐 → 新盐 + 新金属
如何认识Na的性质?
C
C+O2===CO2
点燃
非金属+氧气→非金属氧化物
如何认识S的性质?
非金属
单质
类推S和O2反应的方程式
CaO + H2O Ca(OH)2
课堂探究
一、物质的性质
如何类推SO2和Na2O的性质?
2.基于物质类别研究氧化物的性质
CO2
CO2+H2O H2CO3
CO2+Ca(OH)2 CaCO3↓+H2O
酸性
氧化物
酸性氧化物 + 水 → 酸
酸性氧化物 + 碱 → 盐 + 水
CaO
Fe2O3
Fe2O3 + 6HCl 2FeCl3 + 3H2O
碱性氧化物 + 水 → 碱
碱性氧化物 + 酸 → 盐 + 水
碱性
氧化物
酸性氧化物+碱性氧化物→盐
课堂探究
一、物质的性质
CO2 + 2NaOH Na2CO3 + H2O
SO2 + 2NaOH Na2SO3 + H2O
CaO + 2HCl CaCl2 + H2O
Fe2O3 + 6HCl 2FeCl3 + 3H2O
Na2O + 2HCl 2NaCl + H2O
碱性
氧化物
酸性
氧化物
凡能与酸反应生成盐和水的氧化物
凡能与碱反应生成盐和水的氧化物
类推SO2和Na2O的部分性质
典例精讲
【例1】预测陌生物质的性质——如何吸收烟气中的SO2?
SO2
依据酸性氧化物共性
酸性氧化物
类比CO2性质
预测SO2的性质
SO2+H2O H2SO3
SO2+CaO CaSO3
SO2+2NaOH Na2SO3 +H2O
课堂思考
请你思考!
如何认识H2SO3的性质?请同学们完成P10思考与讨论。
一、物质的性质
课堂探究
3.基于物质类别研究酸的性质
酸的主要化学性质 列举实例(写出反应方程式) 反应类型
指示剂
活泼金属
碱性氧化物
碱
某些盐
2HCl +Fe = FeCl2 +H2↑
使紫色石蕊试液变红色,无色酚酞试液不变色
CaO+2HCl===CaCl2+H2O
HCl +NaOH = NaCl +H2O
Na2CO3+2HCl===2NaCl+CO2↑+H2O
置换反应
复分解反应
复分解反应
复分解反应
酸+碱→盐+水
酸+碱性氧化物→盐+水
酸+盐→新盐+新酸
酸+金属→盐+氢气
酸溶液能使指示剂变色
一、物质的性质
课堂探究
4.基于物质类别研究碱的性质
碱的主要化学性质 列举实例(写出反应方程式) 反应类型
指示剂
酸
酸性氧化物
某些盐
使紫色石蕊试液变蓝色,无色酚酞试液变红色
Ca(OH)2+ H2SO4=CaSO4↓+2H2O
CO2+2NaOH =Na2CO3+H2O
2NaOH+CuSO4 =Cu(OH)2 ↓+Na2SO4
复分解反应
复分解反应
复分解反应
碱溶液能使指示剂变色
碱+盐→新盐+新碱
碱+酸→盐+水
碱+酸性氧化物→盐+水
一、物质的性质
课堂探究
5.基于物质类别研究盐的性质
盐的主要化学性质 列举实例(写出反应方程式) 反应类型
金属
酸
碱
盐
Fe +CuSO4 =Cu+FeSO4
置换反应
CaCO3+2HCl=CaCl2+H2O+CO2↑
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
NaCl+AgNO3=AgCl↓+NaNO3
复分解反应
复分解反应
复分解反应
盐 + 金属→ 新盐 + 新金属
盐 + 酸→ 新盐 + 新酸
盐 + 碱→ 新盐 + 新碱
盐 + 盐→ 新盐 + 新盐
典例精讲
(1)请推断它们的化学式分别为:①_______;②______;③_____;④_____;⑤_________。
(2)写出下列序号之间的化学方程式:
①和②:_______________________________________;
②和④:_______________________________________;
②和⑤:________________________________________;
③和④:_________________________________________。
【例2】在稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉9种物质间存在下面的相互关系,选择①~⑤中适当的物质,使有连线的两物质能发生反应。
单质①
氧化物③
酸②
氧化物④
盐⑤
Fe
H2SO4
CO2
CaO
Na2CO3
Fe+H2SO4===FeSO4+H2↑
CaO+H2SO4===CaSO4+H2O
Na2CO3+H2SO4===Na2SO4+CO2↑+H2O
CO2+CaO===CaCO3
课堂思考
请你思考!
根据物质的性质和分类,结合教材P11页“思考
与讨论”请设计出将金属和非金属单质转化为盐的基本流程。
02
物质的转化
二、物质的转化
课堂探究
探究学习
课堂探究
二、物质的转化
探究学习
1.完成下列物质的转化,写出化学方程式:
①_________________。
②_____________________。
③__________________________________。
2Ca+O2===2CaO
CaO+H2O===Ca(OH)2
Ca(OH)2+H2SO4===CaSO4↓+2H2O
④_______________。
⑤___________________。
⑥__________________________________。
点燃
====
C+O2 CO2
CO2+H2O===H2CO3
Ca(OH)2+H2CO3===CaCO3↓+2H2O
课堂探究
二、物质的转化
探究学习
2.物质转化的应用:
物质制备方法的确定依据:物质的___________、物质之间的_________。
组成和性质
转化关系
03
物质制备模型和转化关系图
方法指导
物质的分类
物质的性质
物质之间的转化关系
认识
认识
人类生活和生产所需要的新物质
制备
制备
原料
产物
核心元素的传递
物质类别
元素组成
元素组成
物质类别
物质类别的转化
元素种类不变反应规律
物质制备的一般思路
课堂探究
三、物质制备模型和转化关系图
制备Na2SO3
设计转化路径
反应和转化关系图
金属单质
碱性氧化物
碱
盐
非金属单质
酸性氧化物
酸
盐
盐
酸和盐
碱和盐
金属
和盐
盐和盐
盐和氢气
1.不同类别物质之间的反应和转化关系图
盐和水
课堂探究
三、物质制备模型和转化关系图
制备Na2SO3
设计转化路径
转化路径和方程式
Na
H2SO3
4Na + O2 2Na2O
第一步
第二步
NaOH
Na2O
第三步
2NaOH + H2SO3 Na2SO3 + 2H2O
Na2O + H2O 2NaOH
2.设计以Na为原料制备Na2SO3的转化路径
课堂思考
请你思考!
请你设计一个以Na为原料制备Na2SO3的转化路径。
Na
4Na + O2 2Na2O
第一步
第二步
Na2O + SO2 Na2SO3
Na2O
SO2
课堂思考
请你思考!
以硫、钠单质为例,归纳单质、氧化物、酸、碱、盐之间的转化关系。
Na
Na2O
NaOH
Na2CO3
S
SO2
H2SO4
CuSO4
SO3
课堂探究
三、物质制备模型和转化关系图
⑤2SO2+O2 2SO3
⑦Na2O+H2SO4=Na2SO4+H2O
1.单质→盐的转化关系:
Na
S
Na2O
NaOH
Na2CO3
SO2
SO3
H2SO4
Na2SO4
①
②
③
④
⑤
⑥
⑦
⑧
⑨
⑩
①4Na+O2=2Na2O
②Na2O+H2O=2NaOH
③2NaOH+CO2=Na2CO3+H2O
④S+O2 SO2
⑥SO3+H2O=H2SO4
箭头表示转化关系,连线表示相互反应。
三、物质制备模型和转化关系图
课堂探究
Na
S
Na2O
NaOH
Na2CO3
SO2
SO3
H2SO4
Na2SO4
①
②
③
④
⑤
⑥
⑦
⑧
⑨
⑩
箭头表示转化关系,连线表示相互反应。
2.八个相互反应的关系:
⑧2Na+S=Na2S
⑨Na2O+SO3=Na2SO4
⑩Na2O+H2SO4=Na2SO4+H2O
2NaOH+SO3=Na2SO4+H2O
2NaOH+H2SO4=Na2SO4+H2O
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
Na2CO3+H2SO4=Na2SO4+CO2↑+H2O
Na2CO3+CuSO4=CuCO3↓+Na2SO4
典例精讲
【例3】单质、氧化物、酸、碱和盐的相互关系,可以用下图简单表示,限选择铁、碳、氧气、盐酸、氧化钙、二氧化碳、水、氢氧化钙8种物质作为反应物,将图中指定序号的转变用化学方程式表示(所写化学方程式不得重复)。
②___________________________________;
③___________________________________;
④___________________________________;
⑤___________________________________;
⑥___________________________________;
⑦___________________________________。
CO2+H2O===H2CO3
CaO+H2O===Ca(OH)2
CO2+Ca(OH)2===CaCO3↓+H2O
Fe+2HCl===FeCl2+H2↑
CaO+2HCl===CaCl2+H2O
Ca(OH)2+2HCl===CaCl2+2H2O
课堂小结
物质的转化
酸的性质
物质的转化及其应用
物理变化和化学变化的判断方法
有无新物质产生
碱的性质
盐的性质
指示剂、金属、金属氧化物、碱、盐
指示剂、酸性氧化物、酸、盐
金属、酸、碱、盐
金属单质、氧化物的性质
物质的制备
随堂演练
1.下列有关氧化物的判断正确的是( )
A.凡是含氧的化合物均可称为氧化物
B.依据性质不同氧化物只能分为酸性氧化物和碱性氧化物
C.酸性氧化物都能与碱反应生成盐和水
D.金属氧化物一定是碱性氧化物
C
2.下列物质中,与酸、碱、盐均能反应的物质是( )
A.CuO B.CaCO3
C.Na2CO3 D.CO2
C
随堂演练
3.A、B、C、D、E中都含有同一种元素,它们之间的相互转化关系如图所示,其中所含的相同元素是 ( )
A.铜
B.碳
C.铁
D.钙
D
演示完毕 感谢聆听
分层作业见本课时word
