第三节 第2课时 氧化剂和还原剂、单双线桥(课件)(共36张PPT)-2024-2025学年高一化学教学课件(人教版2019必修第一册)
文档属性
| 名称 | 第三节 第2课时 氧化剂和还原剂、单双线桥(课件)(共36张PPT)-2024-2025学年高一化学教学课件(人教版2019必修第一册) |

|
|
| 格式 | pptx | ||
| 文件大小 | 11.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-22 19:02:45 | ||
图片预览








文档简介
(共36张PPT)
课时2 氧化剂和还原剂、单双线桥
第一章 物质及其变化
第三节 氧化还原反应
学习目标
1.通过典例分析、归纳小结,从宏观和微观相结合的角度认识和判断氧化剂、还原剂,熟悉氧化还原反应中各概念间的关系。
2.通过阅读归纳、练习应用,依据氧化还原反应原理,预测物质的化学性质和变化,知道常见的氧化剂和还原剂。
3.通过讨论交流、问题探究,学会用单、双线桥法分析氧化还原反应电子转移的方向和数目,初步感受化学反应中的“电子守恒”思想。4、4、理解物质的氧化性、还原性,并初步建立判断物质氧化性、还原性强弱的思维模型。
新课导入
Fe
Fe
食品包装脱氧剂—铁粉
神奇的铁元素?
知识回顾
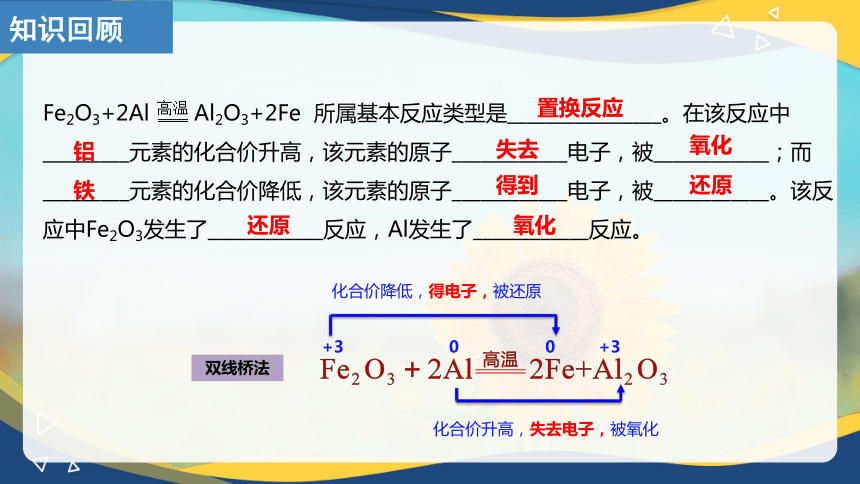
Fe2O3+2Al Al2O3+2Fe 所属基本反应类型是________________。在该反应中_________元素的化合价升高,该元素的原子____________电子,被____________;而_________元素的化合价降低,该元素的原子____________电子,被____________。该反应中Fe2O3发生了____________反应,Al发生了____________反应。
+3 0 0 +3
化合价降低,得电子,被还原
化合价升高,失去电子,被氧化
置换反应
铝
铁
失去
得到
氧化
还原
氧化
还原
双线桥法
教学过程
活动一、氧化剂和还原剂(反应物)
氧化剂:在氧化还原反应中 (或电子对 )电子化合价 的物质。
还原剂:在氧化还原反应中 (或电子对 )电子化合价 的物质。
CuO + H2 === Cu + H2O
△
2e-
氧化剂
还原剂
2e-
氧化剂
还原剂
例如:
得到
偏向
降低
失去
偏离
升高
教学过程
活动二、氧化产物、还原产物
氧化产物:还原剂失去电子 后的生成物。
还原产物:氧化剂得到电子 后的生成物。
还原剂:H2
氧化剂:CuO
被还原
还原产物:Cu
被氧化
氧化产物:H2O
CuO + H2 === Cu + H2O
△
2e-
氧化剂
还原剂
被氧化
被还原
生成物
课堂练习
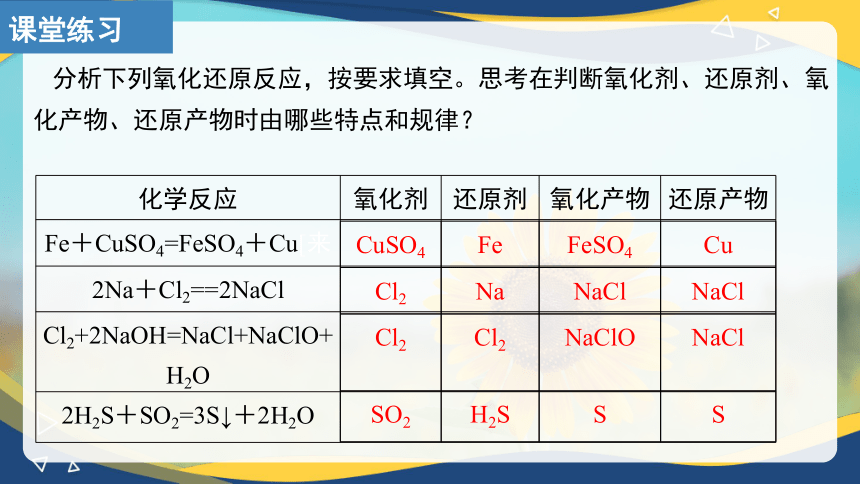
分析下列氧化还原反应,按要求填空。思考在判断氧化剂、还原剂、氧化产物、还原产物时由哪些特点和规律?
化学反应 氧化剂 还原剂 氧化产物 还原产物
Fe+CuSO4=FeSO4+Cu[来
2Na+Cl2==2NaCl
Cl2+2NaOH=NaCl+NaClO+H2O
2H2S+SO2=3S↓+2H2O
CuSO4 Fe FeSO4 Cu
Cl2 Na NaCl NaCl
Cl2 Cl2 NaClO NaCl
SO2 H2S S S
教学过程
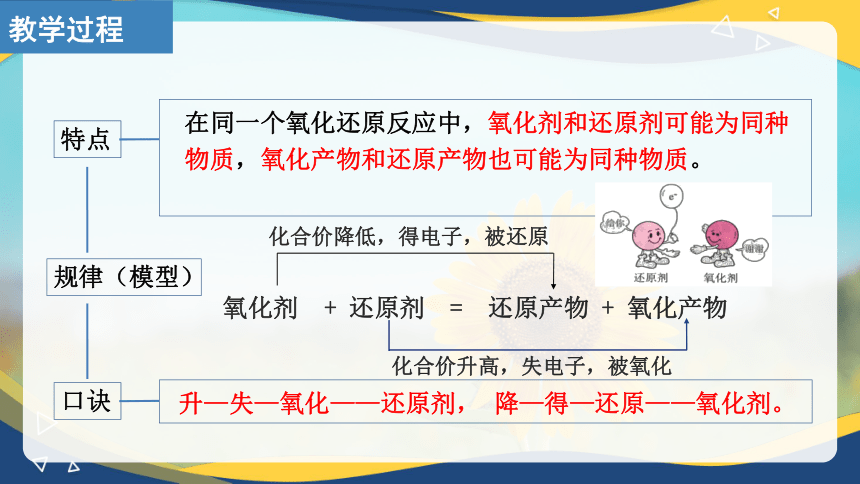
特点
在同一个氧化还原反应中,氧化剂和还原剂可能为同种
物质,氧化产物和还原产物也可能为同种物质。
规律(模型)
氧化剂 + 还原剂 = 还原产物 + 氧化产物
化合价降低,得电子,被还原
化合价升高,失电子,被氧化
口诀
升—失—氧化——还原剂, 降—得—还原——氧化剂。
教学过程
活动三、氧化性和还原性
(1)氧化性:表示氧化剂 能力强弱的性质。
(2)还原性:表示还原剂 能力强弱的性质。
2.氧化性、还原性和元素化合价之间的关系
在氧化还原反应中:同一元素的最高价态只能 电子,具有 性;
最低价态只能 电子,具有 性;
中间价态既有 性又有 性。
得电子
失电子
得
氧化
还原
还原
失
氧化
教学过程
【思考讨论】
金属元素由游离态(单质)转变为化合态是否一定被氧化?非金属单质在氧化还原反应中作反应物时一定是氧化剂吗?
S+2H2SO4(浓)=3SO2↑+2H2O
Cl2+2KBr =2KCl+Br2
Cl2+H2O=HCl+HClO
(Cl既被氧化,又被还原)
(Cl2被还原)
(S被氧化)
金属单质只能失电子,表现出还原性,非金属单质则既可失电子,表现出还原性,又可得电子,表现出氧化性。
教学过程
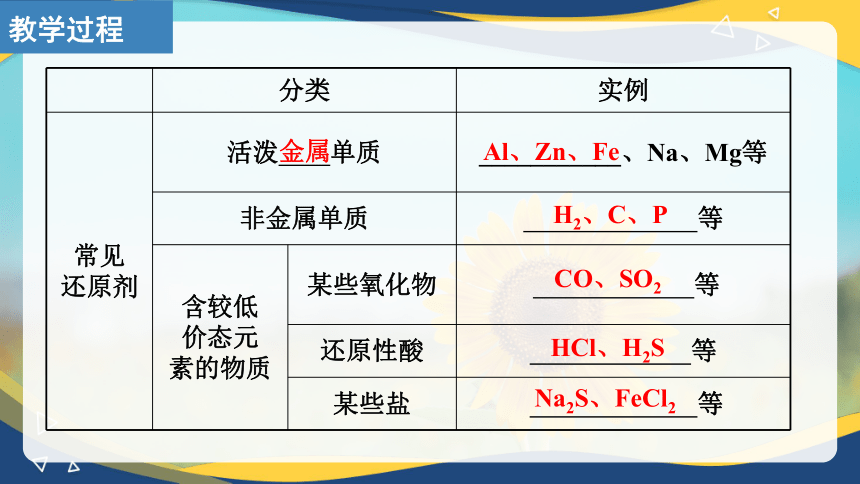
分类 实例
常见 氧化剂 活泼 的单质 _______、S
某些阳离子 H+、Ag+、Fe3+、Cu2+等
含较高 价态元素的物质 某些氧化物 等
氧化性酸 _____________
某些盐 ____________、KClO3
Cl2、O2
浓硫酸、硝酸
KMnO4、FeCl3
非金属
MnO2、NO2、H2O2、Na2O2
活动元四、常见的氧化剂和还原剂
教学过程
分类 实例
常见 还原剂 活泼 单质 ___________、Na、Mg等
非金属单质 等
含较低 价态元 素的物质 某些氧化物 等
还原性酸 等
某些盐 等
Al、Zn、Fe
H2、C、P
CO、SO2
金属
HCl、H2S
Na2S、FeCl2
课堂练习
亚硫酸钠(Na2SO3)在反应中既可作氧化剂,又可作还原
剂。当它作氧化剂时,理论上可能被还原成的是( )
①H2SO4 ②S ③Na2S ④Na2SO4 ⑤H2SO3 ⑥Na2S2O3
A.①④ B.①②③
C.①⑤⑥ D.②③⑥
D
教学过程
氧化性:氧化剂___氧化产物
还原性:还原剂___还原产物
活动五、氧化性、还原性强弱的比较
①根据氧化还原反应方程式判断
>
>
课堂练习
1.常温下,发生下列反应:①16H++10Cl-+ ===2Mn2++5Cl2↑
+8H2O;②2Fe2++Br2===2Fe3++2Br-;③2Br-+Cl2===Br2+2Cl-,根据上述反应,
可得知相关微粒氧化性由强到弱的顺序是 。
>Fe3+
教学过程
(2) 根据金属的活动性顺序判断
教学过程
③根据反应条件判断
①2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
②MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
可判断氧化性:KMnO4____MnO2。
④根据(氧化剂、还原剂)元素的价态进行判断
①2Fe+3Cl2 2FeCl3
②Fe+S FeS
可判断氧化性:氯气____硫。
>
>
教学过程
⑤根据同种元素的价态高低判断
-2 0 +4 +6
硫元素的化合价
H2S
S
SO2
H2SO4
一般来说,对于同种元素来说,价态越高,其氧化性越 ;
价态越低,其还原性越 。
如:
强
强
氧化性:Fe3+ Fe2+ Fe
还原性:H2S S SO2
>
>
>
>
教学过程
影响物质氧化性、还原性的因素
①温度:如热的浓硫酸的氧化性比冷的浓硫酸氧化性要强。
②浓度:如硝酸的浓度越大其氧化性越强。
③酸碱性:如KMnO4的氧化性随溶液酸性的增强而增强。
延伸
教学过程
活动六、预测并实验探究物质的氧化性或还原性
任务一、讨论交流:结合离子的检验方法,思考如何预测并设计实
验验证物质的氧化性和还原性?
探究
物质氧化性和还原性
预测
依据
验证
方法
物质的组成和结构,分析元素化合价,预测氧化性或还原性。如FeCl2溶液具有还原性,FeCl3溶液具有氧化性等。
氧化性物质→加入还原剂→特殊现象→得出结论;
还原性物质→加入氧化剂→特殊现象→得出结论。
教学过程
应用探究:已知H2O2(无色,具有氧化性,能氧化Fe2+),
FeCl2溶液显浅绿色,FeCl3溶液显黄色,FeCl3溶液遇KSCN溶液显血
宏色。请利用提供的试剂,设计合理、有效的实验方案,完成以下
探究实验。
试剂:铁粉、稀硫酸、FeCl2溶液、FeCl3溶液、氯水、KSCN溶液、
维生素C(具有还原性)
实验1:预测Fe2+具有还原性并探究:
教学过程
实验 选择试剂 现象 结论
预测Fe2+的还原性
FeCl2溶液、H2O2、KSCN溶液
FeCl2溶液+H2O2→溶液由浅绿色变成黄色
+KSCN溶液→溶液出现血红色
Fe2+具有还原性
实验2:预测Fe3+具有氧化性并探究:
实验 选择试剂 现象 结论
预测Fe3+的氧化性
FeCl3溶液、维生素C、KSCN溶液
FeCl3溶液+足量维生素C→溶液由黄色变浅绿成色+KSCN溶液→溶液不出现血红色
Fe3+具有氧化性
教学过程
表明反应前后同一元素原子或离子间的电子转移情况
活动六、氧化还原反应电子转移数目的表示方法——双线桥
0 0 +1 -1
2Na + Cl2 = 2NaCl
点 燃
失去2×e-
得到2×e-
教学过程
(1)基本步骤
教学过程
(2)注意事项
①箭头、箭尾必须对应化合价变化的同种元素的原子;
②必须注明“得到”或“失去”;
③电子转移数用a×be-形式表示,a表示发生氧化反应或还原反应的原子个数,b表示每个原子得到或失去的电子数,当a=1或b=1时,要省略;
③被还原的物质和被氧化的物质得、失电子数守恒。
课堂练习
1、下列反应中,电子转移方向和数目正确的是
课堂练习
√
教学过程
3、现有反应:MnO2+4HCl=MnCl2+Cl2↑+2H2O
(1)被氧化的元素是 被还原的元素是
(2)用双线桥法表示电子转移的方向和数目:
Cl
Mn
+4 -1 +2 0
失去2×e-
得到1×2e-
教学过程
标价态:正确标出反应前后各元素的化合价
连单线:从反应物失电子元素指向反应物得电子的元素
注数目:标出电子转移总数目( be- ) 不标得失
2Na + Cl2 = 2NaCl
点 燃
2e-
活动 七、氧化还原反应电子转移数目的表示方法——单线桥法
教学过程
教学过程
(2)注意事项
①不需要标明“得到”或“失去”,只标明电子转移数目;
②要用箭头标明电子转移的方向;
③箭头由反应物中失电子元素原子指向得电子元素原子。
如
课堂练习
1、分别用单线桥法表示下列反应电子转移情况
4e-
2H2+O2 = 2H2O
点 燃
4e-
8e-
2H2S+SO2=3S↓+2H2O
教学过程
氧化还原反应的应用:氧化还原反应是一类重要的化学反应类型,广泛存在于日常的生产生活中。
电镀
燃料的燃烧
光合作用
金属的冶炼
有益影响
教学过程
食物的腐败
钢铁的锈蚀
有害影响
易燃物的自燃
煤矿瓦斯爆炸
课堂小结
化合价升高
化合价降低
失电子(电子对偏离)
得电子(电子对偏向)
被氧化
被还原
还原性
氧化性
反应物
生成物
氧化剂
还原剂
氧化产物
还原产物
升—失—氧化——还原剂
降—得—还原——氧化剂。
谢 谢 观 看!
课时2 氧化剂和还原剂、单双线桥
第一章 物质及其变化
第三节 氧化还原反应
学习目标
1.通过典例分析、归纳小结,从宏观和微观相结合的角度认识和判断氧化剂、还原剂,熟悉氧化还原反应中各概念间的关系。
2.通过阅读归纳、练习应用,依据氧化还原反应原理,预测物质的化学性质和变化,知道常见的氧化剂和还原剂。
3.通过讨论交流、问题探究,学会用单、双线桥法分析氧化还原反应电子转移的方向和数目,初步感受化学反应中的“电子守恒”思想。4、4、理解物质的氧化性、还原性,并初步建立判断物质氧化性、还原性强弱的思维模型。
新课导入
Fe
Fe
食品包装脱氧剂—铁粉
神奇的铁元素?
知识回顾
Fe2O3+2Al Al2O3+2Fe 所属基本反应类型是________________。在该反应中_________元素的化合价升高,该元素的原子____________电子,被____________;而_________元素的化合价降低,该元素的原子____________电子,被____________。该反应中Fe2O3发生了____________反应,Al发生了____________反应。
+3 0 0 +3
化合价降低,得电子,被还原
化合价升高,失去电子,被氧化
置换反应
铝
铁
失去
得到
氧化
还原
氧化
还原
双线桥法
教学过程
活动一、氧化剂和还原剂(反应物)
氧化剂:在氧化还原反应中 (或电子对 )电子化合价 的物质。
还原剂:在氧化还原反应中 (或电子对 )电子化合价 的物质。
CuO + H2 === Cu + H2O
△
2e-
氧化剂
还原剂
2e-
氧化剂
还原剂
例如:
得到
偏向
降低
失去
偏离
升高
教学过程
活动二、氧化产物、还原产物
氧化产物:还原剂失去电子 后的生成物。
还原产物:氧化剂得到电子 后的生成物。
还原剂:H2
氧化剂:CuO
被还原
还原产物:Cu
被氧化
氧化产物:H2O
CuO + H2 === Cu + H2O
△
2e-
氧化剂
还原剂
被氧化
被还原
生成物
课堂练习
分析下列氧化还原反应,按要求填空。思考在判断氧化剂、还原剂、氧化产物、还原产物时由哪些特点和规律?
化学反应 氧化剂 还原剂 氧化产物 还原产物
Fe+CuSO4=FeSO4+Cu[来
2Na+Cl2==2NaCl
Cl2+2NaOH=NaCl+NaClO+H2O
2H2S+SO2=3S↓+2H2O
CuSO4 Fe FeSO4 Cu
Cl2 Na NaCl NaCl
Cl2 Cl2 NaClO NaCl
SO2 H2S S S
教学过程
特点
在同一个氧化还原反应中,氧化剂和还原剂可能为同种
物质,氧化产物和还原产物也可能为同种物质。
规律(模型)
氧化剂 + 还原剂 = 还原产物 + 氧化产物
化合价降低,得电子,被还原
化合价升高,失电子,被氧化
口诀
升—失—氧化——还原剂, 降—得—还原——氧化剂。
教学过程
活动三、氧化性和还原性
(1)氧化性:表示氧化剂 能力强弱的性质。
(2)还原性:表示还原剂 能力强弱的性质。
2.氧化性、还原性和元素化合价之间的关系
在氧化还原反应中:同一元素的最高价态只能 电子,具有 性;
最低价态只能 电子,具有 性;
中间价态既有 性又有 性。
得电子
失电子
得
氧化
还原
还原
失
氧化
教学过程
【思考讨论】
金属元素由游离态(单质)转变为化合态是否一定被氧化?非金属单质在氧化还原反应中作反应物时一定是氧化剂吗?
S+2H2SO4(浓)=3SO2↑+2H2O
Cl2+2KBr =2KCl+Br2
Cl2+H2O=HCl+HClO
(Cl既被氧化,又被还原)
(Cl2被还原)
(S被氧化)
金属单质只能失电子,表现出还原性,非金属单质则既可失电子,表现出还原性,又可得电子,表现出氧化性。
教学过程
分类 实例
常见 氧化剂 活泼 的单质 _______、S
某些阳离子 H+、Ag+、Fe3+、Cu2+等
含较高 价态元素的物质 某些氧化物 等
氧化性酸 _____________
某些盐 ____________、KClO3
Cl2、O2
浓硫酸、硝酸
KMnO4、FeCl3
非金属
MnO2、NO2、H2O2、Na2O2
活动元四、常见的氧化剂和还原剂
教学过程
分类 实例
常见 还原剂 活泼 单质 ___________、Na、Mg等
非金属单质 等
含较低 价态元 素的物质 某些氧化物 等
还原性酸 等
某些盐 等
Al、Zn、Fe
H2、C、P
CO、SO2
金属
HCl、H2S
Na2S、FeCl2
课堂练习
亚硫酸钠(Na2SO3)在反应中既可作氧化剂,又可作还原
剂。当它作氧化剂时,理论上可能被还原成的是( )
①H2SO4 ②S ③Na2S ④Na2SO4 ⑤H2SO3 ⑥Na2S2O3
A.①④ B.①②③
C.①⑤⑥ D.②③⑥
D
教学过程
氧化性:氧化剂___氧化产物
还原性:还原剂___还原产物
活动五、氧化性、还原性强弱的比较
①根据氧化还原反应方程式判断
>
>
课堂练习
1.常温下,发生下列反应:①16H++10Cl-+ ===2Mn2++5Cl2↑
+8H2O;②2Fe2++Br2===2Fe3++2Br-;③2Br-+Cl2===Br2+2Cl-,根据上述反应,
可得知相关微粒氧化性由强到弱的顺序是 。
>Fe3+
教学过程
(2) 根据金属的活动性顺序判断
教学过程
③根据反应条件判断
①2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O
②MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
可判断氧化性:KMnO4____MnO2。
④根据(氧化剂、还原剂)元素的价态进行判断
①2Fe+3Cl2 2FeCl3
②Fe+S FeS
可判断氧化性:氯气____硫。
>
>
教学过程
⑤根据同种元素的价态高低判断
-2 0 +4 +6
硫元素的化合价
H2S
S
SO2
H2SO4
一般来说,对于同种元素来说,价态越高,其氧化性越 ;
价态越低,其还原性越 。
如:
强
强
氧化性:Fe3+ Fe2+ Fe
还原性:H2S S SO2
>
>
>
>
教学过程
影响物质氧化性、还原性的因素
①温度:如热的浓硫酸的氧化性比冷的浓硫酸氧化性要强。
②浓度:如硝酸的浓度越大其氧化性越强。
③酸碱性:如KMnO4的氧化性随溶液酸性的增强而增强。
延伸
教学过程
活动六、预测并实验探究物质的氧化性或还原性
任务一、讨论交流:结合离子的检验方法,思考如何预测并设计实
验验证物质的氧化性和还原性?
探究
物质氧化性和还原性
预测
依据
验证
方法
物质的组成和结构,分析元素化合价,预测氧化性或还原性。如FeCl2溶液具有还原性,FeCl3溶液具有氧化性等。
氧化性物质→加入还原剂→特殊现象→得出结论;
还原性物质→加入氧化剂→特殊现象→得出结论。
教学过程
应用探究:已知H2O2(无色,具有氧化性,能氧化Fe2+),
FeCl2溶液显浅绿色,FeCl3溶液显黄色,FeCl3溶液遇KSCN溶液显血
宏色。请利用提供的试剂,设计合理、有效的实验方案,完成以下
探究实验。
试剂:铁粉、稀硫酸、FeCl2溶液、FeCl3溶液、氯水、KSCN溶液、
维生素C(具有还原性)
实验1:预测Fe2+具有还原性并探究:
教学过程
实验 选择试剂 现象 结论
预测Fe2+的还原性
FeCl2溶液、H2O2、KSCN溶液
FeCl2溶液+H2O2→溶液由浅绿色变成黄色
+KSCN溶液→溶液出现血红色
Fe2+具有还原性
实验2:预测Fe3+具有氧化性并探究:
实验 选择试剂 现象 结论
预测Fe3+的氧化性
FeCl3溶液、维生素C、KSCN溶液
FeCl3溶液+足量维生素C→溶液由黄色变浅绿成色+KSCN溶液→溶液不出现血红色
Fe3+具有氧化性
教学过程
表明反应前后同一元素原子或离子间的电子转移情况
活动六、氧化还原反应电子转移数目的表示方法——双线桥
0 0 +1 -1
2Na + Cl2 = 2NaCl
点 燃
失去2×e-
得到2×e-
教学过程
(1)基本步骤
教学过程
(2)注意事项
①箭头、箭尾必须对应化合价变化的同种元素的原子;
②必须注明“得到”或“失去”;
③电子转移数用a×be-形式表示,a表示发生氧化反应或还原反应的原子个数,b表示每个原子得到或失去的电子数,当a=1或b=1时,要省略;
③被还原的物质和被氧化的物质得、失电子数守恒。
课堂练习
1、下列反应中,电子转移方向和数目正确的是
课堂练习
√
教学过程
3、现有反应:MnO2+4HCl=MnCl2+Cl2↑+2H2O
(1)被氧化的元素是 被还原的元素是
(2)用双线桥法表示电子转移的方向和数目:
Cl
Mn
+4 -1 +2 0
失去2×e-
得到1×2e-
教学过程
标价态:正确标出反应前后各元素的化合价
连单线:从反应物失电子元素指向反应物得电子的元素
注数目:标出电子转移总数目( be- ) 不标得失
2Na + Cl2 = 2NaCl
点 燃
2e-
活动 七、氧化还原反应电子转移数目的表示方法——单线桥法
教学过程
教学过程
(2)注意事项
①不需要标明“得到”或“失去”,只标明电子转移数目;
②要用箭头标明电子转移的方向;
③箭头由反应物中失电子元素原子指向得电子元素原子。
如
课堂练习
1、分别用单线桥法表示下列反应电子转移情况
4e-
2H2+O2 = 2H2O
点 燃
4e-
8e-
2H2S+SO2=3S↓+2H2O
教学过程
氧化还原反应的应用:氧化还原反应是一类重要的化学反应类型,广泛存在于日常的生产生活中。
电镀
燃料的燃烧
光合作用
金属的冶炼
有益影响
教学过程
食物的腐败
钢铁的锈蚀
有害影响
易燃物的自燃
煤矿瓦斯爆炸
课堂小结
化合价升高
化合价降低
失电子(电子对偏离)
得电子(电子对偏向)
被氧化
被还原
还原性
氧化性
反应物
生成物
氧化剂
还原剂
氧化产物
还原产物
升—失—氧化——还原剂
降—得—还原——氧化剂。
谢 谢 观 看!
