第二节第1课时电解质的电离(课件)(共38张PPT)-2024-2025学年高一化学同步教学课件(人教版2019必修第一册)
文档属性
| 名称 | 第二节第1课时电解质的电离(课件)(共38张PPT)-2024-2025学年高一化学同步教学课件(人教版2019必修第一册) |  | |
| 格式 | pptx | ||
| 文件大小 | 267.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-22 19:12:01 | ||
图片预览










文档简介
(共38张PPT)
课时1 电解质的电离
第一章 物质及其变化
第二节 离子反应
学习目标
1.能从宏观和微观的角度理解电解质的概念,了解常见的电解质,会正确识别判断电解质与非电解质。
2.认识酸、碱、盐在水溶液中或熔融状态下能发生电离,并会用电离方程式表示。能从电离的角度认识酸、碱、盐的概念及其各自的通性。
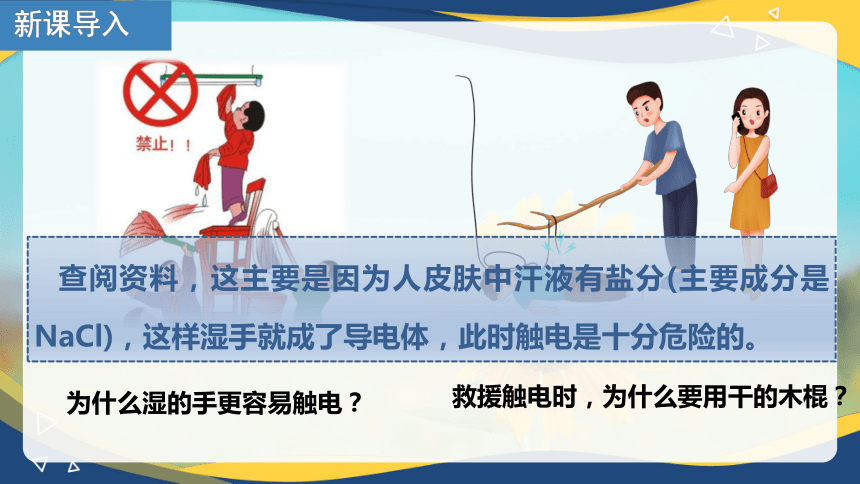
新课导入
救援触电时,为什么要用干的木棍?
为什么湿的手更容易触电?
查阅资料,这主要是因为人皮肤中汗液有盐分(主要成分是NaCl),这样湿手就成了导电体,此时触电是十分危险的。
教学过程
物质 实验现象 导电性
NaCl溶液
提出问题:为什么NaCl溶液能导电呢?
灯泡亮
能够导电
活动一:设计实验证明NaCl溶液能导电
教学过程
课本P13:严格的说,蒸馏水也能导电,只是导电能力非常弱,用上述实验装置不能测出。
不能导电
不能导电
灯泡不亮
灯泡不亮
NaCl溶液
水
+
NaCl
猜想1:水能导电
猜想2:NaCl能导电
猜想3:水和NaCl共同作用能导电
实验序号 物质 实验现象 导电性
1 NaCl溶液 灯泡亮 能够导电
2 蒸馏水
3 NaCl固体
结论:水和NaCl共同作用能导电
活动二:探究NaCl溶液能导电的原因
教学过程
【思考】物质能够导电的原因是什么?
金属:存在自由移动的电子,通电条件下,自由移动的电子定向移动
猜想:在NaCl溶液中存在自由移动的微粒,在通电的作用下,带电微粒定向移动,则产生了电流.
【思考】 NaCl固体不导电, NaCl溶液为什么能导电?
教学过程
NaCl固体在水中的溶解和形成水合离子示意图
教学过程
教学过程
NaCl
固体
NaCl
溶液
加水溶解
能够导电
微观
宏观
不能导电
Na+和Cl
能
自由移动
-
Na+和Cl
不能
自由移动
-
教学过程
熔融NaCl导电性实验
实验序号 物质 实验现象 导电性 微观解释
(猜想)
1 NaCl溶液 灯泡亮 能够导电 有自由移动的带电粒子
4 熔融NaCl
能够导电
有自由移动的带电粒子
灯泡亮
教学过程
熔融NaCl
加热熔化
微观
宏观
NaCl
固体
不能导电
Na+和Cl
能
自由移动
-
Na+和Cl
不能
自由移动
-
干燥的NaCl固体不导电
熔融的NaCl能够导电
教学过程
实验序号 物质 实验现象 导电性 微观解释
1 NaCl 溶液 灯泡亮 能够导电 有自由移动的
带电粒子
2 蒸馏水 灯泡不亮 不能导电
3 NaCl 固体 灯泡不亮 不能导电
4 熔融NaCl 灯泡亮 能够导电 有自由移动的
带电粒子
湿手不要摸电器
干燥绝缘要牢记
无大量
带电粒子
有带电粒子,
不能自由移动
人的手上常会沾有NaCl(汗液的成分之一),有时也会沾有其他电解质,当遇到水时,形成电解质溶液。电解质溶液能够导电,因此,湿手直接接触电源时容易发生触电事故。
教学过程
活动三:物质的导电性
探究HCl、H2SO4、KOH、Ca(OH)2、蒸馏水、酒精的导电性。
教学过程
【思考与讨论】结合教材P14页最后自然段,思考下列物质哪些能导电,哪些本身不能导电,但在一定条件下可以导电?
硫酸溶液、Cu、熔融NaOH、MgCl2、KOH固体、H2SO4 、Fe2(SO4)3、
Na2CO3、硫酸钡、蔗糖、酒精。
本身就能导电
硫酸溶液、Cu、熔融NaOH
本身不能导电,一定条件(溶于水或熔融状态)才能导电
MgCl2、KOH固体、H2SO4 、Fe2(SO4)3、Na2CO3、硫酸钡
蔗糖、酒精(忽略水导电)
本身不能导电,一定条件(溶于水或熔融状态)也不能导电
物质的导电性
教学过程
现有以下物质:①NaCl晶体 ②液态HCl ③CaCO3固体
④熔融KCl ⑤蔗糖 ⑥铜 ⑦CO2 ⑧H2SO4 ⑨KOH固体
⑩氨水 液氨 盐酸
以上物质中能导电的是________。
①③④⑥⑨
教学过程
活动四:电离和电解质
物质溶于水或受热熔化时,离解成能够自由移动的离子的过程。
电离:
物质
离解
水溶液
或熔融
自由移动的离子
电离
化合物
电解质
在水溶液或熔融状态下能够导电的化合物。
电离不需要通电
教学过程
判断题:
铜能够导电,所以是电解质;
氯化钠的水溶液能够导电,所以食盐水是电解质;
盐酸是电解质
硫酸是电解质
剖析电解质定义中的关键词:
(1)化合物:单质和混合物不属于化合物,所以不是电解质。
(×)
(×)
(×):因为盐酸是混合物,只能说氯化氢是电解质。
(√):硫酸是纯净物
教学过程
(2)或:两个条件满足其一即可;
判断:
固体氯化钠不导电,所以氯化钠不是电解质;
NaCl在水溶液和熔融状态下都能导电,所以NaCl是电解质;
液态HCl不导电,所以HCl不是电解质;
BaSO4难溶于水,其水溶液不导电,所以BaSO4不是电解质;
(×)
( √ )
(×)
(×)
剖析电解质定义中的关键词:
教学过程
(3)熔融:对于各种状态的物质,熔融的含义不同
对于常温下是固体的物质(如NaCl,KNO3),熔融态就是指加热至熔化的状态;
对于常温下是液体的物质(如酒精,硫酸),熔融态是指纯液态的状态;
对于常温下是气体的物质(如HCl,NH3),熔融态是指气体液化后的形式。
剖析电解质定义中的关键词:
教学过程
剖析电解质定义中的关键词:
判断:CO2是不是电解质?
CO2不属于电解质。因为CO2溶于水后导电的物质已经不是CO2而是碳酸。
(4)导电是指自身能够导电,而不是发生化学反应才导电。
类似的物质还包括SO2,SO3,NO2,NH3
SO2+H2O=H2SO3; SO3+H2O=H2SO4
3NO2+H2O=2HNO3+NO; NH3+H2O=NH3·H2O
教学过程
常见电解质
酸,如HCl、H2SO4、HNO3、CH3COOH、H2CO3等
碱,如NaOH、Ba(OH)2、NH3·H2O
盐,如NaCl、Na2SO4、BaSO4、CaCO3、AgCl等
活泼金属氧化物,如Na2O、CaO等
水
教学过程
活动五:酸、碱、盐在水溶液中的电离及表示方法
电解质的电离可以用电离方程式表示(为简便起见,一般仍用离子符号表示水合离子)。
(3) 原子团不能拆: 例如NO3-、SO42-、OH-、 NH4+、CO32-等不能拆。
(4) 构成物质的原子或原子团的个数在书写成离子时为系数。
(5) 电荷守恒:电离方程式左右两边正负电荷之和相等。
(6) 质量守恒:即方程式两边原子种类和个数必须相等
(1) 强酸、强碱、盐(大部分)用“=”号,弱酸、弱碱用“ ”号;
(2) 式子左边是化学式,右边是离子符号。
1、电解质电离方程式书写的注意事项
教学过程
1. 强酸、强碱的电离
强酸
强碱
(1)一步、完全电离
(2)用“ ”
教学过程
(1)一元弱酸,一步电离;多元弱酸分步电离,第一步为主
(2)一元弱碱、多元碱均一步电离
2. 弱酸、弱碱的电离(用“ ”)
CH3COOH
H+ + CH3COO—
NH3·H2O
NH4+ + OH—
H2CO3
H+ + HCO3 —
HCO3 —
H+ + CO32 —
Mg2+ + 2OH —
Mg(OH)2
第一步(主要)
第二步
一元弱酸
多元弱酸
一元弱碱
多元弱碱
教学过程
3、盐的电离
FeCl3 Fe3++3Cl-
NaCl Na++ Cl-
(2)酸式盐的电离(与电离条件有关):
①强酸的酸式盐
a、水溶液:
NaHSO4 Na++HSO4-
b、熔融状态:
NaHSO4 Na++H++SO42-
强电解质
弱电解质
(1)正盐的电离:一步电离,若盐为强电解质,用“=”;
若为弱电解质用 “ ”
(CH3COO)2Pb 2CH3COO- + Pb2+
教学过程
②弱酸的酸式盐
a、水溶液:
NaHCO3 Na++HCO3-
b、熔融状态:
NaHCO3 Na++H CO3-
教学过程
例:写出HCl、H2SO4、HNO3 、NaOH、KOH、Ba(OH)2、NaCl、K2SO4和NH4NO3的电离方程式:
HCl =
H+ +Cl-
H2SO4 =
2H++SO42-
HNO3 =
H+ +NO3-
酸:电离时生成的阳离子全部是氢离子(H+)的化合物叫做酸。
HCl+H2O=H3O++Cl-能表示盐酸的电离方程式吗?
课本P15注标:①氢原子失去电子后。剩余1个质子构成的核,即氢离子。氢离子是“裸露”的质子,半径很小,易与水分子结合成水合氢离子,通常用H3O+表示。为了简便,也常把H3O+”写作H+ 。
教学过程
电离时生成的阴离子全部是氢氧根离子(OH-)的化合物叫做碱。
NaOH =
OH- +Na+
KOH =
OH- +K+
Ba(OH)2 =
2OH-+Ba 2+
【思考与讨论】请参考酸的本质,尝试从电离的角度概括出碱的本质。
NaCl =
Na+ + Cl -
K2SO4 =
2K+ + SO4 2-
NH4NO3 =
NH4+ + NO3-
电离时能生成金属阳离子(或者NH4+)和酸根阴离子 的化合物叫做盐。
教学过程
例:已知,水溶液中,强酸的酸式根能完全解离, 而弱酸的酸式根不能完全解离。书写以下物质的电离方程式。
NaHCO3 NaHSO4
NaHSO4 = Na+ +H+ + SO42-
NaHCO3 = Na+ +HCO3-
思考:NaHSO4溶于水时能电离出H+,NaHSO4属于酸吗?
不是。电离时生成的阳离子不全部是氢离子(H+)、还有Na+
课堂练习
1、下表是常见的几种酸、碱、盐在水溶液中电离出的离子的情况,根据表中信息分析正确的是( )
溶质 酸 盐 碱
HCl H2SO4 NaCl NaHSO4 NH4Cl NaOH NH3·H2O
电离出的离子 H+、Cl- H+、SO Na+、Cl- Na+、H+、SO NH、Cl- Na+、OH- NH、OH
A.在水溶液中电离出H+的物质一定是酸
B.在水溶液中电离出金属阳离子和酸根阴离子的物质一定是盐
C.盐在水溶液中电离出来的阳离子一定是金属离子
D.碱在水溶液中电离出的离子一定是金属阳离子和OH-
答案 B
解析 NaHSO4在水溶液中能电离出H+,但不属于酸,A错误;NH4Cl属于盐,在水溶液中电离出的阳离子为NH4(+),而不是金属阳离子,C错误;NH3·H2O属于碱,在水溶液中电离出的阳离子是NH4(+),而不是金属阳离子,D错误。
课堂练习
2、下列在水溶液中的电离方程式,错误的是 ( )
教学过程
3、下列说法正确的是( )
A.将AgCl放入水中不能导电,故AgCl不是电解质
B.CO2溶于水得到的溶液能导电,所以CO2是电解质
C.金属能导电,所以金属是电解质
D.固态的NaCl不导电,熔融态的NaCl能导电,NaCl是电解质
答案D AgCl是电解质,故A错误;电解质本身能电离出自由移动的离子,CO2不能电离出自由移动的离子,CO2是非电解质,故B错误;金属是单质,既不是电解质也不是非电解质,故C错误;熔融态的NaCl能导电,NaCl是电解质,故D正确。
教学过程
活动六:电解质溶液导电能力的影响因素
1、自由移动离子的浓度大小:浓度越大,导电能力越强
单一变量
2、自由移动离子所带电荷数:多带电荷数越多,导电能力越强
例1:2mol/L的NaOH溶液与4 mol / L的NaCl溶液,后者的离子浓度较大,所以导电能力较强。
例2:2mol/L的NaCl溶液与2mol/L的MgSO4溶液,二者的离子浓度相同,但后者的离子所带的电荷数较多,所以后者的导电能力强。
课堂练习
已知:CO2+Ca(OH)2===CaCO3↓+H2O,CaCO3+CO2+H2O===Ca(HCO3)2,Ca(HCO3)2易溶于水。试根据如图所示装置回答下列问题:
(1)通入CO2前,灯泡________(填“亮”或“不亮”)
(2)开始通入CO2时,灯泡的亮度_____________________________
(3)继续通入过量的CO2,灯泡的亮度_________________________
(4)下列四个图中,能比较准确地反映出溶液的导电能力和通入CO2气体量的关系的是(x轴表示CO2通入的量,y轴表示导电能力)________
课堂练习
答案、(1)亮 (2)先变暗后熄灭 (3)熄灭后又逐渐变亮 (4)D
解析:(1)通入CO2前灯泡亮,因为Ca(OH)2溶于水后完全电离出离子,溶液中离子的浓度比较大。(2)灯泡先变暗后熄灭,因为发生反应:CO2+Ca(OH)2===CaCO3↓+H2O,溶液中自由移动的离子减少。(3)灯泡熄灭后又逐渐变亮:CaCO3+CO2+H2O===Ca(HCO3)2,Ca(HCO3)2完全电离出自由移动的离子,溶液中离子浓度增大。(4)由于通入CO2后溶液中自由移动的离子的浓度逐渐减小,所以一开始导电能力逐渐下降,随着反应的进行,离子浓度逐渐增大,导电能力又逐渐增大,所以选D。
课堂练习
氢氧化钡钡与硫酸反应过程中溶液导电性变化实验
课堂练习
思考:
(1)用一定量的硫酸溶液进行导电性实验,发现灯泡较亮。向其中逐滴加入氢氧化钡溶液,发现灯泡亮度先逐渐变暗,后又逐渐变亮。请说明出现此现象的原因。
(1)硫酸是电解质,电离产生了较多的H+和SO42-,所以灯泡较亮,加入氢氧化钡后,溶液中的H+和SO42-与氢氧化钡电离出的Ba2+和OH-反应生成BaSO4和H2O,溶液中离子浓度减小,灯泡变暗。反应完毕后,继续滴加Ba(OH)2溶液,由于Ba(OH)2电离出Ba2+和OH-,灯泡又逐渐变亮。
谢 谢 观 看!
课时1 电解质的电离
第一章 物质及其变化
第二节 离子反应
学习目标
1.能从宏观和微观的角度理解电解质的概念,了解常见的电解质,会正确识别判断电解质与非电解质。
2.认识酸、碱、盐在水溶液中或熔融状态下能发生电离,并会用电离方程式表示。能从电离的角度认识酸、碱、盐的概念及其各自的通性。
新课导入
救援触电时,为什么要用干的木棍?
为什么湿的手更容易触电?
查阅资料,这主要是因为人皮肤中汗液有盐分(主要成分是NaCl),这样湿手就成了导电体,此时触电是十分危险的。
教学过程
物质 实验现象 导电性
NaCl溶液
提出问题:为什么NaCl溶液能导电呢?
灯泡亮
能够导电
活动一:设计实验证明NaCl溶液能导电
教学过程
课本P13:严格的说,蒸馏水也能导电,只是导电能力非常弱,用上述实验装置不能测出。
不能导电
不能导电
灯泡不亮
灯泡不亮
NaCl溶液
水
+
NaCl
猜想1:水能导电
猜想2:NaCl能导电
猜想3:水和NaCl共同作用能导电
实验序号 物质 实验现象 导电性
1 NaCl溶液 灯泡亮 能够导电
2 蒸馏水
3 NaCl固体
结论:水和NaCl共同作用能导电
活动二:探究NaCl溶液能导电的原因
教学过程
【思考】物质能够导电的原因是什么?
金属:存在自由移动的电子,通电条件下,自由移动的电子定向移动
猜想:在NaCl溶液中存在自由移动的微粒,在通电的作用下,带电微粒定向移动,则产生了电流.
【思考】 NaCl固体不导电, NaCl溶液为什么能导电?
教学过程
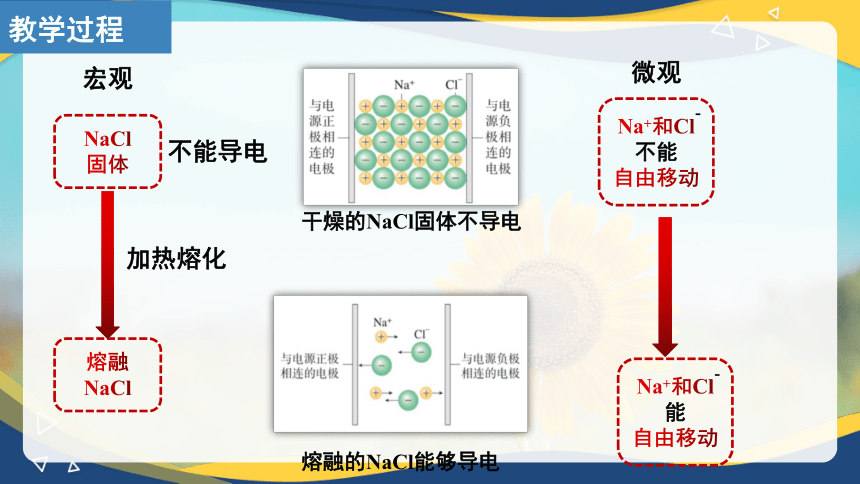
NaCl固体在水中的溶解和形成水合离子示意图
教学过程
教学过程
NaCl
固体
NaCl
溶液
加水溶解
能够导电
微观
宏观
不能导电
Na+和Cl
能
自由移动
-
Na+和Cl
不能
自由移动
-
教学过程
熔融NaCl导电性实验
实验序号 物质 实验现象 导电性 微观解释
(猜想)
1 NaCl溶液 灯泡亮 能够导电 有自由移动的带电粒子
4 熔融NaCl
能够导电
有自由移动的带电粒子
灯泡亮
教学过程
熔融NaCl
加热熔化
微观
宏观
NaCl
固体
不能导电
Na+和Cl
能
自由移动
-
Na+和Cl
不能
自由移动
-
干燥的NaCl固体不导电
熔融的NaCl能够导电
教学过程
实验序号 物质 实验现象 导电性 微观解释
1 NaCl 溶液 灯泡亮 能够导电 有自由移动的
带电粒子
2 蒸馏水 灯泡不亮 不能导电
3 NaCl 固体 灯泡不亮 不能导电
4 熔融NaCl 灯泡亮 能够导电 有自由移动的
带电粒子
湿手不要摸电器
干燥绝缘要牢记
无大量
带电粒子
有带电粒子,
不能自由移动
人的手上常会沾有NaCl(汗液的成分之一),有时也会沾有其他电解质,当遇到水时,形成电解质溶液。电解质溶液能够导电,因此,湿手直接接触电源时容易发生触电事故。
教学过程
活动三:物质的导电性
探究HCl、H2SO4、KOH、Ca(OH)2、蒸馏水、酒精的导电性。
教学过程
【思考与讨论】结合教材P14页最后自然段,思考下列物质哪些能导电,哪些本身不能导电,但在一定条件下可以导电?
硫酸溶液、Cu、熔融NaOH、MgCl2、KOH固体、H2SO4 、Fe2(SO4)3、
Na2CO3、硫酸钡、蔗糖、酒精。
本身就能导电
硫酸溶液、Cu、熔融NaOH
本身不能导电,一定条件(溶于水或熔融状态)才能导电
MgCl2、KOH固体、H2SO4 、Fe2(SO4)3、Na2CO3、硫酸钡
蔗糖、酒精(忽略水导电)
本身不能导电,一定条件(溶于水或熔融状态)也不能导电
物质的导电性
教学过程
现有以下物质:①NaCl晶体 ②液态HCl ③CaCO3固体
④熔融KCl ⑤蔗糖 ⑥铜 ⑦CO2 ⑧H2SO4 ⑨KOH固体
⑩氨水 液氨 盐酸
以上物质中能导电的是________。
①③④⑥⑨
教学过程
活动四:电离和电解质
物质溶于水或受热熔化时,离解成能够自由移动的离子的过程。
电离:
物质
离解
水溶液
或熔融
自由移动的离子
电离
化合物
电解质
在水溶液或熔融状态下能够导电的化合物。
电离不需要通电
教学过程
判断题:
铜能够导电,所以是电解质;
氯化钠的水溶液能够导电,所以食盐水是电解质;
盐酸是电解质
硫酸是电解质
剖析电解质定义中的关键词:
(1)化合物:单质和混合物不属于化合物,所以不是电解质。
(×)
(×)
(×):因为盐酸是混合物,只能说氯化氢是电解质。
(√):硫酸是纯净物
教学过程
(2)或:两个条件满足其一即可;
判断:
固体氯化钠不导电,所以氯化钠不是电解质;
NaCl在水溶液和熔融状态下都能导电,所以NaCl是电解质;
液态HCl不导电,所以HCl不是电解质;
BaSO4难溶于水,其水溶液不导电,所以BaSO4不是电解质;
(×)
( √ )
(×)
(×)
剖析电解质定义中的关键词:
教学过程
(3)熔融:对于各种状态的物质,熔融的含义不同
对于常温下是固体的物质(如NaCl,KNO3),熔融态就是指加热至熔化的状态;
对于常温下是液体的物质(如酒精,硫酸),熔融态是指纯液态的状态;
对于常温下是气体的物质(如HCl,NH3),熔融态是指气体液化后的形式。
剖析电解质定义中的关键词:
教学过程
剖析电解质定义中的关键词:
判断:CO2是不是电解质?
CO2不属于电解质。因为CO2溶于水后导电的物质已经不是CO2而是碳酸。
(4)导电是指自身能够导电,而不是发生化学反应才导电。
类似的物质还包括SO2,SO3,NO2,NH3
SO2+H2O=H2SO3; SO3+H2O=H2SO4
3NO2+H2O=2HNO3+NO; NH3+H2O=NH3·H2O
教学过程
常见电解质
酸,如HCl、H2SO4、HNO3、CH3COOH、H2CO3等
碱,如NaOH、Ba(OH)2、NH3·H2O
盐,如NaCl、Na2SO4、BaSO4、CaCO3、AgCl等
活泼金属氧化物,如Na2O、CaO等
水
教学过程
活动五:酸、碱、盐在水溶液中的电离及表示方法
电解质的电离可以用电离方程式表示(为简便起见,一般仍用离子符号表示水合离子)。
(3) 原子团不能拆: 例如NO3-、SO42-、OH-、 NH4+、CO32-等不能拆。
(4) 构成物质的原子或原子团的个数在书写成离子时为系数。
(5) 电荷守恒:电离方程式左右两边正负电荷之和相等。
(6) 质量守恒:即方程式两边原子种类和个数必须相等
(1) 强酸、强碱、盐(大部分)用“=”号,弱酸、弱碱用“ ”号;
(2) 式子左边是化学式,右边是离子符号。
1、电解质电离方程式书写的注意事项
教学过程
1. 强酸、强碱的电离
强酸
强碱
(1)一步、完全电离
(2)用“ ”
教学过程
(1)一元弱酸,一步电离;多元弱酸分步电离,第一步为主
(2)一元弱碱、多元碱均一步电离
2. 弱酸、弱碱的电离(用“ ”)
CH3COOH
H+ + CH3COO—
NH3·H2O
NH4+ + OH—
H2CO3
H+ + HCO3 —
HCO3 —
H+ + CO32 —
Mg2+ + 2OH —
Mg(OH)2
第一步(主要)
第二步
一元弱酸
多元弱酸
一元弱碱
多元弱碱
教学过程
3、盐的电离
FeCl3 Fe3++3Cl-
NaCl Na++ Cl-
(2)酸式盐的电离(与电离条件有关):
①强酸的酸式盐
a、水溶液:
NaHSO4 Na++HSO4-
b、熔融状态:
NaHSO4 Na++H++SO42-
强电解质
弱电解质
(1)正盐的电离:一步电离,若盐为强电解质,用“=”;
若为弱电解质用 “ ”
(CH3COO)2Pb 2CH3COO- + Pb2+
教学过程
②弱酸的酸式盐
a、水溶液:
NaHCO3 Na++HCO3-
b、熔融状态:
NaHCO3 Na++H CO3-
教学过程
例:写出HCl、H2SO4、HNO3 、NaOH、KOH、Ba(OH)2、NaCl、K2SO4和NH4NO3的电离方程式:
HCl =
H+ +Cl-
H2SO4 =
2H++SO42-
HNO3 =
H+ +NO3-
酸:电离时生成的阳离子全部是氢离子(H+)的化合物叫做酸。
HCl+H2O=H3O++Cl-能表示盐酸的电离方程式吗?
课本P15注标:①氢原子失去电子后。剩余1个质子构成的核,即氢离子。氢离子是“裸露”的质子,半径很小,易与水分子结合成水合氢离子,通常用H3O+表示。为了简便,也常把H3O+”写作H+ 。
教学过程
电离时生成的阴离子全部是氢氧根离子(OH-)的化合物叫做碱。
NaOH =
OH- +Na+
KOH =
OH- +K+
Ba(OH)2 =
2OH-+Ba 2+
【思考与讨论】请参考酸的本质,尝试从电离的角度概括出碱的本质。
NaCl =
Na+ + Cl -
K2SO4 =
2K+ + SO4 2-
NH4NO3 =
NH4+ + NO3-
电离时能生成金属阳离子(或者NH4+)和酸根阴离子 的化合物叫做盐。
教学过程
例:已知,水溶液中,强酸的酸式根能完全解离, 而弱酸的酸式根不能完全解离。书写以下物质的电离方程式。
NaHCO3 NaHSO4
NaHSO4 = Na+ +H+ + SO42-
NaHCO3 = Na+ +HCO3-
思考:NaHSO4溶于水时能电离出H+,NaHSO4属于酸吗?
不是。电离时生成的阳离子不全部是氢离子(H+)、还有Na+
课堂练习
1、下表是常见的几种酸、碱、盐在水溶液中电离出的离子的情况,根据表中信息分析正确的是( )
溶质 酸 盐 碱
HCl H2SO4 NaCl NaHSO4 NH4Cl NaOH NH3·H2O
电离出的离子 H+、Cl- H+、SO Na+、Cl- Na+、H+、SO NH、Cl- Na+、OH- NH、OH
A.在水溶液中电离出H+的物质一定是酸
B.在水溶液中电离出金属阳离子和酸根阴离子的物质一定是盐
C.盐在水溶液中电离出来的阳离子一定是金属离子
D.碱在水溶液中电离出的离子一定是金属阳离子和OH-
答案 B
解析 NaHSO4在水溶液中能电离出H+,但不属于酸,A错误;NH4Cl属于盐,在水溶液中电离出的阳离子为NH4(+),而不是金属阳离子,C错误;NH3·H2O属于碱,在水溶液中电离出的阳离子是NH4(+),而不是金属阳离子,D错误。
课堂练习
2、下列在水溶液中的电离方程式,错误的是 ( )
教学过程
3、下列说法正确的是( )
A.将AgCl放入水中不能导电,故AgCl不是电解质
B.CO2溶于水得到的溶液能导电,所以CO2是电解质
C.金属能导电,所以金属是电解质
D.固态的NaCl不导电,熔融态的NaCl能导电,NaCl是电解质
答案D AgCl是电解质,故A错误;电解质本身能电离出自由移动的离子,CO2不能电离出自由移动的离子,CO2是非电解质,故B错误;金属是单质,既不是电解质也不是非电解质,故C错误;熔融态的NaCl能导电,NaCl是电解质,故D正确。
教学过程
活动六:电解质溶液导电能力的影响因素
1、自由移动离子的浓度大小:浓度越大,导电能力越强
单一变量
2、自由移动离子所带电荷数:多带电荷数越多,导电能力越强
例1:2mol/L的NaOH溶液与4 mol / L的NaCl溶液,后者的离子浓度较大,所以导电能力较强。
例2:2mol/L的NaCl溶液与2mol/L的MgSO4溶液,二者的离子浓度相同,但后者的离子所带的电荷数较多,所以后者的导电能力强。
课堂练习
已知:CO2+Ca(OH)2===CaCO3↓+H2O,CaCO3+CO2+H2O===Ca(HCO3)2,Ca(HCO3)2易溶于水。试根据如图所示装置回答下列问题:
(1)通入CO2前,灯泡________(填“亮”或“不亮”)
(2)开始通入CO2时,灯泡的亮度_____________________________
(3)继续通入过量的CO2,灯泡的亮度_________________________
(4)下列四个图中,能比较准确地反映出溶液的导电能力和通入CO2气体量的关系的是(x轴表示CO2通入的量,y轴表示导电能力)________
课堂练习
答案、(1)亮 (2)先变暗后熄灭 (3)熄灭后又逐渐变亮 (4)D
解析:(1)通入CO2前灯泡亮,因为Ca(OH)2溶于水后完全电离出离子,溶液中离子的浓度比较大。(2)灯泡先变暗后熄灭,因为发生反应:CO2+Ca(OH)2===CaCO3↓+H2O,溶液中自由移动的离子减少。(3)灯泡熄灭后又逐渐变亮:CaCO3+CO2+H2O===Ca(HCO3)2,Ca(HCO3)2完全电离出自由移动的离子,溶液中离子浓度增大。(4)由于通入CO2后溶液中自由移动的离子的浓度逐渐减小,所以一开始导电能力逐渐下降,随着反应的进行,离子浓度逐渐增大,导电能力又逐渐增大,所以选D。
课堂练习
氢氧化钡钡与硫酸反应过程中溶液导电性变化实验
课堂练习
思考:
(1)用一定量的硫酸溶液进行导电性实验,发现灯泡较亮。向其中逐滴加入氢氧化钡溶液,发现灯泡亮度先逐渐变暗,后又逐渐变亮。请说明出现此现象的原因。
(1)硫酸是电解质,电离产生了较多的H+和SO42-,所以灯泡较亮,加入氢氧化钡后,溶液中的H+和SO42-与氢氧化钡电离出的Ba2+和OH-反应生成BaSO4和H2O,溶液中离子浓度减小,灯泡变暗。反应完毕后,继续滴加Ba(OH)2溶液,由于Ba(OH)2电离出Ba2+和OH-,灯泡又逐渐变亮。
谢 谢 观 看!
