【高效备课】2024人教新版九上化学--4.3.3 物质组成的定量认识(教学设计)
文档属性
| 名称 | 【高效备课】2024人教新版九上化学--4.3.3 物质组成的定量认识(教学设计) |  | |
| 格式 | docx | ||
| 文件大小 | 835.3KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-22 22:15:58 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
【2024人教新版九上化学高效完全备课】(教学设计)
4.3.3物质组成的表示 第3课时 物质组成的定量认识
新课导入
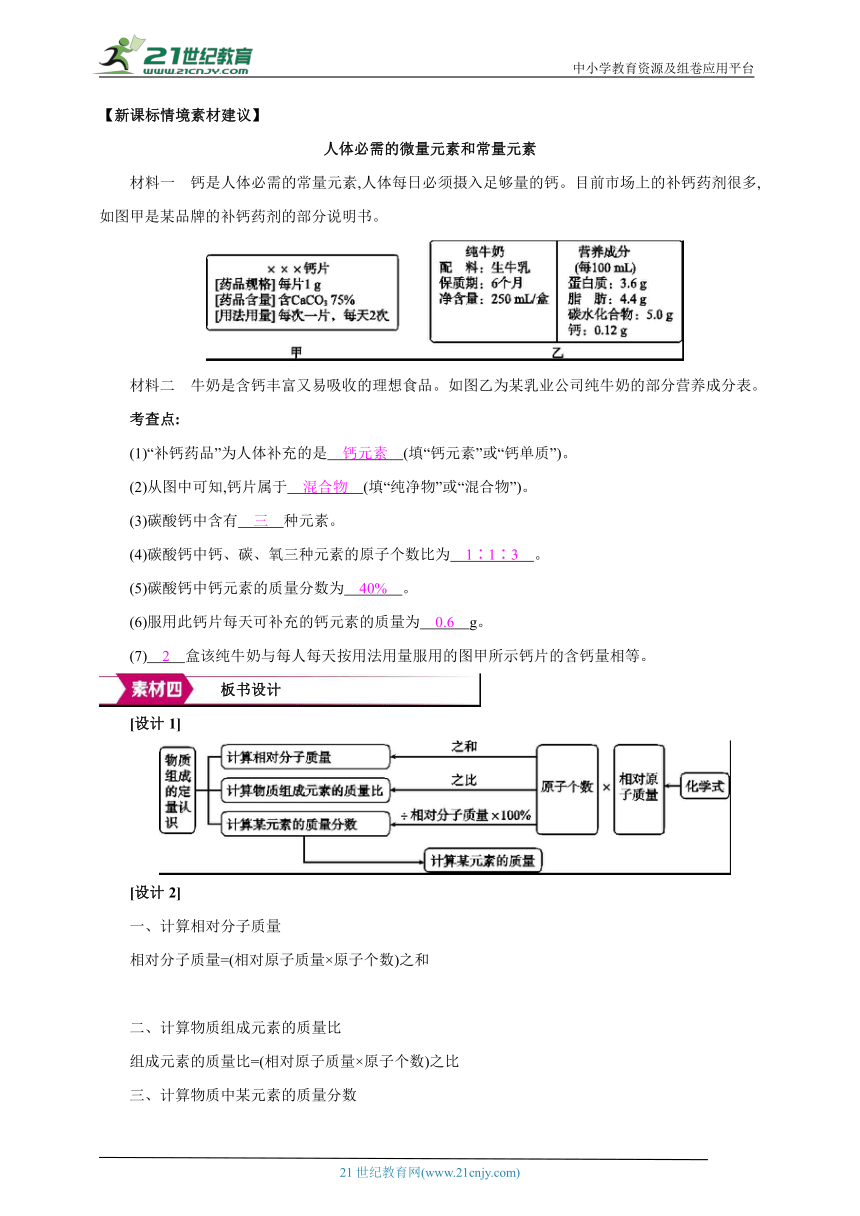
[情境导入] 展示氯化铵、尿素、硫酸铵三种物质的化学式、相对分子质量和含量。
思考:分子量、氮含量是怎么计算出来的
教学建言
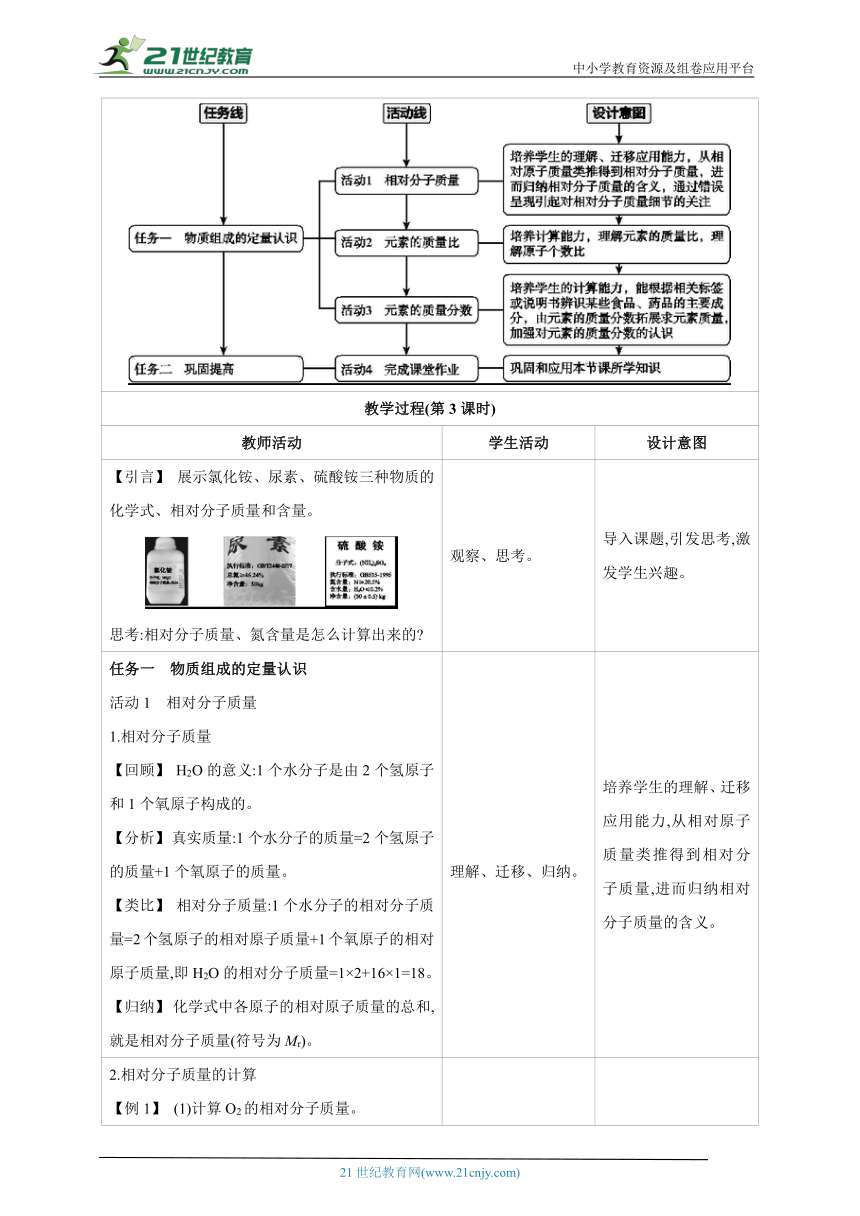
[建言1] 根据化学式计算的基本计算题型
提醒学生抓住化学式中的两个量:相对原子质量和原子个数进行计算。
在教学中应注意以下两点:
(1)强调相对原子质量乘原子个数,原子个数是1时也乘,防止漏乘。
例如:二氧化碳的相对分子质量=12×1+16×2=44。
(2)要注意计算格式,所有求质量分数的题目最后都要乘100%。
例如:计算NH4NO3中氮元素的质量分数。
正确的格式是氮元素的质量分数=×100%。
再代入数据求算。
[建言2] 标签中的化学式计算
首先,牢固掌握根据化学式计算的基本题型;其次,通过创设情境展示一些食品和药品的标签,让学生分析从标签中能获取哪些信息,教给他们查看标签的方法;最后,通过典型的标签式例题进行针对性练习。
情境素材建议
【新课标情境素材建议】
人体必需的微量元素和常量元素
材料一 钙是人体必需的常量元素,人体每日必须摄入足够量的钙。目前市场上的补钙药剂很多,如图甲是某品牌的补钙药剂的部分说明书。
材料二 牛奶是含钙丰富又易吸收的理想食品。如图乙为某乳业公司纯牛奶的部分营养成分表。
考查点:
(1)“补钙药品”为人体补充的是 钙元素 (填“钙元素”或“钙单质”)。
(2)从图中可知,钙片属于 混合物 (填“纯净物”或“混合物”)。
(3)碳酸钙中含有 三 种元素。
(4)碳酸钙中钙、碳、氧三种元素的原子个数比为 1∶1∶3 。
(5)碳酸钙中钙元素的质量分数为 40% 。
(6)服用此钙片每天可补充的钙元素的质量为 0.6 g。
(7) 2 盒该纯牛奶与每人每天按用法用量服用的图甲所示钙片的含钙量相等。
板书设计
[设计1]
[设计2]
一、计算相对分子质量
相对分子质量=(相对原子质量×原子个数)之和
二、计算物质组成元素的质量比
组成元素的质量比=(相对原子质量×原子个数)之比
三、计算物质中某元素的质量分数
某元素的质量分数=×100%
四、计算某元素的质量
某元素的质量=化合物的质量×化合物中该元素的质量分数
第3课时 物质组成的定量认识
教学设计
教学分析: 本课时教材中,先描述了相对分子质量的含义,然后分别计算相对分子质量、物质组成元素的质量比和物质中某元素的质量分数,新课程标准对这些内容要求不高,故教学中不宜任意扩大与加深,本课时只增加了化合物中求某元素质量的计算。 在学习有关相对分子质量的计算之后,可以引导学生查看药品、食品等商品的标签或说明书,了解有关物质的成分或纯度,使其认识到本课时的知识在日常生活中极其重要,化学与生活联系紧密。
教学目标: 1.通过H2O的相对分子质量的学习,了解相对分子质量的含义。 2.通过H2O的相关计算的学习,能根据化学式计算物质的相对分子质量,并能利用相对原子质量和相对分子质量计算物质组成。 3.能看懂某些商品标签或说明书上标识的物质成分,并能分析比较相应物质的含量。
教学重点:计算相对分子质量、物质组成元素的质量比和物质中某元素的质量分数。
教学难点:根据标签或说明书进行有关化学式的计算。
教学思路:
教学过程(第3课时)
教师活动 学生活动 设计意图
【引言】 展示氯化铵、尿素、硫酸铵三种物质的化学式、相对分子质量和含量。 思考:相对分子质量、氮含量是怎么计算出来的 观察、思考。 导入课题,引发思考,激发学生兴趣。
任务一 物质组成的定量认识 活动1 相对分子质量 1.相对分子质量 【回顾】 H2O的意义:1个水分子是由2个氢原子和1个氧原子构成的。 【分析】 真实质量:1个水分子的质量=2个氢原子的质量+1个氧原子的质量。 【类比】 相对分子质量:1个水分子的相对分子质量=2个氢原子的相对原子质量+1个氧原子的相对原子质量,即H2O的相对分子质量=1×2+16×1=18。 【归纳】 化学式中各原子的相对原子质量的总和,就是相对分子质量(符号为Mr)。 理解、迁移、归纳。 培养学生的理解、迁移应用能力,从相对原子质量类推得到相对分子质量,进而归纳相对分子质量的含义。
2.相对分子质量的计算 【例1】 (1)计算O2的相对分子质量。 格式1:解:O2的相对分子质量=16×2=32。 格式2:解:Mr(O2)=16×2=32。 错误格式:解:O2=16×2=32 g。 (2)计算H2O的相对分子质量。 解:H2O的相对分子质量=1×2+16×1=18。 错误格式:解:Mr(H2O)=(1+16)×2=34。 3.牛刀小试 (1)判断图中氯化铵的相对分子质量是否正确。 (2)求H2O2、Ca(OH)2的相对分子质量。 4.根据化学式计算相对分子质量时注意: (1)正确书写化学式。 (2)准确理解化学式中数字的含义。 (3)“元素之间”用“+”号,“元素与对应右下角数字之间”用“×”号。 (4)单位是1,不是“g”。 活动2 元素的质量比 1.【例2】 计算H2O中各元素的质量比。 解题依据:物质组成元素的质量比等于物质化学式中各元素的相对原子质量与其原子个数乘积之比。 方法一: 解:H2O中氢元素和氧元素的质量比为(1×2)∶16=2∶16=1∶8。 方法二: 解:m(H)∶m(O)=(1×2)∶16=2∶16=1∶8。 错误格式: 解:H2∶O=(1×2)∶16=2∶16=1∶8。 2.练一练 计算下列物质中各元素的质量比。 (1)Fe2O3 (2)H2SO4 (3)NH4NO3 (4)(NH4)2SO4 (5)Ca(OH)2 (6)CuSO4·5H2O 注意:在某些物质的化学式中,同种元素并未写在一起时,要注意原子个数。 3.区分原子个数比与元素质量比 【例3】 Fe2O3中铁原子与氧原子的个数比是多少 解:Fe2O3中铁原子与氧原子的个数比为2∶3。 对比分析。 完成学案。 理解、计算,完成学案。 通过错误呈现引起对相对分子质量细节的关注。 培养计算能力,理解元素的质量比。 理解原子个数比。
活动3 元素的质量分数 1.【例4】 计算H2O中氢元素的质量分数。 解题依据:物质中某元素的质量分数= ×100%。 解:H2O中氢元素的质量分数= ×100%=×100%=11.1%。 答:H2O中氢元素的质量分数为11.1%。 2.通过计算判断图中氮元素的含量是否可能符合实际。 3.牛刀小试 (1)计算CaCO3中钙元素的质量分数。 (2)计算NH4NO3中氮元素的质量分数。 4.【例5】 计算60 g硫酸镁(MgSO4)中氧元素的质量。(结果保留整数) 解:MgSO4中氧元素的质量分数为 ×100%=53.3%。 60 g MgSO4中氧元素的质量为60 g×53.3%=32 g。 答:60 g硫酸镁中氧元素的质量为32 g。 5.展示学生单元前收集到的食品或药品的相关信息,提取化学式等有关信息,请你编写一道题并进行相关的计算。 物质名称主要成分 的化学式相对分 子质量含量发酵粉NaHCO384%葡萄糖酸 锌口服液C12H22O14Zn
【课堂小结】 理解、计算,完成学案。 培养学生的计算能力,能根据相关标签或说明书辨识某些食品、药品的主要成分。 由元素质量分数拓展求元素质量,加强对元素质量分数的认识。
任务二 巩固提高 活动4 完成课堂作业(见学案) 完成相关练习。 巩固和应用本节课所学知识。
教学反思:
本课时的内容理论性较强,没有实验来吸引学生,因此教学中采取“发现-讨论、分析-归纳总结”的模式,保持学生学习的专注度,另外结合生活中常见的商品标签或说明书引入真实情境,以活跃课堂,调动学生学习积极性。
配套学案
详见电子资源
配套教学设计PPT
详见电子资源
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
【2024人教新版九上化学高效完全备课】(教学设计)
4.3.3物质组成的表示 第3课时 物质组成的定量认识
新课导入
[情境导入] 展示氯化铵、尿素、硫酸铵三种物质的化学式、相对分子质量和含量。
思考:分子量、氮含量是怎么计算出来的
教学建言
[建言1] 根据化学式计算的基本计算题型
提醒学生抓住化学式中的两个量:相对原子质量和原子个数进行计算。
在教学中应注意以下两点:
(1)强调相对原子质量乘原子个数,原子个数是1时也乘,防止漏乘。
例如:二氧化碳的相对分子质量=12×1+16×2=44。
(2)要注意计算格式,所有求质量分数的题目最后都要乘100%。
例如:计算NH4NO3中氮元素的质量分数。
正确的格式是氮元素的质量分数=×100%。
再代入数据求算。
[建言2] 标签中的化学式计算
首先,牢固掌握根据化学式计算的基本题型;其次,通过创设情境展示一些食品和药品的标签,让学生分析从标签中能获取哪些信息,教给他们查看标签的方法;最后,通过典型的标签式例题进行针对性练习。
情境素材建议
【新课标情境素材建议】
人体必需的微量元素和常量元素
材料一 钙是人体必需的常量元素,人体每日必须摄入足够量的钙。目前市场上的补钙药剂很多,如图甲是某品牌的补钙药剂的部分说明书。
材料二 牛奶是含钙丰富又易吸收的理想食品。如图乙为某乳业公司纯牛奶的部分营养成分表。
考查点:
(1)“补钙药品”为人体补充的是 钙元素 (填“钙元素”或“钙单质”)。
(2)从图中可知,钙片属于 混合物 (填“纯净物”或“混合物”)。
(3)碳酸钙中含有 三 种元素。
(4)碳酸钙中钙、碳、氧三种元素的原子个数比为 1∶1∶3 。
(5)碳酸钙中钙元素的质量分数为 40% 。
(6)服用此钙片每天可补充的钙元素的质量为 0.6 g。
(7) 2 盒该纯牛奶与每人每天按用法用量服用的图甲所示钙片的含钙量相等。
板书设计
[设计1]
[设计2]
一、计算相对分子质量
相对分子质量=(相对原子质量×原子个数)之和
二、计算物质组成元素的质量比
组成元素的质量比=(相对原子质量×原子个数)之比
三、计算物质中某元素的质量分数
某元素的质量分数=×100%
四、计算某元素的质量
某元素的质量=化合物的质量×化合物中该元素的质量分数
第3课时 物质组成的定量认识
教学设计
教学分析: 本课时教材中,先描述了相对分子质量的含义,然后分别计算相对分子质量、物质组成元素的质量比和物质中某元素的质量分数,新课程标准对这些内容要求不高,故教学中不宜任意扩大与加深,本课时只增加了化合物中求某元素质量的计算。 在学习有关相对分子质量的计算之后,可以引导学生查看药品、食品等商品的标签或说明书,了解有关物质的成分或纯度,使其认识到本课时的知识在日常生活中极其重要,化学与生活联系紧密。
教学目标: 1.通过H2O的相对分子质量的学习,了解相对分子质量的含义。 2.通过H2O的相关计算的学习,能根据化学式计算物质的相对分子质量,并能利用相对原子质量和相对分子质量计算物质组成。 3.能看懂某些商品标签或说明书上标识的物质成分,并能分析比较相应物质的含量。
教学重点:计算相对分子质量、物质组成元素的质量比和物质中某元素的质量分数。
教学难点:根据标签或说明书进行有关化学式的计算。
教学思路:
教学过程(第3课时)
教师活动 学生活动 设计意图
【引言】 展示氯化铵、尿素、硫酸铵三种物质的化学式、相对分子质量和含量。 思考:相对分子质量、氮含量是怎么计算出来的 观察、思考。 导入课题,引发思考,激发学生兴趣。
任务一 物质组成的定量认识 活动1 相对分子质量 1.相对分子质量 【回顾】 H2O的意义:1个水分子是由2个氢原子和1个氧原子构成的。 【分析】 真实质量:1个水分子的质量=2个氢原子的质量+1个氧原子的质量。 【类比】 相对分子质量:1个水分子的相对分子质量=2个氢原子的相对原子质量+1个氧原子的相对原子质量,即H2O的相对分子质量=1×2+16×1=18。 【归纳】 化学式中各原子的相对原子质量的总和,就是相对分子质量(符号为Mr)。 理解、迁移、归纳。 培养学生的理解、迁移应用能力,从相对原子质量类推得到相对分子质量,进而归纳相对分子质量的含义。
2.相对分子质量的计算 【例1】 (1)计算O2的相对分子质量。 格式1:解:O2的相对分子质量=16×2=32。 格式2:解:Mr(O2)=16×2=32。 错误格式:解:O2=16×2=32 g。 (2)计算H2O的相对分子质量。 解:H2O的相对分子质量=1×2+16×1=18。 错误格式:解:Mr(H2O)=(1+16)×2=34。 3.牛刀小试 (1)判断图中氯化铵的相对分子质量是否正确。 (2)求H2O2、Ca(OH)2的相对分子质量。 4.根据化学式计算相对分子质量时注意: (1)正确书写化学式。 (2)准确理解化学式中数字的含义。 (3)“元素之间”用“+”号,“元素与对应右下角数字之间”用“×”号。 (4)单位是1,不是“g”。 活动2 元素的质量比 1.【例2】 计算H2O中各元素的质量比。 解题依据:物质组成元素的质量比等于物质化学式中各元素的相对原子质量与其原子个数乘积之比。 方法一: 解:H2O中氢元素和氧元素的质量比为(1×2)∶16=2∶16=1∶8。 方法二: 解:m(H)∶m(O)=(1×2)∶16=2∶16=1∶8。 错误格式: 解:H2∶O=(1×2)∶16=2∶16=1∶8。 2.练一练 计算下列物质中各元素的质量比。 (1)Fe2O3 (2)H2SO4 (3)NH4NO3 (4)(NH4)2SO4 (5)Ca(OH)2 (6)CuSO4·5H2O 注意:在某些物质的化学式中,同种元素并未写在一起时,要注意原子个数。 3.区分原子个数比与元素质量比 【例3】 Fe2O3中铁原子与氧原子的个数比是多少 解:Fe2O3中铁原子与氧原子的个数比为2∶3。 对比分析。 完成学案。 理解、计算,完成学案。 通过错误呈现引起对相对分子质量细节的关注。 培养计算能力,理解元素的质量比。 理解原子个数比。
活动3 元素的质量分数 1.【例4】 计算H2O中氢元素的质量分数。 解题依据:物质中某元素的质量分数= ×100%。 解:H2O中氢元素的质量分数= ×100%=×100%=11.1%。 答:H2O中氢元素的质量分数为11.1%。 2.通过计算判断图中氮元素的含量是否可能符合实际。 3.牛刀小试 (1)计算CaCO3中钙元素的质量分数。 (2)计算NH4NO3中氮元素的质量分数。 4.【例5】 计算60 g硫酸镁(MgSO4)中氧元素的质量。(结果保留整数) 解:MgSO4中氧元素的质量分数为 ×100%=53.3%。 60 g MgSO4中氧元素的质量为60 g×53.3%=32 g。 答:60 g硫酸镁中氧元素的质量为32 g。 5.展示学生单元前收集到的食品或药品的相关信息,提取化学式等有关信息,请你编写一道题并进行相关的计算。 物质名称主要成分 的化学式相对分 子质量含量发酵粉NaHCO384%葡萄糖酸 锌口服液C12H22O14Zn
【课堂小结】 理解、计算,完成学案。 培养学生的计算能力,能根据相关标签或说明书辨识某些食品、药品的主要成分。 由元素质量分数拓展求元素质量,加强对元素质量分数的认识。
任务二 巩固提高 活动4 完成课堂作业(见学案) 完成相关练习。 巩固和应用本节课所学知识。
教学反思:
本课时的内容理论性较强,没有实验来吸引学生,因此教学中采取“发现-讨论、分析-归纳总结”的模式,保持学生学习的专注度,另外结合生活中常见的商品标签或说明书引入真实情境,以活跃课堂,调动学生学习积极性。
配套学案
详见电子资源
配套教学设计PPT
详见电子资源
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
