广东省梅州市梅江区实验中学(人教版)化学九年级上册课件:第二单元 课题3 制取氧气(共29张PPT)
文档属性
| 名称 | 广东省梅州市梅江区实验中学(人教版)化学九年级上册课件:第二单元 课题3 制取氧气(共29张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-01-31 00:00:00 | ||
图片预览





文档简介
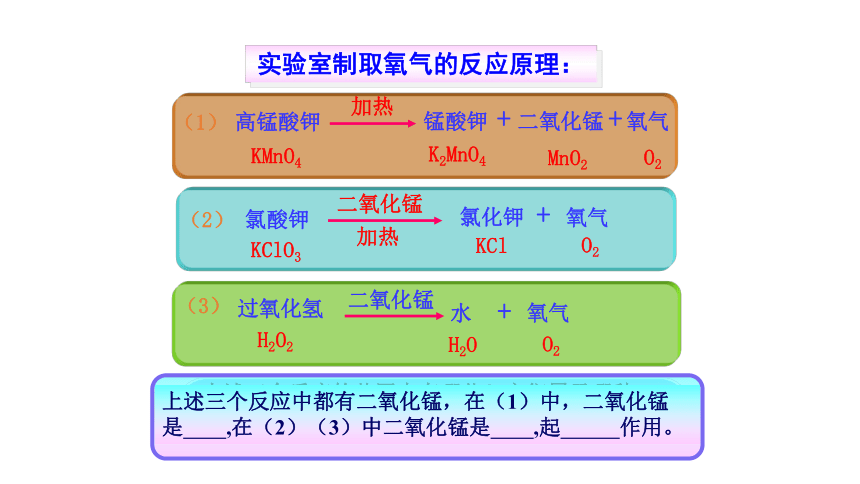
课件29张PPT。课题3 制取氧气一、实验室制取氧气实验室制取氧气常用方法:
1、分解过氧化氢(H2O2)
无色液体(俗名:双氧水)
2、加热氯酸钾(KClO3)和二氧化锰(MnO2)
白色粉末 黑色固体
3、加热高锰酸钾(KMnO4)
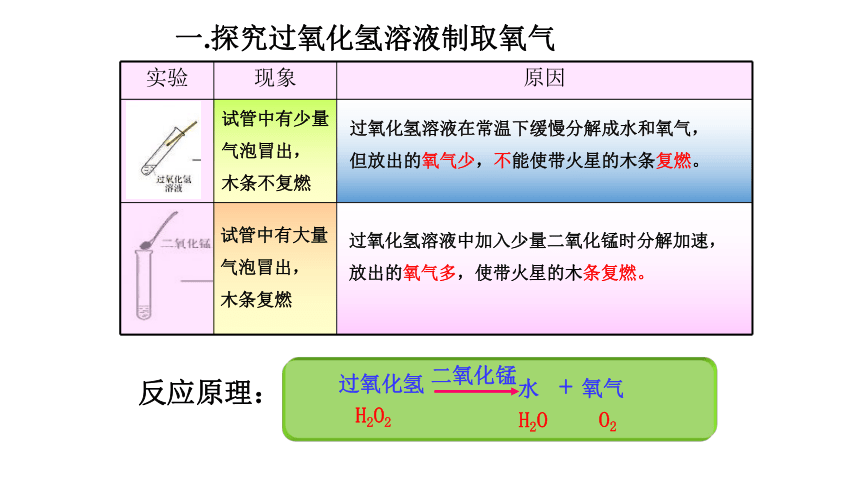
暗紫色固体一.探究过氧化氢溶液制取氧气试管中有少量
气泡冒出,
木条不复燃试管中有大量
气泡冒出,
木条复燃过氧化氢溶液在常温下缓慢分解成水和氧气,
但放出的氧气少,不能使带火星的木条复燃。过氧化氢溶液中加入少量二氧化锰时分解加速,
放出的氧气多,使带火星的木条复燃。反应原理:提出问题:二氧化锰是否发生了变化呢?在上述试验后的试管中再加入过氧化氢溶液,观察现象结论 二氧化锰在反应中加速了过氧化氢溶液的分解,而本身的质量和化学性质在反应前后都没有改变。 这种在化学反应里能改变其它物质的反应速率,而本身的质量和化学性质在反应前后都没有改变的物质叫做催化剂。
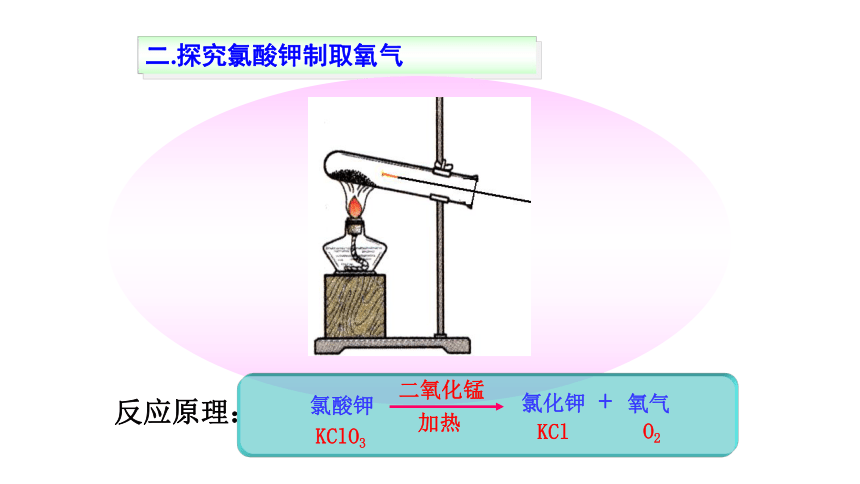
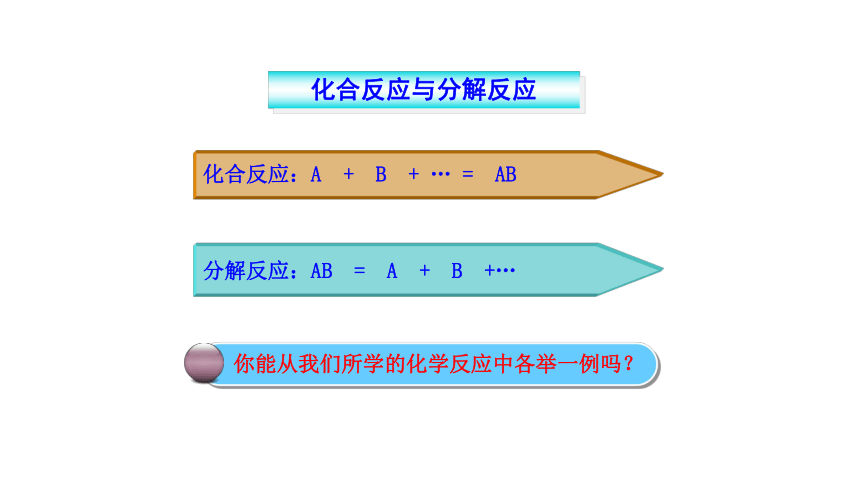
催化剂所起的作用,叫催化作用。二.探究氯酸钾制取氧气反应原理:实验室制取氧气的反应原理:分解反应分解反应:由一种反应物生成两种或两种以上其它物质的反应。
高锰酸钾锰酸钾 + 二氧化锰 + 氧气KMnO4K2MnO4 + MnO2 + O2特征:一变多化合反应与分解反应化合反应:A + B + … = AB分解反应:AB = A + B +…你能从我们所学的化学反应中各举一例吗?1、实验室用过氧化氢制取氧气,若实验中忘记加入二氧化锰,其结果是( )
A、不产生氧气 B、生产氧气的速度慢
C、产生氧气的总量少 D、没有影响2、催化剂在化学反应中所起的作用是( )
A、加快化学反应速率
B、使生成物质量增加
C、改变化学反应速率
D、减慢化学反应速率BC自我诊断检测题(1)(3)1、发生装置(一)、高锰酸钾制取氧气排水法
不易溶于水或难溶于水的气体向上排空气法
密度比空气大的气体向下排空气法
密度比空气小的
气体2、收集装置ABCDE用高锰酸钾制取氧气时不需要的仪器是?×仪器名称:发生装置收集装置A__________B_________
C__________D_________
E__________F_________试 管铁架台酒精灯导 管水槽集气瓶1、实验室制取氧气大致可分为下列步骤:①点燃酒精灯,加热试管.②检查装置的气密性.③将高锰酸钾装入试管,塞入一小团棉花,用带导管的橡皮塞塞紧试管,并把试管固定在铁架台上.④用排水法收集氧气.⑤熄灭酒精灯.⑥将导管从水槽中取出.正确的操作顺序为___________________.②③①④⑥⑤自我诊断检测题2、改正下图中的错误1、发生装置(二)、过氧化氢制取氧气反应容器试管可用锥形瓶、烧瓶、集气瓶、广口瓶等代替。该装置的优点:装置简单,操作简便。该装置检查装置气密性的方法:夹紧弹簧夹,从长颈漏斗中加水,当长颈漏斗的下端管口浸没液面下,静置,若漏斗中的液面不下降,说明该装置不漏气 。★长颈漏斗的下端管口必须伸入液面以下,防止气体从长颈漏斗口逸出。 (液封)该装置的优点:可随时添加液体药品。该装置中的长颈漏斗可用分液漏斗代替,优点是可控制反应速率。该装置的优点:
即开即停,节约药品。 对比下面两套发生装置,讨论一下,它们适合什么样的反应?(A) (B)A装置适合于固体反应物加热的反应。B装置适合于固液反应物不需加热的反应。发生装置的选择依据:反应物的状态和反应条件 对比下面的收集装置,讨论一下,它们适合收集怎样的气体?排水法---不易溶于水或难溶于水,且不与水反应的气体向上排空气法------
密度比空气大,且不与空气中的物质反应的气体。向下排空气法----
密度比空气小,且不与空气中的物质反应的气体收集装置的选择依据:气体的密度和溶解性。点击画面
播放视频思考:用哪一种药品制取氧气最好?
(从安全、环保、节能、简便等方面考虑)写出实验室制取氧气的反应原理
1、分解过氧化氢(H2O2)
2、加热氯酸钾(KClO3)和二氧化锰(MnO2)
3、加热高锰酸钾(KMnO4)
谈谈你的收获Thank you!
1、分解过氧化氢(H2O2)
无色液体(俗名:双氧水)
2、加热氯酸钾(KClO3)和二氧化锰(MnO2)
白色粉末 黑色固体
3、加热高锰酸钾(KMnO4)
暗紫色固体一.探究过氧化氢溶液制取氧气试管中有少量
气泡冒出,
木条不复燃试管中有大量
气泡冒出,
木条复燃过氧化氢溶液在常温下缓慢分解成水和氧气,
但放出的氧气少,不能使带火星的木条复燃。过氧化氢溶液中加入少量二氧化锰时分解加速,
放出的氧气多,使带火星的木条复燃。反应原理:提出问题:二氧化锰是否发生了变化呢?在上述试验后的试管中再加入过氧化氢溶液,观察现象结论 二氧化锰在反应中加速了过氧化氢溶液的分解,而本身的质量和化学性质在反应前后都没有改变。 这种在化学反应里能改变其它物质的反应速率,而本身的质量和化学性质在反应前后都没有改变的物质叫做催化剂。
催化剂所起的作用,叫催化作用。二.探究氯酸钾制取氧气反应原理:实验室制取氧气的反应原理:分解反应分解反应:由一种反应物生成两种或两种以上其它物质的反应。
高锰酸钾锰酸钾 + 二氧化锰 + 氧气KMnO4K2MnO4 + MnO2 + O2特征:一变多化合反应与分解反应化合反应:A + B + … = AB分解反应:AB = A + B +…你能从我们所学的化学反应中各举一例吗?1、实验室用过氧化氢制取氧气,若实验中忘记加入二氧化锰,其结果是( )
A、不产生氧气 B、生产氧气的速度慢
C、产生氧气的总量少 D、没有影响2、催化剂在化学反应中所起的作用是( )
A、加快化学反应速率
B、使生成物质量增加
C、改变化学反应速率
D、减慢化学反应速率BC自我诊断检测题(1)(3)1、发生装置(一)、高锰酸钾制取氧气排水法
不易溶于水或难溶于水的气体向上排空气法
密度比空气大的气体向下排空气法
密度比空气小的
气体2、收集装置ABCDE用高锰酸钾制取氧气时不需要的仪器是?×仪器名称:发生装置收集装置A__________B_________
C__________D_________
E__________F_________试 管铁架台酒精灯导 管水槽集气瓶1、实验室制取氧气大致可分为下列步骤:①点燃酒精灯,加热试管.②检查装置的气密性.③将高锰酸钾装入试管,塞入一小团棉花,用带导管的橡皮塞塞紧试管,并把试管固定在铁架台上.④用排水法收集氧气.⑤熄灭酒精灯.⑥将导管从水槽中取出.正确的操作顺序为___________________.②③①④⑥⑤自我诊断检测题2、改正下图中的错误1、发生装置(二)、过氧化氢制取氧气反应容器试管可用锥形瓶、烧瓶、集气瓶、广口瓶等代替。该装置的优点:装置简单,操作简便。该装置检查装置气密性的方法:夹紧弹簧夹,从长颈漏斗中加水,当长颈漏斗的下端管口浸没液面下,静置,若漏斗中的液面不下降,说明该装置不漏气 。★长颈漏斗的下端管口必须伸入液面以下,防止气体从长颈漏斗口逸出。 (液封)该装置的优点:可随时添加液体药品。该装置中的长颈漏斗可用分液漏斗代替,优点是可控制反应速率。该装置的优点:
即开即停,节约药品。 对比下面两套发生装置,讨论一下,它们适合什么样的反应?(A) (B)A装置适合于固体反应物加热的反应。B装置适合于固液反应物不需加热的反应。发生装置的选择依据:反应物的状态和反应条件 对比下面的收集装置,讨论一下,它们适合收集怎样的气体?排水法---不易溶于水或难溶于水,且不与水反应的气体向上排空气法------
密度比空气大,且不与空气中的物质反应的气体。向下排空气法----
密度比空气小,且不与空气中的物质反应的气体收集装置的选择依据:气体的密度和溶解性。点击画面
播放视频思考:用哪一种药品制取氧气最好?
(从安全、环保、节能、简便等方面考虑)写出实验室制取氧气的反应原理
1、分解过氧化氢(H2O2)
2、加热氯酸钾(KClO3)和二氧化锰(MnO2)
3、加热高锰酸钾(KMnO4)
谈谈你的收获Thank you!
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
