人教版(2019)选择性必修第三册 5.1 原子核的组成 课件(共26张PPT)
文档属性
| 名称 | 人教版(2019)选择性必修第三册 5.1 原子核的组成 课件(共26张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 9.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 物理 | ||
| 更新时间 | 2024-09-23 09:24:55 | ||
图片预览







文档简介
(共26张PPT)
原子核的组成
CONTENTS
01
天然放射现象
02
射线的本质
03
原子核的组成
04
目录
典型例题
典例分析
关于原子核内部信息的研究,最早来自矿物的天然放射现象。那么,人们是怎样从破解天然放射现象入手,一步步揭开了原子核秘密的呢?
新课导入
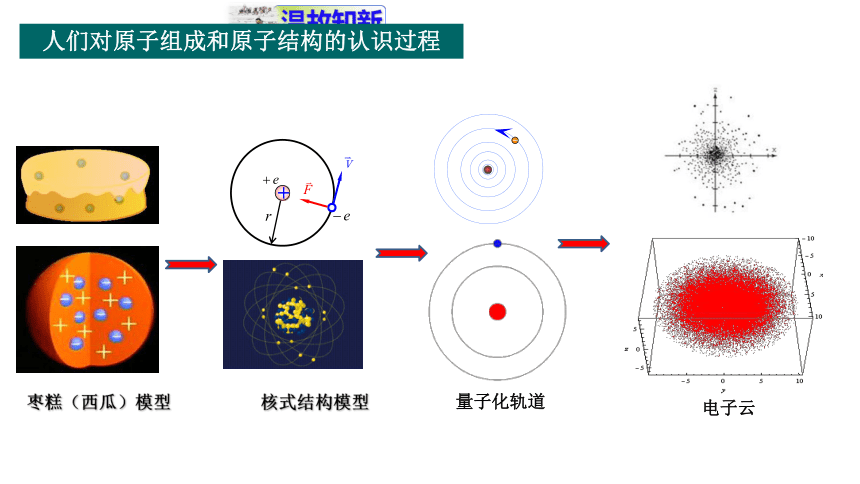
人们对原子组成和原子结构的认识过程
枣糕(西瓜)模型
+
+
核式结构模型
量子化轨道
电子云
01
天然放射现象
原子核
关于原子核内部的信息最早来自天然放射现象。
贝克勒尔,
1852-1908,法国
1896年3月,贝克勒尔
双氧铀硫酸钾盐
纯铀金属板
天然放射性的发现
贝克勒尔在实验室中
居里夫妇对最早提出了放射性的概念。
发现并命名两种新元素:钋(Po)和镭(Ra)。
玛丽.居里与皮埃尔.居里
玛丽.居里把其中一种元素命名为钋(Po)(为了纪念她的祖国波兰而) ,
另一种元素命名为镭(Ra) 。
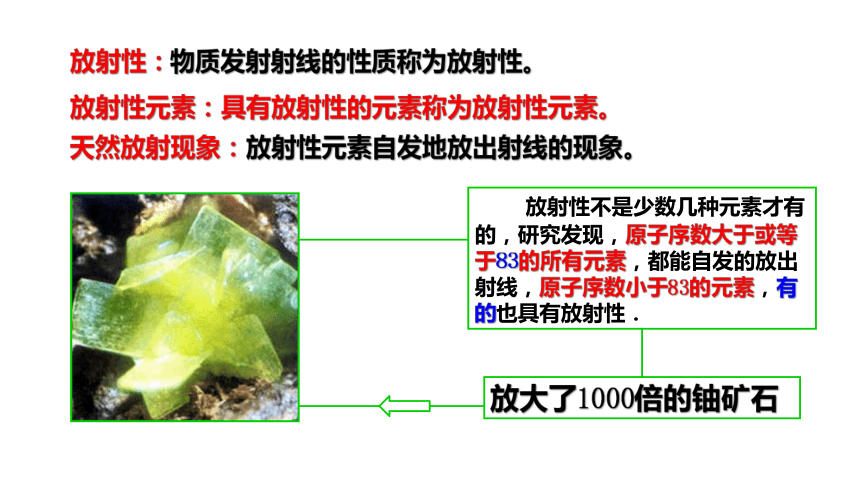
放射性:物质发射射线的性质称为放射性。
放射性元素:具有放射性的元素称为放射性元素。
天然放射现象:放射性元素自发地放出射线的现象。
放大了1000倍的铀矿石
放射性不是少数几种元素才有的,研究发现,原子序数大于或等于83的所有元素,都能自发的放出射线,原子序数小于83的元素,有的也具有放射性.
02
射线的本质
原子核
1、研究方法
⑴把放射源铀、钋或镭放入用铅做成的容器中,射线只能从容器的小孔射出,成为细细的一束。
这三种射线分别叫作α射线、β射线和γ射线。
⑵在射线经过的空间施加磁场。
①射线分裂成三束;
②两束在磁场中向不同的方向偏转,这说明它们是带电粒子流;且电性相反。
③另一束在磁场中不偏转,说明它不带电。
如果α射线、β射线都是带电粒子流,按照图5.1-1中标出的径迹判断,它们分别带什么电荷?
如果不用磁场而用电场判断它们带电的性质,两个电极怎样放置可以使三种射线大致沿图示的方向偏转?
× × × × ×
× × × × ×
× × × × ×
× × × × ×
α射线
β射线
γ射线
正电
负电
α射线
+
β射线-
γ射线
电场E
思考与讨论
2、三种射线
射线
射线
射线
电离能力
贯穿能力
速度
本质
0.99C
光速 c
氦核流
高速电子流
波长极短的电磁波(光子)
射线使原子中的电子脱离核的束缚成为自由电子,这样的过程叫作电离。射线的上述作用叫作电离作用。
由于与物质中的微粒作用时会损失自己的能量,在空气中只能前进几厘米,用一张纸就能把它挡住。(最弱)
最强
较弱
最弱
穿透能力较强,很容易穿透黑纸,也能穿透几毫米厚的铝板。(较弱)
甚至能穿透几厘米厚的铅板和几十厘米厚的混凝土(最强)
纸
铝
α射线
β射线
γ射线
铅
课本中说“γ射线是能量很高的电磁波”。为什么说电磁波的光子能量高,它的波长就一定短?
根据光子的能量公式 可知,电磁波的光子能量越大,频率越高,波长越短
想一想
元素的放射性是原子的性质还是原子核的性质?放射性的发现有何重要意义
表明原子核也有内部结构。
放射性与元素所处的化学状态无关。
放射性与元素存在的物理状态无关。
是原子核的性质,而不是原子的性质。只与原子核的内部结构有关。
3、射线的来源
射线与核外电子无关,它来自原子核。说明原子核内部是有结构的。
单质、化合物
温度、压强
原子核
威耳逊云室
由微观粒子构成的射线,肉眼是看不见的。但是,射线中的粒子与其他物质作用时产生的现象,会显示射线的存在。威尔逊云室就是一种常用的射线探测装置。
剑桥卡文迪许实验室陈列的威尔逊云室
拓展学习
α射线,β射线都是高速运动的粒子,能量很高,Y射线是波长很短的光子,能量也很高。从原子内部能够射出这样高能的粒子,这使科学家们意识到原子核是一个能量的宝库。
放射性现象中放出的三种射线都是从放射性元素的原子核内释放出来的,这表明原子核也有内部结构.
原子核内究竟还有什么结构?
原子核又是由什么粒子组成的呢?
03
原子核的组成
原子核
1、发现质子
——1919年,卢瑟福用α粒子轰击氮原子核发现质子。
质子:P
电量:e=1.602×10-19C
质量:mp=1.672×10-27kg
后来,人们用同样的方法,从氟、钠、铝的原子核中打出了质子,由此断定质子是原子核的组成部分。
卢瑟福发现质子的核反应方程:
原子核是只由质子组成的吗?如果原子核中只有质子,那么,任何一种原子核的质量与电荷量之比,都应该等于质子的质量与电荷量之比。但事实是这样的吗?
如果原子核中内只有质子,则:
实际上:
说明原子核还有其他组成部分
思考与讨论
1932年,英国物理学家查德威克又发现了中子,用符号n表示。
通过研究证明中子的质量和质子的质量非常接近,但是不带电,是中性粒子。
在对各种原子核进行的实验中,发现质子和电子是组成原子核的两种基本粒子。
查德威克发现中子的核反应方程:
中子的质量:
查德威克
2、发现中子
mn=1.674927471×10-27 kg
mp=1.672×10-27kg
原子核具有结构
天然放射性现象
原子核=质子+中子
原子具有核式结构
α粒子散射实验
原子具有结构
重要实验
结论
原子=原子核+核外电子
原子内部存在电子
阴极射线
核子
3、原子核的组成
mn=1.674927471×10-27 kg
mp=1.672×10-27kg
质子:P
电量+:e=1.602×10-19C
中子:n
中子质量比质子质量约大千分之一
4、原子核的表示方法
=质子数=原子序数=核外电子数
⑴核电荷数Z
⑵质量数A
=核子数=质子数+中子数
电荷数
(原子序数)
质量数
原子核的电荷数不是它所带的电荷量,质量数也不是它的质量。
原子核符号(元素符号)
(α粒子)
表示:带2个单位正电荷,即有2个质子和4-2=2个中子。
氦原子核
铀原子核
电荷数是2,质量数是4。
电荷数是92,质量数是235。
表示:带92个单位正电荷,即有92个质子和235-92=143个中子。
——元素符号
质子数相同而中子数不同的原子核,在元素周期表中处于同一位置,因而互称同位素。例如,氢有三种同位素,分别叫做氕(也就是通常说的氢)、氘(也叫重氢)、氚(也叫超重氢),符号分别是 。
5、同位素
原子核的质子数决定了核外电子数目,也决定了电子在核外的分布情况,进而决定了这种元素的化学性质。因此,同种元素的原子,质子数相同,核外电子数也相同,它们就会具有相同的化学性质。
同位素:质子数相同,中子数不同(质量数A当然不同),则互为同位素。
碳有两种同位素,符号分别是
元素符号相同
质子数相同(电荷数相同 )
质量数不同
科学漫步
天然放射现象的发现
1895年末,德国物理学家伦琴发现了一种新的射线——X射线,即伦琴射线。它具有一定的辐射性。
原子核的组成
CONTENTS
01
天然放射现象
02
射线的本质
03
原子核的组成
04
目录
典型例题
典例分析
关于原子核内部信息的研究,最早来自矿物的天然放射现象。那么,人们是怎样从破解天然放射现象入手,一步步揭开了原子核秘密的呢?
新课导入
人们对原子组成和原子结构的认识过程
枣糕(西瓜)模型
+
+
核式结构模型
量子化轨道
电子云
01
天然放射现象
原子核
关于原子核内部的信息最早来自天然放射现象。
贝克勒尔,
1852-1908,法国
1896年3月,贝克勒尔
双氧铀硫酸钾盐
纯铀金属板
天然放射性的发现
贝克勒尔在实验室中
居里夫妇对最早提出了放射性的概念。
发现并命名两种新元素:钋(Po)和镭(Ra)。
玛丽.居里与皮埃尔.居里
玛丽.居里把其中一种元素命名为钋(Po)(为了纪念她的祖国波兰而) ,
另一种元素命名为镭(Ra) 。
放射性:物质发射射线的性质称为放射性。
放射性元素:具有放射性的元素称为放射性元素。
天然放射现象:放射性元素自发地放出射线的现象。
放大了1000倍的铀矿石
放射性不是少数几种元素才有的,研究发现,原子序数大于或等于83的所有元素,都能自发的放出射线,原子序数小于83的元素,有的也具有放射性.
02
射线的本质
原子核
1、研究方法
⑴把放射源铀、钋或镭放入用铅做成的容器中,射线只能从容器的小孔射出,成为细细的一束。
这三种射线分别叫作α射线、β射线和γ射线。
⑵在射线经过的空间施加磁场。
①射线分裂成三束;
②两束在磁场中向不同的方向偏转,这说明它们是带电粒子流;且电性相反。
③另一束在磁场中不偏转,说明它不带电。
如果α射线、β射线都是带电粒子流,按照图5.1-1中标出的径迹判断,它们分别带什么电荷?
如果不用磁场而用电场判断它们带电的性质,两个电极怎样放置可以使三种射线大致沿图示的方向偏转?
× × × × ×
× × × × ×
× × × × ×
× × × × ×
α射线
β射线
γ射线
正电
负电
α射线
+
β射线-
γ射线
电场E
思考与讨论
2、三种射线
射线
射线
射线
电离能力
贯穿能力
速度
本质
0.99C
光速 c
氦核流
高速电子流
波长极短的电磁波(光子)
射线使原子中的电子脱离核的束缚成为自由电子,这样的过程叫作电离。射线的上述作用叫作电离作用。
由于与物质中的微粒作用时会损失自己的能量,在空气中只能前进几厘米,用一张纸就能把它挡住。(最弱)
最强
较弱
最弱
穿透能力较强,很容易穿透黑纸,也能穿透几毫米厚的铝板。(较弱)
甚至能穿透几厘米厚的铅板和几十厘米厚的混凝土(最强)
纸
铝
α射线
β射线
γ射线
铅
课本中说“γ射线是能量很高的电磁波”。为什么说电磁波的光子能量高,它的波长就一定短?
根据光子的能量公式 可知,电磁波的光子能量越大,频率越高,波长越短
想一想
元素的放射性是原子的性质还是原子核的性质?放射性的发现有何重要意义
表明原子核也有内部结构。
放射性与元素所处的化学状态无关。
放射性与元素存在的物理状态无关。
是原子核的性质,而不是原子的性质。只与原子核的内部结构有关。
3、射线的来源
射线与核外电子无关,它来自原子核。说明原子核内部是有结构的。
单质、化合物
温度、压强
原子核
威耳逊云室
由微观粒子构成的射线,肉眼是看不见的。但是,射线中的粒子与其他物质作用时产生的现象,会显示射线的存在。威尔逊云室就是一种常用的射线探测装置。
剑桥卡文迪许实验室陈列的威尔逊云室
拓展学习
α射线,β射线都是高速运动的粒子,能量很高,Y射线是波长很短的光子,能量也很高。从原子内部能够射出这样高能的粒子,这使科学家们意识到原子核是一个能量的宝库。
放射性现象中放出的三种射线都是从放射性元素的原子核内释放出来的,这表明原子核也有内部结构.
原子核内究竟还有什么结构?
原子核又是由什么粒子组成的呢?
03
原子核的组成
原子核
1、发现质子
——1919年,卢瑟福用α粒子轰击氮原子核发现质子。
质子:P
电量:e=1.602×10-19C
质量:mp=1.672×10-27kg
后来,人们用同样的方法,从氟、钠、铝的原子核中打出了质子,由此断定质子是原子核的组成部分。
卢瑟福发现质子的核反应方程:
原子核是只由质子组成的吗?如果原子核中只有质子,那么,任何一种原子核的质量与电荷量之比,都应该等于质子的质量与电荷量之比。但事实是这样的吗?
如果原子核中内只有质子,则:
实际上:
说明原子核还有其他组成部分
思考与讨论
1932年,英国物理学家查德威克又发现了中子,用符号n表示。
通过研究证明中子的质量和质子的质量非常接近,但是不带电,是中性粒子。
在对各种原子核进行的实验中,发现质子和电子是组成原子核的两种基本粒子。
查德威克发现中子的核反应方程:
中子的质量:
查德威克
2、发现中子
mn=1.674927471×10-27 kg
mp=1.672×10-27kg
原子核具有结构
天然放射性现象
原子核=质子+中子
原子具有核式结构
α粒子散射实验
原子具有结构
重要实验
结论
原子=原子核+核外电子
原子内部存在电子
阴极射线
核子
3、原子核的组成
mn=1.674927471×10-27 kg
mp=1.672×10-27kg
质子:P
电量+:e=1.602×10-19C
中子:n
中子质量比质子质量约大千分之一
4、原子核的表示方法
=质子数=原子序数=核外电子数
⑴核电荷数Z
⑵质量数A
=核子数=质子数+中子数
电荷数
(原子序数)
质量数
原子核的电荷数不是它所带的电荷量,质量数也不是它的质量。
原子核符号(元素符号)
(α粒子)
表示:带2个单位正电荷,即有2个质子和4-2=2个中子。
氦原子核
铀原子核
电荷数是2,质量数是4。
电荷数是92,质量数是235。
表示:带92个单位正电荷,即有92个质子和235-92=143个中子。
——元素符号
质子数相同而中子数不同的原子核,在元素周期表中处于同一位置,因而互称同位素。例如,氢有三种同位素,分别叫做氕(也就是通常说的氢)、氘(也叫重氢)、氚(也叫超重氢),符号分别是 。
5、同位素
原子核的质子数决定了核外电子数目,也决定了电子在核外的分布情况,进而决定了这种元素的化学性质。因此,同种元素的原子,质子数相同,核外电子数也相同,它们就会具有相同的化学性质。
同位素:质子数相同,中子数不同(质量数A当然不同),则互为同位素。
碳有两种同位素,符号分别是
元素符号相同
质子数相同(电荷数相同 )
质量数不同
科学漫步
天然放射现象的发现
1895年末,德国物理学家伦琴发现了一种新的射线——X射线,即伦琴射线。它具有一定的辐射性。
同课章节目录
- 第一章 分子动理论
- 1 分子动理论的基本内容
- 2 实验:用油膜法估测油酸分子的大小
- 3 分子运动速率分布规律
- 4 分子动能和分子势能
- 第二章 气体、固体和液体
- 1 温度和温标
- 2 气体的等温变化
- 3 气体的等压变化和等容变化
- 4 固体
- 5 液体
- 第三章 热力学定律
- 1 功、热和内能的改变
- 2 热力学第一定律
- 3 能量守恒定律
- 4 热力学第二定律
- 第四章 原子结构和波粒二象性
- 1 普朗克黑体辐射理论
- 2 光电效应
- 3 原子的核式结构模型
- 4 氢原子光谱和玻尔的原子模型
- 5 粒子的波动性和量子力学的建立
- 第五章 原子核
- 1 原子核的组成
- 2 放射性元素的衰变
- 3 核力与结合能
- 4 核裂变与核聚变
- 5 “基本”粒子
