3.2.1醇--高二化学同步备课课件(人教版2019选择性必修3)
文档属性
| 名称 | 3.2.1醇--高二化学同步备课课件(人教版2019选择性必修3) |  | |
| 格式 | pptx | ||
| 文件大小 | 32.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-24 11:06:50 | ||
图片预览







文档简介
(共37张PPT)
人教版化学 选择性必修3
主讲人
第三章 烃的衍生物
第二节 卤代烃
第一课时
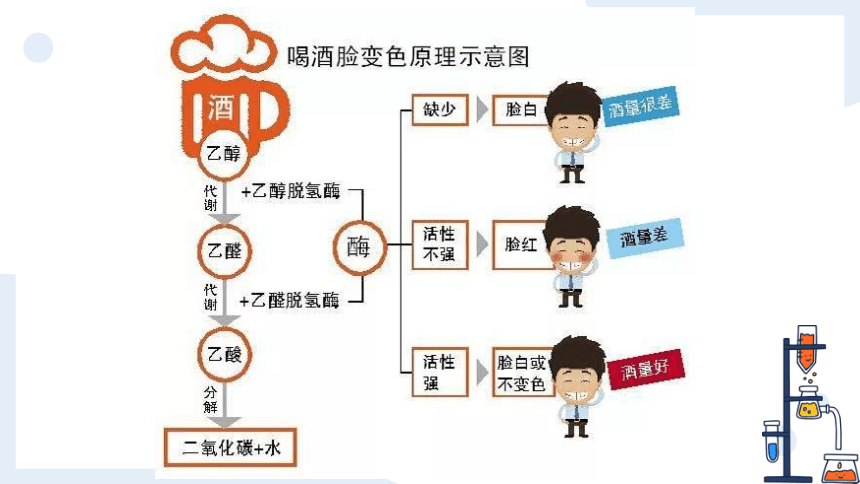
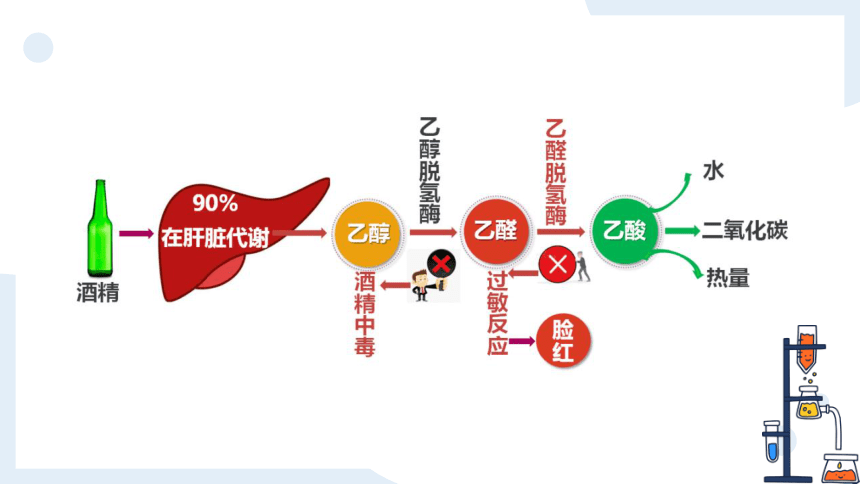
聚会时酒必不可少
但不是所有人酒量都好
在日常生活中,我们看到有些人喝酒后,会产生脸部变红、呕吐、昏迷等醉酒症状;有些人喝了一定量的酒,却并不会出现上述症状。这是什么原因造成的呢
一
醇 酚
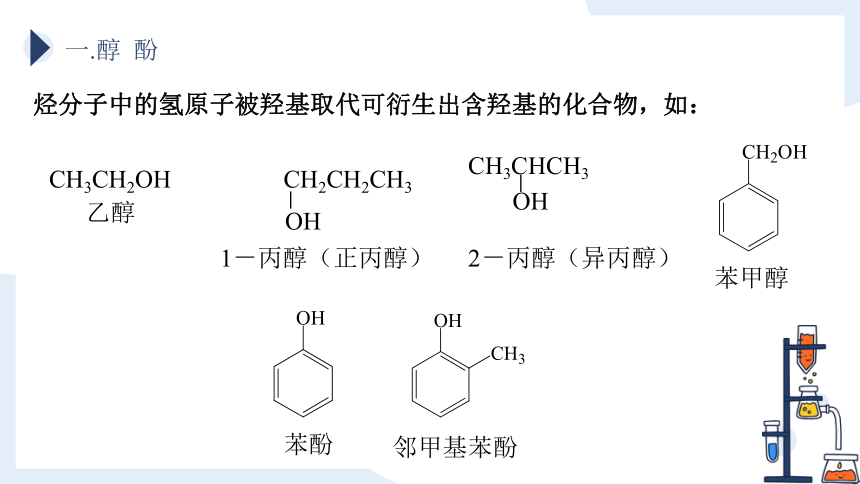
一.醇 酚
烃分子中的氢原子被羟基取代可衍生出含羟基的化合物,如:
CH3CH2OH
乙醇
苯甲醇
邻甲基苯酚
苯酚
CH3CHCH3
OH
2-丙醇(异丙醇)
CH2CH2CH3
OH
1-丙醇(正丙醇)
一.醇 酚
羟基与饱和碳原子相连的化合物称为醇
羟基与苯环直接相连而形成的化合物称为酚
1.醇
2.酚
一.醇 酚
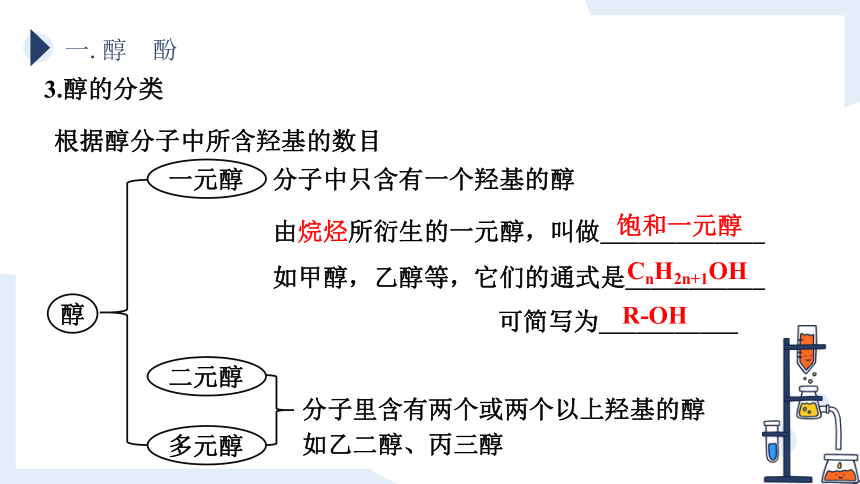
3.醇的分类
根据醇分子中所含羟基的数目
醇
一元醇
二元醇
多元醇
分子中只含有一个羟基的醇
由烷烃所衍生的一元醇,叫做_____________
如甲醇,乙醇等,它们的通式是___________
饱和一元醇
CnH2n+1OH
可简写为___________
R-OH
分子里含有两个或两个以上羟基的醇
如乙二醇、丙三醇
一.醇 酚
3.醇的分类
一元醇
二元醇
多元醇
甲醇
无色、具有挥发性的液体,易溶于水,沸点为65℃,有毒。
乙二醇
无色、黏稠的液体,易溶于水
丙三醇(甘油)
CH2-OH
CH2-OH
CH2-OH
CH-OH
CH2-OH
一.醇 酚
4.醇的物理性质
水溶性
随碳原子数的增加而降低
低级醇(如甲、乙、丙醇)与水互溶
沸点
随碳原子数增加而升高。
相对分子质量相近的醇与烷烃:醇 > 烷烃
一.醇 酚
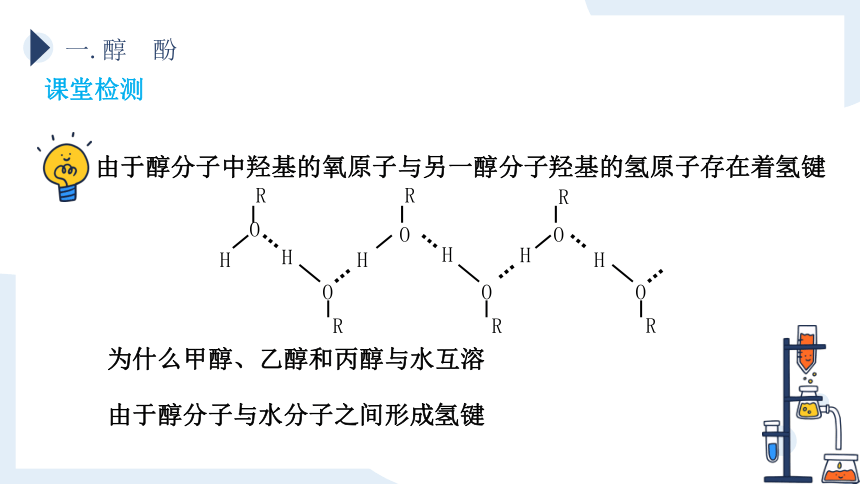
课堂检测
由于醇分子中羟基的氧原子与另一醇分子羟基的氢原子存在着氢键
为什么甲醇、乙醇和丙醇与水互溶
由于醇分子与水分子之间形成氢键
R
R
R
R
R
R
O
O
O
O
O
O
H
H
H
H
H
H
一.醇 酚
5.醇的化学性质(以乙醇为例) 氧化反应
C2H5OH+3O2 2CO2+3H2O
点燃
(1)可燃性
实验室里也常用乙醇作为燃料,
乙醇也可用作内燃机的燃料,
一.醇 酚
5.醇的化学性质(以乙醇为例) 氧化反应
现象:铜丝保持红热,说明反应______(放热,吸热)
在试管口可以闻到刺激性气体,说明有_____生成.
铜丝的颜色变化:____ → _____ → ______,反应后,铜丝的质量____.
放热
乙醛
红 黑 红
不变
(2)催化氧化
实验回顾
步骤:①用小试管取3~4mL无水乙醇。②加热一端绕成螺旋状的铜丝至红热③将铜丝趁热插到盛有乙醇的试管④反复操作几次,观察铜丝颜色和液体气味的变化。
一.醇 酚
举一反三
①-③位断键
①
③
R2—C—O—H
R1
H
+ O2
2
+ 2H2O
—C=O
R1
R2
2
Cu
△
※羟基所在碳上有两个氢催化氧化生成醛
去羟基上的氢和羟基所连碳上的氢,碳原子和氧原子形成碳氧双键。
※羟基所在碳上有一个氢催化氧化生成酮
※羟基所在碳上没有氢不能发生催化氧化
醇的催化氧化
一.醇 酚
课堂检测
写出下列醇发生催化氧化的反应方程式
2CH3CH2CHO+2H2O
① CH3CH2CH2OH
④ (CH3)3COH
② CH3CHCH3
OH
③ CH2OH
CH2OH
+O2
Cu
△
2
+O2
Cu
△
2
2CH3—C—CH3+2H2O
O
+O2
Cu
△
+2H2O
CHO
CHO
不能发生催化氧化
一.醇 酚
5.醇的化学性质(以乙醇为例) 氧化反应
(3)与强氧化剂反应
CH3CH2OH
CH3CHO
氧化
氧化
KMnO4酸性溶液
紫红色→无色
重铬酸钾(K2Cr2O7)酸性溶液
Cr2O72-→Cr3+
(橙红色)→(绿色)
CH3COOH
一.醇 酚
酒驾怎么查
一.醇 酚
举一反三
①羟基所在碳上有两个氢可氧化生成酸
②羟基所在碳上有一个氢可氧化生成酮
③羟基所在碳上没有氢不能被氧化
R CH2OH
R COOH
KMnO4(H+)或
K2Cr2O7(H+)
R1 CH R2
OH
KMnO4(H+)或
K2Cr2O7(H+)
R1 C R2
O
醇与强氧化剂反应
一.醇 酚
课堂检测
某饱和一元醇的分子式为C5H12O的同分异构体中,
能发生催化氧化的有( )种;能被氧化成醛的有( ) 种
能被酸性高锰酸钾褪色的有( )种;能被氧化成酸的有( ) 种
7
4
7
4
一.醇 酚
5.醇的化学性质(以乙醇为例) 置换反应
2CH3CH2O-H +2Na →2CH3CH2ONa +H2↑
H C C O H
H
H
H
H
①
①处O-H键断开
一.醇 酚
5.醇的化学性质(以乙醇为例) 取代反应
(1)酯化反应
酸脱羟基、醇脱羟基上的氢原子
18
18
O O
CH3—C—OH+H—O—C2H5 CH3—C—O—C2H5 + H2O
浓H2SO4
H C C O H
H
H
H
H
一.醇 酚
5.醇的化学性质(以乙醇为例) 取代反应
(2)与氢卤酸HX反应
C2H5 OH + H Br C2H5 Br + H2O
△
乙醇与浓氢溴酸混合加热
H C C O H
H
H
H
H
一.醇 酚
5.醇的化学性质(以乙醇为例) 取代反应
(3)分子间脱水
C2H5 OH + HO C2H5 C2H5 O C2H5 + H2O
浓H2SO4
140 ℃
一分子脱羟基,另一分子脱羟基氢
乙醚
像乙醚这样有两个烃基通过一个氧原子连接起来的化合物叫做醚
醚的结构可用R-O-R‘来表示
醚类物质可用作溶剂和麻醉剂
一.醇 酚
5.醇的化学性质(以乙醇为例) 消去反应
1700C
浓H2SO4
H C C H CH2=CH2 +H2O
H
H
H
OH
分子内脱水
一.醇 酚
5.醇的化学性质(以乙醇为例) 消去反应
一.醇 酚
举一反三
醇分子中,连有羟基(—OH)的碳原子必须有相邻的碳原子,并且此相邻的碳原子上必须连有氢原子时,才可发生消去反应
醇与消去反应
不能发生消去反应
一.醇 酚
课堂检测
写出下列醇发生消去反应的化学反应方程式
① CH3CH2CH2OH
④ (CH3)3COH
② CH3CHCH2CH3
OH
③ CH2OH
CH2OH
二
乙烯的实验室制法
一.乙烯的实验室制法
1.实验原理
CH2=CH2 ↑ +H2O
1700C
浓H2SO4
CH3CH2OH
2.实验装置
酸性KMnO4溶液
NaOH溶液
溴的四氯化碳溶液
混合液
碎瓷片
温度计
一.乙烯的实验室制法
一.乙烯的实验式制法
3.实验现象
现象 解释
烧瓶中的液体逐渐变黑
在加热的条件下,浓硫酸还能将无水乙醇氧化生成碳的单质等。
酸性高锰酸钾溶液褪色
反应生成乙烯与其发生氧化反应
溴的四氯化碳溶液褪色
反应生成乙烯与其发生加成反应
一.乙烯的实验室制法
4.实验注意事项
e. 酒精与浓硫酸体积比为何要为1∶3?
因为浓硫酸是催化剂和脱水剂,为了保证有足够的脱水性,硫酸要用98%的浓硫酸,酒精要用无水乙醇,酒精与浓硫酸体积比以1∶3为宜。
d. 加药品顺序——浓硫酸缓慢加入乙醇中
(1)放入几片碎瓷片作用
(2) 浓硫酸的作用
防止暴沸
催化剂和脱水剂
(3)温度计的位置
一.乙烯的实验室制法
4.实验注意事项
(1)放入几片碎瓷片作用
(2) 浓硫酸的作用
温度计水银球要置于反应物的液面下,因为需要测量的是反应物的温度。
防止暴沸
催化剂和脱水剂
(3)温度计的位置
(4)加药品顺序
浓硫酸缓慢加入乙醇中
一.乙烯的实验室制法
4.实验注意事项
(5)反应有杂质气体生成,需要除去
反应制得的乙烯中往往混有CO2、SO2等气体。其中SO2会干扰后续实验现象,可将气体通过NaOH溶液除去。
(6)温度要迅速升高并稳定在170℃
乙醇和浓硫酸混合物在170℃的温度下主要生成乙烯和水,而在140℃时乙醇将以另一种方式脱水,即分子间脱水,生成乙醚。
一.乙烯的实验室制法
课堂小结
②
①
⑤
③
④
H―C―C―O―H
H
H
H
H
反应 断键位置
分子间脱水
与HX反应
②④
②
①③
①②
与金属反应
消去反应
催化氧化
①
感谢观看
人教版化学 选择性必修3
主讲人
人教版化学 选择性必修3
主讲人
第三章 烃的衍生物
第二节 卤代烃
第一课时
聚会时酒必不可少
但不是所有人酒量都好
在日常生活中,我们看到有些人喝酒后,会产生脸部变红、呕吐、昏迷等醉酒症状;有些人喝了一定量的酒,却并不会出现上述症状。这是什么原因造成的呢
一
醇 酚
一.醇 酚
烃分子中的氢原子被羟基取代可衍生出含羟基的化合物,如:
CH3CH2OH
乙醇
苯甲醇
邻甲基苯酚
苯酚
CH3CHCH3
OH
2-丙醇(异丙醇)
CH2CH2CH3
OH
1-丙醇(正丙醇)
一.醇 酚
羟基与饱和碳原子相连的化合物称为醇
羟基与苯环直接相连而形成的化合物称为酚
1.醇
2.酚
一.醇 酚
3.醇的分类
根据醇分子中所含羟基的数目
醇
一元醇
二元醇
多元醇
分子中只含有一个羟基的醇
由烷烃所衍生的一元醇,叫做_____________
如甲醇,乙醇等,它们的通式是___________
饱和一元醇
CnH2n+1OH
可简写为___________
R-OH
分子里含有两个或两个以上羟基的醇
如乙二醇、丙三醇
一.醇 酚
3.醇的分类
一元醇
二元醇
多元醇
甲醇
无色、具有挥发性的液体,易溶于水,沸点为65℃,有毒。
乙二醇
无色、黏稠的液体,易溶于水
丙三醇(甘油)
CH2-OH
CH2-OH
CH2-OH
CH-OH
CH2-OH
一.醇 酚
4.醇的物理性质
水溶性
随碳原子数的增加而降低
低级醇(如甲、乙、丙醇)与水互溶
沸点
随碳原子数增加而升高。
相对分子质量相近的醇与烷烃:醇 > 烷烃
一.醇 酚
课堂检测
由于醇分子中羟基的氧原子与另一醇分子羟基的氢原子存在着氢键
为什么甲醇、乙醇和丙醇与水互溶
由于醇分子与水分子之间形成氢键
R
R
R
R
R
R
O
O
O
O
O
O
H
H
H
H
H
H
一.醇 酚
5.醇的化学性质(以乙醇为例) 氧化反应
C2H5OH+3O2 2CO2+3H2O
点燃
(1)可燃性
实验室里也常用乙醇作为燃料,
乙醇也可用作内燃机的燃料,
一.醇 酚
5.醇的化学性质(以乙醇为例) 氧化反应
现象:铜丝保持红热,说明反应______(放热,吸热)
在试管口可以闻到刺激性气体,说明有_____生成.
铜丝的颜色变化:____ → _____ → ______,反应后,铜丝的质量____.
放热
乙醛
红 黑 红
不变
(2)催化氧化
实验回顾
步骤:①用小试管取3~4mL无水乙醇。②加热一端绕成螺旋状的铜丝至红热③将铜丝趁热插到盛有乙醇的试管④反复操作几次,观察铜丝颜色和液体气味的变化。
一.醇 酚
举一反三
①-③位断键
①
③
R2—C—O—H
R1
H
+ O2
2
+ 2H2O
—C=O
R1
R2
2
Cu
△
※羟基所在碳上有两个氢催化氧化生成醛
去羟基上的氢和羟基所连碳上的氢,碳原子和氧原子形成碳氧双键。
※羟基所在碳上有一个氢催化氧化生成酮
※羟基所在碳上没有氢不能发生催化氧化
醇的催化氧化
一.醇 酚
课堂检测
写出下列醇发生催化氧化的反应方程式
2CH3CH2CHO+2H2O
① CH3CH2CH2OH
④ (CH3)3COH
② CH3CHCH3
OH
③ CH2OH
CH2OH
+O2
Cu
△
2
+O2
Cu
△
2
2CH3—C—CH3+2H2O
O
+O2
Cu
△
+2H2O
CHO
CHO
不能发生催化氧化
一.醇 酚
5.醇的化学性质(以乙醇为例) 氧化反应
(3)与强氧化剂反应
CH3CH2OH
CH3CHO
氧化
氧化
KMnO4酸性溶液
紫红色→无色
重铬酸钾(K2Cr2O7)酸性溶液
Cr2O72-→Cr3+
(橙红色)→(绿色)
CH3COOH
一.醇 酚
酒驾怎么查
一.醇 酚
举一反三
①羟基所在碳上有两个氢可氧化生成酸
②羟基所在碳上有一个氢可氧化生成酮
③羟基所在碳上没有氢不能被氧化
R CH2OH
R COOH
KMnO4(H+)或
K2Cr2O7(H+)
R1 CH R2
OH
KMnO4(H+)或
K2Cr2O7(H+)
R1 C R2
O
醇与强氧化剂反应
一.醇 酚
课堂检测
某饱和一元醇的分子式为C5H12O的同分异构体中,
能发生催化氧化的有( )种;能被氧化成醛的有( ) 种
能被酸性高锰酸钾褪色的有( )种;能被氧化成酸的有( ) 种
7
4
7
4
一.醇 酚
5.醇的化学性质(以乙醇为例) 置换反应
2CH3CH2O-H +2Na →2CH3CH2ONa +H2↑
H C C O H
H
H
H
H
①
①处O-H键断开
一.醇 酚
5.醇的化学性质(以乙醇为例) 取代反应
(1)酯化反应
酸脱羟基、醇脱羟基上的氢原子
18
18
O O
CH3—C—OH+H—O—C2H5 CH3—C—O—C2H5 + H2O
浓H2SO4
H C C O H
H
H
H
H
一.醇 酚
5.醇的化学性质(以乙醇为例) 取代反应
(2)与氢卤酸HX反应
C2H5 OH + H Br C2H5 Br + H2O
△
乙醇与浓氢溴酸混合加热
H C C O H
H
H
H
H
一.醇 酚
5.醇的化学性质(以乙醇为例) 取代反应
(3)分子间脱水
C2H5 OH + HO C2H5 C2H5 O C2H5 + H2O
浓H2SO4
140 ℃
一分子脱羟基,另一分子脱羟基氢
乙醚
像乙醚这样有两个烃基通过一个氧原子连接起来的化合物叫做醚
醚的结构可用R-O-R‘来表示
醚类物质可用作溶剂和麻醉剂
一.醇 酚
5.醇的化学性质(以乙醇为例) 消去反应
1700C
浓H2SO4
H C C H CH2=CH2 +H2O
H
H
H
OH
分子内脱水
一.醇 酚
5.醇的化学性质(以乙醇为例) 消去反应
一.醇 酚
举一反三
醇分子中,连有羟基(—OH)的碳原子必须有相邻的碳原子,并且此相邻的碳原子上必须连有氢原子时,才可发生消去反应
醇与消去反应
不能发生消去反应
一.醇 酚
课堂检测
写出下列醇发生消去反应的化学反应方程式
① CH3CH2CH2OH
④ (CH3)3COH
② CH3CHCH2CH3
OH
③ CH2OH
CH2OH
二
乙烯的实验室制法
一.乙烯的实验室制法
1.实验原理
CH2=CH2 ↑ +H2O
1700C
浓H2SO4
CH3CH2OH
2.实验装置
酸性KMnO4溶液
NaOH溶液
溴的四氯化碳溶液
混合液
碎瓷片
温度计
一.乙烯的实验室制法
一.乙烯的实验式制法
3.实验现象
现象 解释
烧瓶中的液体逐渐变黑
在加热的条件下,浓硫酸还能将无水乙醇氧化生成碳的单质等。
酸性高锰酸钾溶液褪色
反应生成乙烯与其发生氧化反应
溴的四氯化碳溶液褪色
反应生成乙烯与其发生加成反应
一.乙烯的实验室制法
4.实验注意事项
e. 酒精与浓硫酸体积比为何要为1∶3?
因为浓硫酸是催化剂和脱水剂,为了保证有足够的脱水性,硫酸要用98%的浓硫酸,酒精要用无水乙醇,酒精与浓硫酸体积比以1∶3为宜。
d. 加药品顺序——浓硫酸缓慢加入乙醇中
(1)放入几片碎瓷片作用
(2) 浓硫酸的作用
防止暴沸
催化剂和脱水剂
(3)温度计的位置
一.乙烯的实验室制法
4.实验注意事项
(1)放入几片碎瓷片作用
(2) 浓硫酸的作用
温度计水银球要置于反应物的液面下,因为需要测量的是反应物的温度。
防止暴沸
催化剂和脱水剂
(3)温度计的位置
(4)加药品顺序
浓硫酸缓慢加入乙醇中
一.乙烯的实验室制法
4.实验注意事项
(5)反应有杂质气体生成,需要除去
反应制得的乙烯中往往混有CO2、SO2等气体。其中SO2会干扰后续实验现象,可将气体通过NaOH溶液除去。
(6)温度要迅速升高并稳定在170℃
乙醇和浓硫酸混合物在170℃的温度下主要生成乙烯和水,而在140℃时乙醇将以另一种方式脱水,即分子间脱水,生成乙醚。
一.乙烯的实验室制法
课堂小结
②
①
⑤
③
④
H―C―C―O―H
H
H
H
H
反应 断键位置
分子间脱水
与HX反应
②④
②
①③
①②
与金属反应
消去反应
催化氧化
①
感谢观看
人教版化学 选择性必修3
主讲人
