2.2.2炔烃--高二化学同步备课课件(人教版2019选择性必修3))
文档属性
| 名称 | 2.2.2炔烃--高二化学同步备课课件(人教版2019选择性必修3)) |

|
|
| 格式 | pptx | ||
| 文件大小 | 84.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-24 00:00:00 | ||
图片预览






文档简介
(共20张PPT)
人教版化学 选择性必修3
主讲人
第二章 烃
第二节 烯烃 炔烃
第二课时
炔烃
炔烃
炔烃的官能团是碳碳三键,炔烃只含有一个碳碳三键时,其通式一般表示为CnH2n-2。
乙炔
乙炔(俗称电石气)是最简单的炔烃
乙炔是无色、无臭的气体,微溶于水,易溶于有机溶剂。
炔烃
一
乙炔的结构
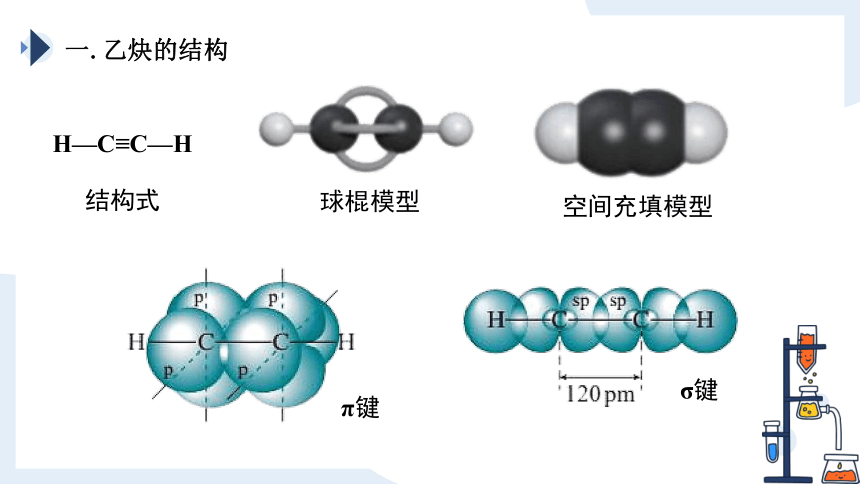
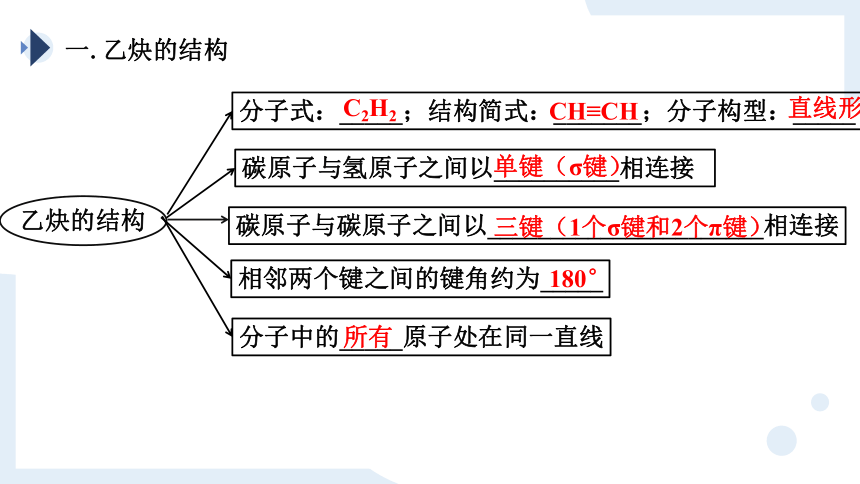
一.乙炔的结构
σ键
π键
H—C≡C—H
结构式
球棍模型
空间充填模型
一.乙炔的结构
乙炔的结构
分子式:_____;结构简式:_______;分子构型:_____
C2H2
碳原子与氢原子之间以__________相连接
CH≡CH
碳原子与碳原子之间以______________________相连接
直线形
相邻两个键之间的键角约为_____
分子中的_____原子处在同一直线
180°
所有
单键(σ键)
三键(1个σ键和2个π键)
二
乙炔的化学性质
二.乙炔的化学性质
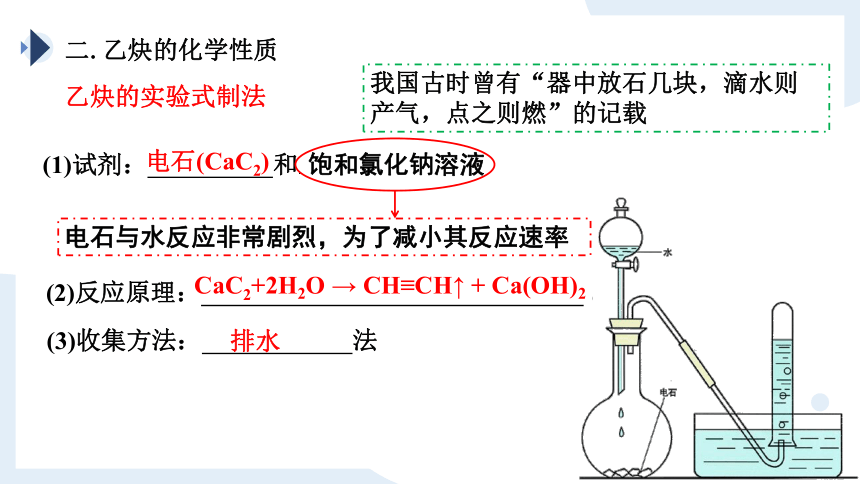
乙炔的实验式制法
二.乙炔的化学性质
(1)试剂: 和水。
(2)反应原理: 。
(3)收集方法: 法
排水
电石(CaC2)
CaC2+2H2O → CH≡CH↑ + Ca(OH)2
我国古时曾有“器中放石几块,滴水则产气,点之则燃”的记载
饱和氯化钠溶液
电石与水反应非常剧烈,为了减小其反应速率
乙炔的实验式制法
一.乙炔的结构
电石(主要是CaC2,还含有 CaS、Ca3P2等)
(3)杂质气体为:__________
除杂试剂为:____________________
H2S
CuSO4溶液
或NaOH溶液
氧化反应
加成反应
乙炔的氧化反应
二.乙炔的化学性质
①可燃性
O2
4CO2+2H2O
2C2H2+ 5
甲烷
乙烯
乙炔
火焰明亮,并伴有浓烟
乙炔跟空气的混合物遇火会发生爆炸,在生产和使用乙炔时,点燃前要验纯!
含碳量不同导致燃烧现象有所不同,可用于三者鉴别
1.乙炔的氧化反应
二.乙炔的化学性质
2KMnO4+ 3H2SO4+ C2H2→2MnSO4+ K2SO4+2CO2↑+ 4H2O
②使酸性KMnO4溶液褪色
2.乙炔的加成反应
二.乙炔的化学性质
乙炔分子中含有不饱和的碳碳三键,乙炔能与溴发生加成反应
1, 2—二溴乙烯
1, 1, 2, 2—四溴乙烷
2.乙炔的加成反应
二.乙炔的化学性质
CH≡CH+H2
催化剂
△
CH2=CH2
催化剂
△
CH≡CH+2H2
CH3CH3
(少量氢气)
(足量氢气)
催化剂
△
CH≡CH+HCl
CH2=CHCl
与氯化氢反应
CH≡CH+H2O
催化剂
△
CH3CHO
与水反应
乙炔与水加成后的产物乙烯醇(CH2=CH—OH不稳定,很快转化为乙醛)
三
炔烃
1.炔烃的化学性质
三.炔烃
炔烃的结构和性质与乙炔的相似
氧化反应
加成反应
加聚反应
①可燃性
②使酸性KMnO4溶液褪色
卤素单质或其溶液
卤代烃
氢气
烯烃或烷烃
卤化氢
卤代烃
水
醛或酮
一定条件下
nX—C≡C—Y [ C=C ]n
X
Y
思考与讨论
三.炔烃
(1)请写出戊炔所有属于炔烃的同分异构体的结构简式,并用系统命名法命名。
CH≡C(CH2)2CH3 1 戊炔
思考与讨论
三.炔烃
(2)请写出1 丁炔与足量氢气完全反应的化学方程式,并分析该反应中化学键和官能团的变化。
CH3—CH2—CH2CH3
CH≡C—CH2CH3+2H2
催化剂
△
思考与讨论
三.炔烃
(3)某炔烃通过催化加氢反应得到2 甲基戊烷,请由此推断该炔烃可能的结构简式,并命名。
(CH3)2CHC≡C—CH3 、(CH3)2CHCH2C≡CH
4-甲基-2 戊炔
4-甲基-1 戊炔
感谢观看
人教版化学 选择性必修3
主讲人
人教版化学 选择性必修3
主讲人
第二章 烃
第二节 烯烃 炔烃
第二课时
炔烃
炔烃
炔烃的官能团是碳碳三键,炔烃只含有一个碳碳三键时,其通式一般表示为CnH2n-2。
乙炔
乙炔(俗称电石气)是最简单的炔烃
乙炔是无色、无臭的气体,微溶于水,易溶于有机溶剂。
炔烃
一
乙炔的结构
一.乙炔的结构
σ键
π键
H—C≡C—H
结构式
球棍模型
空间充填模型
一.乙炔的结构
乙炔的结构
分子式:_____;结构简式:_______;分子构型:_____
C2H2
碳原子与氢原子之间以__________相连接
CH≡CH
碳原子与碳原子之间以______________________相连接
直线形
相邻两个键之间的键角约为_____
分子中的_____原子处在同一直线
180°
所有
单键(σ键)
三键(1个σ键和2个π键)
二
乙炔的化学性质
二.乙炔的化学性质
乙炔的实验式制法
二.乙炔的化学性质
(1)试剂: 和水。
(2)反应原理: 。
(3)收集方法: 法
排水
电石(CaC2)
CaC2+2H2O → CH≡CH↑ + Ca(OH)2
我国古时曾有“器中放石几块,滴水则产气,点之则燃”的记载
饱和氯化钠溶液
电石与水反应非常剧烈,为了减小其反应速率
乙炔的实验式制法
一.乙炔的结构
电石(主要是CaC2,还含有 CaS、Ca3P2等)
(3)杂质气体为:__________
除杂试剂为:____________________
H2S
CuSO4溶液
或NaOH溶液
氧化反应
加成反应
乙炔的氧化反应
二.乙炔的化学性质
①可燃性
O2
4CO2+2H2O
2C2H2+ 5
甲烷
乙烯
乙炔
火焰明亮,并伴有浓烟
乙炔跟空气的混合物遇火会发生爆炸,在生产和使用乙炔时,点燃前要验纯!
含碳量不同导致燃烧现象有所不同,可用于三者鉴别
1.乙炔的氧化反应
二.乙炔的化学性质
2KMnO4+ 3H2SO4+ C2H2→2MnSO4+ K2SO4+2CO2↑+ 4H2O
②使酸性KMnO4溶液褪色
2.乙炔的加成反应
二.乙炔的化学性质
乙炔分子中含有不饱和的碳碳三键,乙炔能与溴发生加成反应
1, 2—二溴乙烯
1, 1, 2, 2—四溴乙烷
2.乙炔的加成反应
二.乙炔的化学性质
CH≡CH+H2
催化剂
△
CH2=CH2
催化剂
△
CH≡CH+2H2
CH3CH3
(少量氢气)
(足量氢气)
催化剂
△
CH≡CH+HCl
CH2=CHCl
与氯化氢反应
CH≡CH+H2O
催化剂
△
CH3CHO
与水反应
乙炔与水加成后的产物乙烯醇(CH2=CH—OH不稳定,很快转化为乙醛)
三
炔烃
1.炔烃的化学性质
三.炔烃
炔烃的结构和性质与乙炔的相似
氧化反应
加成反应
加聚反应
①可燃性
②使酸性KMnO4溶液褪色
卤素单质或其溶液
卤代烃
氢气
烯烃或烷烃
卤化氢
卤代烃
水
醛或酮
一定条件下
nX—C≡C—Y [ C=C ]n
X
Y
思考与讨论
三.炔烃
(1)请写出戊炔所有属于炔烃的同分异构体的结构简式,并用系统命名法命名。
CH≡C(CH2)2CH3 1 戊炔
思考与讨论
三.炔烃
(2)请写出1 丁炔与足量氢气完全反应的化学方程式,并分析该反应中化学键和官能团的变化。
CH3—CH2—CH2CH3
CH≡C—CH2CH3+2H2
催化剂
△
思考与讨论
三.炔烃
(3)某炔烃通过催化加氢反应得到2 甲基戊烷,请由此推断该炔烃可能的结构简式,并命名。
(CH3)2CHC≡C—CH3 、(CH3)2CHCH2C≡CH
4-甲基-2 戊炔
4-甲基-1 戊炔
感谢观看
人教版化学 选择性必修3
主讲人
