2.2 课时2 物质的量浓度的相关计算 课件 (共25张PPT)2024-2025学年高一化学苏教版(2019)必修第一册
文档属性
| 名称 | 2.2 课时2 物质的量浓度的相关计算 课件 (共25张PPT)2024-2025学年高一化学苏教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-25 16:11:01 | ||
图片预览






文档简介
(共25张PPT)
第二节 溶液组成的定量研究
/ 课时2 质的量浓度相关计算 /
学习目标
1.掌握以物质的量为核心的微粒数目、质量、气体体积之间的转化关系。
2.掌握相对密度、平均摩尔质量有关问题的分析方法。
3.掌握溶液中以物质的量浓度为核心的相关计算,提升宏观辨识与微观探析的化学核心素养。
4.掌握表示溶液组成的c、ρ、w、S之间的转化关系,提升证据推理与模型认知的核心素养。
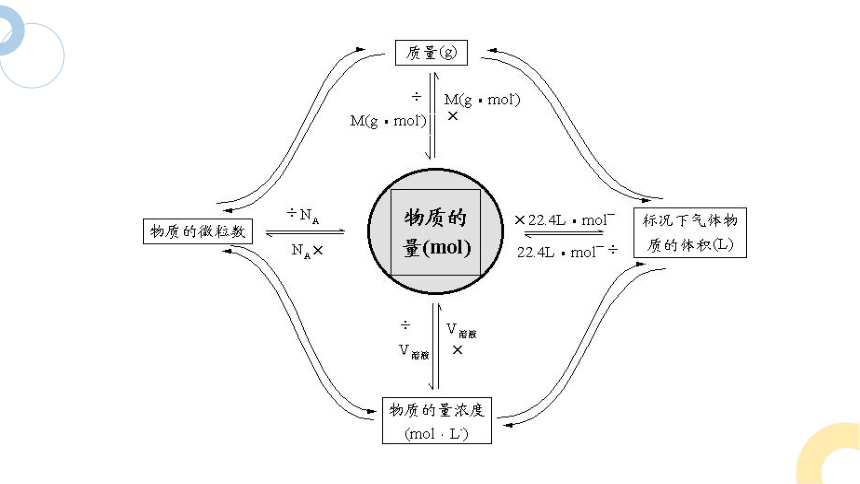
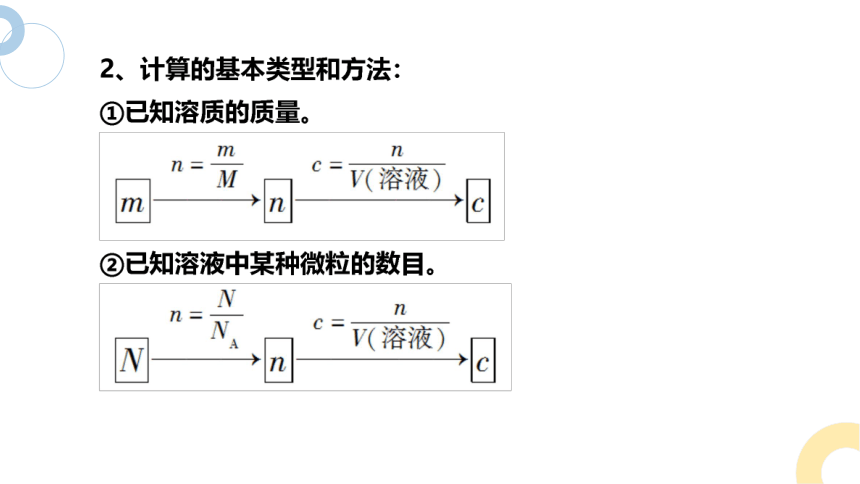
1、基本公式
n(B)=c(B)·V[B(aq)]
一、物质的量浓度相关计算
N
NA
n
m
M
V气
Vm
CB
V液
B
课堂练习
化学方程式 2Na+2H2O===2NaOH+H2↑
化学计量数之比 2∶2∶2∶1
扩大NA倍之后 2NA∶2NA∶2NA∶NA
物质的量之比 ∶ ∶ ∶ 。
结论 化学方程式中各物质的化学计量数之比= 。之比= 之比
1.化学方程式相关计算
二、物质的量综合计算
2 mol
各物质的物质的量
2 mol
2 mol
1 mol
各物质的粒子数
解题步骤
例2 把1.1 g铁、铝混合物溶于200 mL 5 mol·L-1盐酸中,反应后盐酸的浓度变为4.6 mol·L-1(溶液体积变化忽略不计)。求:(1)反应中消耗HCl的物质的量。(2)该混合物中铝、铁的物质的量。
课堂练习
解:(1)消耗HCl的物质的量:
0.2 L×5 mol·L-1-0.2 L×4.6 mol·L-1=0.08 mol。
解得:x=0.02 mol,y=0.01 mol
答:(1)反应中消耗HCl的物质的量为0.08 mol;
(2)该混合物中铝、铁的物质的量分别为0.02 mol、0.01 mol。
2.相对密度
即相对密度等于摩尔质量之比。
3.平均摩尔质量
(1)平均摩尔质量是单位物质的量的混合物(即1 mol混合物)的质量。
(2)对于气体,气体的物质的量分数等于体积分数。
(3)已知两种气体的平均摩尔质量,可用十字交叉法快速求出两种成分的物质的量之比(分子数之比、同温同压下的体积比):
(不是质量之比)!
3.平均摩尔质量
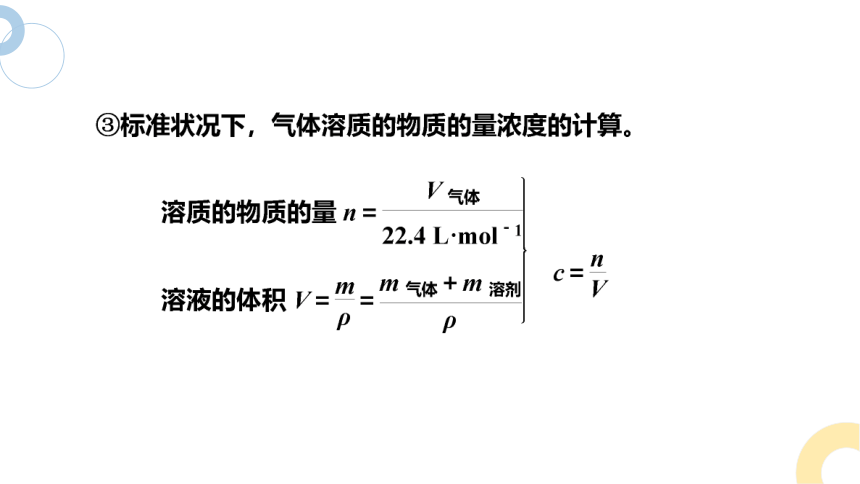
因忽视“标准状况”而出错。给出气体的体积,但是没有注明“标准状况”,不能用22.4 L·mol-1计算气体的物质的量。
1
因忽视“物质的状态”而出错。标准状况下,所给的物质为液体
或固体,不能用气体摩尔体积计算所给物质的物质的量。
2
因忽视“溶液的体积”而出错。只给出溶液中溶质的物质的量浓度,没有给出溶液的体积,不能计算溶液中某溶质的物质的量。
3
常见陷阱
因忽视“溶剂中的微粒”而出错。给出溶液中溶质的物质的量
浓度及体积,能计算出溶质的物质的量及溶质中的微粒数,但不能计算出溶液中的微粒数。气体的物质的量。
4
因忽视“单质组成”而出错。气体单质的组成除常见的双原子外,还有单原子分子(如He、Ne等)、多原子分子(如O3等)。
5
因忽视“粒子种类”而出错。粒子种类一般有分子、原子、离子、
质子、中子、电子等。解答时要看准题目要求,防止误入陷阱。
6
常见陷阱
D
课堂练习
例4.设NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.4.48 L Cl2所含的分子数为0.2NA
B.常温常压下,4.4 g CO2与N2O混合气体含有的原子数为0.1NA
C.标准状况下,11.2 L煤油中含有的分子数为0.5NA
D.100 mL 1 mol·L-1 NaOH溶液中含Na+数为0.1NA
D
课堂练习
课堂小结
物质的量浓度相关计算
物质的量综合计算
基本公式
计算类型与方法
与质量分数换算
溶液稀释问题
化学方程式
相对密度
平均摩尔质量
课堂练习
B
课堂练习
C
第二节 溶液组成的定量研究
/ 课时2 质的量浓度相关计算 /
学习目标
1.掌握以物质的量为核心的微粒数目、质量、气体体积之间的转化关系。
2.掌握相对密度、平均摩尔质量有关问题的分析方法。
3.掌握溶液中以物质的量浓度为核心的相关计算,提升宏观辨识与微观探析的化学核心素养。
4.掌握表示溶液组成的c、ρ、w、S之间的转化关系,提升证据推理与模型认知的核心素养。
1、基本公式
n(B)=c(B)·V[B(aq)]
一、物质的量浓度相关计算
N
NA
n
m
M
V气
Vm
CB
V液
B
课堂练习
化学方程式 2Na+2H2O===2NaOH+H2↑
化学计量数之比 2∶2∶2∶1
扩大NA倍之后 2NA∶2NA∶2NA∶NA
物质的量之比 ∶ ∶ ∶ 。
结论 化学方程式中各物质的化学计量数之比= 。之比= 之比
1.化学方程式相关计算
二、物质的量综合计算
2 mol
各物质的物质的量
2 mol
2 mol
1 mol
各物质的粒子数
解题步骤
例2 把1.1 g铁、铝混合物溶于200 mL 5 mol·L-1盐酸中,反应后盐酸的浓度变为4.6 mol·L-1(溶液体积变化忽略不计)。求:(1)反应中消耗HCl的物质的量。(2)该混合物中铝、铁的物质的量。
课堂练习
解:(1)消耗HCl的物质的量:
0.2 L×5 mol·L-1-0.2 L×4.6 mol·L-1=0.08 mol。
解得:x=0.02 mol,y=0.01 mol
答:(1)反应中消耗HCl的物质的量为0.08 mol;
(2)该混合物中铝、铁的物质的量分别为0.02 mol、0.01 mol。
2.相对密度
即相对密度等于摩尔质量之比。
3.平均摩尔质量
(1)平均摩尔质量是单位物质的量的混合物(即1 mol混合物)的质量。
(2)对于气体,气体的物质的量分数等于体积分数。
(3)已知两种气体的平均摩尔质量,可用十字交叉法快速求出两种成分的物质的量之比(分子数之比、同温同压下的体积比):
(不是质量之比)!
3.平均摩尔质量
因忽视“标准状况”而出错。给出气体的体积,但是没有注明“标准状况”,不能用22.4 L·mol-1计算气体的物质的量。
1
因忽视“物质的状态”而出错。标准状况下,所给的物质为液体
或固体,不能用气体摩尔体积计算所给物质的物质的量。
2
因忽视“溶液的体积”而出错。只给出溶液中溶质的物质的量浓度,没有给出溶液的体积,不能计算溶液中某溶质的物质的量。
3
常见陷阱
因忽视“溶剂中的微粒”而出错。给出溶液中溶质的物质的量
浓度及体积,能计算出溶质的物质的量及溶质中的微粒数,但不能计算出溶液中的微粒数。气体的物质的量。
4
因忽视“单质组成”而出错。气体单质的组成除常见的双原子外,还有单原子分子(如He、Ne等)、多原子分子(如O3等)。
5
因忽视“粒子种类”而出错。粒子种类一般有分子、原子、离子、
质子、中子、电子等。解答时要看准题目要求,防止误入陷阱。
6
常见陷阱
D
课堂练习
例4.设NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.4.48 L Cl2所含的分子数为0.2NA
B.常温常压下,4.4 g CO2与N2O混合气体含有的原子数为0.1NA
C.标准状况下,11.2 L煤油中含有的分子数为0.5NA
D.100 mL 1 mol·L-1 NaOH溶液中含Na+数为0.1NA
D
课堂练习
课堂小结
物质的量浓度相关计算
物质的量综合计算
基本公式
计算类型与方法
与质量分数换算
溶液稀释问题
化学方程式
相对密度
平均摩尔质量
课堂练习
B
课堂练习
C
