3.1 课时3 氧化还原反应(共44张PPT) 2024-2025学年高一化学苏教版(2019)必修第一册
文档属性
| 名称 | 3.1 课时3 氧化还原反应(共44张PPT) 2024-2025学年高一化学苏教版(2019)必修第一册 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-25 16:22:44 | ||
图片预览










文档简介
(共44张PPT)
课时3 氧化还原反应
感受氧化还原反应的存在
刚削好的苹果
放置30分钟后的苹果
刚泡好的绿茶
放置2小时后的绿茶
感受氧化还原反应的存在
好吃的月饼
幕后的“英雄”
感受氧化还原反应的存在
金属生锈
感受氧化还原反应的存在
如何判断一个反应是否属于氧化还原反应
反应中有元素化合价的改变
四种基本类型反应与氧化还原反应的关系
氧化还原反应
分解反应
化合反应
置换反应
复分解反应
元素化合价确定的一般规律
1、由金属和非金属组成的化合物中,金属元素一般显 价,非金属元素一般显 价;
2、化合物中,氧通常显 价,氢通常显 价;
3、化合物中各元素化合价的代数和为 ;
4、单质中元素的化合价为 。
负
正
-2
+1
0
0
CaCO3 = CaO + CO2 ↑
2Fe + 3Cl2 2FeCl3
Na2O + H2O = 2NaOH
非氧化还原反应
氧化还原反应
非氧化还原反应
判断下列反应是否属于氧化还原反应?
CuO + CO = Cu + CO2
CuO + C = Cu + CO2 ↑
Ca(ClO)2 + CO2 + H2O = CaCO3 + 2HClO
2HClO O2↑ + 2HCl
氧化还原反应
非氧化还原反应
氧化还原反应
氧化还原反应
对于氧化还原反应,元素的化合价在反应过程中为什么有升有降?
分析 NaCl 的形成过程
2Na + Cl2 2NaCl
问题探究
2Na + Cl2 = 2NaCl
+11
+17
+17
+11
Na+ Cl-
Na
Cl
Cl-
Na+
该化学反应中化合价升降的原因 。
0
0
+1
-1
电子的得失
生成 NaCl 时是“电子得失”,生成 HCl 时是“电子对偏移”。
即“电子得失”和“电子对偏移”统称为“电子的转移”。
说 明
一、氧化还原反应
1.定义:
凡是有电子转移的化学反应,称为氧化还原反应
2.特征:
反应前后化合价发生变化 (判断依据)
3.实质:
电子发生转移 (得失或偏移)
有电子转移的化学反应都是氧化还原反应。
氧化剂
还原剂
n个e-
失去电子
,被氧化
得到电子
,被还原
反应物中失去电子(元素化合价升高)的物质—被氧化
二、氧化剂和还原剂
1.定义:
反应物中得到电子(元素化合价降低)的物质—被还原
氧化剂:
还原剂:
0
0
+1
-1
化合价降低
被还原
化合价升高
被氧化
失去2e-
得到2e-
还原剂
氧化剂
①氧化剂和还原剂均是指反应物质,是一种化学试剂,不是某一种元素。
②氧化剂本身被还原,发生还原反应,得到的产物是还原产物。
③还原剂本身被氧化,发生氧化反应,得到的产物是氧化产物。
说 明
-4 -3 -2 -1 0 +1 +2 +3 +4 +5 +6 +7
失去e-,
化合价升高,
被氧化,
作还原剂
得到e-,
作氧化剂
化合价降低,
被还原,
2.化合价升降与得失电子的关系
2HCl + Fe = FeCl2 + H2↑
氧化剂, 还原剂;
元素被氧化, 元素被还原.
+1 0 +2 0
HCl
Fe
Fe
H
三、氧化产物和还原产物
氧化产物:还原剂失去电子生成的产物—(元素
化合价升高)生成物。
还原产物:氧化剂得到电子生成的物质—(元素
化合价降低)生成物。
2HCl + Fe = FeCl2 + H2↑
还原剂
氧化产物
氧化剂
还原产物
MnO2 + 4HCl(浓)=== MnCl2 + Cl2 + 2H2O↑
氧化剂 还原剂
被氧化 被还原
氧化产物 还原产物
0
-1
-1
+4
+2
MnO2
HCl
HCl
MnO2
Cl2
MnCl2
氧化剂 + 还原剂 = 氧化产物 + 还原产物
得到电子,化合价降低,被还原,发生还原反应
失去电子,化合价升高,被氧化,发生氧化反应
指出下列反应中的氧化剂、还原剂、氧化产物、还原产物。
① CuO + CO Cu + CO2
② 2KClO3 2KCl + 3O2↑
③ Cl2 + H2O = HCl + HClO
④ MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O
⑤ Cu + 2H2SO4(浓) = CuSO4 + SO2↑+ 2H2O
MnO2
歧化反应
小窍门:提供氧的一般是氧化剂
Cl2 + H2O = HCl + HClO
SO2 + 2H2S = 3S↓ + H2O
歧化反应
0
-1
+1
归中反应
0
-2
+4
知识拓展
四、氧化还原反应得失电子的表示方法——双线桥法
例如:2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
1.正确判断各反应物、生成物各元素的化合价及其变化。
0 +1 +3 0
步骤:
2.两个线桥一个在上、一个在下,线桥的方向是从反应物一方指向生成物一方,首尾都必须对应与发生化合价发生变化的同种元素。
步骤:
例如:2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
0 +1 +3 0
3.标出得失电子数,电子符号用“e-”来表示。
4.得失电子总数 = 原子个数 × 每个原子得失电子数
失去 2×3e-
得到 3×2e-
注意:反应中失去电子的总数等于得到电子的总数
步骤:
例如:2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
0 +1 +3 0
失去 2×e-
Cl2 + H2O = HCl + HClO
失去 e-
得到 e-
得到 2e-
+4
+2
-1
0
0
+1
-1
MnO2 + 4 HCl(浓) = MnCl2 + Cl2 + 2H2O
1.
2.
H2 + Cl2 = 2HCl
2Na + Cl2 = 2NaCl
0
0
+1
-1
2e-
箭头由失电子(偏移)元素指向得电子(偏向)元素,并标明转移数目。
0
0
+1
-1
2e-
四、氧化还原反应得失电子的表示方法——单线桥法
箭头必须由还原剂中失电子的元素指向氧化剂中得电子的元素。
箭头方向表示 电子转移的方向 。
在“桥”上标明转移的 电子总数 。
知识拓展
五、氧化还原反应方程式的配平
(1)配平原则:电子守恒、原子守恒、电荷守恒
(2)配平步骤 (以高锰酸钾和浓盐酸反应制氯气为例):
① 标出化合价变化了的元素的化合价。
KMnO4 + HCl KCl + MnCl2 + Cl2↑+ H2O
+7
-1
+2
0
② 根据元素存在的实际形式调整发生了氧化还原反应的物质的系数,使之成 1︰1 的关系,然后使化合价升降总数相等。
KMnO4 + 2HCl KCl + MnCl2 + Cl2↑+ H2O
+7
-1
+2
0
化合价 ↓ 5×2
化合价 ↑ 2×5
③ 根据化合价升降总数相等确定发生氧化还原反应的物质的化学计量数。
2KMnO4+10HCl KCl+2MnCl2+5Cl2↑+H2O
④ 利用元素守恒,用观察法配平没有参加氧化还原反应的其他物质的系数。
2KMnO4+16HCl 2KCl+2MnCl2+5Cl2↑+8H2O
⑤ 检查方程式两边各原子的个数是否相等,离子方程式还要检查方程式两边的离子所带的电荷数是否相等。
2KMnO4+16HCl = 2KCl+2MnCl2+5Cl2↑+8H2O
例:24mL浓度为0.05mol/L的Na2SO3溶液,恰好与20mL浓度为0.02mol/L的K2X2O7溶液完全反应,则元素X在被还原产物中的化合价是 ( )
A. +6 B. +3 C. +2 D. 0
B
六、氧化还原反应的计算
A
1. 还原性:失去电子的性质 (实质)
化合价升高 (特征)
2. 氧化性:得到电子的性质 (实质)
化合价降低 (特征)
七、氧化性与还原性
下列由左边物质生成右边物质有无氧化还原变化?左边物质表现什么性质?
(1) KI → I2
(2) SO2 → SO3
(3) HgCl2 → Hg2Cl2
(4) SO2 → S
(5) N2O5 → N2O3
(6) KMnO4 → K2MnO4
还原性
还原性
氧化性
氧化性
氧化性
氧化性
-1 0 +1 +3 +5 +7
Cl -- Cl -- Cl -- Cl -- Cl -- Cl
HCl Cl2 HClO HClO2 HClO3 HClO4
只能做还原剂
只能做氧化剂
既能做氧化剂,又能做还原剂
小结:判断微粒(分子、原子、离子)是否具有氧化性或还原性。
(1)元素处于最高价态--只能得电子
--只有氧化性
(2)元素处于最低价态--只能失电子
--只有还原性
(3)元素处于中间价态--
即能得电子 既有氧化性
又能失电子 又有还原性
下列微粒中只有氧化性的是 ________;
只有还原性的是 ___________
既有氧化性又有还原性的是 _______________。
(1) Cl2 (2) Cl- (3) Fe (4) Fe2+
(5) Fe3+ (6) O2 (7) S2- (8) S
(9) SO2 (10) HCl
5、6
2、3、7
1、4、
8、9、10
课时3 氧化还原反应
感受氧化还原反应的存在
刚削好的苹果
放置30分钟后的苹果
刚泡好的绿茶
放置2小时后的绿茶
感受氧化还原反应的存在
好吃的月饼
幕后的“英雄”
感受氧化还原反应的存在
金属生锈
感受氧化还原反应的存在
如何判断一个反应是否属于氧化还原反应
反应中有元素化合价的改变
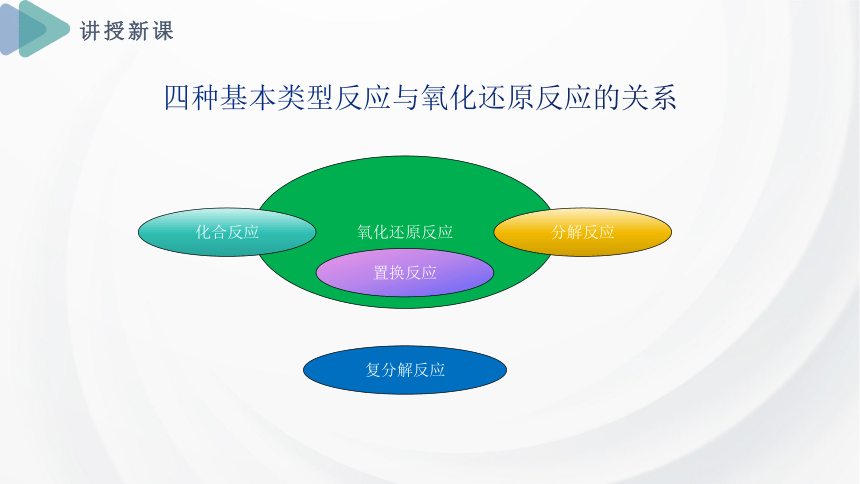
四种基本类型反应与氧化还原反应的关系
氧化还原反应
分解反应
化合反应
置换反应
复分解反应
元素化合价确定的一般规律
1、由金属和非金属组成的化合物中,金属元素一般显 价,非金属元素一般显 价;
2、化合物中,氧通常显 价,氢通常显 价;
3、化合物中各元素化合价的代数和为 ;
4、单质中元素的化合价为 。
负
正
-2
+1
0
0
CaCO3 = CaO + CO2 ↑
2Fe + 3Cl2 2FeCl3
Na2O + H2O = 2NaOH
非氧化还原反应
氧化还原反应
非氧化还原反应
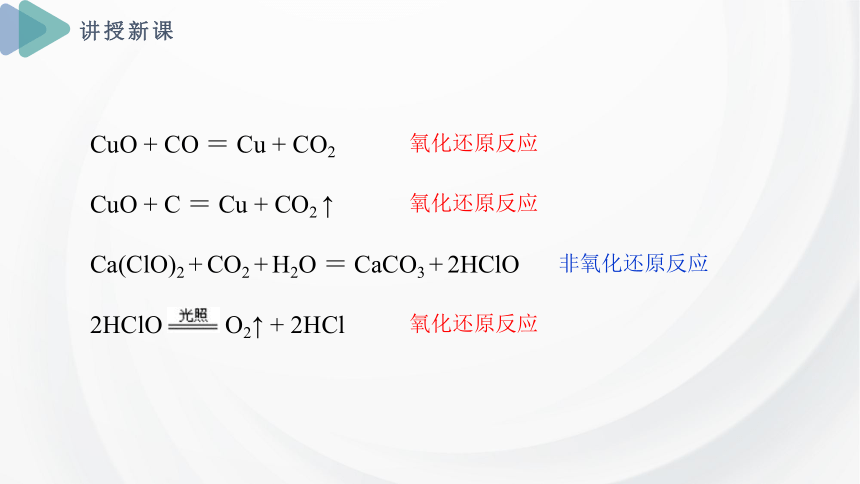
判断下列反应是否属于氧化还原反应?
CuO + CO = Cu + CO2
CuO + C = Cu + CO2 ↑
Ca(ClO)2 + CO2 + H2O = CaCO3 + 2HClO
2HClO O2↑ + 2HCl
氧化还原反应
非氧化还原反应
氧化还原反应
氧化还原反应
对于氧化还原反应,元素的化合价在反应过程中为什么有升有降?
分析 NaCl 的形成过程
2Na + Cl2 2NaCl
问题探究
2Na + Cl2 = 2NaCl
+11
+17
+17
+11
Na+ Cl-
Na
Cl
Cl-
Na+
该化学反应中化合价升降的原因 。
0
0
+1
-1
电子的得失
生成 NaCl 时是“电子得失”,生成 HCl 时是“电子对偏移”。
即“电子得失”和“电子对偏移”统称为“电子的转移”。
说 明
一、氧化还原反应
1.定义:
凡是有电子转移的化学反应,称为氧化还原反应
2.特征:
反应前后化合价发生变化 (判断依据)
3.实质:
电子发生转移 (得失或偏移)
有电子转移的化学反应都是氧化还原反应。
氧化剂
还原剂
n个e-
失去电子
,被氧化
得到电子
,被还原
反应物中失去电子(元素化合价升高)的物质—被氧化
二、氧化剂和还原剂
1.定义:
反应物中得到电子(元素化合价降低)的物质—被还原
氧化剂:
还原剂:
0
0
+1
-1
化合价降低
被还原
化合价升高
被氧化
失去2e-
得到2e-
还原剂
氧化剂
①氧化剂和还原剂均是指反应物质,是一种化学试剂,不是某一种元素。
②氧化剂本身被还原,发生还原反应,得到的产物是还原产物。
③还原剂本身被氧化,发生氧化反应,得到的产物是氧化产物。
说 明
-4 -3 -2 -1 0 +1 +2 +3 +4 +5 +6 +7
失去e-,
化合价升高,
被氧化,
作还原剂
得到e-,
作氧化剂
化合价降低,
被还原,
2.化合价升降与得失电子的关系
2HCl + Fe = FeCl2 + H2↑
氧化剂, 还原剂;
元素被氧化, 元素被还原.
+1 0 +2 0
HCl
Fe
Fe
H
三、氧化产物和还原产物
氧化产物:还原剂失去电子生成的产物—(元素
化合价升高)生成物。
还原产物:氧化剂得到电子生成的物质—(元素
化合价降低)生成物。
2HCl + Fe = FeCl2 + H2↑
还原剂
氧化产物
氧化剂
还原产物
MnO2 + 4HCl(浓)=== MnCl2 + Cl2 + 2H2O↑
氧化剂 还原剂
被氧化 被还原
氧化产物 还原产物
0
-1
-1
+4
+2
MnO2
HCl
HCl
MnO2
Cl2
MnCl2
氧化剂 + 还原剂 = 氧化产物 + 还原产物
得到电子,化合价降低,被还原,发生还原反应
失去电子,化合价升高,被氧化,发生氧化反应
指出下列反应中的氧化剂、还原剂、氧化产物、还原产物。
① CuO + CO Cu + CO2
② 2KClO3 2KCl + 3O2↑
③ Cl2 + H2O = HCl + HClO
④ MnO2 + 4HCl(浓) MnCl2 + Cl2↑+ 2H2O
⑤ Cu + 2H2SO4(浓) = CuSO4 + SO2↑+ 2H2O
MnO2
歧化反应
小窍门:提供氧的一般是氧化剂
Cl2 + H2O = HCl + HClO
SO2 + 2H2S = 3S↓ + H2O
歧化反应
0
-1
+1
归中反应
0
-2
+4
知识拓展
四、氧化还原反应得失电子的表示方法——双线桥法
例如:2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
1.正确判断各反应物、生成物各元素的化合价及其变化。
0 +1 +3 0
步骤:
2.两个线桥一个在上、一个在下,线桥的方向是从反应物一方指向生成物一方,首尾都必须对应与发生化合价发生变化的同种元素。
步骤:
例如:2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
0 +1 +3 0
3.标出得失电子数,电子符号用“e-”来表示。
4.得失电子总数 = 原子个数 × 每个原子得失电子数
失去 2×3e-
得到 3×2e-
注意:反应中失去电子的总数等于得到电子的总数
步骤:
例如:2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑
0 +1 +3 0
失去 2×e-
Cl2 + H2O = HCl + HClO
失去 e-
得到 e-
得到 2e-
+4
+2
-1
0
0
+1
-1
MnO2 + 4 HCl(浓) = MnCl2 + Cl2 + 2H2O
1.
2.
H2 + Cl2 = 2HCl
2Na + Cl2 = 2NaCl
0
0
+1
-1
2e-
箭头由失电子(偏移)元素指向得电子(偏向)元素,并标明转移数目。
0
0
+1
-1
2e-
四、氧化还原反应得失电子的表示方法——单线桥法
箭头必须由还原剂中失电子的元素指向氧化剂中得电子的元素。
箭头方向表示 电子转移的方向 。
在“桥”上标明转移的 电子总数 。
知识拓展
五、氧化还原反应方程式的配平
(1)配平原则:电子守恒、原子守恒、电荷守恒
(2)配平步骤 (以高锰酸钾和浓盐酸反应制氯气为例):
① 标出化合价变化了的元素的化合价。
KMnO4 + HCl KCl + MnCl2 + Cl2↑+ H2O
+7
-1
+2
0
② 根据元素存在的实际形式调整发生了氧化还原反应的物质的系数,使之成 1︰1 的关系,然后使化合价升降总数相等。
KMnO4 + 2HCl KCl + MnCl2 + Cl2↑+ H2O
+7
-1
+2
0
化合价 ↓ 5×2
化合价 ↑ 2×5
③ 根据化合价升降总数相等确定发生氧化还原反应的物质的化学计量数。
2KMnO4+10HCl KCl+2MnCl2+5Cl2↑+H2O
④ 利用元素守恒,用观察法配平没有参加氧化还原反应的其他物质的系数。
2KMnO4+16HCl 2KCl+2MnCl2+5Cl2↑+8H2O
⑤ 检查方程式两边各原子的个数是否相等,离子方程式还要检查方程式两边的离子所带的电荷数是否相等。
2KMnO4+16HCl = 2KCl+2MnCl2+5Cl2↑+8H2O
例:24mL浓度为0.05mol/L的Na2SO3溶液,恰好与20mL浓度为0.02mol/L的K2X2O7溶液完全反应,则元素X在被还原产物中的化合价是 ( )
A. +6 B. +3 C. +2 D. 0
B
六、氧化还原反应的计算
A
1. 还原性:失去电子的性质 (实质)
化合价升高 (特征)
2. 氧化性:得到电子的性质 (实质)
化合价降低 (特征)
七、氧化性与还原性
下列由左边物质生成右边物质有无氧化还原变化?左边物质表现什么性质?
(1) KI → I2
(2) SO2 → SO3
(3) HgCl2 → Hg2Cl2
(4) SO2 → S
(5) N2O5 → N2O3
(6) KMnO4 → K2MnO4
还原性
还原性
氧化性
氧化性
氧化性
氧化性
-1 0 +1 +3 +5 +7
Cl -- Cl -- Cl -- Cl -- Cl -- Cl
HCl Cl2 HClO HClO2 HClO3 HClO4
只能做还原剂
只能做氧化剂
既能做氧化剂,又能做还原剂
小结:判断微粒(分子、原子、离子)是否具有氧化性或还原性。
(1)元素处于最高价态--只能得电子
--只有氧化性
(2)元素处于最低价态--只能失电子
--只有还原性
(3)元素处于中间价态--
即能得电子 既有氧化性
又能失电子 又有还原性
下列微粒中只有氧化性的是 ________;
只有还原性的是 ___________
既有氧化性又有还原性的是 _______________。
(1) Cl2 (2) Cl- (3) Fe (4) Fe2+
(5) Fe3+ (6) O2 (7) S2- (8) S
(9) SO2 (10) HCl
5、6
2、3、7
1、4、
8、9、10
