2.3 课时1 人类认识原子结构的历程 原子的构成 课件(共20张PPT) 2024-2025学年高一化学苏教版(2019)必修第一册
文档属性
| 名称 | 2.3 课时1 人类认识原子结构的历程 原子的构成 课件(共20张PPT) 2024-2025学年高一化学苏教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-25 19:42:54 | ||
图片预览






文档简介
(共20张PPT)
请大家结合初中学过的知识及教材P 44-45的介绍,思考下列几个问题。
1、原子结构模型的演变经历了哪几个重要阶段?
2、用简洁的语言表达各阶段(道尔顿、汤姆生、卢瑟福、波尔)
对原子结构模型的认识特点?
3、请你谈谈从原子结构的演变得到什么启迪?
一、原子结构模型的演变
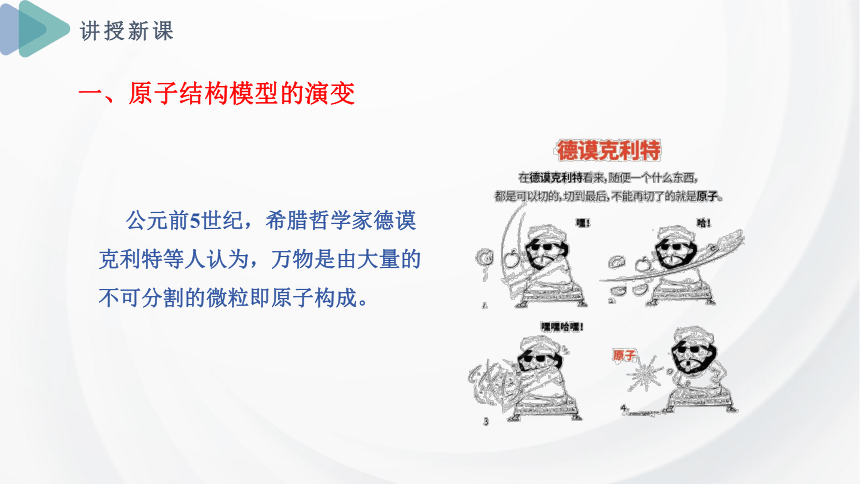
公元前5世纪,希腊哲学家德谟克利特等人认为,万物是由大量的不可分割的微粒即原子构成。
1803年,英国科学家道尔顿认为物质是由原子组成,原子不能被创造,也不能被毁灭。原子是一颗不可再分的实心球。
科学家 观点 原子结构模型
道尔顿
物质由原子组成,且原子不可再分割
同种元素的原子质量和性质是相同的
原子是一个实心球体
科学家 观点 原子结构模型
汤姆生
电子是一种比原子小的微粒
电子带负电荷,原子内均匀分布正电荷
电子镶嵌在原子上
葡萄干面包模型
1904年,汤姆生提出“葡萄干面包式”模型。他认为原子是一个平均分布着正电荷的球铁,其中镶嵌了许多电子,中和了正电荷,使得整个原子显中性。
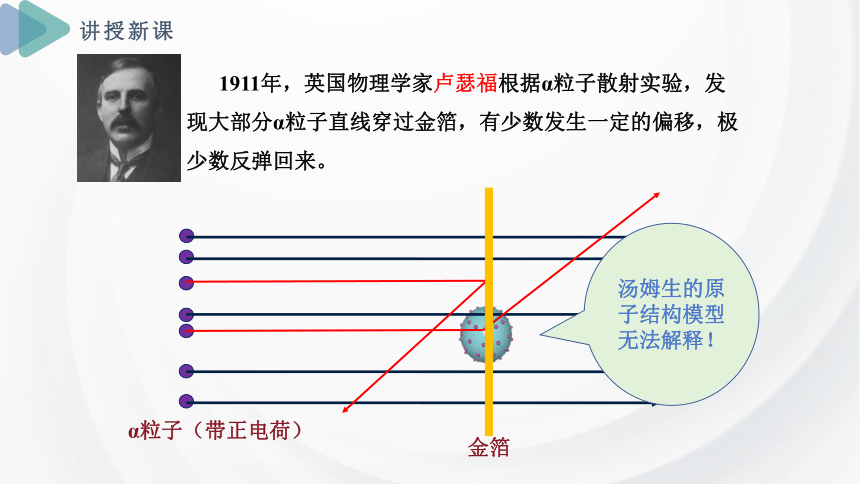
1911年,英国物理学家卢瑟福根据α粒子散射实验,发现大部分α粒子直线穿过金箔,有少数发生一定的偏移,极少数反弹回来。
金箔
α粒子(带正电荷)
汤姆生的原子结构模型无法解释!
原子
原子核
核外电子
卢瑟福提出原子核式结构
科学家 观点 原子结构模型
卢瑟福
原子中存在一个质量极大带正电的原子核
电子绕核高速运动(类似行星绕恒星)
带核的原子
结构模型
原子核体积极小,与电子间间隙很大
科学家 观点 原子结构模型
玻尔
玻尔发现氢原子光谱不连续的现象,通过实验并引入量子论观点,解决了卢瑟福核式结构模型不稳定的问题,提出了一个全新的原子结构模型。
电子在一系列稳定的轨道上运动
玻尔原子模型
每个轨道都有一个确定的能量值
电子在稳定的轨道上,能量不变
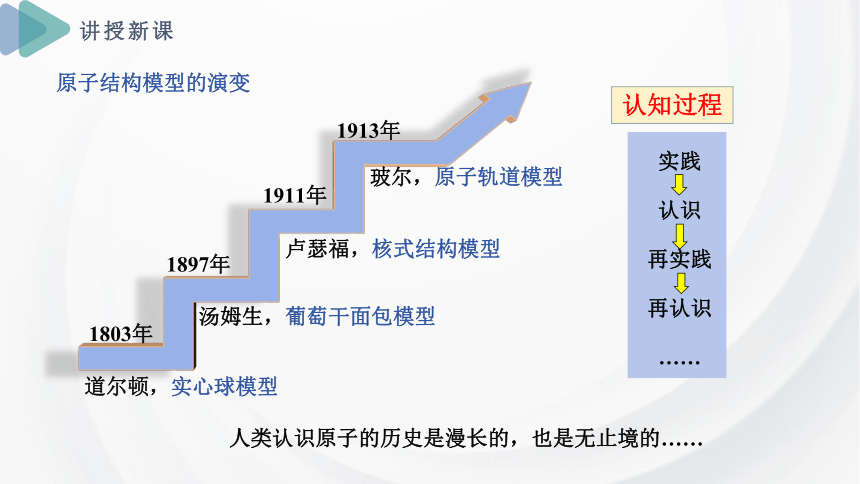
原子结构模型的演变
1803年
1897年
道尔顿,实心球模型
汤姆生,葡萄干面包模型
1911年
1913年
卢瑟福,核式结构模型
玻尔,原子轨道模型
实践
认识
再实践
再认识
……
认知过程
人类认识原子的历史是漫长的,也是无止境的……
1、核式结构模型是哪位科学家提出的( )
A、玻尔 B、道尔顿
C、卢瑟福 D、汤姆生
2、汤姆生提出了哪种原子结构理论( )
A、实心球模型 B、葡萄干面包模型
C、核式结构模型 D、电子分层排布
C
B
二、原子核的构成
(电中性)
(带正电)
(带正电)
(不带电)
(带负电)
核电荷数=质子数
=核外电子数
=原子序数
原子的质量主要是由哪些微观粒子决定的?
微粒 质量/kg 相对质量 电量/C 电荷
电子 9.109×10-31 0.0005484 -1.602×10-19 -1
质子 1.673×10-27 1.007 1.602×10-19 +1
中子 1.675×10-27 1.008 0 0
原子的质量≈原子核质量=质子质量+中子质量
根据数据分析原子的微观粒子之间的关系
原子的相对质量在数值上与原子核内质子数和中子数有什么关系?
相对原子的质量≈质子数+中子数=质量数
微粒 质量/kg 相对质量 电量/C 电荷
电子 9.109×10-31 0.0005484 -1.602×10-19 -1
质子 1.673×10-27 1.007 1.602×10-19 +1
中子 1.675×10-27 1.008 0 0
【原子的表示方法】
X
——元素符号
质量数——
A
(核内质子数)核电荷数 ——
Z
粒子符号 质子数(Z) 质量数(A) 中子数(N) 核外电子数
2311Na
3717Cl
11
17
23
37
12
20
11
17
质子数(Z)+中子数(N)=质量数(A)
阳离子的核外电子数=质子数-电荷数
阴离子的核外电子数=质子数+电荷数
【离子的表示方法】
粒子符号 质子数(Z) 质量数(A) 中子数(N) 电荷数 核外电子数
2311Na+
3717Cl-
11
17
23
37
1
1
10
18
12
20
【三种氢原子】
氢元素的原子核 原子符号AZX 称
质子数(Z) 中子数(N) 1 0 氕
1 1 氘
1 2 氚
11H
21H
31H
这三种氢原子的原子结构有什么异同?
它们是同一种元素吗?
元素是具有相同质子数(或核电荷数)的一类原子的总称。
【核素和同位素】
具有一定数目质子和一定数目中子的一种原子叫做核素。
质子数相同而中子数不同的同一元素的不同原子互称为同位素。
同一种元素
三种不同核素
互称为同位素
同一种元素
三种不同核素
互称为同位素
元素、核素、同位素、同素异形体的比较
元素 核素 同位素 同素异形体
本质 质子数相同的一类原子 质子数、中子数都一定的原子 质子数相同、中子数不同的核素 同种元素形成的不同单质
范畴 同类原子 原子 原子 单质
特性 只论种类,不论个数 — 化学性质几乎完全相同 组成元素相同、性质不同
决定因素
质子数
质子数、中子数
质子数、中子数
组成元素、结构
14C的考古应用:测定年代
宇宙射线中的中子与大气中的大量存在的稳定核素氮14发生N(n,p)C反应能够产生碳14,而碳14又会发生半衰期T=5730年的β衰变变成氮14,由此构建一个核素平衡。
碳14与氧气反应生成的二氧化碳被生物圈接收,活体生物体内的碳14与碳12浓度比例是一定【经测定,碳14的同位素丰度为1.2×10-12】的,只有当生物死亡后,碳循环中断,碳14逐渐衰变至没有。在化石标本中采样测量碳14的丰度,与1.2×10-12比较,即可计算出生物生活的年代。
拓展视野
科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。下列有关“四中子”粒子的说法中错误的是( )
A.该粒子不显电性
B.该粒子的质量数为4
C.该粒子是氢元素的一种同位素原子
D.该粒子质量比氢原子大
C
请大家结合初中学过的知识及教材P 44-45的介绍,思考下列几个问题。
1、原子结构模型的演变经历了哪几个重要阶段?
2、用简洁的语言表达各阶段(道尔顿、汤姆生、卢瑟福、波尔)
对原子结构模型的认识特点?
3、请你谈谈从原子结构的演变得到什么启迪?
一、原子结构模型的演变
公元前5世纪,希腊哲学家德谟克利特等人认为,万物是由大量的不可分割的微粒即原子构成。
1803年,英国科学家道尔顿认为物质是由原子组成,原子不能被创造,也不能被毁灭。原子是一颗不可再分的实心球。
科学家 观点 原子结构模型
道尔顿
物质由原子组成,且原子不可再分割
同种元素的原子质量和性质是相同的
原子是一个实心球体
科学家 观点 原子结构模型
汤姆生
电子是一种比原子小的微粒
电子带负电荷,原子内均匀分布正电荷
电子镶嵌在原子上
葡萄干面包模型
1904年,汤姆生提出“葡萄干面包式”模型。他认为原子是一个平均分布着正电荷的球铁,其中镶嵌了许多电子,中和了正电荷,使得整个原子显中性。
1911年,英国物理学家卢瑟福根据α粒子散射实验,发现大部分α粒子直线穿过金箔,有少数发生一定的偏移,极少数反弹回来。
金箔
α粒子(带正电荷)
汤姆生的原子结构模型无法解释!
原子
原子核
核外电子
卢瑟福提出原子核式结构
科学家 观点 原子结构模型
卢瑟福
原子中存在一个质量极大带正电的原子核
电子绕核高速运动(类似行星绕恒星)
带核的原子
结构模型
原子核体积极小,与电子间间隙很大
科学家 观点 原子结构模型
玻尔
玻尔发现氢原子光谱不连续的现象,通过实验并引入量子论观点,解决了卢瑟福核式结构模型不稳定的问题,提出了一个全新的原子结构模型。
电子在一系列稳定的轨道上运动
玻尔原子模型
每个轨道都有一个确定的能量值
电子在稳定的轨道上,能量不变
原子结构模型的演变
1803年
1897年
道尔顿,实心球模型
汤姆生,葡萄干面包模型
1911年
1913年
卢瑟福,核式结构模型
玻尔,原子轨道模型
实践
认识
再实践
再认识
……
认知过程
人类认识原子的历史是漫长的,也是无止境的……
1、核式结构模型是哪位科学家提出的( )
A、玻尔 B、道尔顿
C、卢瑟福 D、汤姆生
2、汤姆生提出了哪种原子结构理论( )
A、实心球模型 B、葡萄干面包模型
C、核式结构模型 D、电子分层排布
C
B
二、原子核的构成
(电中性)
(带正电)
(带正电)
(不带电)
(带负电)
核电荷数=质子数
=核外电子数
=原子序数
原子的质量主要是由哪些微观粒子决定的?
微粒 质量/kg 相对质量 电量/C 电荷
电子 9.109×10-31 0.0005484 -1.602×10-19 -1
质子 1.673×10-27 1.007 1.602×10-19 +1
中子 1.675×10-27 1.008 0 0
原子的质量≈原子核质量=质子质量+中子质量
根据数据分析原子的微观粒子之间的关系
原子的相对质量在数值上与原子核内质子数和中子数有什么关系?
相对原子的质量≈质子数+中子数=质量数
微粒 质量/kg 相对质量 电量/C 电荷
电子 9.109×10-31 0.0005484 -1.602×10-19 -1
质子 1.673×10-27 1.007 1.602×10-19 +1
中子 1.675×10-27 1.008 0 0
【原子的表示方法】
X
——元素符号
质量数——
A
(核内质子数)核电荷数 ——
Z
粒子符号 质子数(Z) 质量数(A) 中子数(N) 核外电子数
2311Na
3717Cl
11
17
23
37
12
20
11
17
质子数(Z)+中子数(N)=质量数(A)
阳离子的核外电子数=质子数-电荷数
阴离子的核外电子数=质子数+电荷数
【离子的表示方法】
粒子符号 质子数(Z) 质量数(A) 中子数(N) 电荷数 核外电子数
2311Na+
3717Cl-
11
17
23
37
1
1
10
18
12
20
【三种氢原子】
氢元素的原子核 原子符号AZX 称
质子数(Z) 中子数(N) 1 0 氕
1 1 氘
1 2 氚
11H
21H
31H
这三种氢原子的原子结构有什么异同?
它们是同一种元素吗?
元素是具有相同质子数(或核电荷数)的一类原子的总称。
【核素和同位素】
具有一定数目质子和一定数目中子的一种原子叫做核素。
质子数相同而中子数不同的同一元素的不同原子互称为同位素。
同一种元素
三种不同核素
互称为同位素
同一种元素
三种不同核素
互称为同位素
元素、核素、同位素、同素异形体的比较
元素 核素 同位素 同素异形体
本质 质子数相同的一类原子 质子数、中子数都一定的原子 质子数相同、中子数不同的核素 同种元素形成的不同单质
范畴 同类原子 原子 原子 单质
特性 只论种类,不论个数 — 化学性质几乎完全相同 组成元素相同、性质不同
决定因素
质子数
质子数、中子数
质子数、中子数
组成元素、结构
14C的考古应用:测定年代
宇宙射线中的中子与大气中的大量存在的稳定核素氮14发生N(n,p)C反应能够产生碳14,而碳14又会发生半衰期T=5730年的β衰变变成氮14,由此构建一个核素平衡。
碳14与氧气反应生成的二氧化碳被生物圈接收,活体生物体内的碳14与碳12浓度比例是一定【经测定,碳14的同位素丰度为1.2×10-12】的,只有当生物死亡后,碳循环中断,碳14逐渐衰变至没有。在化石标本中采样测量碳14的丰度,与1.2×10-12比较,即可计算出生物生活的年代。
拓展视野
科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。下列有关“四中子”粒子的说法中错误的是( )
A.该粒子不显电性
B.该粒子的质量数为4
C.该粒子是氢元素的一种同位素原子
D.该粒子质量比氢原子大
C
