2.3 课时2 原子核外电子排布 课件 (共22张PPT)2024-2025学年高一化学苏教版(2019)必修第一册
文档属性
| 名称 | 2.3 课时2 原子核外电子排布 课件 (共22张PPT)2024-2025学年高一化学苏教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-25 19:44:13 | ||
图片预览



文档简介
(共22张PPT)
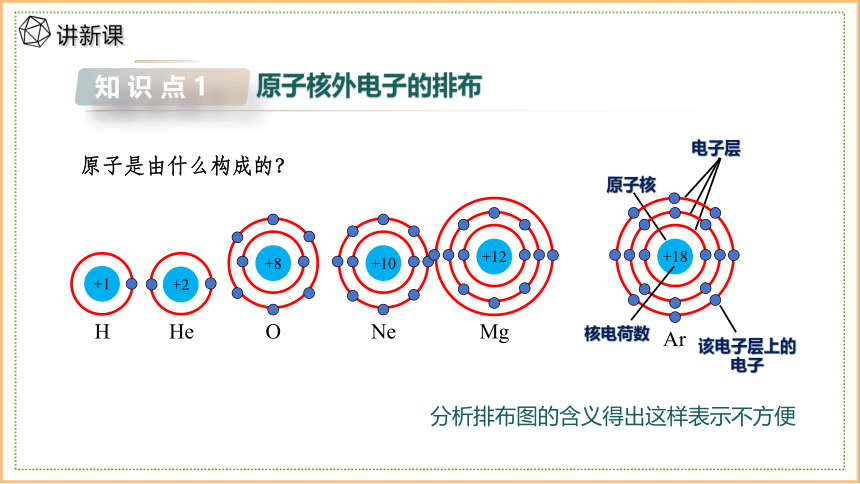
现代物质结构学说中电子在原子核外很小的空间内做高速运动,其运动规律与一般物体不同,没有确定的轨道。
钠原子核外有11个电子,这11个电子是聚成一堆在离核相同的距离处运动,还是分散在离核不同的距离处运动?
思考与讨论
+2
He
+10
Ne
+1
H
该电子层上的电子
原子核
电子层
+8
O
+12
Mg
+18
Ar
核电荷数
原子核外电子的排布
知 识 点 1
分析排布图的含义得出这样表示不方便
原子是由什么构成的?
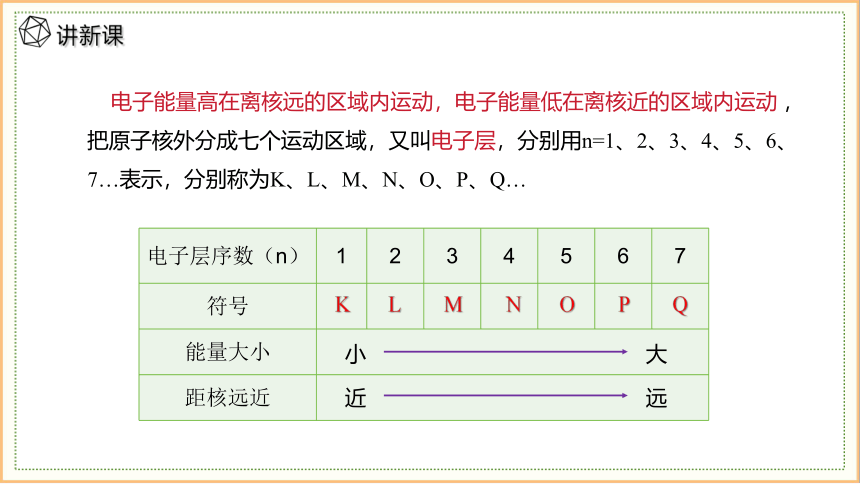
电子层序数(n) 1 2 3 4 5 6 7
符号
能量大小 距核远近 K L M N O P Q
小 大
近 远
电子能量高在离核远的区域内运动,电子能量低在离核近的区域内运动 ,把原子核外分成七个运动区域,又叫电子层,分别用n=1、2、3、4、5、6、7…表示,分别称为K、L、M、N、O、P、Q…
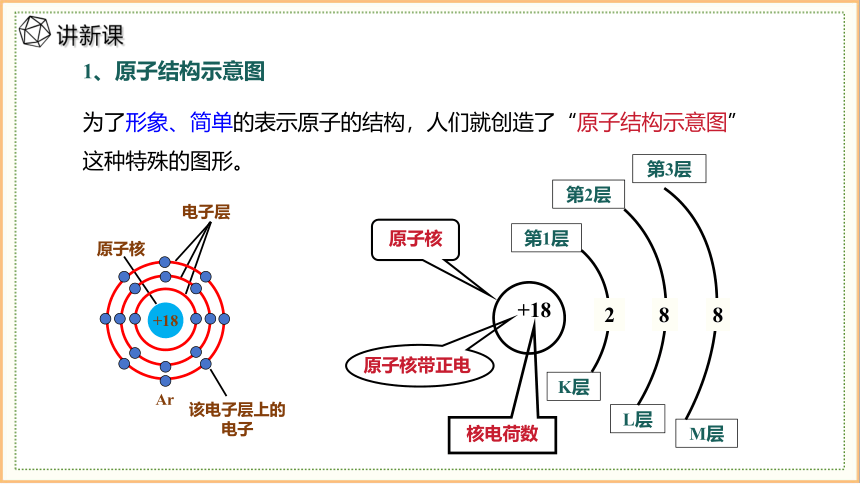
为了形象、简单的表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。
+18
第1层
第2层
第3层
K层
L层
M层
2
8
8
1、原子结构示意图
原子核
原子核带正电
核电荷数
该电子层上的电子
原子核
电子层
+18
Ar
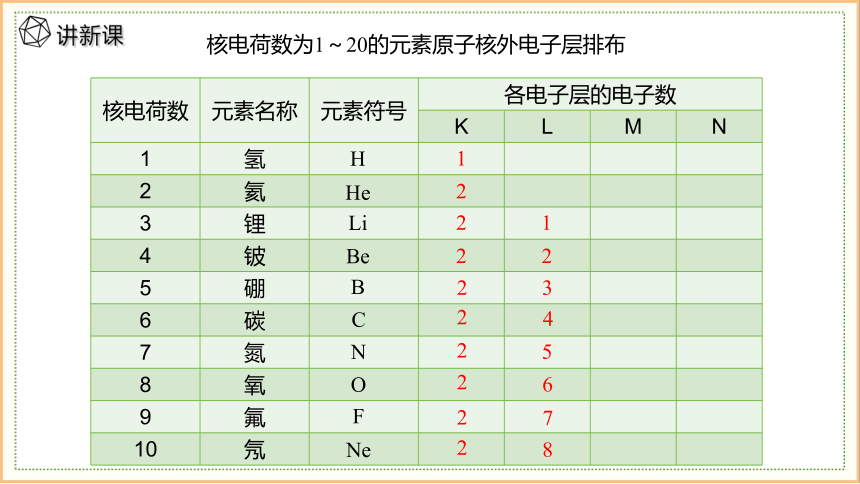
核电荷数 元素名称 元素符号 各电子层的电子数 K L M N
1 氢
2 氦
3 锂
4 铍
5 硼
6 碳
7 氮
8 氧
9 氟
10 氖
B
Be
Li
He
H
1
2
2
1
2
2
2
3
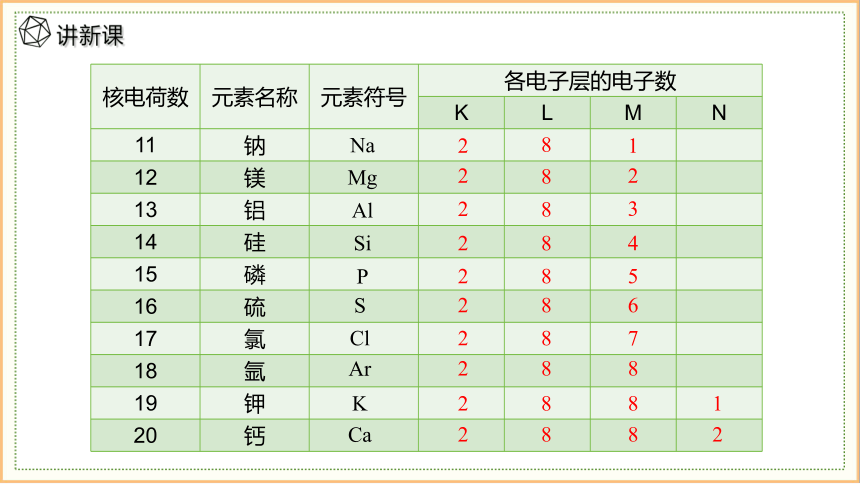
核电荷数为1~20的元素原子核外电子层排布
Ne
F
O
N
C
2
2
2
2
2
4
5
6
7
8
核电荷数 元素名称 元素符号 各电子层的电子数 K L M N
11 钠
12 镁
13 铝
14 硅
15 磷
16 硫
17 氯
18 氩
19 钾
20 钙
P
Si
Al
Mg
Na
2
2
2
2
2
8
8
8
8
8
5
4
3
2
1
S
Cl
Ar
K
Ca
2
2
2
2
2
8
8
8
8
8
8
8
8
7
6
2
1
①电子总是尽先排布在能量最低的电子层里,然后由往外,依次排在能量逐步升高的电子层里(能量最低原理),先排K层,排满K层后再排L层,排满L层后再排M层。
2、原子核外电子排布一般规律
②每个电子层最多只能容纳2n2个电子。
③最外层最多只能容纳 8 个电子(K层为最外层时不能超过 2 个),次外层不超过 18 个,倒数第三层不超过 32 个。
以下规律相互制约,相互联系
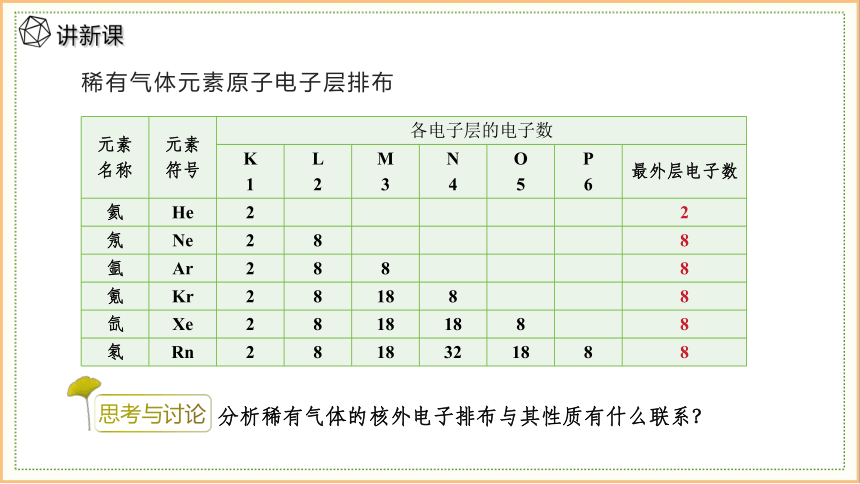
稀有气体元素原子电子层排布
元素 名称 元素 符号 各电子层的电子数 K 1 L 2 M 3 N 4 O 5 P 6 最外层电子数
氦 He 2 2
氖 Ne 2 8 8
氩 Ar 2 8 8 8
氪 Kr 2 8 18 8 8
氙 Xe 2 8 18 18 8 8
氡 Rn 2 8 18 32 18 8 8
分析稀有气体的核外电子排布与其性质有什么联系?
思考与讨论
1、对比稀有气体的结构,分析 Mg、O 核外电子排布特点。
2、Mg、O 为什么容易形成 Mg2+、O2-?在变化过程中改变的是什么微粒?
3、由 Mg、O 你分别想到了哪些类似的原子,它们在结构上有什么共同点?性质上呢?
+8
O
+12
Mg
思考与讨论
+12
2
8
2
失去电子
+12
2
8
Mg
Mg2+
+8
2
6
+8
2
8
得到电子
O
O2-
氧化镁的形成过程
氧气和金属镁反应生成氧化镁,氧化镁是氧元素与镁元素相结合的产物。
2 Mg + O2 ===== 2 MgO
点燃
01
STEP
宏观
每个 Mg 失去2个电子形成与 Ne 一样的稳定电子层结构的 Mg2+,每个 O 得到2个电子形成与 Ne 一样的稳定电子层结构的 O2-,带正电荷的Mg2+ 与带负电荷的 O2- 相互发生电性作用,形成稳定的MgO。
02
STEP
+12
Mg
+8
O
+8
Mg2+
O2-
MgO
+12
微观
原子最外层的电子数小于8个时,在化学反应中总是得到或失去电子而达到最外层8电子的稳定结构。
(1)稳定结构:原子既不容易失去电子又不容易得到电子,即原子最外层有 8 个电子(He为 2 )处于稳定。
(如 He、Ne、Ar等)
(2)不稳定结构:原子容易失去电子或容易得到电子转化最外电子层上为 8(有些为 2 )个电子的稳定结构。
(如,失去: Na、Mg、Al 得到:F、O、Cl)
3、原子结构与元素性质的关系 (结构决定性质)
金属元素 非金属元素
最外层电子数: <4 ≥4
得失电子趋势: 易失 易得
元素性质: 金属性 非金属性
元素 化合价 原子最外层电子数目 失去(或得到)电子的数目
Na
Mg 2
O 6
Cl -1
+1
1
失1
+2
失2
-2
得2
7
得1
4、元素化合价与最外层电子数的关系
原子
最外层电子数﹤4时,容易失去电子
最外层电子数 > 4时,容易得到电子
化合价=+失去的电子数
化合价=-得到的电子数(8-最外层电子数)
1、原子核外电子是 排布的。
2、金属元素的原子最外层一般 个电子,在化学反应中易 电子形成与稀有气体原子电子层排布相同的阳离子(稳定结构)。
分层
小于四
失去
3、非金属元素的原子最外层一般 个电子,在化学反应中易 电子形成与稀有气体原子电子层排布相同的阴离子(稳定结构)。
4、在化学反应过程中,原子核不发生任何变化,但原子的 发生变化,元素的化学性质主要决定于原子结构中的 。
大于或等于四
得到
最外层电子
最外层电子
决定
原子结构
原子构成
核素、同位素
核外电子排布
质子、中子、电子
同一元素不同核素互称为同位素
规律
能量最低
数量规律
K每层最多电子数:2n2
最外层最多8个(K层除外)
次外层不超过18个
质子数=核外电子数
质量数=质子数+中子数
互
相
制
约
C
A. B.
1.下列各原子结构示意图中所表示的核外电子排布正确的是( )
C. D.
2.关于原子核外电子排布的下列叙述不正确的( )
A.核外电子总是尽可能排布在能量最低的电子层
B.每一个电子层最多可容纳的电子数为2n2
C.某原子的核外最外层最多可容纳8个电子
D.当M层为次外层时,最多可容纳18个电子
C
3.写出1~18号元素中符合下列条件的原子(或离子)的微粒符号,并画出其结构示意图。
(1)某元素原子L层上的电子数为K层的3倍:______________。
O:
(2)某元素原子L层上的电子数为K层的一半:____________。
Li:
(3)某元素原子得到2个电子后所形成的电子总数与氩原子的电子总数相同的离子:______________。
S2-:
(4)某元素原子的最外层电子数等于次外层电子数的2倍:__________。
C:
现代物质结构学说中电子在原子核外很小的空间内做高速运动,其运动规律与一般物体不同,没有确定的轨道。
钠原子核外有11个电子,这11个电子是聚成一堆在离核相同的距离处运动,还是分散在离核不同的距离处运动?
思考与讨论
+2
He
+10
Ne
+1
H
该电子层上的电子
原子核
电子层
+8
O
+12
Mg
+18
Ar
核电荷数
原子核外电子的排布
知 识 点 1
分析排布图的含义得出这样表示不方便
原子是由什么构成的?
电子层序数(n) 1 2 3 4 5 6 7
符号
能量大小 距核远近 K L M N O P Q
小 大
近 远
电子能量高在离核远的区域内运动,电子能量低在离核近的区域内运动 ,把原子核外分成七个运动区域,又叫电子层,分别用n=1、2、3、4、5、6、7…表示,分别称为K、L、M、N、O、P、Q…
为了形象、简单的表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。
+18
第1层
第2层
第3层
K层
L层
M层
2
8
8
1、原子结构示意图
原子核
原子核带正电
核电荷数
该电子层上的电子
原子核
电子层
+18
Ar
核电荷数 元素名称 元素符号 各电子层的电子数 K L M N
1 氢
2 氦
3 锂
4 铍
5 硼
6 碳
7 氮
8 氧
9 氟
10 氖
B
Be
Li
He
H
1
2
2
1
2
2
2
3
核电荷数为1~20的元素原子核外电子层排布
Ne
F
O
N
C
2
2
2
2
2
4
5
6
7
8
核电荷数 元素名称 元素符号 各电子层的电子数 K L M N
11 钠
12 镁
13 铝
14 硅
15 磷
16 硫
17 氯
18 氩
19 钾
20 钙
P
Si
Al
Mg
Na
2
2
2
2
2
8
8
8
8
8
5
4
3
2
1
S
Cl
Ar
K
Ca
2
2
2
2
2
8
8
8
8
8
8
8
8
7
6
2
1
①电子总是尽先排布在能量最低的电子层里,然后由往外,依次排在能量逐步升高的电子层里(能量最低原理),先排K层,排满K层后再排L层,排满L层后再排M层。
2、原子核外电子排布一般规律
②每个电子层最多只能容纳2n2个电子。
③最外层最多只能容纳 8 个电子(K层为最外层时不能超过 2 个),次外层不超过 18 个,倒数第三层不超过 32 个。
以下规律相互制约,相互联系
稀有气体元素原子电子层排布
元素 名称 元素 符号 各电子层的电子数 K 1 L 2 M 3 N 4 O 5 P 6 最外层电子数
氦 He 2 2
氖 Ne 2 8 8
氩 Ar 2 8 8 8
氪 Kr 2 8 18 8 8
氙 Xe 2 8 18 18 8 8
氡 Rn 2 8 18 32 18 8 8
分析稀有气体的核外电子排布与其性质有什么联系?
思考与讨论
1、对比稀有气体的结构,分析 Mg、O 核外电子排布特点。
2、Mg、O 为什么容易形成 Mg2+、O2-?在变化过程中改变的是什么微粒?
3、由 Mg、O 你分别想到了哪些类似的原子,它们在结构上有什么共同点?性质上呢?
+8
O
+12
Mg
思考与讨论
+12
2
8
2
失去电子
+12
2
8
Mg
Mg2+
+8
2
6
+8
2
8
得到电子
O
O2-
氧化镁的形成过程
氧气和金属镁反应生成氧化镁,氧化镁是氧元素与镁元素相结合的产物。
2 Mg + O2 ===== 2 MgO
点燃
01
STEP
宏观
每个 Mg 失去2个电子形成与 Ne 一样的稳定电子层结构的 Mg2+,每个 O 得到2个电子形成与 Ne 一样的稳定电子层结构的 O2-,带正电荷的Mg2+ 与带负电荷的 O2- 相互发生电性作用,形成稳定的MgO。
02
STEP
+12
Mg
+8
O
+8
Mg2+
O2-
MgO
+12
微观
原子最外层的电子数小于8个时,在化学反应中总是得到或失去电子而达到最外层8电子的稳定结构。
(1)稳定结构:原子既不容易失去电子又不容易得到电子,即原子最外层有 8 个电子(He为 2 )处于稳定。
(如 He、Ne、Ar等)
(2)不稳定结构:原子容易失去电子或容易得到电子转化最外电子层上为 8(有些为 2 )个电子的稳定结构。
(如,失去: Na、Mg、Al 得到:F、O、Cl)
3、原子结构与元素性质的关系 (结构决定性质)
金属元素 非金属元素
最外层电子数: <4 ≥4
得失电子趋势: 易失 易得
元素性质: 金属性 非金属性
元素 化合价 原子最外层电子数目 失去(或得到)电子的数目
Na
Mg 2
O 6
Cl -1
+1
1
失1
+2
失2
-2
得2
7
得1
4、元素化合价与最外层电子数的关系
原子
最外层电子数﹤4时,容易失去电子
最外层电子数 > 4时,容易得到电子
化合价=+失去的电子数
化合价=-得到的电子数(8-最外层电子数)
1、原子核外电子是 排布的。
2、金属元素的原子最外层一般 个电子,在化学反应中易 电子形成与稀有气体原子电子层排布相同的阳离子(稳定结构)。
分层
小于四
失去
3、非金属元素的原子最外层一般 个电子,在化学反应中易 电子形成与稀有气体原子电子层排布相同的阴离子(稳定结构)。
4、在化学反应过程中,原子核不发生任何变化,但原子的 发生变化,元素的化学性质主要决定于原子结构中的 。
大于或等于四
得到
最外层电子
最外层电子
决定
原子结构
原子构成
核素、同位素
核外电子排布
质子、中子、电子
同一元素不同核素互称为同位素
规律
能量最低
数量规律
K
最外层最多8个(K层除外)
次外层不超过18个
质子数=核外电子数
质量数=质子数+中子数
互
相
制
约
C
A. B.
1.下列各原子结构示意图中所表示的核外电子排布正确的是( )
C. D.
2.关于原子核外电子排布的下列叙述不正确的( )
A.核外电子总是尽可能排布在能量最低的电子层
B.每一个电子层最多可容纳的电子数为2n2
C.某原子的核外最外层最多可容纳8个电子
D.当M层为次外层时,最多可容纳18个电子
C
3.写出1~18号元素中符合下列条件的原子(或离子)的微粒符号,并画出其结构示意图。
(1)某元素原子L层上的电子数为K层的3倍:______________。
O:
(2)某元素原子L层上的电子数为K层的一半:____________。
Li:
(3)某元素原子得到2个电子后所形成的电子总数与氩原子的电子总数相同的离子:______________。
S2-:
(4)某元素原子的最外层电子数等于次外层电子数的2倍:__________。
C:
