3.2 课时4 离子反应的应用课件 (共23张PPT)2024-2025学年高一化学苏教版(2019)必修第一册
文档属性
| 名称 | 3.2 课时4 离子反应的应用课件 (共23张PPT)2024-2025学年高一化学苏教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 451.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-25 19:45:16 | ||
图片预览




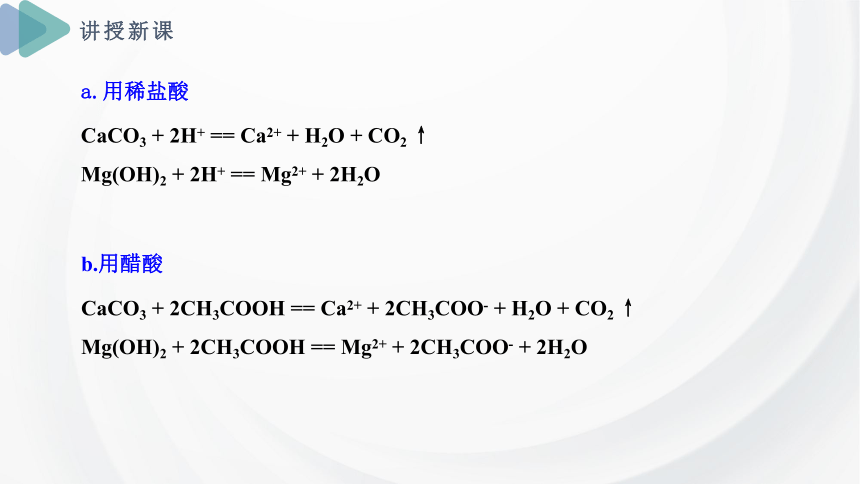




文档简介
(共23张PPT)
课时4 离子反应的应用
③ 离子反应发生的条件
(1)生成难溶的物质,如 AgCl、BaSO4、CaCO3、Cu(OH)2
(2)生成挥发性的物质,如 H2、CO2、NH3、H2S、Cl2
BaCl2 + Na2SO4 == BaSO4↓+ NaCl
Ba2+ + SO42- == BaSO4↓
HCl + Na2CO3 == H2O + CO2↑+ 2NaCl
2H+ + CO32- == H2O + CO2↑
一、离子反应
(3)生成难电离的物质,如 弱酸、弱碱、水
(4)发生氧化还原反应
HCl + NaOH == H2O + NaCl
H+ + OH- == H2O
1.暖水瓶使用一段时间后,壶胆内壁会形成一层水垢(组成为碳酸钙、氢氧化镁),水垢可用稀盐酸、醋酸来溶解而除去。请写出其反应的离子方程式。
b.用醋酸
CaCO3 + 2CH3COOH == Ca2+ + 2CH3COO- + H2O + CO2 ↑
Mg(OH)2 + 2CH3COOH == Mg2+ + 2CH3COO- + 2H2O
a.用稀盐酸
CaCO3 + 2H+ == Ca2+ + H2O + CO2 ↑
Mg(OH)2 + 2H+ == Mg2+ + 2H2O
C
1.下列离子方程式书写正确的是( )
A.碳酸钡与稀硫酸反应CO32- + 2H+ == CO2↑+ H2O
B.硫酸和氯化钡溶液反应Ba2+ + SO42- == BaSO4↓
C.氢氧化钙和少量二氧化碳反应2OH- + CO2 + Ca2+ == CaCO3↓+ H2O
D.铁钉放入硫酸铜溶液中Fe + 3Cu2+ == Fe3+ + 3Cu
离子方程式书写正确的判断依据:
(1)是否符合客观事实
(2)是否改写正确
(3)方程式是否配平(原子守恒、电荷守恒)
(4)是否漏写条件
注意
2.下列离子方程式的书写正确的是( )
A.实验室用大理石和稀盐酸制取CO2:
B.醋酸和氢氧化钠溶液反应:
C.铜和氯化铁溶液反应:
D.氢氧化铁和盐酸反应:
B
CO32- + 2H+ == CO2↑+ H2O
CH3COOH + OH- == CH3COO- + H2O
Cu + Fe3+ == Cu2+ + Fe2+
OH- + H+ == H2O
根据离子方程式的书写步骤写出下列反应的离子方程式。
(1)盐酸与氢氧化钠溶液反应.
(2)硫酸与氢氧化钾溶液反应.
(3)盐酸与氢氧化钡溶液反应.
(4)硝酸溶液与氢氧化钡溶液反应.
H+ + OH- = H2O
H+ + OH- = H2O
H+ + OH- = H2O
H+ + OH- = H2O
说说你的发现
H+ + OH- = H2O
H+ + OH- = H2O
H+ + OH- = H2O
H+ + OH- = H2O
H+ + OH- = H2O
④ 离子方程式的意义
一个离子反应不仅可表示一定物质间的反应,而且可表示所有同一类型的反应,揭示了反应的实质。
例如: H+ + OH- = H2O
这一离子方程式可以表示强酸和强碱生成可溶性盐和水的这一类中和反应。
二、离子共存
(1)离子间反应生成难溶的物质(沉淀);
(2)离子间反应生成挥发性的物质(气体);
(3)离子间反应生成难电离的物质(弱酸、弱碱或水等);
(4)离子间发生氧化还原反应。
离子间不能共存的情况有四种:
注意:隐含条件
如:溶液的颜色
溶液的酸碱性等
1. 下列各组中的离子,能够大量共存的是( )
D
2.下列各组离子,在强碱性溶液中可以大量共存的是( )
B
注意
(1)溶液无色透明时,则不能存在有色离子;
(Fe3+、MnO4-、Fe2+、Cu2+)
(2)强酸性溶液中不能存在与H+反应的离子;
(H+和弱酸根如 CO32-、HCO3-、F-、CH3COO-、S2-等)
(3) 强碱性溶液中不能存在与OH-反应的离子;
(OH-和弱碱根如 NH4+、Mg2+ 、Ag+等)
(4) 既不能跟H+又不能跟OH-大量共存
所有的多元弱酸的酸式酸根
(如HCO3-、HSO3-、HS-等)。
1.一种无色溶液中加入BaCl2溶液,生成不溶于稀HCl的白色沉淀,则该溶液中含有的离子是( )
A. 一定含有SO42-
B. 一定含有CO32-
C. 一定含有Ag+
D. 可能含有SO42-,也可能含有Ag+
D
2.向某溶液中加入过量盐酸生成白色沉淀;过滤后向滤液中加入过量的氨水,又有白色沉淀生成,原溶液中含有的离子可能是( )
A. Na+、Cu2+ B. Ag+、Al3+
C. Ag+、Ca2+ D. Al3+、Mg2+
B
3.实验室中有甲、乙两种含毒性的重金属离子的废液,甲废液呈碱性,主要含有毒离子Ba2+,如将甲、乙两废液按一定比例混合,毒性明显降低。则乙废液中可能含有的离子是( )
A. Cu2+和SO42- B. Cu2+和Cl
C. K+和SO42- D. Ag+和NO3
A
1.在酸性溶液中Fe2+与MnO4-能否共存?
2.向同浓度NaBr与NaI的混合溶液中通入氯气,哪种离子先被氧化?
3.向同浓度的Cu(NO3)2与AgNO3混合溶液中加入铁屑,哪种离子先被还原?
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
I-先被氧化。
Ag+先被还原。
思考
一、离子反应
③ 离子反应发生的条件
生成沉淀、气体、弱电解质或发生氧化还原
④ 离子方程式的意义
可以表示所有同一类型的反应
二、离子共存
(1)离子间反应生成难溶的物质(沉淀);
(2)离子间反应生成挥发性的物质(气体);
(3)离子间反应生成难电离的物质(弱酸、弱碱或水等);
(4)离子间发生氧化还原反应。
课时4 离子反应的应用
③ 离子反应发生的条件
(1)生成难溶的物质,如 AgCl、BaSO4、CaCO3、Cu(OH)2
(2)生成挥发性的物质,如 H2、CO2、NH3、H2S、Cl2
BaCl2 + Na2SO4 == BaSO4↓+ NaCl
Ba2+ + SO42- == BaSO4↓
HCl + Na2CO3 == H2O + CO2↑+ 2NaCl
2H+ + CO32- == H2O + CO2↑
一、离子反应
(3)生成难电离的物质,如 弱酸、弱碱、水
(4)发生氧化还原反应
HCl + NaOH == H2O + NaCl
H+ + OH- == H2O
1.暖水瓶使用一段时间后,壶胆内壁会形成一层水垢(组成为碳酸钙、氢氧化镁),水垢可用稀盐酸、醋酸来溶解而除去。请写出其反应的离子方程式。
b.用醋酸
CaCO3 + 2CH3COOH == Ca2+ + 2CH3COO- + H2O + CO2 ↑
Mg(OH)2 + 2CH3COOH == Mg2+ + 2CH3COO- + 2H2O
a.用稀盐酸
CaCO3 + 2H+ == Ca2+ + H2O + CO2 ↑
Mg(OH)2 + 2H+ == Mg2+ + 2H2O
C
1.下列离子方程式书写正确的是( )
A.碳酸钡与稀硫酸反应CO32- + 2H+ == CO2↑+ H2O
B.硫酸和氯化钡溶液反应Ba2+ + SO42- == BaSO4↓
C.氢氧化钙和少量二氧化碳反应2OH- + CO2 + Ca2+ == CaCO3↓+ H2O
D.铁钉放入硫酸铜溶液中Fe + 3Cu2+ == Fe3+ + 3Cu
离子方程式书写正确的判断依据:
(1)是否符合客观事实
(2)是否改写正确
(3)方程式是否配平(原子守恒、电荷守恒)
(4)是否漏写条件
注意
2.下列离子方程式的书写正确的是( )
A.实验室用大理石和稀盐酸制取CO2:
B.醋酸和氢氧化钠溶液反应:
C.铜和氯化铁溶液反应:
D.氢氧化铁和盐酸反应:
B
CO32- + 2H+ == CO2↑+ H2O
CH3COOH + OH- == CH3COO- + H2O
Cu + Fe3+ == Cu2+ + Fe2+
OH- + H+ == H2O
根据离子方程式的书写步骤写出下列反应的离子方程式。
(1)盐酸与氢氧化钠溶液反应.
(2)硫酸与氢氧化钾溶液反应.
(3)盐酸与氢氧化钡溶液反应.
(4)硝酸溶液与氢氧化钡溶液反应.
H+ + OH- = H2O
H+ + OH- = H2O
H+ + OH- = H2O
H+ + OH- = H2O
说说你的发现
H+ + OH- = H2O
H+ + OH- = H2O
H+ + OH- = H2O
H+ + OH- = H2O
H+ + OH- = H2O
④ 离子方程式的意义
一个离子反应不仅可表示一定物质间的反应,而且可表示所有同一类型的反应,揭示了反应的实质。
例如: H+ + OH- = H2O
这一离子方程式可以表示强酸和强碱生成可溶性盐和水的这一类中和反应。
二、离子共存
(1)离子间反应生成难溶的物质(沉淀);
(2)离子间反应生成挥发性的物质(气体);
(3)离子间反应生成难电离的物质(弱酸、弱碱或水等);
(4)离子间发生氧化还原反应。
离子间不能共存的情况有四种:
注意:隐含条件
如:溶液的颜色
溶液的酸碱性等
1. 下列各组中的离子,能够大量共存的是( )
D
2.下列各组离子,在强碱性溶液中可以大量共存的是( )
B
注意
(1)溶液无色透明时,则不能存在有色离子;
(Fe3+、MnO4-、Fe2+、Cu2+)
(2)强酸性溶液中不能存在与H+反应的离子;
(H+和弱酸根如 CO32-、HCO3-、F-、CH3COO-、S2-等)
(3) 强碱性溶液中不能存在与OH-反应的离子;
(OH-和弱碱根如 NH4+、Mg2+ 、Ag+等)
(4) 既不能跟H+又不能跟OH-大量共存
所有的多元弱酸的酸式酸根
(如HCO3-、HSO3-、HS-等)。
1.一种无色溶液中加入BaCl2溶液,生成不溶于稀HCl的白色沉淀,则该溶液中含有的离子是( )
A. 一定含有SO42-
B. 一定含有CO32-
C. 一定含有Ag+
D. 可能含有SO42-,也可能含有Ag+
D
2.向某溶液中加入过量盐酸生成白色沉淀;过滤后向滤液中加入过量的氨水,又有白色沉淀生成,原溶液中含有的离子可能是( )
A. Na+、Cu2+ B. Ag+、Al3+
C. Ag+、Ca2+ D. Al3+、Mg2+
B
3.实验室中有甲、乙两种含毒性的重金属离子的废液,甲废液呈碱性,主要含有毒离子Ba2+,如将甲、乙两废液按一定比例混合,毒性明显降低。则乙废液中可能含有的离子是( )
A. Cu2+和SO42- B. Cu2+和Cl
C. K+和SO42- D. Ag+和NO3
A
1.在酸性溶液中Fe2+与MnO4-能否共存?
2.向同浓度NaBr与NaI的混合溶液中通入氯气,哪种离子先被氧化?
3.向同浓度的Cu(NO3)2与AgNO3混合溶液中加入铁屑,哪种离子先被还原?
5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O
I-先被氧化。
Ag+先被还原。
思考
一、离子反应
③ 离子反应发生的条件
生成沉淀、气体、弱电解质或发生氧化还原
④ 离子方程式的意义
可以表示所有同一类型的反应
二、离子共存
(1)离子间反应生成难溶的物质(沉淀);
(2)离子间反应生成挥发性的物质(气体);
(3)离子间反应生成难电离的物质(弱酸、弱碱或水等);
(4)离子间发生氧化还原反应。
