2.2 课时1 化学反应的计算课件(共23张PPT) 2024-2025学年高一化学苏教版(2019)必修第一册
文档属性
| 名称 | 2.2 课时1 化学反应的计算课件(共23张PPT) 2024-2025学年高一化学苏教版(2019)必修第一册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-25 00:00:00 | ||
图片预览







文档简介
(共23张PPT)
1.认识物质的量在化学定量研究中的重要作用,能从定量的角度描述和分析物质及其变化。
2.能运用化学计量关系和物质的量概念研究溶液的组成。
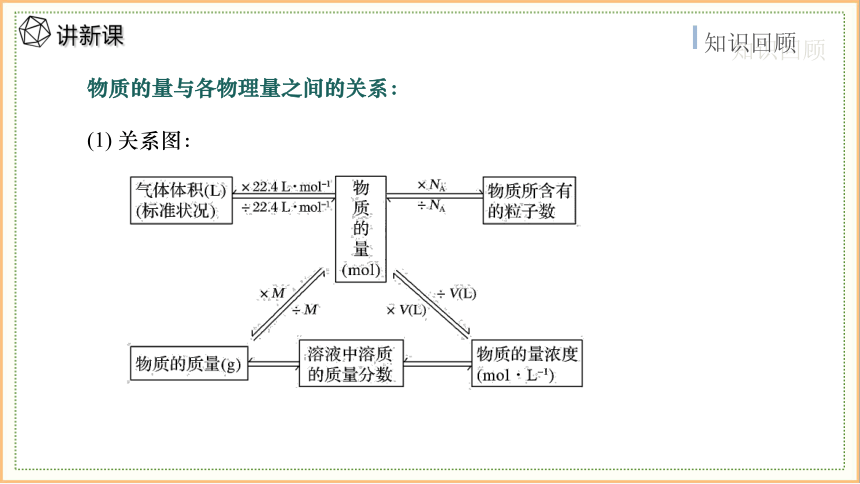
物质的量与各物理量之间的关系:
(1) 关系图:
知识回顾
知识回顾
nB =c·V
m
M
①已知物质的质量:nB=
V
22.4 L/mol
②已知标准状况时的气体体积: nB=
N
NA
③已知物质的粒子数: nB=
④已知溶液中的物质的量浓度:
(2)计算公式:
知识回顾
知识回顾
一、溶质物质的量浓度的基本计算
1. 根据定义式计算
cB =
关键找出溶质的物质的量(n)和溶液的体积(V)
在 200 mL 稀盐酸里溶有0.73 g HCl ,计算溶液的 c 。
n (HCl) =
0.73 g
36.5 g/mol
= 0.02 mol
V (HCl) =
200 mL
1000 mL/L
= 0.2 L
c (HCl) =
0.02 mol
0.2 L
= 0.1 mol/L
例1
2. 标准状况下气体溶于水,其物质的量浓度的计算
V(气体)
n
c
若已知溶液的体积
标准状况下 448 L NH3 溶于 1 L 水中,得密度0.9 g/cm3 的氨水。求此氨水的c。
例2
n (NH3) =
448 L
22.4 L/mol
= 20 mol
m (NH3) = 20 mol × 17 g/mol = 340 g
V(氨水) =
1340 g
0. 9 g/mL ×1000 mL/L
≈ 1.49 L
m (氨水) = 340 g + 1000 g = 1340 g
c(氨水) =
20 mol
1. 49L
≈13. 4 mol/L
(1)c=n/V中,V是溶液体积,不是溶剂体积,也不是两者之和;
(2)气体溶于水,溶质是气体与水反应的生成物。
NH3溶于水后主要溶质是NH3 H2O,但以NH3计算。
特别提醒
关于 c 计算的注意事项
1.一定物质的量浓度的某溶液,其浓度不因所取体积不同而变化;
2.找准溶质。比如Na2O溶于水,溶质是NaOH而不是Na2O;
3.表达式中的体积(V)是指溶液体积,不是溶剂的,也不是溶质与溶剂体积之和;
4.若将气体通入溶液中,则不能将气体体积与溶剂体积进行简单加和;
5.溶液相混合,除特殊说明体积可相加外,其他情况用公式V溶液= 计算。
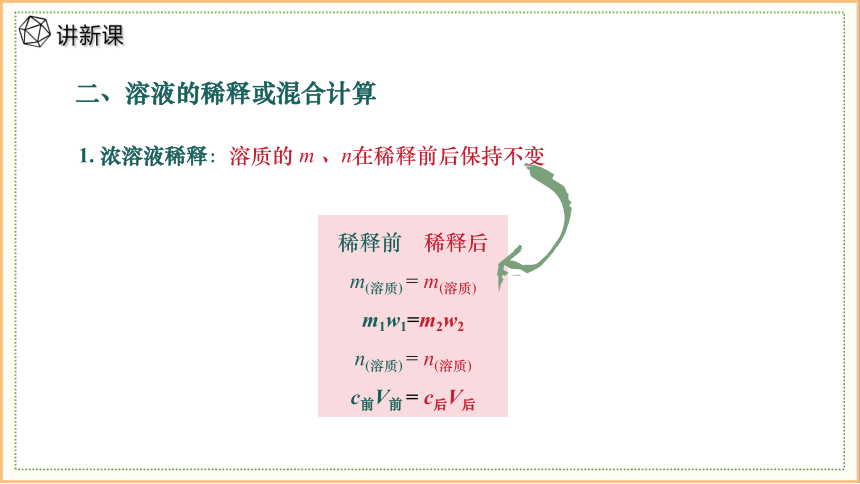
二、溶液的稀释或混合计算
1. 浓溶液稀释:溶质的 m 、n在稀释前后保持不变
稀释前 稀释后
m(溶质) = m(溶质)
m1w1=m2w2
n(溶质) = n(溶质)
c前V前 = c后V后
配制500 mL 0.6 mol/L 的NaOH溶液,需6 mol/LNaOH溶液多少 mL ?
6 mol/L×V = 0.6 mol/L ×500 mL
V = 50 mL
将5 mol/L的Mg(NO3)2溶液a mL加水稀释至b mL,问稀释后的溶液中c()?
10 mol/L×a mL= c() ×b mL
c()= —
10a
b
mol/L
例3
例4
2. 相同溶质的两溶液混合
(1)溶质的物质的量不变:c1V1+c2V2=c(混)·V(混);
(2)溶质的质量不变: m1w1+m2w2=m(混)·w(混)。
将0.10 mol·L-1氢氧化钠溶液和0.60 mol·L-1氢氧化钠溶液混合成0.20 mol·L-1的氢氧化钠溶液。求两种溶液的体积比(忽略混合时溶液体积变化)为_____。
4∶1
设所需0.10 mol·L-1的NaOH溶液体积V1,所需0.60 mol·L-1的NaOH溶液体积V2,0.10 mol·L-1·V1+0.60 mol·L-1·V2=0.20 mol·L-1·(V1+V2)
例5
溶液稀释或混合计算的注意事项
(1)同一溶质、不同浓度的溶液混合,在混合前后溶质的质量、物质的量保持守恒,溶液的质量保持守恒,但溶液的体积一般不守恒。
(2)混合后溶液的体积:
①若指出不考虑溶液体积改变,可认为是原溶液的体积之和;
②若给出混合后溶液的密度,应根据V(混)= 来计算。
三、物质的量浓度与溶质的质量分数的换算
c = ──
n
V
ω = ───── ×100%
m(溶质)
m(溶液)
换算公式:
M:溶质B的摩尔质量(单位:g·mol-1);
ρ:溶液密度(单位:g·mL-1 g/cm3);
ω = ─── ×100%
1000ρ
cM
(1)75 mL 2 mol/L NaOH 溶液的质量为 80 g,求该溶液ω
(2)12 mol/L 密度为1.32 g/cm3的硝酸溶液的质量分数
75 mL=0.075 L
n(NaOH)=c(NaOH) ×V[NaOH(aq)]
=2 mol/L×0.075 L
=0.15 mol
m(NaOH)=n(NaOH) ×M (NaOH )
=0.15 mol×40 g/mol
=6 g
ω(NaOH)= —————
m(NaOH)
m[NaOH(aq)]
×100%
=7.5%
ω=
设溶液的体积为 1 L即1000 mL
≈57.3%
12 mol/L×1 L×63 g/mol
1.32 g/cm3×1000 mL
×100%
例6
四、化学反应的计算
250 mL 稀硫酸与 28 g 铁恰好完全反应,计算该稀硫酸的物质的量浓度,生成H2的体积(标准状况)。
Fe + H2SO4 === FeSO4 + H2↑
化学计量数 1 1 1 1
扩大NA倍之后 NA NA NA NA
物质的量之比
1 1 1 1
例7
第一步:将已知物理量转化为对应物质的物质的量;
第二步:依据化学方程式求出待求物质的物质的量;
第三步:根据题目要求,再将待求物质的物质的量转化为所求的物理量。
解题方法
化学方程式中:各物质的化学计量数之比=各物质的物质的量之比
解:
n(Fe)=
= 0.5 mol
28 g
56 g·mol-1
化学计量数 1 1 1 1
物质的量
0.5 mol n(H2SO4) n(H2)
Fe + H2SO4 === FeSO4 + H2↑
1
1
—=———
0.5 mol
n(H2SO4)
n(H2SO4) =0.5 mol
稀硫酸的物质的量浓度为 c= 2 mol/L
250 mL = 0.25 L
1
1
—=———
0.5 mol
n(H2)
n(H2) =0.5 mol
生成标准状况V(H2) = 11.2 L
答:稀硫酸的物质的量浓度为 2 mol/L;生成标准状况H2的体积 11.2 L。
1. 基本步骤
写——写出反应化学方程式
标——标出已知物质和所求物质有关物理量的关系,并代入数据
列——列出比例式
解——根据比例式求解
答——简明地写出答案
2. 基本方法
把已知量转化为物质的量;利用计量数之比=物质的量之比,求出未知物的物质的量。
方法归纳
已知反应:3Cl2+8NH3===6NH4Cl+N2,在标准状况下有33.6 L氯气参加反应,计算:(1)参加反应的氨的物质的量是多少
(2)产生氮气的分子数是多少
3Cl2 + 8NH3 === 6NH4Cl + N2
3 8 1
1.5 mol n(NH3) n( N2 )
解:参加反应的 Cl2: = 1.5 mol
n(NH3)=4 mol
n( N2 ) =0.5 mol
N( N2 ) =0.5NA
例8
答:参加反应的氨的物质的量为4mol;产生氮气的分子数为0.5NA。
物质的量浓度的基本计算
1.熟练掌握基本公式:
cB =
m1w1=m2w2
c前V前 = c后V后
2.涉及化学反应的计算:
利用化学方程式中各物质的计量数之比=物质的量之比
A
1.300 mL 某浓度的NaOH溶液中含有 60 g 溶质。现要配制 1 mol/L NaOH溶液,应取原溶液与蒸馏水的体积比约为( )
A.1∶4 B.1∶5 C.2∶1 D.2∶3
2. 将100 mL 0.1 mol·L-1的氯化钡溶液与50 mL 0.2 mol·L-1的氯化钠溶液混合,若不考虑溶液混合时体积的变化,则混合溶液中氯离子浓度是( )
A. 0.2 mol·L-1 B.0.01 mol·L-1
C.0.1 mol·L-1 D.0.02 mol·L-1
A
3. 一定质量的铜粉和碳粉的混合物,在空气中充分灼烧后其固体与原混合物的质量不变,则原混合物中铜粉和碳粉的质量比为( )
A.4:1 B. 2:1
C. 3:2 D. 1:1
A
1.认识物质的量在化学定量研究中的重要作用,能从定量的角度描述和分析物质及其变化。
2.能运用化学计量关系和物质的量概念研究溶液的组成。
物质的量与各物理量之间的关系:
(1) 关系图:
知识回顾
知识回顾
nB =c·V
m
M
①已知物质的质量:nB=
V
22.4 L/mol
②已知标准状况时的气体体积: nB=
N
NA
③已知物质的粒子数: nB=
④已知溶液中的物质的量浓度:
(2)计算公式:
知识回顾
知识回顾
一、溶质物质的量浓度的基本计算
1. 根据定义式计算
cB =
关键找出溶质的物质的量(n)和溶液的体积(V)
在 200 mL 稀盐酸里溶有0.73 g HCl ,计算溶液的 c 。
n (HCl) =
0.73 g
36.5 g/mol
= 0.02 mol
V (HCl) =
200 mL
1000 mL/L
= 0.2 L
c (HCl) =
0.02 mol
0.2 L
= 0.1 mol/L
例1
2. 标准状况下气体溶于水,其物质的量浓度的计算
V(气体)
n
c
若已知溶液的体积
标准状况下 448 L NH3 溶于 1 L 水中,得密度0.9 g/cm3 的氨水。求此氨水的c。
例2
n (NH3) =
448 L
22.4 L/mol
= 20 mol
m (NH3) = 20 mol × 17 g/mol = 340 g
V(氨水) =
1340 g
0. 9 g/mL ×1000 mL/L
≈ 1.49 L
m (氨水) = 340 g + 1000 g = 1340 g
c(氨水) =
20 mol
1. 49L
≈13. 4 mol/L
(1)c=n/V中,V是溶液体积,不是溶剂体积,也不是两者之和;
(2)气体溶于水,溶质是气体与水反应的生成物。
NH3溶于水后主要溶质是NH3 H2O,但以NH3计算。
特别提醒
关于 c 计算的注意事项
1.一定物质的量浓度的某溶液,其浓度不因所取体积不同而变化;
2.找准溶质。比如Na2O溶于水,溶质是NaOH而不是Na2O;
3.表达式中的体积(V)是指溶液体积,不是溶剂的,也不是溶质与溶剂体积之和;
4.若将气体通入溶液中,则不能将气体体积与溶剂体积进行简单加和;
5.溶液相混合,除特殊说明体积可相加外,其他情况用公式V溶液= 计算。
二、溶液的稀释或混合计算
1. 浓溶液稀释:溶质的 m 、n在稀释前后保持不变
稀释前 稀释后
m(溶质) = m(溶质)
m1w1=m2w2
n(溶质) = n(溶质)
c前V前 = c后V后
配制500 mL 0.6 mol/L 的NaOH溶液,需6 mol/LNaOH溶液多少 mL ?
6 mol/L×V = 0.6 mol/L ×500 mL
V = 50 mL
将5 mol/L的Mg(NO3)2溶液a mL加水稀释至b mL,问稀释后的溶液中c()?
10 mol/L×a mL= c() ×b mL
c()= —
10a
b
mol/L
例3
例4
2. 相同溶质的两溶液混合
(1)溶质的物质的量不变:c1V1+c2V2=c(混)·V(混);
(2)溶质的质量不变: m1w1+m2w2=m(混)·w(混)。
将0.10 mol·L-1氢氧化钠溶液和0.60 mol·L-1氢氧化钠溶液混合成0.20 mol·L-1的氢氧化钠溶液。求两种溶液的体积比(忽略混合时溶液体积变化)为_____。
4∶1
设所需0.10 mol·L-1的NaOH溶液体积V1,所需0.60 mol·L-1的NaOH溶液体积V2,0.10 mol·L-1·V1+0.60 mol·L-1·V2=0.20 mol·L-1·(V1+V2)
例5
溶液稀释或混合计算的注意事项
(1)同一溶质、不同浓度的溶液混合,在混合前后溶质的质量、物质的量保持守恒,溶液的质量保持守恒,但溶液的体积一般不守恒。
(2)混合后溶液的体积:
①若指出不考虑溶液体积改变,可认为是原溶液的体积之和;
②若给出混合后溶液的密度,应根据V(混)= 来计算。
三、物质的量浓度与溶质的质量分数的换算
c = ──
n
V
ω = ───── ×100%
m(溶质)
m(溶液)
换算公式:
M:溶质B的摩尔质量(单位:g·mol-1);
ρ:溶液密度(单位:g·mL-1 g/cm3);
ω = ─── ×100%
1000ρ
cM
(1)75 mL 2 mol/L NaOH 溶液的质量为 80 g,求该溶液ω
(2)12 mol/L 密度为1.32 g/cm3的硝酸溶液的质量分数
75 mL=0.075 L
n(NaOH)=c(NaOH) ×V[NaOH(aq)]
=2 mol/L×0.075 L
=0.15 mol
m(NaOH)=n(NaOH) ×M (NaOH )
=0.15 mol×40 g/mol
=6 g
ω(NaOH)= —————
m(NaOH)
m[NaOH(aq)]
×100%
=7.5%
ω=
设溶液的体积为 1 L即1000 mL
≈57.3%
12 mol/L×1 L×63 g/mol
1.32 g/cm3×1000 mL
×100%
例6
四、化学反应的计算
250 mL 稀硫酸与 28 g 铁恰好完全反应,计算该稀硫酸的物质的量浓度,生成H2的体积(标准状况)。
Fe + H2SO4 === FeSO4 + H2↑
化学计量数 1 1 1 1
扩大NA倍之后 NA NA NA NA
物质的量之比
1 1 1 1
例7
第一步:将已知物理量转化为对应物质的物质的量;
第二步:依据化学方程式求出待求物质的物质的量;
第三步:根据题目要求,再将待求物质的物质的量转化为所求的物理量。
解题方法
化学方程式中:各物质的化学计量数之比=各物质的物质的量之比
解:
n(Fe)=
= 0.5 mol
28 g
56 g·mol-1
化学计量数 1 1 1 1
物质的量
0.5 mol n(H2SO4) n(H2)
Fe + H2SO4 === FeSO4 + H2↑
1
1
—=———
0.5 mol
n(H2SO4)
n(H2SO4) =0.5 mol
稀硫酸的物质的量浓度为 c= 2 mol/L
250 mL = 0.25 L
1
1
—=———
0.5 mol
n(H2)
n(H2) =0.5 mol
生成标准状况V(H2) = 11.2 L
答:稀硫酸的物质的量浓度为 2 mol/L;生成标准状况H2的体积 11.2 L。
1. 基本步骤
写——写出反应化学方程式
标——标出已知物质和所求物质有关物理量的关系,并代入数据
列——列出比例式
解——根据比例式求解
答——简明地写出答案
2. 基本方法
把已知量转化为物质的量;利用计量数之比=物质的量之比,求出未知物的物质的量。
方法归纳
已知反应:3Cl2+8NH3===6NH4Cl+N2,在标准状况下有33.6 L氯气参加反应,计算:(1)参加反应的氨的物质的量是多少
(2)产生氮气的分子数是多少
3Cl2 + 8NH3 === 6NH4Cl + N2
3 8 1
1.5 mol n(NH3) n( N2 )
解:参加反应的 Cl2: = 1.5 mol
n(NH3)=4 mol
n( N2 ) =0.5 mol
N( N2 ) =0.5NA
例8
答:参加反应的氨的物质的量为4mol;产生氮气的分子数为0.5NA。
物质的量浓度的基本计算
1.熟练掌握基本公式:
cB =
m1w1=m2w2
c前V前 = c后V后
2.涉及化学反应的计算:
利用化学方程式中各物质的计量数之比=物质的量之比
A
1.300 mL 某浓度的NaOH溶液中含有 60 g 溶质。现要配制 1 mol/L NaOH溶液,应取原溶液与蒸馏水的体积比约为( )
A.1∶4 B.1∶5 C.2∶1 D.2∶3
2. 将100 mL 0.1 mol·L-1的氯化钡溶液与50 mL 0.2 mol·L-1的氯化钠溶液混合,若不考虑溶液混合时体积的变化,则混合溶液中氯离子浓度是( )
A. 0.2 mol·L-1 B.0.01 mol·L-1
C.0.1 mol·L-1 D.0.02 mol·L-1
A
3. 一定质量的铜粉和碳粉的混合物,在空气中充分灼烧后其固体与原混合物的质量不变,则原混合物中铜粉和碳粉的质量比为( )
A.4:1 B. 2:1
C. 3:2 D. 1:1
A
