【考点突破】第二章第6课时气体摩尔体积-2024~2025学年高一化学同步课件(共29张PPT)(人教版2019必修第一册)
文档属性
| 名称 | 【考点突破】第二章第6课时气体摩尔体积-2024~2025学年高一化学同步课件(共29张PPT)(人教版2019必修第一册) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-27 00:00:00 | ||
图片预览






文档简介
(共29张PPT)
第三节 物质的量
第二章 海水中的重要元素——钠和氯
第6课时 气体摩尔体积
气体摩尔体积
01
阿伏加德罗定律及推论
02
课堂练习
03
04
考点 · 突破
Exam Points
Breakthrough
巩固提升
EPB
考点突破
01
气体摩尔体积
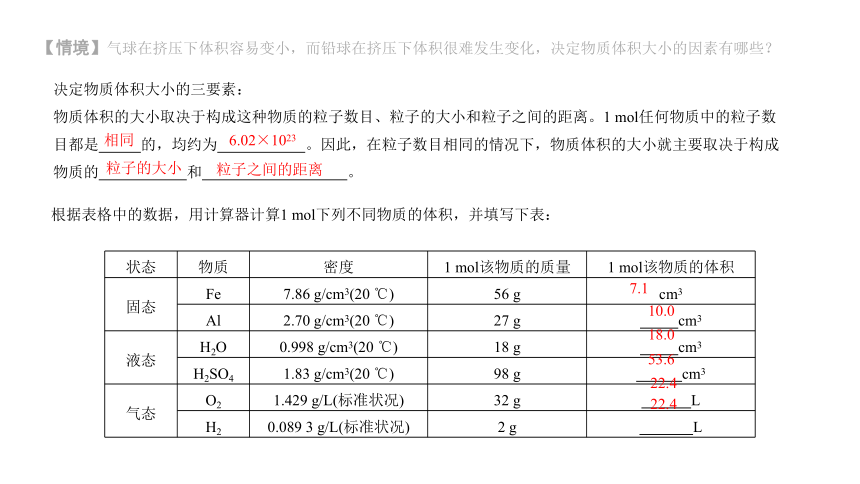
【情境】气球在挤压下体积容易变小,而铅球在挤压下体积很难发生变化,决定物质体积大小的因素有哪些?
决定物质体积大小的三要素:
物质体积的大小取决于构成这种物质的粒子数目、粒子的大小和粒子之间的距离。1 mol任何物质中的粒子数目都是 的,均约为 。因此,在粒子数目相同的情况下,物质体积的大小就主要取决于构成物质的 和 。
根据表格中的数据,用计算器计算1 mol下列不同物质的体积,并填写下表:
状态 物质 密度 1 mol该物质的质量 1 mol该物质的体积
固态 Fe 7.86 g/cm3(20 ℃) 56 g cm3
Al 2.70 g/cm3(20 ℃) 27 g cm3
液态 H2O 0.998 g/cm3(20 ℃) 18 g cm3
H2SO4 1.83 g/cm3(20 ℃) 98 g cm3
气态 O2 1.429 g/L(标准状况) 32 g L
H2 0.089 3 g/L(标准状况) 2 g L
相同
6.02×1023
粒子的大小
粒子之间的距离
7.1
10.0
18.0
53.6
22.4
22.4
【问题探究】
1.在温度、压强一定的条件下,1 mol固态碘和1 mol气态水所含的分子数相同吗?它们的体积相同吗?
【解析】1 mol固体碘和1 mol气态水所含的分子数均为6.02×1023,二者所含分子数相同,但由于分子之间的距离非常小,且不同分子的大小不同,所以1 mol固态碘和1 mol 气态水的体积不相同。
【解析】决定物质体积大小的因素:
归纳总结
1.气体摩尔体积
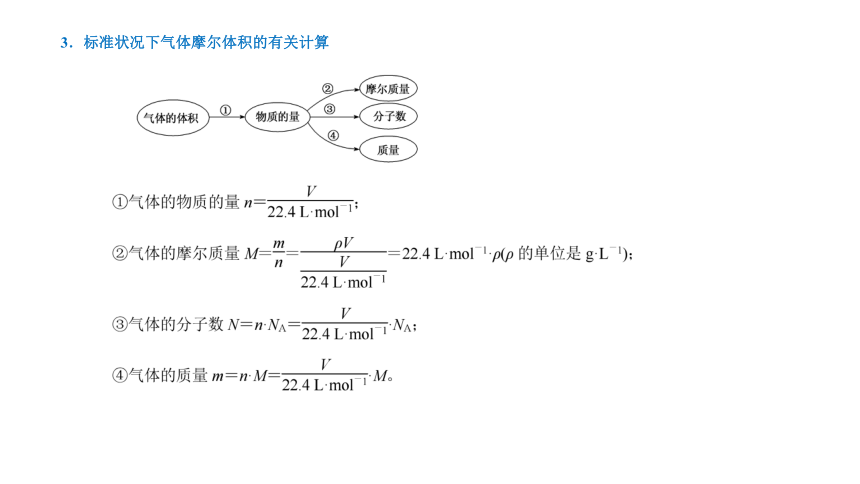
2.标准状况下气体摩尔体积
3.标准状况下气体摩尔体积的有关计算
易错点
(1)气体摩尔体积的描述对象是气态物质,可以是单一气体,也可以是混合气体。
(2)不同温度和压强下,气体摩尔体积不同,如在0 ℃和101 kPa(通常称为标准状况)时,Vm=22.4 L·mol-1;在25 ℃、101 kPa时,Vm=24.5 L·mol-1。因此,在讨论气体摩尔体积时,必须注明气体所处的温度和压强。
课堂练习
1.下列关于物质聚集状态的说法正确的是
A.固体、液体不易被压缩的原因是构成的微粒直径太大
B.不同聚集状态的物质其内部微粒之间的平均距离、作用力和运动方式各不相同
C.影响物质聚集状态的外界因素主要是温度
D.气体有固定的形状和体积
【答案】B
【解析】A.固体、液体不易被压缩的原因是粒子之间间距很小,几乎为零,故A错误;
B.气体微粒间间距一般大于固体和液体微粒间间距,气体分子运动速度一般比固体和液体分子运动速度快,因此不同聚集状态的物质其内部微粒之间的平均距离、运动方式不相同,故B正确;
C.影响物质聚集状态的外界因素是温度、压强,故C错误;
D.压缩气体,一般来说气体体积减小,故气体没有固定的形状和体积,故D错误;
故选B。
2.下列叙述不正确的是
A.同温同压下,1mol N2 与1mol CO 可能具有不同的体积
B.同温同压下,CO2与笑气(N2O)具有相同密度
C.气体摩尔体积不一定只有在标准状况下才为22.4L·mol-1
D.标准状况下,0.2mol H2与0.8mol O2组成的混合气体,体积为22.4L
EPB
考点突破
02
阿伏加德罗定律及推论
【情境】某同学在元旦晚会上表演的化学节目为猜气球——他先在实验室中用等质量的CH4、CO2、O2、SO2分别吹出四个气球,然后在晚会的现场让同学猜测气球是用哪种气体吹起的。
【问题探究】
(1)等质量的CH4、CO2、O2、SO2的物质的量大小顺序为______________,含有的分子数大小顺序______________。
【答案】 CH4>O2>CO2>SO2 CH4>O2>CO2>SO2
(2)上述气球A、B、C、D依次相应的吹入的气体是什么?为什么?
【答案】 SO2、CO2、O2、CH4。在相同的温度和压强下,等质量的SO2、CO2、O2、CH4的物质的量SO2<CO2<O2<CH4故体积SO2<CO2<O2<CH4。
(3)若CH4、CO2、O2、SO2的物质的量相同,则吹出的四个气球的体积大小如何?为什么?
【答案】四个气球的体积大小相同,因为物质的量相同,气体的分子数相同,在相同条件下,体积相同。.
归纳总结
1.阿伏加德罗定律
(1)内容
(2)解释:同温、同压下,气体粒子间的平均距离相等,故体积相同时,气体粒子数相等,其物质的量也相等。
易错点
(1)阿伏加德罗定律适用于任何气体,包括混合气体,但不适用于非气体。
(2)同温、同压、同体积和同分子数,“四同”共同存在,“三同定一同”。
2.阿伏加德罗定律的推论
易错点
课堂练习
【答案】B
【分析】同温同压同质量下,气体的物质的量之比=气体分子数之比=气体体积比=其摩尔质量的反比。
【解析】A.同温同压同质量下,气体体积比与摩尔质量成反比,所以体积的大小顺序是:CH4>O2>CO2>SO2,②中装的是CO2,故A正确;
B.根据A的分析,④、③、②、①四个球中分别是CH4、O2、CO2、SO2,气球①和气球③中气体分子数之比等于体积之比,等于相对分子质量M的倒数之比,即为32:64=1:2,故B错误;
C.气球①和气球②中气体分子数之比等于体积之比,等于M的倒数之比,即为44:64=11:16,又因为两者都是三原子分子,所以原子数之比也为11:16,则故C正确;
D.气球③和气球④中气体体积比与摩尔质量成反比,即为:16:32=1:2,故D正确;
故选B。
2.在两个密闭容器中,分别充有质量相等的甲、乙两种气体,它们的温度和密度均相同。试根据甲、乙的摩尔质量(M)的关系,判断下列说法中正确的是
A.若M(甲)>M(乙),则分子数:甲>乙
B.若M(甲)乙
C.若M(甲)乙
D.若M(甲)>M(乙),则气体体积:甲<乙
EPB
考点突破
03
巩固提升
01
练习与应用
1.下列有关气体摩尔体积的描述中正确的是
A.单位物质的量的气体所占的体积就是气体摩尔体积
B.通常状况下的气体摩尔体积约为22.4L/mol
C.标准状况下的气体摩尔体积约为22.4L
D.标准状况下,1mol任何物质所占的体积都约是22.4L
练习与应用
02
【答案】A
【解析】A.1个SO2分子中有2个氧原子,故2mol SO2中含有氧原子数为4NA,A正确;
B.2 mol SO2在标准状况下体积为44.8L,选项没有指明标准状况,B错误;
C.1个SO2分子中有质子16+2×8=32个,故2 mol SO2中含有96NA个质子,C错误;
D.2 mol SO2的质量为2 mol×64g/mol=128g,D错误;
本题选A。
03
练习与应用
练习与应用
04
练习与应用
04
练习与应用
05
练习与应用
05
【答案】C
【解析】①46 g NO2和N2O4混合气体中含有1molNO2,原子数为3NA,正确;
②1g H2和14g N2的物质的量相同,相同条件下体积相同,正确;
③28 g CO在标准状况下的体积为22.4 L,错误;
④两种气体物质的物质的量相同,则它们在标准状况下的体积也相同,错误;
⑤在同温同体积时,压强比等于物质的量比,气体物质的物质的量越大,则压强越大,正确;
⑥同温同压下气体的密度比等于气体的相对分子质量比,正确;
故选C。
练习与应用
06
THANK YOU
第三节 物质的量
第二章 海水中的重要元素——钠和氯
第6课时 气体摩尔体积
气体摩尔体积
01
阿伏加德罗定律及推论
02
课堂练习
03
04
考点 · 突破
Exam Points
Breakthrough
巩固提升
EPB
考点突破
01
气体摩尔体积
【情境】气球在挤压下体积容易变小,而铅球在挤压下体积很难发生变化,决定物质体积大小的因素有哪些?
决定物质体积大小的三要素:
物质体积的大小取决于构成这种物质的粒子数目、粒子的大小和粒子之间的距离。1 mol任何物质中的粒子数目都是 的,均约为 。因此,在粒子数目相同的情况下,物质体积的大小就主要取决于构成物质的 和 。
根据表格中的数据,用计算器计算1 mol下列不同物质的体积,并填写下表:
状态 物质 密度 1 mol该物质的质量 1 mol该物质的体积
固态 Fe 7.86 g/cm3(20 ℃) 56 g cm3
Al 2.70 g/cm3(20 ℃) 27 g cm3
液态 H2O 0.998 g/cm3(20 ℃) 18 g cm3
H2SO4 1.83 g/cm3(20 ℃) 98 g cm3
气态 O2 1.429 g/L(标准状况) 32 g L
H2 0.089 3 g/L(标准状况) 2 g L
相同
6.02×1023
粒子的大小
粒子之间的距离
7.1
10.0
18.0
53.6
22.4
22.4
【问题探究】
1.在温度、压强一定的条件下,1 mol固态碘和1 mol气态水所含的分子数相同吗?它们的体积相同吗?
【解析】1 mol固体碘和1 mol气态水所含的分子数均为6.02×1023,二者所含分子数相同,但由于分子之间的距离非常小,且不同分子的大小不同,所以1 mol固态碘和1 mol 气态水的体积不相同。
【解析】决定物质体积大小的因素:
归纳总结
1.气体摩尔体积
2.标准状况下气体摩尔体积
3.标准状况下气体摩尔体积的有关计算
易错点
(1)气体摩尔体积的描述对象是气态物质,可以是单一气体,也可以是混合气体。
(2)不同温度和压强下,气体摩尔体积不同,如在0 ℃和101 kPa(通常称为标准状况)时,Vm=22.4 L·mol-1;在25 ℃、101 kPa时,Vm=24.5 L·mol-1。因此,在讨论气体摩尔体积时,必须注明气体所处的温度和压强。
课堂练习
1.下列关于物质聚集状态的说法正确的是
A.固体、液体不易被压缩的原因是构成的微粒直径太大
B.不同聚集状态的物质其内部微粒之间的平均距离、作用力和运动方式各不相同
C.影响物质聚集状态的外界因素主要是温度
D.气体有固定的形状和体积
【答案】B
【解析】A.固体、液体不易被压缩的原因是粒子之间间距很小,几乎为零,故A错误;
B.气体微粒间间距一般大于固体和液体微粒间间距,气体分子运动速度一般比固体和液体分子运动速度快,因此不同聚集状态的物质其内部微粒之间的平均距离、运动方式不相同,故B正确;
C.影响物质聚集状态的外界因素是温度、压强,故C错误;
D.压缩气体,一般来说气体体积减小,故气体没有固定的形状和体积,故D错误;
故选B。
2.下列叙述不正确的是
A.同温同压下,1mol N2 与1mol CO 可能具有不同的体积
B.同温同压下,CO2与笑气(N2O)具有相同密度
C.气体摩尔体积不一定只有在标准状况下才为22.4L·mol-1
D.标准状况下,0.2mol H2与0.8mol O2组成的混合气体,体积为22.4L
EPB
考点突破
02
阿伏加德罗定律及推论
【情境】某同学在元旦晚会上表演的化学节目为猜气球——他先在实验室中用等质量的CH4、CO2、O2、SO2分别吹出四个气球,然后在晚会的现场让同学猜测气球是用哪种气体吹起的。
【问题探究】
(1)等质量的CH4、CO2、O2、SO2的物质的量大小顺序为______________,含有的分子数大小顺序______________。
【答案】 CH4>O2>CO2>SO2 CH4>O2>CO2>SO2
(2)上述气球A、B、C、D依次相应的吹入的气体是什么?为什么?
【答案】 SO2、CO2、O2、CH4。在相同的温度和压强下,等质量的SO2、CO2、O2、CH4的物质的量SO2<CO2<O2<CH4故体积SO2<CO2<O2<CH4。
(3)若CH4、CO2、O2、SO2的物质的量相同,则吹出的四个气球的体积大小如何?为什么?
【答案】四个气球的体积大小相同,因为物质的量相同,气体的分子数相同,在相同条件下,体积相同。.
归纳总结
1.阿伏加德罗定律
(1)内容
(2)解释:同温、同压下,气体粒子间的平均距离相等,故体积相同时,气体粒子数相等,其物质的量也相等。
易错点
(1)阿伏加德罗定律适用于任何气体,包括混合气体,但不适用于非气体。
(2)同温、同压、同体积和同分子数,“四同”共同存在,“三同定一同”。
2.阿伏加德罗定律的推论
易错点
课堂练习
【答案】B
【分析】同温同压同质量下,气体的物质的量之比=气体分子数之比=气体体积比=其摩尔质量的反比。
【解析】A.同温同压同质量下,气体体积比与摩尔质量成反比,所以体积的大小顺序是:CH4>O2>CO2>SO2,②中装的是CO2,故A正确;
B.根据A的分析,④、③、②、①四个球中分别是CH4、O2、CO2、SO2,气球①和气球③中气体分子数之比等于体积之比,等于相对分子质量M的倒数之比,即为32:64=1:2,故B错误;
C.气球①和气球②中气体分子数之比等于体积之比,等于M的倒数之比,即为44:64=11:16,又因为两者都是三原子分子,所以原子数之比也为11:16,则故C正确;
D.气球③和气球④中气体体积比与摩尔质量成反比,即为:16:32=1:2,故D正确;
故选B。
2.在两个密闭容器中,分别充有质量相等的甲、乙两种气体,它们的温度和密度均相同。试根据甲、乙的摩尔质量(M)的关系,判断下列说法中正确的是
A.若M(甲)>M(乙),则分子数:甲>乙
B.若M(甲)
C.若M(甲)
D.若M(甲)>M(乙),则气体体积:甲<乙
EPB
考点突破
03
巩固提升
01
练习与应用
1.下列有关气体摩尔体积的描述中正确的是
A.单位物质的量的气体所占的体积就是气体摩尔体积
B.通常状况下的气体摩尔体积约为22.4L/mol
C.标准状况下的气体摩尔体积约为22.4L
D.标准状况下,1mol任何物质所占的体积都约是22.4L
练习与应用
02
【答案】A
【解析】A.1个SO2分子中有2个氧原子,故2mol SO2中含有氧原子数为4NA,A正确;
B.2 mol SO2在标准状况下体积为44.8L,选项没有指明标准状况,B错误;
C.1个SO2分子中有质子16+2×8=32个,故2 mol SO2中含有96NA个质子,C错误;
D.2 mol SO2的质量为2 mol×64g/mol=128g,D错误;
本题选A。
03
练习与应用
练习与应用
04
练习与应用
04
练习与应用
05
练习与应用
05
【答案】C
【解析】①46 g NO2和N2O4混合气体中含有1molNO2,原子数为3NA,正确;
②1g H2和14g N2的物质的量相同,相同条件下体积相同,正确;
③28 g CO在标准状况下的体积为22.4 L,错误;
④两种气体物质的物质的量相同,则它们在标准状况下的体积也相同,错误;
⑤在同温同体积时,压强比等于物质的量比,气体物质的物质的量越大,则压强越大,正确;
⑥同温同压下气体的密度比等于气体的相对分子质量比,正确;
故选C。
练习与应用
06
THANK YOU
