1.5.4 物质的溶解(课件 10张PPT)
文档属性
| 名称 | 1.5.4 物质的溶解(课件 10张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-09-27 00:00:00 | ||
图片预览




文档简介
(共10张PPT)
1
新课导入
1. 简述”溶解度“表示的含义
在一定温度下,100g溶剂中达到饱和状态时能溶解的溶质质量
2. 写出求溶质质量分数的公式(通用法和饱和法)
3. 分别写出求溶质质量和溶液质量的公式
1.5.4 物质的溶解
2
新知探究
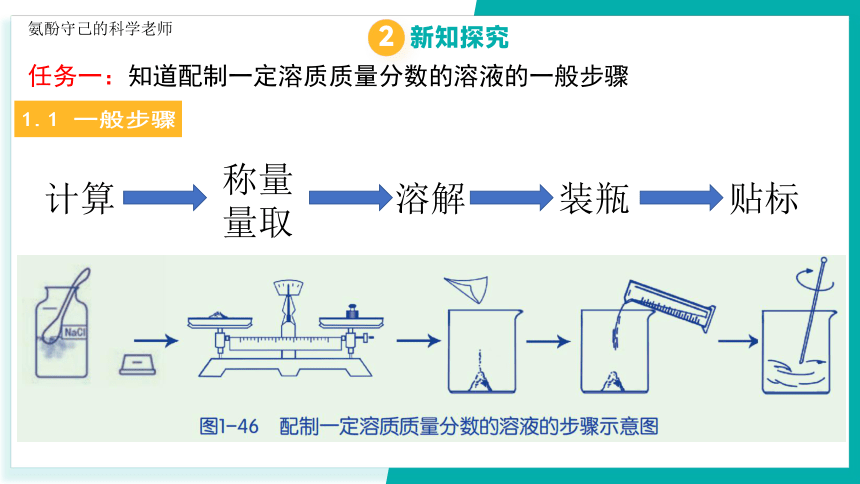
1.1 一般步骤
任务一:知道配制一定溶质质量分数的溶液的一般步骤
计算
称量
量取
溶解
装瓶
贴标
1.2 溶液配制仪器的正确使用
(1)瓶塞:要倒放
(2)调平前:游码归零(镊子)
(3)调平:平衡螺母往轻的一侧调节(往高的一侧调节)
(4)平衡:指针指向分度盘中央刻度线
(5)称量:没有腐蚀性的物质需要垫上纸片(两边都要)
(6)物质和砝码放置:左物右码
(7)砝码:先放大砝码
(8)读书:m左盘=m右盘+游码示数
1.3 溶液配制仪器的正确使用
(1)放置:放置在水平桌面上
(2)视线:与凹形液面中央最低处相平
(3)取液:加液体至接近示数时,该用胶头滴管
(4)误差分析:画图
溶液的质量分数越大,密度和浓度是否也越大呢?
硫酸的密度和硫酸溶液中溶质的质量分数对照表(20℃)
密度(g/cm3) 1.01 1.07 1.14 1.22 1.30 1.40 1.50 1.61 1.73 1.81 1.84
质量分数(%) 1 10 20 30 40 50 60 70 80 90 98
任务二:通过实验感受溶液稀释的过程
配制100g12%的硫酸溶液,需要24%的硫酸溶液多少克?
加水稀释后
溶液的质量_______
溶质的质量_______
溶剂的质量_______
增大
不变
增大
2.1 寻找等量关系
配制100g12%的硫酸溶液,需要24%的硫酸溶液多少克?
溶质的质量不变
请你分别写出稀释前(浓溶液)和稀释后(稀溶液)的溶质质量表达式
稀释前(浓溶液):
m质=m浓a%
稀释后(稀溶液):
m质=m稀b%
m浓a%=m稀b%
稀溶液
浓溶液
m浓a%=m稀b%
m浓×24%=100g×12%
m浓=50g
1
新课导入
1. 简述”溶解度“表示的含义
在一定温度下,100g溶剂中达到饱和状态时能溶解的溶质质量
2. 写出求溶质质量分数的公式(通用法和饱和法)
3. 分别写出求溶质质量和溶液质量的公式
1.5.4 物质的溶解
2
新知探究
1.1 一般步骤
任务一:知道配制一定溶质质量分数的溶液的一般步骤
计算
称量
量取
溶解
装瓶
贴标
1.2 溶液配制仪器的正确使用
(1)瓶塞:要倒放
(2)调平前:游码归零(镊子)
(3)调平:平衡螺母往轻的一侧调节(往高的一侧调节)
(4)平衡:指针指向分度盘中央刻度线
(5)称量:没有腐蚀性的物质需要垫上纸片(两边都要)
(6)物质和砝码放置:左物右码
(7)砝码:先放大砝码
(8)读书:m左盘=m右盘+游码示数
1.3 溶液配制仪器的正确使用
(1)放置:放置在水平桌面上
(2)视线:与凹形液面中央最低处相平
(3)取液:加液体至接近示数时,该用胶头滴管
(4)误差分析:画图
溶液的质量分数越大,密度和浓度是否也越大呢?
硫酸的密度和硫酸溶液中溶质的质量分数对照表(20℃)
密度(g/cm3) 1.01 1.07 1.14 1.22 1.30 1.40 1.50 1.61 1.73 1.81 1.84
质量分数(%) 1 10 20 30 40 50 60 70 80 90 98
任务二:通过实验感受溶液稀释的过程
配制100g12%的硫酸溶液,需要24%的硫酸溶液多少克?
加水稀释后
溶液的质量_______
溶质的质量_______
溶剂的质量_______
增大
不变
增大
2.1 寻找等量关系
配制100g12%的硫酸溶液,需要24%的硫酸溶液多少克?
溶质的质量不变
请你分别写出稀释前(浓溶液)和稀释后(稀溶液)的溶质质量表达式
稀释前(浓溶液):
m质=m浓a%
稀释后(稀溶液):
m质=m稀b%
m浓a%=m稀b%
稀溶液
浓溶液
m浓a%=m稀b%
m浓×24%=100g×12%
m浓=50g
同课章节目录
- 第1章 水和水的溶液
- 第1节 地球上的水
- 第2节 水的组成
- 第3节 水的浮力
- 第4节 物质在水中的分散状况
- 第5节 物质的溶解
- 第6节 物质的分离
- 第7节 水资源的利用、开发和保护
- 第2章 天气与气候
- 第1节 大气层
- 第2节 气温
- 第3节 大气的压强
- 第4节 风和降水
- 第5节 天气预报
- 第6节 气候和影响气候的因素
- 第7节 我国的气候特征与主要气象灾害
- 第3章 生命活动的调节
- 第1节 植物生命活动的调节
- 第2节 人体的激素调节
- 第3节 神经调节
- 第4节 动物的行为
- 第5节 体温的控制
- 第4章 电路探秘
- 第1节 电荷与电流
- 第2节 电流的测量
- 第3节 物质的导电性与电阻
- 第4节 变阻器
- 第5节 电压的测量
- 第6节 电流与电压、电阻的关系
- 第7节 电路分析与应用
- 研究性学习课题
- 一 测定本地区的“酸雨”情况及分析原因
- 二 太阳黑子活动与本地区降水的关系
- 三 训练小动物建立某种条件反射
- 四 调查在自然界或生命活动中的电现象
