2024-2025学年高二化学人教版选择性必修一课时作业:1.1 反应热(含解析)
文档属性
| 名称 | 2024-2025学年高二化学人教版选择性必修一课时作业:1.1 反应热(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 567.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-27 15:34:34 | ||
图片预览



文档简介
2024-2025学年高二化学人教版选择性必修一课时作业: 反应热
一、单选题
1.下列变化中,属于放热反应的是( )
A.碳酸氢钠与盐酸反应 B.生石灰与水混合
C.碳与水蒸气反应制备水煤气 D.煅烧石灰石
2.下列叙述中不正确的是( )
A.常温下,能够自发进行,则该反应的
B.需加热才能进行的反应是吸热反应,不需加热就能进行的反应是放热反应
C.C(金刚石,s)=C(石墨,s) ,则石墨比金刚石稳定
D.常温下,溶液加水稀释后,溶液中的值增大
3.下列依据热化学方程式得出的结论正确的是( )
A.已知,则氢气的燃烧热为241.8
B.已知,则含40.0gNaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3kJ
C.已知,则a>b
D.已知,则白磷比红磷稳定
4.下列说法正确的是( )
A.能量变化必然伴随发生化学反应
B.需要加热的化学反应都是吸热反应
C.化学反应中的能量变化主要是由化学键变化引起的
D.化学反应中能量变化的大小与反应物的质量多少无关
5.化学反应的能量变化如图所示,则下列说法正确的是( )
A.该反应是吸热反应
B.断裂键需要吸收的能量
C.断裂键和键放出的能量
D.的总能量高于和的总能量
6.在实验室进行中和热测定实验,下列有关叙述错误的是( )
A.大小烧杯之间塞满碎泡沫,目的是减少热量损失
B.测量终止温度时,应当记录混合溶液的最高温度
C.为了使酸碱充分反应,应当缓慢分次倒入NaOH溶液并搅拌
D.碱过量的目的是保证盐酸完全反应
7.已知:。若断裂1molH-H、1molN-H需要吸收的能量分别为436kJ、391kJ,则断裂1molN≡N需要吸收的能量为( )
A.431kJ B.945.6kJ C.649kJ D.869kJ
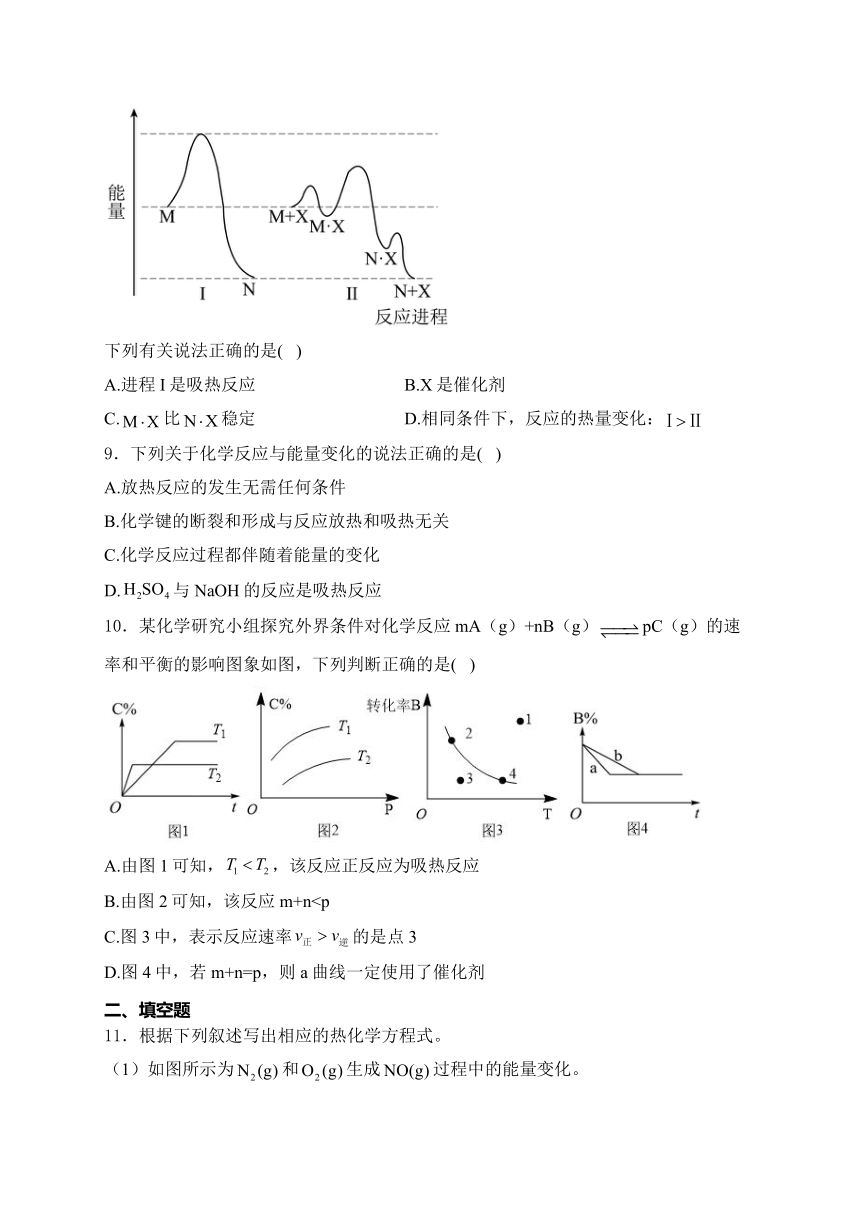
8.反应过程I、Ⅱ都能将反应物(M)转化为产物(N)。其能量与反应进程的关系如下:
下列有关说法正确的是( )
A.进程I是吸热反应 B.X是催化剂
C.比稳定 D.相同条件下,反应的热量变化:
9.下列关于化学反应与能量变化的说法正确的是( )
A.放热反应的发生无需任何条件
B.化学键的断裂和形成与反应放热和吸热无关
C.化学反应过程都伴随着能量的变化
D.与NaOH的反应是吸热反应
10.某化学研究小组探究外界条件对化学反应mA(g)+nB(g)pC(g)的速率和平衡的影响图象如图,下列判断正确的是( )
A.由图1可知,,该反应正反应为吸热反应
B.由图2可知,该反应m+nC.图3中,表示反应速率的是点3
D.图4中,若m+n=p,则a曲线一定使用了催化剂
二、填空题
11.根据下列叙述写出相应的热化学方程式。
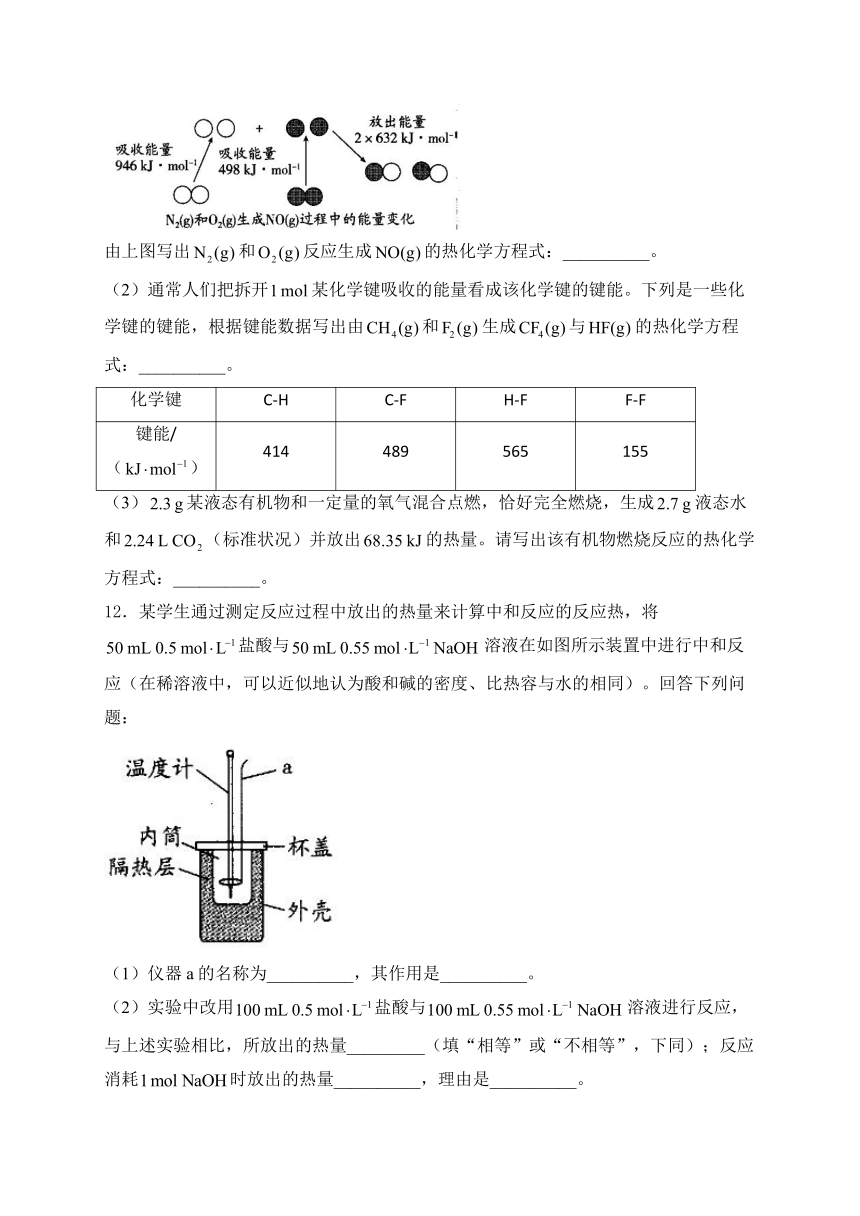
(1)如图所示为和生成过程中的能量变化。
由上图写出和反应生成的热化学方程式:__________。
(2)通常人们把拆开某化学键吸收的能量看成该化学键的键能。下列是一些化学键的键能,根据键能数据写出由和生成与的热化学方程式:__________。
化学键 C-H C-F H-F F-F
键能/() 414 489 565 155
(3)某液态有机物和一定量的氧气混合点燃,恰好完全燃烧,生成液态水和(标准状况)并放出的热量。请写出该有机物燃烧反应的热化学方程式:__________。
12.某学生通过测定反应过程中放出的热量来计算中和反应的反应热,将盐酸与溶液在如图所示装置中进行中和反应(在稀溶液中,可以近似地认为酸和碱的密度、比热容与水的相同)。回答下列问题:
(1)仪器a的名称为__________,其作用是__________。
(2)实验中改用盐酸与溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”或“不相等”,下同);反应消耗时放出的热量__________,理由是__________。
(3)若用等物质的量的固体进行上述实验,测得的中和反应的反应热的绝对值()将__________(填“偏大”“偏小”或“无影响”)。
(4)若四次操作测得终止温度与起始温度差分别为:①、②、③、④,则所得的中和反应的反应热________[已知该温度下生成溶液的比热容,忽略量热计的比热容,保留三位有效数字]。
13.当今社会,能源的发展已成为全世界共同关注的话题,乙烷、二甲醚的燃烧热的值较大,可用作燃料。如图表示乙烷、二甲醚燃烧过程中的能量变化。请回答下列问题:
(1)__________
(2)乙烷的燃烧热__________。
(3)等物质的量的比完全燃烧生成指定产物时放出的热量__________(填“多”或“少”)。
(4)根据题图写出表示二甲醚燃烧热的热化学方程式:__________。
三、实验题
14.I.研究化学反应中的能量变化,能更好地利用化学反应为生产和生活服务。
(1)已知、时,32g甲烷燃烧生成和液态水时放出1780.6kJ热量,则该条件下反应的热化学方程式为___________。
Ⅱ.反应的能量变化如图所示。
(2)该反应为___________(填“吸热”或“放热”)反应。
(3)如图三个装置中,不能证明“锌与稀硫酸反应是吸热反应还是放热反应”的是___________(填序号)
Ⅲ.如图是某兴趣小组设计原电池示意图
(4)下列实验叙述合理的是___________(填序号)
A.Cu极有产生 B.锌作负极,发生还原反应
C.向Zn极移动 D.电子由Zn经导线流向Cu
(5)请写出该电池的正极反应式___________
(6)若有1mol电子流过导线,则理论上在标准状况下,产生的体积为___________L
(7)将稀换成溶液,电极质量增加的是___________(填“锌极”或“铜极”)。
参考答案
1.答案:B
解析:A.碳酸氢钠与盐酸反应属于吸热反应,A不符合;B.生石灰与水混合生成氢氧化钙的反应是放热反应,B符合;C.碳与水蒸气反应制备水煤气属于吸热反应,不符合;D.煅烧石灰石生成氧化钙和二氧化碳,属于吸热反应,D不符合;故答案为:B.
2.答案:B
解析:
3.答案:B
4.答案:C
解析:化学反应一定伴随能量变化,能量变化不一定伴随发生化学反应,A错误;
反应吸放热与反应条件无关,需要加热的化学反应不一定是吸热反应,B错误;
化学反应的实质是旧键断、新键生,旧键断吸热、新键生放热,所以能量变化主要是由化学键变化引起的,C正确;
化学反应中能量变化的大小与反应物的质量多少有关,D错误。
故选C。
5.答案:B
解析:A.由图可知,该反应是反应物总能量高于生成物总能量的放热反应,故A错误;
B.学键的断裂需要吸收能量,由图可知,断裂2molA—B键需要吸收ykJ的能量,故B正确;
C.化学键的断裂需要吸收能量,由图可知,断裂1molA A键和1molB B键能吸收xkJ的能量,故C错误;
D.由图可知,该反应是反应物总能量高于生成物总能量的放热反应,则2molAB的总能量低于1mol和1mol的总能量,故D错误;
故选B。
6.答案:C
解析:A.大小烧杯之间塞满碎泡沫,目的是减少热量损失,减小测量误差,故A正确;
B.充分反应,放出热量最多时,温度最高,测量终止温度时,应当记录混合溶液的最高温度,故B正确;
C.为了使酸碱充分反应,应当快速一次倒入溶液并搅拌,防止热量散失,故C错误;
D.碱过量的目的是保证盐酸完全反应,防止出现实验误差,故D正确;
故选C。
7.答案:B
解析:,若断裂1molH-H和1molN-H需要吸收的能量分别为436kJ和391kJ,则断裂1molN≡N需要吸收的能量为-92.4kJ-(3×436kJ-6×391kJ)=945.6;
故选B。
8.答案:B
解析:A.进程Ⅰ中产物N能量比反应物M低,为放热反应,故A错误;
B.由进程Ⅱ可知,反应前为M+X,反应后为N+X,X为催化剂,故B正确;
C.能量越低越稳定,由图可知,N·X能量更低,更稳定,故C错误;
D.X为催化剂,不该改变反应热,相同条件下,反应的热量变化:;故D错误;
故选B。
9.答案:C
解析:化学反应过程都伴随着能量的变化。
10.答案:C
解析:A.根据“先拐先平数值大”,可知,升高温度,C的百分含量减小,说明该反应的正反应为放热反应,选项A错误;
B.由图可知,增大压强,C的百分含量增大,说明加压平衡正向移动,所以该反应m+n>p,选项B错误;
C.图中点3的转化率小于同温下的平衡转化率,说明点3反应正向进行,反应速率:,选项C正确;
D.曲线a速率加快、平衡没移动,若m+n=p,曲线a可能使用了催化剂或加压,选项D错误;
答案选C。
11.答案:(1)
(2)
(3)
解析:(1)由图可知,键的键能为,反应热=反应物总键能-生成物总键能,热化学方程式为。
(2)在反应中,反应物的总键能-生成物的总键能=,故其热化学方程式为。
(3)通过燃烧产物的元素组成可知该有机物中肯定含有碳元素和氢元素,可能含有氧元素。
$,,,,,,碳元素和氢元素的质量之和是,故该有机物中还含有氧元素,羍元素的质量是,,故该有机物中原子个数比为从而可确定该有机物的分子式为。由上述分析可知,该有机物的物质的量为,结合题意可知,该液态有机物完全燃烧生成液态水和气体时放出的热量为,则该液态有机物完全燃烧生成液态水和气体时放出的热量为,故该反应的热化学方程式为。
12.答案:(1)玻璃搅拌器使酸和碱充分反应
(2)不相等相等反应放出的热量与生成的物质的量成比例
(3)偏大
(4)-56.8
解析:(2)反应放出的热量与所用酸以及碱的量的多少有关,实验中改用盐酸与溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏多,即中和反应放出的热量与生成的物质的量成比例,所以反应消耗放出的热量是相等的。
(3)固体溶解会放出热量,所以测得的会偏大。
(4)四次实验数据中,数据②误差大,应舍去,故温度差的平均值为,盐酸与溶液混合,氢氧化钠过量,反应生成水,混合溶液的总质量,则生成水放出的热量,所以生成水放出的热量为,即生成时的反应热。
13.答案:(1)
(2)
(3)少
(4)
解析:(1)依据氢原子守恒,,。
(2)根据图像分析可知乙烷完全燃烧放热,所以乙烷完全燃烧放热为,则乙烷的燃烧热
(3)物质气态时比液态时能量高,则等物质的量的比完全燃烧生成指定产物时放出的热量少。
(4)结合状态及焓变可知,二甲醚完全燃烧时放出的热量为,则二甲醚完全燃烧的热化学方程式为。
14.答案:(1)或者
(2)放热
(3)Ⅲ
(4)AD
(5)
(6)11.2
(7)铜极
解析:
(1)
已知32gCH4燃烧生成液态水时放出热量为1780.6kJ,即1molCH4燃烧放出的热量为890kJ,热化学方程式为或者。
(2)从图看出反应物的能量高于生成物的总能量,该反应放热反应。答案为放热;
(3)锌和稀硫酸反应放热,装置中的温度升高而Ⅰ、Ⅱ的压强增大,从而Ⅰ中左端红墨水下降,而Ⅱ中烧杯有气泡,但Ⅲ为敞开体系压强变化不大,所以无明显现象。答案为Ⅲ;
(4)该电池的总反应为:,Zn更活泼为电池的负极,而Cu为正极。
A.Cu发生还原反应,,A项正确;
B.Zn为负极,发生氧化反应,B项错误;
C.移向Cu极,C项错误;
D.电子从负极流出经导线到达正极,即从Zn经导线到达Cu,D项正确;
故选AD。
(5)Cu发生还原反应,;
(6)即当2mol电子转移时产生1molH2标况下的体积为22.4L。那么1mol电子时,产生的为11.2L;
(7)
若换成CuSO4,总反应为,在Cu极发生还原反应而析出,故Cu电极质量增加。答案为铜极。
一、单选题
1.下列变化中,属于放热反应的是( )
A.碳酸氢钠与盐酸反应 B.生石灰与水混合
C.碳与水蒸气反应制备水煤气 D.煅烧石灰石
2.下列叙述中不正确的是( )
A.常温下,能够自发进行,则该反应的
B.需加热才能进行的反应是吸热反应,不需加热就能进行的反应是放热反应
C.C(金刚石,s)=C(石墨,s) ,则石墨比金刚石稳定
D.常温下,溶液加水稀释后,溶液中的值增大
3.下列依据热化学方程式得出的结论正确的是( )
A.已知,则氢气的燃烧热为241.8
B.已知,则含40.0gNaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3kJ
C.已知,则a>b
D.已知,则白磷比红磷稳定
4.下列说法正确的是( )
A.能量变化必然伴随发生化学反应
B.需要加热的化学反应都是吸热反应
C.化学反应中的能量变化主要是由化学键变化引起的
D.化学反应中能量变化的大小与反应物的质量多少无关
5.化学反应的能量变化如图所示,则下列说法正确的是( )
A.该反应是吸热反应
B.断裂键需要吸收的能量
C.断裂键和键放出的能量
D.的总能量高于和的总能量
6.在实验室进行中和热测定实验,下列有关叙述错误的是( )
A.大小烧杯之间塞满碎泡沫,目的是减少热量损失
B.测量终止温度时,应当记录混合溶液的最高温度
C.为了使酸碱充分反应,应当缓慢分次倒入NaOH溶液并搅拌
D.碱过量的目的是保证盐酸完全反应
7.已知:。若断裂1molH-H、1molN-H需要吸收的能量分别为436kJ、391kJ,则断裂1molN≡N需要吸收的能量为( )
A.431kJ B.945.6kJ C.649kJ D.869kJ
8.反应过程I、Ⅱ都能将反应物(M)转化为产物(N)。其能量与反应进程的关系如下:
下列有关说法正确的是( )
A.进程I是吸热反应 B.X是催化剂
C.比稳定 D.相同条件下,反应的热量变化:
9.下列关于化学反应与能量变化的说法正确的是( )
A.放热反应的发生无需任何条件
B.化学键的断裂和形成与反应放热和吸热无关
C.化学反应过程都伴随着能量的变化
D.与NaOH的反应是吸热反应
10.某化学研究小组探究外界条件对化学反应mA(g)+nB(g)pC(g)的速率和平衡的影响图象如图,下列判断正确的是( )
A.由图1可知,,该反应正反应为吸热反应
B.由图2可知,该反应m+n
D.图4中,若m+n=p,则a曲线一定使用了催化剂
二、填空题
11.根据下列叙述写出相应的热化学方程式。
(1)如图所示为和生成过程中的能量变化。
由上图写出和反应生成的热化学方程式:__________。
(2)通常人们把拆开某化学键吸收的能量看成该化学键的键能。下列是一些化学键的键能,根据键能数据写出由和生成与的热化学方程式:__________。
化学键 C-H C-F H-F F-F
键能/() 414 489 565 155
(3)某液态有机物和一定量的氧气混合点燃,恰好完全燃烧,生成液态水和(标准状况)并放出的热量。请写出该有机物燃烧反应的热化学方程式:__________。
12.某学生通过测定反应过程中放出的热量来计算中和反应的反应热,将盐酸与溶液在如图所示装置中进行中和反应(在稀溶液中,可以近似地认为酸和碱的密度、比热容与水的相同)。回答下列问题:
(1)仪器a的名称为__________,其作用是__________。
(2)实验中改用盐酸与溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”或“不相等”,下同);反应消耗时放出的热量__________,理由是__________。
(3)若用等物质的量的固体进行上述实验,测得的中和反应的反应热的绝对值()将__________(填“偏大”“偏小”或“无影响”)。
(4)若四次操作测得终止温度与起始温度差分别为:①、②、③、④,则所得的中和反应的反应热________[已知该温度下生成溶液的比热容,忽略量热计的比热容,保留三位有效数字]。
13.当今社会,能源的发展已成为全世界共同关注的话题,乙烷、二甲醚的燃烧热的值较大,可用作燃料。如图表示乙烷、二甲醚燃烧过程中的能量变化。请回答下列问题:
(1)__________
(2)乙烷的燃烧热__________。
(3)等物质的量的比完全燃烧生成指定产物时放出的热量__________(填“多”或“少”)。
(4)根据题图写出表示二甲醚燃烧热的热化学方程式:__________。
三、实验题
14.I.研究化学反应中的能量变化,能更好地利用化学反应为生产和生活服务。
(1)已知、时,32g甲烷燃烧生成和液态水时放出1780.6kJ热量,则该条件下反应的热化学方程式为___________。
Ⅱ.反应的能量变化如图所示。
(2)该反应为___________(填“吸热”或“放热”)反应。
(3)如图三个装置中,不能证明“锌与稀硫酸反应是吸热反应还是放热反应”的是___________(填序号)
Ⅲ.如图是某兴趣小组设计原电池示意图
(4)下列实验叙述合理的是___________(填序号)
A.Cu极有产生 B.锌作负极,发生还原反应
C.向Zn极移动 D.电子由Zn经导线流向Cu
(5)请写出该电池的正极反应式___________
(6)若有1mol电子流过导线,则理论上在标准状况下,产生的体积为___________L
(7)将稀换成溶液,电极质量增加的是___________(填“锌极”或“铜极”)。
参考答案
1.答案:B
解析:A.碳酸氢钠与盐酸反应属于吸热反应,A不符合;B.生石灰与水混合生成氢氧化钙的反应是放热反应,B符合;C.碳与水蒸气反应制备水煤气属于吸热反应,不符合;D.煅烧石灰石生成氧化钙和二氧化碳,属于吸热反应,D不符合;故答案为:B.
2.答案:B
解析:
3.答案:B
4.答案:C
解析:化学反应一定伴随能量变化,能量变化不一定伴随发生化学反应,A错误;
反应吸放热与反应条件无关,需要加热的化学反应不一定是吸热反应,B错误;
化学反应的实质是旧键断、新键生,旧键断吸热、新键生放热,所以能量变化主要是由化学键变化引起的,C正确;
化学反应中能量变化的大小与反应物的质量多少有关,D错误。
故选C。
5.答案:B
解析:A.由图可知,该反应是反应物总能量高于生成物总能量的放热反应,故A错误;
B.学键的断裂需要吸收能量,由图可知,断裂2molA—B键需要吸收ykJ的能量,故B正确;
C.化学键的断裂需要吸收能量,由图可知,断裂1molA A键和1molB B键能吸收xkJ的能量,故C错误;
D.由图可知,该反应是反应物总能量高于生成物总能量的放热反应,则2molAB的总能量低于1mol和1mol的总能量,故D错误;
故选B。
6.答案:C
解析:A.大小烧杯之间塞满碎泡沫,目的是减少热量损失,减小测量误差,故A正确;
B.充分反应,放出热量最多时,温度最高,测量终止温度时,应当记录混合溶液的最高温度,故B正确;
C.为了使酸碱充分反应,应当快速一次倒入溶液并搅拌,防止热量散失,故C错误;
D.碱过量的目的是保证盐酸完全反应,防止出现实验误差,故D正确;
故选C。
7.答案:B
解析:,若断裂1molH-H和1molN-H需要吸收的能量分别为436kJ和391kJ,则断裂1molN≡N需要吸收的能量为-92.4kJ-(3×436kJ-6×391kJ)=945.6;
故选B。
8.答案:B
解析:A.进程Ⅰ中产物N能量比反应物M低,为放热反应,故A错误;
B.由进程Ⅱ可知,反应前为M+X,反应后为N+X,X为催化剂,故B正确;
C.能量越低越稳定,由图可知,N·X能量更低,更稳定,故C错误;
D.X为催化剂,不该改变反应热,相同条件下,反应的热量变化:;故D错误;
故选B。
9.答案:C
解析:化学反应过程都伴随着能量的变化。
10.答案:C
解析:A.根据“先拐先平数值大”,可知,升高温度,C的百分含量减小,说明该反应的正反应为放热反应,选项A错误;
B.由图可知,增大压强,C的百分含量增大,说明加压平衡正向移动,所以该反应m+n>p,选项B错误;
C.图中点3的转化率小于同温下的平衡转化率,说明点3反应正向进行,反应速率:,选项C正确;
D.曲线a速率加快、平衡没移动,若m+n=p,曲线a可能使用了催化剂或加压,选项D错误;
答案选C。
11.答案:(1)
(2)
(3)
解析:(1)由图可知,键的键能为,反应热=反应物总键能-生成物总键能,热化学方程式为。
(2)在反应中,反应物的总键能-生成物的总键能=,故其热化学方程式为。
(3)通过燃烧产物的元素组成可知该有机物中肯定含有碳元素和氢元素,可能含有氧元素。
$,,,,,,碳元素和氢元素的质量之和是,故该有机物中还含有氧元素,羍元素的质量是,,故该有机物中原子个数比为从而可确定该有机物的分子式为。由上述分析可知,该有机物的物质的量为,结合题意可知,该液态有机物完全燃烧生成液态水和气体时放出的热量为,则该液态有机物完全燃烧生成液态水和气体时放出的热量为,故该反应的热化学方程式为。
12.答案:(1)玻璃搅拌器使酸和碱充分反应
(2)不相等相等反应放出的热量与生成的物质的量成比例
(3)偏大
(4)-56.8
解析:(2)反应放出的热量与所用酸以及碱的量的多少有关,实验中改用盐酸与溶液进行反应,与上述实验相比,生成水的量增多,所放出的热量偏多,即中和反应放出的热量与生成的物质的量成比例,所以反应消耗放出的热量是相等的。
(3)固体溶解会放出热量,所以测得的会偏大。
(4)四次实验数据中,数据②误差大,应舍去,故温度差的平均值为,盐酸与溶液混合,氢氧化钠过量,反应生成水,混合溶液的总质量,则生成水放出的热量,所以生成水放出的热量为,即生成时的反应热。
13.答案:(1)
(2)
(3)少
(4)
解析:(1)依据氢原子守恒,,。
(2)根据图像分析可知乙烷完全燃烧放热,所以乙烷完全燃烧放热为,则乙烷的燃烧热
(3)物质气态时比液态时能量高,则等物质的量的比完全燃烧生成指定产物时放出的热量少。
(4)结合状态及焓变可知,二甲醚完全燃烧时放出的热量为,则二甲醚完全燃烧的热化学方程式为。
14.答案:(1)或者
(2)放热
(3)Ⅲ
(4)AD
(5)
(6)11.2
(7)铜极
解析:
(1)
已知32gCH4燃烧生成液态水时放出热量为1780.6kJ,即1molCH4燃烧放出的热量为890kJ,热化学方程式为或者。
(2)从图看出反应物的能量高于生成物的总能量,该反应放热反应。答案为放热;
(3)锌和稀硫酸反应放热,装置中的温度升高而Ⅰ、Ⅱ的压强增大,从而Ⅰ中左端红墨水下降,而Ⅱ中烧杯有气泡,但Ⅲ为敞开体系压强变化不大,所以无明显现象。答案为Ⅲ;
(4)该电池的总反应为:,Zn更活泼为电池的负极,而Cu为正极。
A.Cu发生还原反应,,A项正确;
B.Zn为负极,发生氧化反应,B项错误;
C.移向Cu极,C项错误;
D.电子从负极流出经导线到达正极,即从Zn经导线到达Cu,D项正确;
故选AD。
(5)Cu发生还原反应,;
(6)即当2mol电子转移时产生1molH2标况下的体积为22.4L。那么1mol电子时,产生的为11.2L;
(7)
若换成CuSO4,总反应为,在Cu极发生还原反应而析出,故Cu电极质量增加。答案为铜极。
