1.3常见的酸
图片预览









文档简介
课件34张PPT。常见的酸1.生活中的酸有哪些? 生活中的酸有:食醋有酸味、食醋中的醋酸(CH3COOH);水果有酸味、水果中有果酸,如杨梅很酸——望梅止渴、苹果中有苹果酸、柠檬、柑桔等水果中有柠檬酸,酸奶中有乳酸,汽水中有碳酸等。2.生活中的碱有哪些? 生活中的碱有:石灰水中有氢氧化钙Ca(OH)2,炉具清洁剂中含有氢氧化钠NaOH,它们都是碱。吃的皮蛋中也有碱。 你已经知道哪些酸?了解它们的性质吗?它们在生产、生活中有哪些应用?讨论:1、人的胃液里含有什么酸?
2、汽车电瓶里含有什么酸?
3、食醋里含有什么酸?
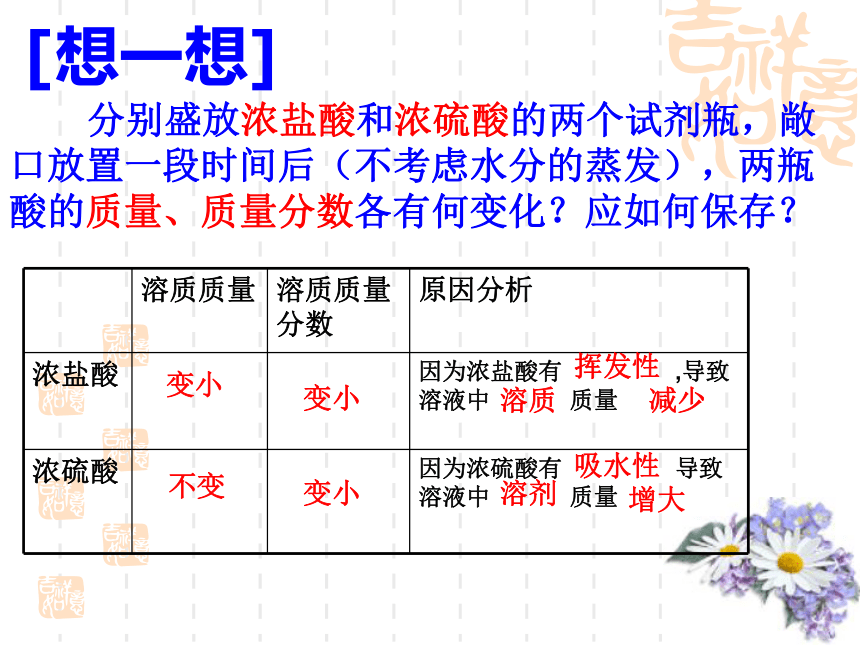
4、汽水里含有什么酸?盐酸硫酸醋酸碳酸探究一:浓硫酸和浓盐酸的物理性质 观察浓硫酸和浓盐酸的状态、颜色,打开瓶塞,观察发生的现象;闻一闻是否有气味?注意:闻气体的方法探究一:浓硫酸和浓盐酸的物理性质 观察浓硫酸和浓盐酸的状态、颜色,比较它们与同体积水的质量大小,打开瓶塞,观察发生的现象;闻一闻是否有气味?无色液体无色油状液体
有挥发性,能在
空气中形成白雾
不易挥发
有刺激性气味无味盐酸和硫酸的用途很广[想一想] 分别盛放浓盐酸和浓硫酸的两个试剂瓶,敞口放置一段时间后(不考虑水分的蒸发),两瓶酸的质量、质量分数各有何变化?应如何保存?变小变小不变变小挥发性溶质减少吸水性溶剂增大2、浓硫酸的腐蚀性【实验10—3】将纸、小木棍、玻璃片上做实验
(注意不要将浓硫酸沾到皮肤或衣服上)纸上显出黑色字迹蘸有浓硫酸的部位变黑滴有浓硫酸的部位变黑,甚至烧成洞浓硫酸的特性1、可以利用浓硫酸的吸水性将其作为干燥剂。
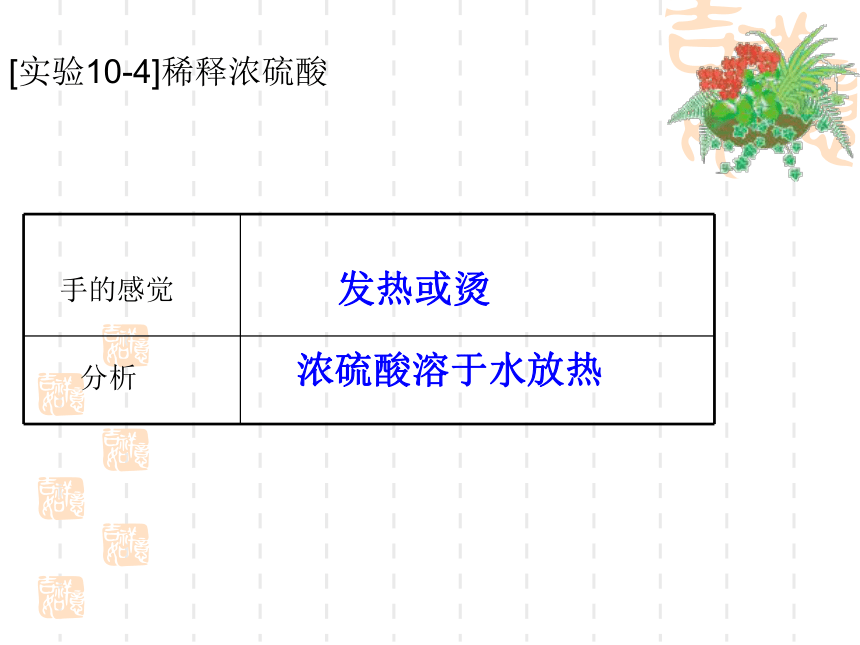
2、浓硫酸有强烈的腐蚀性,能夺取纸张、木材、布料、皮肤里的水分,生成黑色的炭。所以,使用浓硫酸应十分小心。[实验10-4]稀释浓硫酸手的感觉分析发热或烫浓硫酸溶于水放热浓硫酸的特性 你知道稀释浓硫酸时为什么不能将水倒进浓硫酸里而是要将浓硫酸沿着器壁慢慢注入水中,而且还不断搅拌? 因为水的密度较小,浮在浓硫酸上面,溶解时放出的热会使水立刻沸腾,使硫酸液滴向四周飞溅,这是非常危险的 通过前面的学习我们已经知道,酸可以跟许多物质发生反应,这些反应在生产、生活和科学研究中应用广泛。如某些工厂常用稀硫酸清洗金属器件,就是利用酸与金属氧化物的反应。你还知道酸与哪些物质能发生反应?请将你所知道的与同学们交流、讨论。探究二:稀硫酸和稀盐酸的化学性质 用稀硫酸和稀盐酸做几个简单的实验,把观察到的现象填入下表,并与同学们讨论以下问题:石蕊:变红 酚酞:不变色除铜外,有气泡产生,反应速率:镁>锌>铁铁锈溶解,溶液黄色
氧化铜溶解,溶液蓝色氢氧化铜溶解,溶液蓝色
氢氧化铁溶解,溶液黄色石灰石溶解,产生大量气泡1、与指示剂作用
酸溶液能使紫色石蕊试液变红
无色酚酞试液不变色三、常见的酸结论:镁、铝、锌、铁等活动性较强的金属都能与稀硫酸、盐酸发性置换反应,放出氢气,同时生成一种称为盐的化合物。三、常见的酸金属 + 酸→盐 + 氢气如:Zn + 2HCl == ZnCl2 + H2↑
Fe + H2SO4 == FeSO4 + H2↑2、金属与酸反应问题:铁锈的主要成分是什么?请分别写出稀硫酸和稀盐酸与铁锈的主要成分反应的化学方程式。Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O
Fe2O3 + 6HCl == 2FeCl3+ 3H2O三、常见的酸3、金属氧化物与酸的反应金属氧化物 + 酸→盐 + 水三、常见的酸4、碱与酸的反应Cu(OH)2 + H2SO4 == CuSO4 + H2O
Fe(OH)3 + 3HCl == FeCl3+ 3H2O碱 + 酸→盐 + 水中和反应(属于复分解反应)问题:石灰石的主要成分是什么?请写出稀盐酸与石灰石的主要成分反应的化学方程式。一、常见的酸CaCO3 + 2HCl == CaCl2+ CO2↑+ H2O5、盐与酸反应盐 + 酸→盐 + 酸硝酸银和稀盐酸反应补充实验氯化钡和稀硫酸反应AgNO3 + HCl = AgCl ↓+ HNO3BaCl2 + H2SO4 = BaSO4↓+ 2HCl思考:1、如何检验含Cl-的化合物?
2、如何检验含SO42-的化合物?
3、如何区分盐酸和硫酸?
先滴加AgNO3,再滴几滴稀HNO3方法一:先滴加Ba(NO3)2,再滴几滴稀HNO3方法二:先滴几滴稀HCl,再滴加BaCl2用BaCl2溶液,不用AgNO3溶液思考:4、除杂
HCl(H2SO4)
HNO3(H2SO4)
HNO3(HCl)
5、转化
H2SO4 HCl HNO3小组讨论:
1、盐酸、硫酸、硝酸在组成和性质上有许多共同之处。请你尽可能多地归纳出它们的共同点,并与同学们交流。
2、请你回忆你有关溶液导电性实验,通过讨论,对“酸的水溶液有共同的化学性质”做出解释。总结:酸所具有的共同特点
酸在水溶液中都能电离出氢离子,因此酸溶液会具有许多共同的性质。如:
(1)酸溶液与酸碱指示剂的反应
A.紫色石蕊试液或蓝色石蕊试纸遇到酸溶液变红色;
B.无色酚酞试剂遇到酸溶液不变色。
提醒:紫色石蕊试剂变色情况为:“酸红碱蓝”;是指示剂变色,而非待测溶液本身变色。 总结:酸所具有的共同特点
酸在水溶液中都能电离出氢离子,因此酸溶液会具有许多共同的性质。如:
(2)酸溶液与某些金属反应
酸溶液 + 活动性较强的金属 → 盐溶液 + 氢气
注意:A.在金属活动性顺序表中,排在氢前面的金属能置换出酸中的氢,排在氢后面的金属则不能;
B.排在金属活动性顺序表越前面的金属,反应现象越剧烈,速度越快,如Mg反应有明显放热现象;
C.强氧化性酸与金属反应后,不能生成氢气,而是生成水。如浓硫酸、硝酸等强氧化性酸;
D.该类反应属于置换反应总结:酸所具有的共同特点
酸在水溶液中都能电离出氢离子,因此酸溶液会具有许多共同的性质。如:
(3)酸溶液与某些金属氧化物反应
酸溶液 + 金属氧化物 → 盐溶液 + 水
注意:该反应过程中,金属元素的化合价不变,酸中的原子团不变总结:酸所具有的共同特点
酸在水溶液中都能电离出氢离子,因此酸溶液会具有许多共同的性质。如:
(4)酸溶液与某些盐反应
酸溶液 + 盐 → 新酸 + 新盐
注意:A.我们通常遇到的盐是碳酸盐,因此绝大部分反应是:
酸 + 碳酸盐 → 新盐 + 水 + 二氧化碳你能得出答案吗?1.下列各物质露置在空气中,一段时间后,物质的总质量会增加的是( )
A.浓盐酸 B.浓硝酸
C.浓硫酸 D.醋酸C2.相同质量的下列金属与足量的等质量的相同质量分数的稀硫酸反应,产生氢气质量最多的是( )
A.Zn B.Fe
C.Mg D.AlD3.下列物质不能与锌发生置换反应生成氢气的是( )
A.稀硫酸 B.盐酸
C.硝酸 D.浓硫酸 CDD 4.有5.6g含一种杂质的不纯的铁和足量的稀盐酸反应放出0.21g氢气,则铁片中含有的另一种金属杂质是下列金属中的①Zn ②Mg ③Cu ④Al ( )
A. ①或② B. ②或③
C. ③或④ D. ②或④课外作业(计算):
将一定量的石灰石放入烧杯中,加入100g稀盐酸恰好完全反应(杂质不溶解,也不参加反应),此时,烧杯中物质的总质量比反应前减少了8.8g,则石灰石中碳酸钙的质量为多少克?所用盐酸的溶质质量分数为多少?
2、汽车电瓶里含有什么酸?
3、食醋里含有什么酸?
4、汽水里含有什么酸?盐酸硫酸醋酸碳酸探究一:浓硫酸和浓盐酸的物理性质 观察浓硫酸和浓盐酸的状态、颜色,打开瓶塞,观察发生的现象;闻一闻是否有气味?注意:闻气体的方法探究一:浓硫酸和浓盐酸的物理性质 观察浓硫酸和浓盐酸的状态、颜色,比较它们与同体积水的质量大小,打开瓶塞,观察发生的现象;闻一闻是否有气味?无色液体无色油状液体
有挥发性,能在
空气中形成白雾
不易挥发
有刺激性气味无味盐酸和硫酸的用途很广[想一想] 分别盛放浓盐酸和浓硫酸的两个试剂瓶,敞口放置一段时间后(不考虑水分的蒸发),两瓶酸的质量、质量分数各有何变化?应如何保存?变小变小不变变小挥发性溶质减少吸水性溶剂增大2、浓硫酸的腐蚀性【实验10—3】将纸、小木棍、玻璃片上做实验
(注意不要将浓硫酸沾到皮肤或衣服上)纸上显出黑色字迹蘸有浓硫酸的部位变黑滴有浓硫酸的部位变黑,甚至烧成洞浓硫酸的特性1、可以利用浓硫酸的吸水性将其作为干燥剂。
2、浓硫酸有强烈的腐蚀性,能夺取纸张、木材、布料、皮肤里的水分,生成黑色的炭。所以,使用浓硫酸应十分小心。[实验10-4]稀释浓硫酸手的感觉分析发热或烫浓硫酸溶于水放热浓硫酸的特性 你知道稀释浓硫酸时为什么不能将水倒进浓硫酸里而是要将浓硫酸沿着器壁慢慢注入水中,而且还不断搅拌? 因为水的密度较小,浮在浓硫酸上面,溶解时放出的热会使水立刻沸腾,使硫酸液滴向四周飞溅,这是非常危险的 通过前面的学习我们已经知道,酸可以跟许多物质发生反应,这些反应在生产、生活和科学研究中应用广泛。如某些工厂常用稀硫酸清洗金属器件,就是利用酸与金属氧化物的反应。你还知道酸与哪些物质能发生反应?请将你所知道的与同学们交流、讨论。探究二:稀硫酸和稀盐酸的化学性质 用稀硫酸和稀盐酸做几个简单的实验,把观察到的现象填入下表,并与同学们讨论以下问题:石蕊:变红 酚酞:不变色除铜外,有气泡产生,反应速率:镁>锌>铁铁锈溶解,溶液黄色
氧化铜溶解,溶液蓝色氢氧化铜溶解,溶液蓝色
氢氧化铁溶解,溶液黄色石灰石溶解,产生大量气泡1、与指示剂作用
酸溶液能使紫色石蕊试液变红
无色酚酞试液不变色三、常见的酸结论:镁、铝、锌、铁等活动性较强的金属都能与稀硫酸、盐酸发性置换反应,放出氢气,同时生成一种称为盐的化合物。三、常见的酸金属 + 酸→盐 + 氢气如:Zn + 2HCl == ZnCl2 + H2↑
Fe + H2SO4 == FeSO4 + H2↑2、金属与酸反应问题:铁锈的主要成分是什么?请分别写出稀硫酸和稀盐酸与铁锈的主要成分反应的化学方程式。Fe2O3 + 3H2SO4 == Fe2(SO4)3 + 3H2O
Fe2O3 + 6HCl == 2FeCl3+ 3H2O三、常见的酸3、金属氧化物与酸的反应金属氧化物 + 酸→盐 + 水三、常见的酸4、碱与酸的反应Cu(OH)2 + H2SO4 == CuSO4 + H2O
Fe(OH)3 + 3HCl == FeCl3+ 3H2O碱 + 酸→盐 + 水中和反应(属于复分解反应)问题:石灰石的主要成分是什么?请写出稀盐酸与石灰石的主要成分反应的化学方程式。一、常见的酸CaCO3 + 2HCl == CaCl2+ CO2↑+ H2O5、盐与酸反应盐 + 酸→盐 + 酸硝酸银和稀盐酸反应补充实验氯化钡和稀硫酸反应AgNO3 + HCl = AgCl ↓+ HNO3BaCl2 + H2SO4 = BaSO4↓+ 2HCl思考:1、如何检验含Cl-的化合物?
2、如何检验含SO42-的化合物?
3、如何区分盐酸和硫酸?
先滴加AgNO3,再滴几滴稀HNO3方法一:先滴加Ba(NO3)2,再滴几滴稀HNO3方法二:先滴几滴稀HCl,再滴加BaCl2用BaCl2溶液,不用AgNO3溶液思考:4、除杂
HCl(H2SO4)
HNO3(H2SO4)
HNO3(HCl)
5、转化
H2SO4 HCl HNO3小组讨论:
1、盐酸、硫酸、硝酸在组成和性质上有许多共同之处。请你尽可能多地归纳出它们的共同点,并与同学们交流。
2、请你回忆你有关溶液导电性实验,通过讨论,对“酸的水溶液有共同的化学性质”做出解释。总结:酸所具有的共同特点
酸在水溶液中都能电离出氢离子,因此酸溶液会具有许多共同的性质。如:
(1)酸溶液与酸碱指示剂的反应
A.紫色石蕊试液或蓝色石蕊试纸遇到酸溶液变红色;
B.无色酚酞试剂遇到酸溶液不变色。
提醒:紫色石蕊试剂变色情况为:“酸红碱蓝”;是指示剂变色,而非待测溶液本身变色。 总结:酸所具有的共同特点
酸在水溶液中都能电离出氢离子,因此酸溶液会具有许多共同的性质。如:
(2)酸溶液与某些金属反应
酸溶液 + 活动性较强的金属 → 盐溶液 + 氢气
注意:A.在金属活动性顺序表中,排在氢前面的金属能置换出酸中的氢,排在氢后面的金属则不能;
B.排在金属活动性顺序表越前面的金属,反应现象越剧烈,速度越快,如Mg反应有明显放热现象;
C.强氧化性酸与金属反应后,不能生成氢气,而是生成水。如浓硫酸、硝酸等强氧化性酸;
D.该类反应属于置换反应总结:酸所具有的共同特点
酸在水溶液中都能电离出氢离子,因此酸溶液会具有许多共同的性质。如:
(3)酸溶液与某些金属氧化物反应
酸溶液 + 金属氧化物 → 盐溶液 + 水
注意:该反应过程中,金属元素的化合价不变,酸中的原子团不变总结:酸所具有的共同特点
酸在水溶液中都能电离出氢离子,因此酸溶液会具有许多共同的性质。如:
(4)酸溶液与某些盐反应
酸溶液 + 盐 → 新酸 + 新盐
注意:A.我们通常遇到的盐是碳酸盐,因此绝大部分反应是:
酸 + 碳酸盐 → 新盐 + 水 + 二氧化碳你能得出答案吗?1.下列各物质露置在空气中,一段时间后,物质的总质量会增加的是( )
A.浓盐酸 B.浓硝酸
C.浓硫酸 D.醋酸C2.相同质量的下列金属与足量的等质量的相同质量分数的稀硫酸反应,产生氢气质量最多的是( )
A.Zn B.Fe
C.Mg D.AlD3.下列物质不能与锌发生置换反应生成氢气的是( )
A.稀硫酸 B.盐酸
C.硝酸 D.浓硫酸 CDD 4.有5.6g含一种杂质的不纯的铁和足量的稀盐酸反应放出0.21g氢气,则铁片中含有的另一种金属杂质是下列金属中的①Zn ②Mg ③Cu ④Al ( )
A. ①或② B. ②或③
C. ③或④ D. ②或④课外作业(计算):
将一定量的石灰石放入烧杯中,加入100g稀盐酸恰好完全反应(杂质不溶解,也不参加反应),此时,烧杯中物质的总质量比反应前减少了8.8g,则石灰石中碳酸钙的质量为多少克?所用盐酸的溶质质量分数为多少?
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
