华师版科学九年级上册 期中测试卷(1-3章 含答案)
文档属性
| 名称 | 华师版科学九年级上册 期中测试卷(1-3章 含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-09-30 16:59:40 | ||
图片预览

文档简介
期中测试卷
班级 得分 学号 姓名
本卷可能用到的相对原子质量:
H—1 C—12 O—16 Na—23 Cl—35.5 Ca—40
一、选择题(每小题只有一个正确答案,每题2分,共30分)
1.在一定条件下,一密闭容器内发生某反应,测得反应前后各物质的质量如表所示。下列说法正确的是( )
物质 a b c d
反应前的质量/g 30 5 10 15
反应后的质量/g x y 20 20
A. b一定是反应物
B. x+y=30
C. x的取值范围一定是0≤x<20
D.参加反应的a与d的质量比可能为2:1
2.生活中一些常见食物的pH如下:
食物 柠檬汁 鸡蛋清 纯水 牛奶 红豆汁
pH 2.0~2.5 7.4~7.6 7 6.3~8.5 10.2~11.4
上述食物中,胃酸过多的人不宜食用的是( )
A.柠檬汁 B.牛奶 C.鸡蛋 D.红豆汁
3.下列是分析已变质氢氧化钠溶液的相关实验,其中合理的是 ( )
①证明变质:取少量溶液,滴加过量的稀盐酸,观察现象
②确定成分:取少量溶液,加入适量氢氧化钙溶液,过滤,向滤液中滴加酚酞试液
③测定纯度:取一定量溶液,加入浓盐酸,用氢氧化钠固体吸收气体,称量
④除去杂质:向溶液中滴加氯化钙溶液至恰好完全反应,过滤
A.②③ B.①②③ C.①②④ D.①
4.下列物质的性质与用途的对应关系正确的是( )
选项 性质 用途
A 白色硫酸铜粉末遇水会变蓝色 检验水
B 浓硫酸具有脱水性 干燥氧气
C 稀盐酸能与某些金属反应 除铁锈
D 氢氧化钠能与某些金属氧化物反应 吸收二氧化碳
5.酸、碱、盐在工农业生产和日常生活中具有广泛应用。下列关于酸、碱、盐的生产或应用的说法不合理的是( )
A.苛性钠用于改良酸性土壤,也可用于食品干燥剂
B.小苏打可用于治疗胃酸过多,也可做面点发酵剂
C.消石灰可以配制农药波尔多液,也可用于处理污水
D.石灰石可制生石灰,也是炼铁的原料
6.下列各组溶液中,仅用同组间的相互反应就可区别开的是 ( )
A. Na2CO3、HCl、HNO3、Na2SO4 B. K2CO3、H2SO4、HNO3、BaCl2
C. HCl、AgNO3、HNO3、NaCl D. Na2SO4、NaOH、CuSO4、NaCl
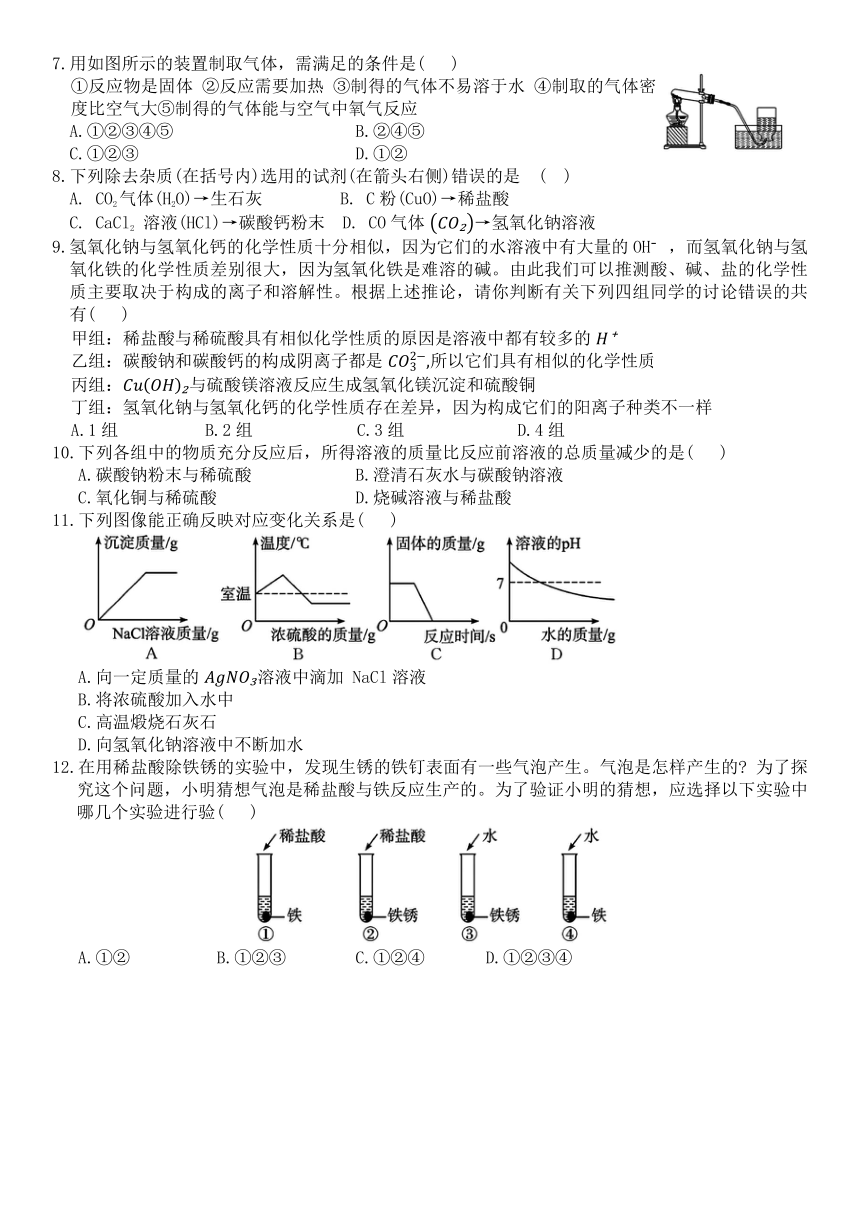
7.用如图所示的装置制取气体,需满足的条件是( )
①反应物是固体 ②反应需要加热 ③制得的气体不易溶于水 ④制取的气体密度比空气大⑤制得的气体能与空气中氧气反应
A.①②③④⑤ B.②④⑤
C.①②③ D.①②
8.下列除去杂质(在括号内)选用的试剂(在箭头右侧)错误的是 ( )
A. CO2气体(H2O)→生石灰 B. C粉(CuO)→稀盐酸
C. CaCl2 溶液(HCl)→碳酸钙粉末 D. CO气体 →氢氧化钠溶液
9.氢氧化钠与氢氧化钙的化学性质十分相似,因为它们的水溶液中有大量的OH ,而氢氧化钠与氢氧化铁的化学性质差别很大,因为氢氧化铁是难溶的碱。由此我们可以推测酸、碱、盐的化学性质主要取决于构成的离子和溶解性。根据上述推论,请你判断有关下列四组同学的讨论错误的共有( )
甲组:稀盐酸与稀硫酸具有相似化学性质的原因是溶液中都有较多的
乙组:碳酸钠和碳酸钙的构成阴离子都是 所以它们具有相似的化学性质
丙组:与硫酸镁溶液反应生成氢氧化镁沉淀和硫酸铜
丁组:氢氧化钠与氢氧化钙的化学性质存在差异,因为构成它们的阳离子种类不一样
A.1组 B.2组 C.3组 D.4组
10.下列各组中的物质充分反应后,所得溶液的质量比反应前溶液的总质量减少的是( )
A.碳酸钠粉末与稀硫酸 B.澄清石灰水与碳酸钠溶液
C.氧化铜与稀硫酸 D.烧碱溶液与稀盐酸
11.下列图像能正确反映对应变化关系是( )
A.向一定质量的 溶液中滴加 NaCl溶液
B.将浓硫酸加入水中
C.高温煅烧石灰石
D.向氢氧化钠溶液中不断加水
12.在用稀盐酸除铁锈的实验中,发现生锈的铁钉表面有一些气泡产生。气泡是怎样产生的 为了探究这个问题,小明猜想气泡是稀盐酸与铁反应生产的。为了验证小明的猜想,应选择以下实验中哪几个实验进行验( )
A.①② B.①②③ C.①②④ D.①②③④
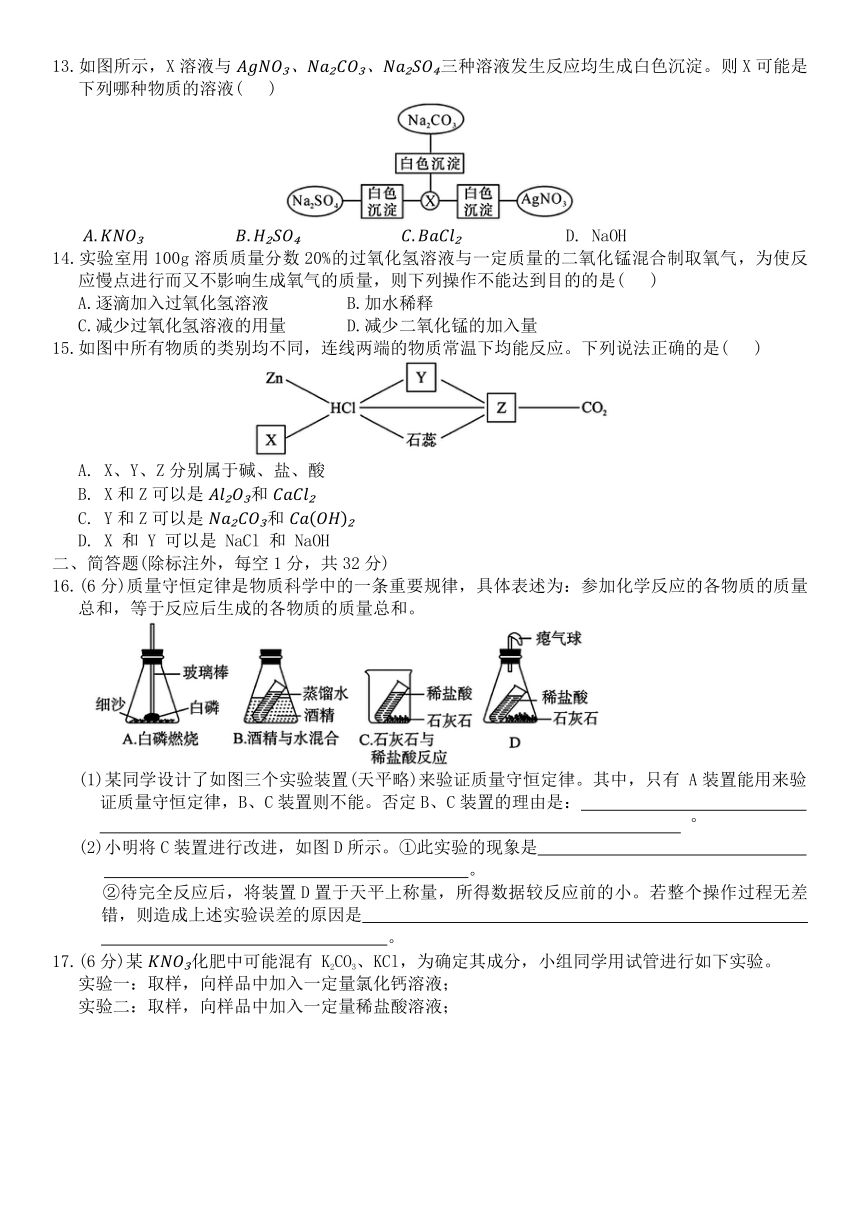
13.如图所示,X溶液与 三种溶液发生反应均生成白色沉淀。则X可能是下列哪种物质的溶液( )
D. NaOH
14.实验室用100g溶质质量分数20%的过氧化氢溶液与一定质量的二氧化锰混合制取氧气,为使反应慢点进行而又不影响生成氧气的质量,则下列操作不能达到目的的是( )
A.逐滴加入过氧化氢溶液 B.加水稀释
C.减少过氧化氢溶液的用量 D.减少二氧化锰的加入量
15.如图中所有物质的类别均不同,连线两端的物质常温下均能反应。下列说法正确的是( )
A. X、Y、Z分别属于碱、盐、酸
B. X和Z可以是 和
C. Y和Z可以是 和
D. X 和 Y 可以是 NaCl 和 NaOH
二、简答题(除标注外,每空1分,共32分)
16.(6分)质量守恒定律是物质科学中的一条重要规律,具体表述为:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
(1)某同学设计了如图三个实验装置(天平略)来验证质量守恒定律。其中,只有 A装置能用来验证质量守恒定律,B、C装置则不能。否定B、C装置的理由是: °
(2)小明将C装置进行改进,如图D所示。①此实验的现象是 。
②待完全反应后,将装置D置于天平上称量,所得数据较反应前的小。若整个操作过程无差错,则造成上述实验误差的原因是 。
17.(6分)某 化肥中可能混有 K2CO3、KCl,为确定其成分,小组同学用试管进行如下实验。
实验一:取样,向样品中加入一定量氯化钙溶液;
实验二:取样,向样品中加入一定量稀盐酸溶液;
实验三:取样,向样品中加入一定量石灰水。
三个实验均观察到明显现象,回答下列问题:
(1)实验一用化学方程式表示为 。
(2)在以上三个实验中,取实验 (填“一”“二”或“三”)过滤后的滤液,先加入过量稀硝酸,再加入 溶液,即可确定KCl是否存在。
(3)实验后,将三个实验试管中的所有物质依次倒入烧杯中,充分混合,烧杯中沉淀质量与时间关系如图所示。根据图示判断,下列说法中,正确的是 (2分)。
A.混合前实验一试管中溶液的溶质是 KNO3、KCl和
B.若测图中 ab段(不包括a、b点)溶液的pH,pH一定大于7
C.图示 cd段沉淀质量增加,说明混合前实验三试管中 一定有剩余
D.向d点混合物中加入稀盐酸恰好完全反应后,可将无色溶液直接排放
18.侯德榜在氨碱法的基础上创立了更为先进的联合制碱法,主要工艺流程如图:
(1)反应①的化学方程式为 。
(2)工业上常用分离液态空气法制取氮气,该过程属于 变化。
(3)在工农业生产过程中,会排放 加剧温室效应。下列做法能减少二氧化碳排放的是 (填序号)。
A.焚烧秸秆肥田 B.提高火力发电量 C.大力使用清洁能源
(4)操作a的名称是 。
(5)有一种处理CO2 的方法,是将 与氢气在一定条件下反应生成甲烷和水,该反应的化学方程式为 ,参加反应的 与 H2 的质量之比是 。(4分)
19.某兴趣小组同学去盐场参观,带回了部分粗盐样品,并对其进行了如下探究,查阅资料得知:粗盐中除含少量泥沙等不溶性杂质外,还含有少量的可溶性杂质(假定可溶性杂质只有 一种),为了得到较纯净的氯化钠,小组同学将所得的“精盐”又做了如图处理:
(1)往溶液Ⅰ中加入过量NaOH溶液的原因是 (2分),生成白色沉淀的化学方程式为 。
(2)在得到的滤液中加入足量的稀盐酸的目的是 (2分)。
(3)若实验过程中不考虑损耗,最终到的 NaCl固体的质量将 (填“大于”“小于”或“等于”)原精盐中 NaCl的质量(2分)。
20.常见的酸、碱、盐在初中科学学习中占有非常重要地位,回答下列问题。
(1)将浓盐酸敞口放在空气中一段时间,浓盐酸的质量有何变化 (2分)。
(2)KCl是一种重要的盐,写出有 KCl生成的中和反应方程式 。
(3)实验室有失去标签的五瓶溶液:稀盐酸、石蕊试液、 溶液、NaOH溶液、 溶液。根据观察溶液的颜色或分别取样再两两混合,首先被鉴别出来的试剂是石蕊试液或 。
(4)根据常温下部分酸、碱、盐的溶解性表,能获取的信息为 (填序号)。
在水中的溶解性
②浓盐酸在实验室里要密封保存
③常温下 Mg(OH)2 能使酚酞试液变红
④在化合物中碳酸根离子显示的化合价
⑤不能用水来鉴别NaCl和 Na2SO4 两种白色粉末
⑥判断 Na2CO3溶液与 Ba(OH)2溶液能否发生复分解反应
三、实验探究题(每空2分,共24分)
21.如图是实验室制取某些常见气体所使用的一些装置和仪器。
(1)从图1的装置中任意选择一种仪器,写出它的名称: ,简要说出它的一种用途: 。
(2)写出实验室制取氧气的一个化学方程式: ,用该方法制取氧气的发生装置可选择图1中的 (填字母)。
(3)实验室制取二氧化碳选择的药品是 和 。收集二氧化碳通常选择图2中的 (填字母)仪器进行组合。欲收集满一瓶二氧化碳气体,收集一段时间后,将燃着的木条放在集气瓶口,若观察到火焰熄灭,则接下来应进行的操作是 ;若火焰不熄灭,则可能的原因是 。
22.用“侯氏制碱法”制得的纯碱中常含有氯化钠等杂质,兴趣小组欲对某品牌纯碱样品中碳酸钠的质量分数进行实验探究,他们设计了下列实验方案进行实验:利用如图所示实验装置(铁架台略去)和试剂,通过测定样品和稀盐酸反应产生的 气体的质量,计算 的质量分数(装置气密性良好,忽略盐酸的挥发性且每步反应或作用都是完全的)。
(1)打开止水夹K,先对装置 A和B(已连接)通入 一会儿,其目的是 ,再接上装置C和 D。
(2)待装置 A中的反应结束后,再一次打开止水夹K,继续往装置通入N2 一会儿。根据质量守恒定律,装置 (填标号)在反应前后的质量差就是产生的( 的质量,由此计算出该样品中 的质量分数。
(3)若省略B装置,将会使测定结果 (填“偏大”“不变”或“偏小”)。
四、计算题(23题6分,24题8分,共14分)
23.某兴趣小组用15g石灰石样品(杂质不溶于水且不与酸反应)与足量的稀盐酸反应,进行实验探究。实验装置如下:
(提示:碱石灰的成分为氧化钙和氢氧化钠,可吸收二氧化碳和水蒸气以及其他酸性气体)当A装置中无气体产生时,测得B装置的质量增加了4.7g,C装置的质量未发生变化且无明显现象。请回答:
(1)石灰石样品中碳酸钙的质量为 g。
(2)当A装置中无气体产生时,消耗掉稀盐酸 g。
(3)15g样品最多能产生二氧化碳气体的质量多少克
24.某氢氧化钙 粉末中含有碳酸钙及其他少量杂质,现取样品10克于锥形瓶中并加适量水搅拌得悬浊液,然后向锥形瓶中滴加稀盐酸,充分反应,测得加入稀盐酸的质量与反应生成气体的质量关系如图所示。
(1)充分反应后生成二氧化碳的质量是 g。
(2)横坐标“25”处的点,除表面滴加稀盐酸为25g,还隐含的相关信息有 。 (写出一点)
(3)加入60g稀盐酸后所得溶液中所含的溶质有 。
(4)计算样品中碳酸钙的质量分数。(提示:其他少量杂质不溶于水也不参加反应)(写出计算过程)
期中测试卷
1. D 2. A 3. D 4. A 5. A 6. B 7. C 8. A 9. B 10. B11. A 12. C 13. C 14. C 15. C
16.(1)B装置内发生的反应属于物理变化;C装置内产生的气体会逸出到空气中 (2)①锥形瓶内有大量气泡产生,气球变大②气球变大后,受到空气的浮力,方向竖直向上,导致天平称量反应后物质质量的读数偏小
↓ (2)三 (3)B
(2)物理 (3)C
(4)过滤
19.(1)将氯化镁全部除去 2NaCl (2)除去过量的氢氧化钠 (3)大于
20.(1)减少(
(3)稀盐酸 (4)①②④⑤⑥
21.(1)酒精灯(合理即可) 用于加热(或其他合理答案)
(或 2KCl+3O2↑或 A(或B,与上一空对应即可) (3)大理石 稀盐酸 CEF 将导管移出集气瓶,盖上玻璃片,正放在桌面上 CO2 还没有收集满(或其他合理答案)
22.(1)为了排尽装置A和B中含有的二氧化碳,使实验结果更准确(2)C (3)偏大
23.(1)10 (2)100
(3)设生成二氧化碳的质量为x,则
100 44
10g x
解得x=4.4g
24.(1)2.2 (2)此时氢氧化钙完全反应(或者碳酸钙开始反应)
和 HCl(名称也可以)
(4)根据图可以看出生成的二氧化碳的质量为2.2g。当滴加盐酸25g时,此时才会有气体产生,所以在加入盐酸到氢氧化钙和碳酸钙的混合物中时,盐酸先和氢氧化钙反应,待氢氧化钙完全反应后才和碳酸钙反应产生气体。当加入盐酸到45g时,气体不再产生,也就是碳酸钙消耗殆尽,再加入盐酸,此时盐酸过量,所以当加入盐酸达到60时,溶质是生成的氯化钙和剩余的过量的HCl。
设样品中碳酸钙的质量为x,则
100 44
x 2.2g
解得x=5g
则样品中碳酸钙的质量分数为
班级 得分 学号 姓名
本卷可能用到的相对原子质量:
H—1 C—12 O—16 Na—23 Cl—35.5 Ca—40
一、选择题(每小题只有一个正确答案,每题2分,共30分)
1.在一定条件下,一密闭容器内发生某反应,测得反应前后各物质的质量如表所示。下列说法正确的是( )
物质 a b c d
反应前的质量/g 30 5 10 15
反应后的质量/g x y 20 20
A. b一定是反应物
B. x+y=30
C. x的取值范围一定是0≤x<20
D.参加反应的a与d的质量比可能为2:1
2.生活中一些常见食物的pH如下:
食物 柠檬汁 鸡蛋清 纯水 牛奶 红豆汁
pH 2.0~2.5 7.4~7.6 7 6.3~8.5 10.2~11.4
上述食物中,胃酸过多的人不宜食用的是( )
A.柠檬汁 B.牛奶 C.鸡蛋 D.红豆汁
3.下列是分析已变质氢氧化钠溶液的相关实验,其中合理的是 ( )
①证明变质:取少量溶液,滴加过量的稀盐酸,观察现象
②确定成分:取少量溶液,加入适量氢氧化钙溶液,过滤,向滤液中滴加酚酞试液
③测定纯度:取一定量溶液,加入浓盐酸,用氢氧化钠固体吸收气体,称量
④除去杂质:向溶液中滴加氯化钙溶液至恰好完全反应,过滤
A.②③ B.①②③ C.①②④ D.①
4.下列物质的性质与用途的对应关系正确的是( )
选项 性质 用途
A 白色硫酸铜粉末遇水会变蓝色 检验水
B 浓硫酸具有脱水性 干燥氧气
C 稀盐酸能与某些金属反应 除铁锈
D 氢氧化钠能与某些金属氧化物反应 吸收二氧化碳
5.酸、碱、盐在工农业生产和日常生活中具有广泛应用。下列关于酸、碱、盐的生产或应用的说法不合理的是( )
A.苛性钠用于改良酸性土壤,也可用于食品干燥剂
B.小苏打可用于治疗胃酸过多,也可做面点发酵剂
C.消石灰可以配制农药波尔多液,也可用于处理污水
D.石灰石可制生石灰,也是炼铁的原料
6.下列各组溶液中,仅用同组间的相互反应就可区别开的是 ( )
A. Na2CO3、HCl、HNO3、Na2SO4 B. K2CO3、H2SO4、HNO3、BaCl2
C. HCl、AgNO3、HNO3、NaCl D. Na2SO4、NaOH、CuSO4、NaCl
7.用如图所示的装置制取气体,需满足的条件是( )
①反应物是固体 ②反应需要加热 ③制得的气体不易溶于水 ④制取的气体密度比空气大⑤制得的气体能与空气中氧气反应
A.①②③④⑤ B.②④⑤
C.①②③ D.①②
8.下列除去杂质(在括号内)选用的试剂(在箭头右侧)错误的是 ( )
A. CO2气体(H2O)→生石灰 B. C粉(CuO)→稀盐酸
C. CaCl2 溶液(HCl)→碳酸钙粉末 D. CO气体 →氢氧化钠溶液
9.氢氧化钠与氢氧化钙的化学性质十分相似,因为它们的水溶液中有大量的OH ,而氢氧化钠与氢氧化铁的化学性质差别很大,因为氢氧化铁是难溶的碱。由此我们可以推测酸、碱、盐的化学性质主要取决于构成的离子和溶解性。根据上述推论,请你判断有关下列四组同学的讨论错误的共有( )
甲组:稀盐酸与稀硫酸具有相似化学性质的原因是溶液中都有较多的
乙组:碳酸钠和碳酸钙的构成阴离子都是 所以它们具有相似的化学性质
丙组:与硫酸镁溶液反应生成氢氧化镁沉淀和硫酸铜
丁组:氢氧化钠与氢氧化钙的化学性质存在差异,因为构成它们的阳离子种类不一样
A.1组 B.2组 C.3组 D.4组
10.下列各组中的物质充分反应后,所得溶液的质量比反应前溶液的总质量减少的是( )
A.碳酸钠粉末与稀硫酸 B.澄清石灰水与碳酸钠溶液
C.氧化铜与稀硫酸 D.烧碱溶液与稀盐酸
11.下列图像能正确反映对应变化关系是( )
A.向一定质量的 溶液中滴加 NaCl溶液
B.将浓硫酸加入水中
C.高温煅烧石灰石
D.向氢氧化钠溶液中不断加水
12.在用稀盐酸除铁锈的实验中,发现生锈的铁钉表面有一些气泡产生。气泡是怎样产生的 为了探究这个问题,小明猜想气泡是稀盐酸与铁反应生产的。为了验证小明的猜想,应选择以下实验中哪几个实验进行验( )
A.①② B.①②③ C.①②④ D.①②③④
13.如图所示,X溶液与 三种溶液发生反应均生成白色沉淀。则X可能是下列哪种物质的溶液( )
D. NaOH
14.实验室用100g溶质质量分数20%的过氧化氢溶液与一定质量的二氧化锰混合制取氧气,为使反应慢点进行而又不影响生成氧气的质量,则下列操作不能达到目的的是( )
A.逐滴加入过氧化氢溶液 B.加水稀释
C.减少过氧化氢溶液的用量 D.减少二氧化锰的加入量
15.如图中所有物质的类别均不同,连线两端的物质常温下均能反应。下列说法正确的是( )
A. X、Y、Z分别属于碱、盐、酸
B. X和Z可以是 和
C. Y和Z可以是 和
D. X 和 Y 可以是 NaCl 和 NaOH
二、简答题(除标注外,每空1分,共32分)
16.(6分)质量守恒定律是物质科学中的一条重要规律,具体表述为:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和。
(1)某同学设计了如图三个实验装置(天平略)来验证质量守恒定律。其中,只有 A装置能用来验证质量守恒定律,B、C装置则不能。否定B、C装置的理由是: °
(2)小明将C装置进行改进,如图D所示。①此实验的现象是 。
②待完全反应后,将装置D置于天平上称量,所得数据较反应前的小。若整个操作过程无差错,则造成上述实验误差的原因是 。
17.(6分)某 化肥中可能混有 K2CO3、KCl,为确定其成分,小组同学用试管进行如下实验。
实验一:取样,向样品中加入一定量氯化钙溶液;
实验二:取样,向样品中加入一定量稀盐酸溶液;
实验三:取样,向样品中加入一定量石灰水。
三个实验均观察到明显现象,回答下列问题:
(1)实验一用化学方程式表示为 。
(2)在以上三个实验中,取实验 (填“一”“二”或“三”)过滤后的滤液,先加入过量稀硝酸,再加入 溶液,即可确定KCl是否存在。
(3)实验后,将三个实验试管中的所有物质依次倒入烧杯中,充分混合,烧杯中沉淀质量与时间关系如图所示。根据图示判断,下列说法中,正确的是 (2分)。
A.混合前实验一试管中溶液的溶质是 KNO3、KCl和
B.若测图中 ab段(不包括a、b点)溶液的pH,pH一定大于7
C.图示 cd段沉淀质量增加,说明混合前实验三试管中 一定有剩余
D.向d点混合物中加入稀盐酸恰好完全反应后,可将无色溶液直接排放
18.侯德榜在氨碱法的基础上创立了更为先进的联合制碱法,主要工艺流程如图:
(1)反应①的化学方程式为 。
(2)工业上常用分离液态空气法制取氮气,该过程属于 变化。
(3)在工农业生产过程中,会排放 加剧温室效应。下列做法能减少二氧化碳排放的是 (填序号)。
A.焚烧秸秆肥田 B.提高火力发电量 C.大力使用清洁能源
(4)操作a的名称是 。
(5)有一种处理CO2 的方法,是将 与氢气在一定条件下反应生成甲烷和水,该反应的化学方程式为 ,参加反应的 与 H2 的质量之比是 。(4分)
19.某兴趣小组同学去盐场参观,带回了部分粗盐样品,并对其进行了如下探究,查阅资料得知:粗盐中除含少量泥沙等不溶性杂质外,还含有少量的可溶性杂质(假定可溶性杂质只有 一种),为了得到较纯净的氯化钠,小组同学将所得的“精盐”又做了如图处理:
(1)往溶液Ⅰ中加入过量NaOH溶液的原因是 (2分),生成白色沉淀的化学方程式为 。
(2)在得到的滤液中加入足量的稀盐酸的目的是 (2分)。
(3)若实验过程中不考虑损耗,最终到的 NaCl固体的质量将 (填“大于”“小于”或“等于”)原精盐中 NaCl的质量(2分)。
20.常见的酸、碱、盐在初中科学学习中占有非常重要地位,回答下列问题。
(1)将浓盐酸敞口放在空气中一段时间,浓盐酸的质量有何变化 (2分)。
(2)KCl是一种重要的盐,写出有 KCl生成的中和反应方程式 。
(3)实验室有失去标签的五瓶溶液:稀盐酸、石蕊试液、 溶液、NaOH溶液、 溶液。根据观察溶液的颜色或分别取样再两两混合,首先被鉴别出来的试剂是石蕊试液或 。
(4)根据常温下部分酸、碱、盐的溶解性表,能获取的信息为 (填序号)。
在水中的溶解性
②浓盐酸在实验室里要密封保存
③常温下 Mg(OH)2 能使酚酞试液变红
④在化合物中碳酸根离子显示的化合价
⑤不能用水来鉴别NaCl和 Na2SO4 两种白色粉末
⑥判断 Na2CO3溶液与 Ba(OH)2溶液能否发生复分解反应
三、实验探究题(每空2分,共24分)
21.如图是实验室制取某些常见气体所使用的一些装置和仪器。
(1)从图1的装置中任意选择一种仪器,写出它的名称: ,简要说出它的一种用途: 。
(2)写出实验室制取氧气的一个化学方程式: ,用该方法制取氧气的发生装置可选择图1中的 (填字母)。
(3)实验室制取二氧化碳选择的药品是 和 。收集二氧化碳通常选择图2中的 (填字母)仪器进行组合。欲收集满一瓶二氧化碳气体,收集一段时间后,将燃着的木条放在集气瓶口,若观察到火焰熄灭,则接下来应进行的操作是 ;若火焰不熄灭,则可能的原因是 。
22.用“侯氏制碱法”制得的纯碱中常含有氯化钠等杂质,兴趣小组欲对某品牌纯碱样品中碳酸钠的质量分数进行实验探究,他们设计了下列实验方案进行实验:利用如图所示实验装置(铁架台略去)和试剂,通过测定样品和稀盐酸反应产生的 气体的质量,计算 的质量分数(装置气密性良好,忽略盐酸的挥发性且每步反应或作用都是完全的)。
(1)打开止水夹K,先对装置 A和B(已连接)通入 一会儿,其目的是 ,再接上装置C和 D。
(2)待装置 A中的反应结束后,再一次打开止水夹K,继续往装置通入N2 一会儿。根据质量守恒定律,装置 (填标号)在反应前后的质量差就是产生的( 的质量,由此计算出该样品中 的质量分数。
(3)若省略B装置,将会使测定结果 (填“偏大”“不变”或“偏小”)。
四、计算题(23题6分,24题8分,共14分)
23.某兴趣小组用15g石灰石样品(杂质不溶于水且不与酸反应)与足量的稀盐酸反应,进行实验探究。实验装置如下:
(提示:碱石灰的成分为氧化钙和氢氧化钠,可吸收二氧化碳和水蒸气以及其他酸性气体)当A装置中无气体产生时,测得B装置的质量增加了4.7g,C装置的质量未发生变化且无明显现象。请回答:
(1)石灰石样品中碳酸钙的质量为 g。
(2)当A装置中无气体产生时,消耗掉稀盐酸 g。
(3)15g样品最多能产生二氧化碳气体的质量多少克
24.某氢氧化钙 粉末中含有碳酸钙及其他少量杂质,现取样品10克于锥形瓶中并加适量水搅拌得悬浊液,然后向锥形瓶中滴加稀盐酸,充分反应,测得加入稀盐酸的质量与反应生成气体的质量关系如图所示。
(1)充分反应后生成二氧化碳的质量是 g。
(2)横坐标“25”处的点,除表面滴加稀盐酸为25g,还隐含的相关信息有 。 (写出一点)
(3)加入60g稀盐酸后所得溶液中所含的溶质有 。
(4)计算样品中碳酸钙的质量分数。(提示:其他少量杂质不溶于水也不参加反应)(写出计算过程)
期中测试卷
1. D 2. A 3. D 4. A 5. A 6. B 7. C 8. A 9. B 10. B11. A 12. C 13. C 14. C 15. C
16.(1)B装置内发生的反应属于物理变化;C装置内产生的气体会逸出到空气中 (2)①锥形瓶内有大量气泡产生,气球变大②气球变大后,受到空气的浮力,方向竖直向上,导致天平称量反应后物质质量的读数偏小
↓ (2)三 (3)B
(2)物理 (3)C
(4)过滤
19.(1)将氯化镁全部除去 2NaCl (2)除去过量的氢氧化钠 (3)大于
20.(1)减少(
(3)稀盐酸 (4)①②④⑤⑥
21.(1)酒精灯(合理即可) 用于加热(或其他合理答案)
(或 2KCl+3O2↑或 A(或B,与上一空对应即可) (3)大理石 稀盐酸 CEF 将导管移出集气瓶,盖上玻璃片,正放在桌面上 CO2 还没有收集满(或其他合理答案)
22.(1)为了排尽装置A和B中含有的二氧化碳,使实验结果更准确(2)C (3)偏大
23.(1)10 (2)100
(3)设生成二氧化碳的质量为x,则
100 44
10g x
解得x=4.4g
24.(1)2.2 (2)此时氢氧化钙完全反应(或者碳酸钙开始反应)
和 HCl(名称也可以)
(4)根据图可以看出生成的二氧化碳的质量为2.2g。当滴加盐酸25g时,此时才会有气体产生,所以在加入盐酸到氢氧化钙和碳酸钙的混合物中时,盐酸先和氢氧化钙反应,待氢氧化钙完全反应后才和碳酸钙反应产生气体。当加入盐酸到45g时,气体不再产生,也就是碳酸钙消耗殆尽,再加入盐酸,此时盐酸过量,所以当加入盐酸达到60时,溶质是生成的氯化钙和剩余的过量的HCl。
设样品中碳酸钙的质量为x,则
100 44
x 2.2g
解得x=5g
则样品中碳酸钙的质量分数为
同课章节目录
