2.2金属的化学性质
图片预览









文档简介
课件45张PPT。 在利用某种金属材料时,人们往往要考虑这种材料的化学性质。
那么,我们常用的金属有哪些重要的化学性质?
这些性质是怎样为人类所利用的?一、金属与氧气的反应在元素周期表中,除汞外,金属元素的中文名称都带有金字旁。金属与其他物质发生反应时,会生成新的物质,表现出金属的化学性质。你知道金属的化学性质有哪些吗?将1 根镁带、1 根铜丝同时在酒精灯的外焰上加热,如图2-12所示,哪根金属会在空气中燃烧?____________。
不燃烧的那根金属冷却后表面的颜色发生了什么变化? ___________________。红色铜丝不会燃烧,但表面变成黑色。镁带会燃烧结论:(1)有些金属能在氧气中燃烧现象:银白色的镁带很快燃烧起来,发出耀眼的白光,放出大量的热,生成一种白色固体。现象:铁剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体。(2)有些金属不能燃烧,但能生成氧化物。现象:铜丝表面由红色变成黑色。结论:(3)有些金属在常温下就能与O2反应。金属铁在潮湿的空气中会被氧气所氧化而生锈(铁锈的主要成分是Fe2O3)。金属铝的表面易生成一层致密的氧化铝保护膜,它能阻止金属铝继续被空气氧化。在我们的身边有许多的铝制品,如饮料罐、铝锅、餐具等。金属的化学性质之一:
某些金属能与氧气反应,生成氧化物。
铝质容器在使用时应注意些什么?铝制容器洗涤时,请不要用钢丝球擦洗,以免破坏氧化膜。还不可盛放酸性或碱性物质,因为酸性或碱性物质会破坏铝的氧化膜,进而腐蚀金属铝。你知道其中的原因吗?Al2O3+6HCl==2AlCl3+ 3H2O
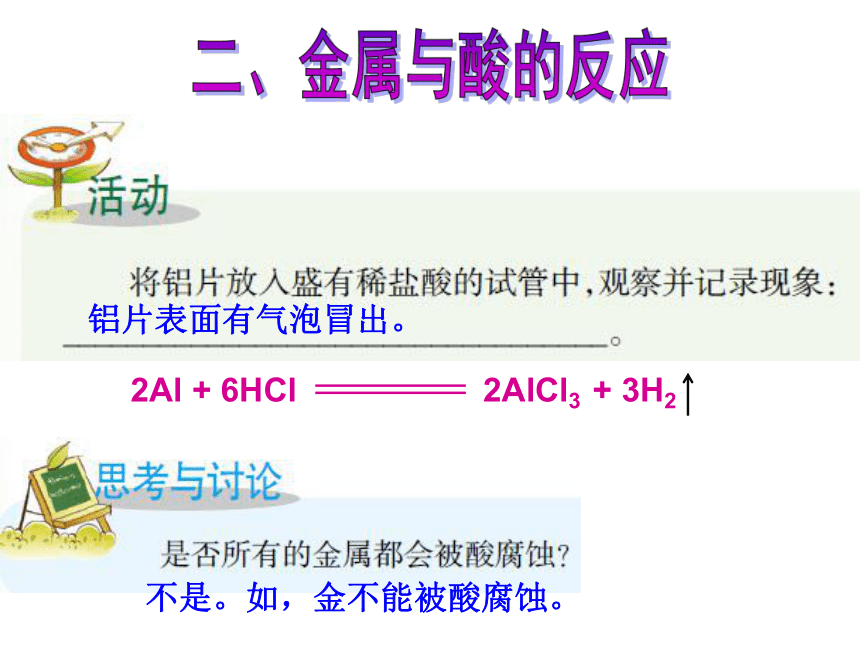
Al2O3+ 2NaOH==2NaAlO2+ H2O二、金属与酸的反应铝片表面有气泡冒出。不是。如,金不能被酸腐蚀。1.取少量镁条、锌粒、铜片分别放入盛有稀盐酸的3 支试管中,观察实验现象:____________________________________________。金属镁、锌溶解,有气泡产生,镁产生气泡的速度比锌的快;铜片无变化。Mg+2HCl=MgCl2+H2↑Zn+2HCl=ZnCl2+H2↑ 如何检验产生的气体?气体燃烧,有轻微的爆鸣声氢气2.用拇指按住盛有锌粒和稀盐酸的试管口, 将燃着的火柴接近试管口,松开拇指发现
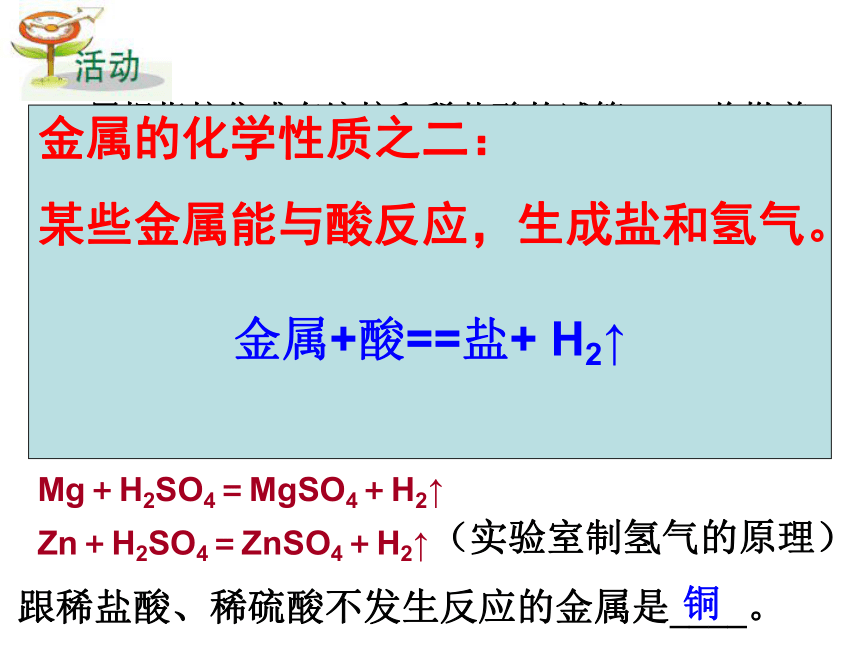
,此气体应是______。3.取少量镁条、锌粒、铜片分别放入盛有稀硫酸的3支试管中,观察实验现象:______________________________________ 。金属镁、锌溶解,有气泡产生,镁产生气泡的速度比锌的快;铜片无变化。反应的化学方程式分别为:Mg+H2SO4=MgSO4+H2↑Zn+H2SO4=ZnSO4+H2↑ (实验室制氢气的原理)跟稀盐酸、稀硫酸不发生反应的金属是____。铜金属的化学性质之二:
某些金属能与酸反应,生成盐和氢气。
金属+酸==盐+ H2↑
单质化合物单质化合物+=+【归纳】 (1) 由一种______跟一种_______起反应生成另一种______和另一种_______的反应叫做置换反应。(2) 通式:A+BC=AC+B(3) 金属跟酸和金属跟盐的反应都是置换反应。单质化合物单质化合物 答:不是置换反应。因为反应物都是化合物,而不是一种单质跟一种化合物。C比较:四种基本反应类型两种或两种以上两种或两种以上两种化合物一种单质和一种化合物一种一种两种新化合物一种新单质和一种新化合物 为什么镁和锌能与酸反应放出氢气,而铜不能?
为什么镁与酸反应放出氢气的速度比锌的快?
有些金属化学性质稳定,而有些金属化学性质活泼,我们可以用金属的化学活动性顺序来表示。三、金属的活动性顺序通过金属与氧气反应的条件的难易,可以得出金属的活动性不同,那么还有其他的方法判断金属的活动性吗?讨论:观察此图,你有何看法?MgZnFeCuMg + 2HCl = MgCl2 + H2↑金属活动性由强到弱 通过以上实验分析,我们知道,有些金属能与酸反应,有些金属不能与酸反应。如果把一种金属浸入另一种金属的盐的溶液中,相互之间能发生反应吗?比较铁与铜、铜与银的化学活动性提供的实验药品:铜丝、铁丝、FeSO4 溶液、CuSO4 溶液、AgNO3 溶液。1.提出问题,建立假设:一种活动性较强的金属能把另一种活动性较弱的金属从它的盐的水溶液中置换出来。2.设计实验方案:(1)铁和铜的活动性比较:在盛有硫酸铜溶液的试管里浸入一段洁净的(经过除油、除锈处理)铁丝,过一会儿取出,如图2-14所示。你也可以有其他的实验方案,与同学进行交流。实验现象:
(1) __________________。
相应的化学方程式:______________。铁丝表面附着一层红色物质。Fe+CuSO4=FeSO4+Cu说明铁与铜的化学活动性是:铁>铜(2)铜和银的活动性比较:根据实验室提供的药品设计可行的方案,与同学进行交流。在盛有硝酸银溶液的试管里浸入一段洁净的(经过除油、除锈处理)铜丝,过一会儿取出。实验现象:
(2) __________________。
相应的化学方程式:______________。在铜丝表面附着一层银白色的物质。Cu+2AgNO3=Cu(NO3)2+2Ag说明铜与银的化学活动性是:铜>银根据以上实验事实,铁与铜、铜与银的化学活动性是______________。Fe>Cu>Ag金属的化学性质之三:
一种活动性较强的金属能把另一种活动性较弱的金属从它的盐的水溶液中置换出来。
活泼金属+盐→另一种盐+另一种金属
1.设计实验比较镁、锌、铜的活动性,并从大到小列出镁、锌、铜的活动性顺序。①比较三种金属在氧气中反应的剧烈程度;
②比较三种金属与稀硫酸反应的剧烈程度;
③观察金属镁、金属铜在硫酸锌溶液中的现象。结论:Mg> Zn >Cu2.如果把氢也列入其中,应如何排列?结论:Mg> Zn > H >Cu镁、锌能与稀硫酸反应,铜不能,说明镁、锌比氢活泼,氢比铜活泼。K Ca Na Mg Al Zn F e Sn Pb H Cu Hg Ag Pt Au 金属活动性由强逐渐减弱常见金属活动性顺序判断的依据:
1、在金属活动性顺序里,位置越前,它的活动性越强。
2、在金属活动性顺序里,位于氢前的金属能置换出盐酸、稀硫酸中的氢。
3、在金属活动性顺序里,位于前面的金属能把后面的金
属从它们化合物的溶液里置换出来。(K、Ca、Na三种金属除外)(不是氢气)(钾最强)注意:特别活泼金属 K、Ca、Na与 金属盐溶液或酸溶液反应时先与水反应生成碱和氢气,然后是碱与盐或酸反应。2NaOH+CuSO4=Na2SO4+Cu(OH)2↓2Na+2H2O=2NaOH+H2↑金属活动性顺序说明金属具有怎样的化学性质?它对置换反应的发生有何意义?①一种活动性较强的金属能把另一种活动性较弱的金属从它的盐的水溶液中置换出来;
②排在氢前面的金属可以把酸里的氢置换出来。这些反应都是置换反应。意义:可以帮助我们判断金属与酸、金属与盐的化学反应能否发生。如:用铜、银、金等不活泼金属制造钱币等。湿法炼铜湿法炼铜技术原理是:先用硫酸将铜矿中的铜转变成可溶性的硫酸铜,再将铁放入硫酸铜溶液中把铜置换出来Fe + CuSO4 = FeSO4 + Cu1.根据金属活动性顺序表判断能否用锡壶装酸性物质,并说出理由。2.能否用铁制的容器配制浸种用的波尔多液(含硫酸铜)?为什么?不能,因为锡的活动性顺序排在氢前面,它能跟酸反应。Sn + 2HCl = SnCl2 + H2↑不能。因为波尔多液中含CuSO4 , Fe比Cu活泼,能将Cu从CuSO4溶液中置换出来, Fe参加了反应,容器被腐蚀。Fe + CuSO4 = FeSO4 + Cu思考:为什么铜离子会从溶液中析出变成金属铜,而金属锌则变成新离子进入溶液? 在上述的化学反应中,金属锌失去电子变成新离子进入溶液,而铜离子从金属锌表面得到了电子变成了金属铜,上述反应的过程实际上是电子转移的过程。Zn + CuSO4 = Zn SO4 + Cu 2e金属越活泼,越容易失去电子。四、防止金属腐蚀的常用方法金属腐蚀现象 金属腐蚀的危害 据有关专家介绍,全球每一分钟就有1吨钢腐蚀成铁锈,每年由于锈蚀而直接损失的钢铁材料大约占年产钢铁量的1/4。目前我国由于金属材料的腐蚀损失每年大约5000亿元人民币,约占我国国民生产总值的6%左右。 各种铁制品的锈蚀 为了减少损失,需要探究钢铁锈蚀的原因、防护的方法钢铁是应用最普遍且最容易被锈蚀的金属材料金属产生锈蚀的条件有哪些?活动1、材料准备2、设计实验方案——控制变量法 ①取3支试管:A试管中是水和空气;B试管中是装有干燥剂的干燥空气;C试管中是煮沸过的蒸馏水。
②3支试管中各放入一枚铁钉,并用塞子塞紧试管口。
③几天后,观察实验现象。A:普通铁片,水、空气
B:普通铁片,空气。(内有干燥剂)
C:普通铁片,蒸馏水。(无空气)3、实验装置图几天后4、实验现象5、分析得出结论通过A.B的比较可知铁的锈蚀与 有关,通过 的比较可知铁的锈蚀与空气有关;本实验中 为对照组。水A.CA结论:金属的锈蚀与水、空气等物质接触有关6、继续探究取一支试管D,装入一半水和一半空气中,放入一枚纯铁钉,几天后,观察:__________________________。铁钉没有生锈。结论:金属的锈蚀与金属内部的结构有关结论:铁锈蚀的外部条件:同时具备空气和水。铁锈蚀的内部条件:与内部结构有关。思考:金属防锈的方法有哪些?防锈 方法保护膜法改变内部结构法(加Cr.Ni制不锈钢)非金属覆盖层(如搪瓷等)金属镀层(如镀锌等)自身氧化膜保护层(Fe3O4)最常用最理想防止铁制品生锈的具体方法为:
保持铁制品表面干燥和洁净
在钢铁表面涂一层保护膜如:涂刷矿物油、油漆;覆盖搪瓷塑料)
镀上一层不易锈蚀的金属或通过化学反应使表面生成一层致密的氧化膜如 “烤蓝”
改变组成结构,制成合金,如不锈钢小结:同学们,今天你都学了哪些?1、设计实验除去杂质:
?铜粉中含有的少量铁粉; ?FeCl2溶液中含有的少量CuCl2 。a.用稀盐酸 b.用铁粉2、把铁片分别放入下列各物质的溶液中,片刻后取出,溶液的质量增加的是( )
A.硫酸铝 B.硫酸铜 C.硫酸 D.硝酸银C3. 已知排在金属活动性顺序表最前几位的活泼金属能与水反应生成碱和氢气。请写出下列反应的化学方程式,并推测可能产生的实验现象。
(1) 把1 块绿豆大的金属钠放入1 小杯滴有酚酞的水中。
(2) 把1 块绿豆大的金属钾放入1 小杯硫酸铜溶液中。4、有X、Y、Z三种金属,将X、Y、Z分别浸入稀硫酸中,Z溶解,X和Y不溶解;将X浸入Y的硫酸盐溶液中,在X的表面由Y析出。则X、Y、Z的金属活动性由强到弱的顺序为(?????? ) A.Z、Y、X???? B.Y、Z、X???
C.Z、X、Y??? D.Y、X、ZC5、已知甲、乙、丙三种不同的金属,甲在空气中缓慢氧化而腐蚀,乙在空气中加热后仍保持金属光泽,丙需保存在煤油中,以防止氧化,则甲、乙、丙三种
金属的活泼性强弱关系为(????? ) A.甲>乙>丙? B.乙>丙>甲?
C.丙>甲>乙? D.丙>乙>甲C6.在下列情况下,埋在地下的铸铁管道腐蚀最慢的是( )
A.在干燥、致密、不透气的土壤中
B.在潮湿、疏松、透气的土壤中
C.在潮湿、致密、不透气的土壤中
D.在潮湿、疏松、透气的酸性土壤中A
那么,我们常用的金属有哪些重要的化学性质?
这些性质是怎样为人类所利用的?一、金属与氧气的反应在元素周期表中,除汞外,金属元素的中文名称都带有金字旁。金属与其他物质发生反应时,会生成新的物质,表现出金属的化学性质。你知道金属的化学性质有哪些吗?将1 根镁带、1 根铜丝同时在酒精灯的外焰上加热,如图2-12所示,哪根金属会在空气中燃烧?____________。
不燃烧的那根金属冷却后表面的颜色发生了什么变化? ___________________。红色铜丝不会燃烧,但表面变成黑色。镁带会燃烧结论:(1)有些金属能在氧气中燃烧现象:银白色的镁带很快燃烧起来,发出耀眼的白光,放出大量的热,生成一种白色固体。现象:铁剧烈燃烧,火星四射,放出大量的热,生成一种黑色固体。(2)有些金属不能燃烧,但能生成氧化物。现象:铜丝表面由红色变成黑色。结论:(3)有些金属在常温下就能与O2反应。金属铁在潮湿的空气中会被氧气所氧化而生锈(铁锈的主要成分是Fe2O3)。金属铝的表面易生成一层致密的氧化铝保护膜,它能阻止金属铝继续被空气氧化。在我们的身边有许多的铝制品,如饮料罐、铝锅、餐具等。金属的化学性质之一:
某些金属能与氧气反应,生成氧化物。
铝质容器在使用时应注意些什么?铝制容器洗涤时,请不要用钢丝球擦洗,以免破坏氧化膜。还不可盛放酸性或碱性物质,因为酸性或碱性物质会破坏铝的氧化膜,进而腐蚀金属铝。你知道其中的原因吗?Al2O3+6HCl==2AlCl3+ 3H2O
Al2O3+ 2NaOH==2NaAlO2+ H2O二、金属与酸的反应铝片表面有气泡冒出。不是。如,金不能被酸腐蚀。1.取少量镁条、锌粒、铜片分别放入盛有稀盐酸的3 支试管中,观察实验现象:____________________________________________。金属镁、锌溶解,有气泡产生,镁产生气泡的速度比锌的快;铜片无变化。Mg+2HCl=MgCl2+H2↑Zn+2HCl=ZnCl2+H2↑ 如何检验产生的气体?气体燃烧,有轻微的爆鸣声氢气2.用拇指按住盛有锌粒和稀盐酸的试管口, 将燃着的火柴接近试管口,松开拇指发现
,此气体应是______。3.取少量镁条、锌粒、铜片分别放入盛有稀硫酸的3支试管中,观察实验现象:______________________________________ 。金属镁、锌溶解,有气泡产生,镁产生气泡的速度比锌的快;铜片无变化。反应的化学方程式分别为:Mg+H2SO4=MgSO4+H2↑Zn+H2SO4=ZnSO4+H2↑ (实验室制氢气的原理)跟稀盐酸、稀硫酸不发生反应的金属是____。铜金属的化学性质之二:
某些金属能与酸反应,生成盐和氢气。
金属+酸==盐+ H2↑
单质化合物单质化合物+=+【归纳】 (1) 由一种______跟一种_______起反应生成另一种______和另一种_______的反应叫做置换反应。(2) 通式:A+BC=AC+B(3) 金属跟酸和金属跟盐的反应都是置换反应。单质化合物单质化合物 答:不是置换反应。因为反应物都是化合物,而不是一种单质跟一种化合物。C比较:四种基本反应类型两种或两种以上两种或两种以上两种化合物一种单质和一种化合物一种一种两种新化合物一种新单质和一种新化合物 为什么镁和锌能与酸反应放出氢气,而铜不能?
为什么镁与酸反应放出氢气的速度比锌的快?
有些金属化学性质稳定,而有些金属化学性质活泼,我们可以用金属的化学活动性顺序来表示。三、金属的活动性顺序通过金属与氧气反应的条件的难易,可以得出金属的活动性不同,那么还有其他的方法判断金属的活动性吗?讨论:观察此图,你有何看法?MgZnFeCuMg + 2HCl = MgCl2 + H2↑金属活动性由强到弱 通过以上实验分析,我们知道,有些金属能与酸反应,有些金属不能与酸反应。如果把一种金属浸入另一种金属的盐的溶液中,相互之间能发生反应吗?比较铁与铜、铜与银的化学活动性提供的实验药品:铜丝、铁丝、FeSO4 溶液、CuSO4 溶液、AgNO3 溶液。1.提出问题,建立假设:一种活动性较强的金属能把另一种活动性较弱的金属从它的盐的水溶液中置换出来。2.设计实验方案:(1)铁和铜的活动性比较:在盛有硫酸铜溶液的试管里浸入一段洁净的(经过除油、除锈处理)铁丝,过一会儿取出,如图2-14所示。你也可以有其他的实验方案,与同学进行交流。实验现象:
(1) __________________。
相应的化学方程式:______________。铁丝表面附着一层红色物质。Fe+CuSO4=FeSO4+Cu说明铁与铜的化学活动性是:铁>铜(2)铜和银的活动性比较:根据实验室提供的药品设计可行的方案,与同学进行交流。在盛有硝酸银溶液的试管里浸入一段洁净的(经过除油、除锈处理)铜丝,过一会儿取出。实验现象:
(2) __________________。
相应的化学方程式:______________。在铜丝表面附着一层银白色的物质。Cu+2AgNO3=Cu(NO3)2+2Ag说明铜与银的化学活动性是:铜>银根据以上实验事实,铁与铜、铜与银的化学活动性是______________。Fe>Cu>Ag金属的化学性质之三:
一种活动性较强的金属能把另一种活动性较弱的金属从它的盐的水溶液中置换出来。
活泼金属+盐→另一种盐+另一种金属
1.设计实验比较镁、锌、铜的活动性,并从大到小列出镁、锌、铜的活动性顺序。①比较三种金属在氧气中反应的剧烈程度;
②比较三种金属与稀硫酸反应的剧烈程度;
③观察金属镁、金属铜在硫酸锌溶液中的现象。结论:Mg> Zn >Cu2.如果把氢也列入其中,应如何排列?结论:Mg> Zn > H >Cu镁、锌能与稀硫酸反应,铜不能,说明镁、锌比氢活泼,氢比铜活泼。K Ca Na Mg Al Zn F e Sn Pb H Cu Hg Ag Pt Au 金属活动性由强逐渐减弱常见金属活动性顺序判断的依据:
1、在金属活动性顺序里,位置越前,它的活动性越强。
2、在金属活动性顺序里,位于氢前的金属能置换出盐酸、稀硫酸中的氢。
3、在金属活动性顺序里,位于前面的金属能把后面的金
属从它们化合物的溶液里置换出来。(K、Ca、Na三种金属除外)(不是氢气)(钾最强)注意:特别活泼金属 K、Ca、Na与 金属盐溶液或酸溶液反应时先与水反应生成碱和氢气,然后是碱与盐或酸反应。2NaOH+CuSO4=Na2SO4+Cu(OH)2↓2Na+2H2O=2NaOH+H2↑金属活动性顺序说明金属具有怎样的化学性质?它对置换反应的发生有何意义?①一种活动性较强的金属能把另一种活动性较弱的金属从它的盐的水溶液中置换出来;
②排在氢前面的金属可以把酸里的氢置换出来。这些反应都是置换反应。意义:可以帮助我们判断金属与酸、金属与盐的化学反应能否发生。如:用铜、银、金等不活泼金属制造钱币等。湿法炼铜湿法炼铜技术原理是:先用硫酸将铜矿中的铜转变成可溶性的硫酸铜,再将铁放入硫酸铜溶液中把铜置换出来Fe + CuSO4 = FeSO4 + Cu1.根据金属活动性顺序表判断能否用锡壶装酸性物质,并说出理由。2.能否用铁制的容器配制浸种用的波尔多液(含硫酸铜)?为什么?不能,因为锡的活动性顺序排在氢前面,它能跟酸反应。Sn + 2HCl = SnCl2 + H2↑不能。因为波尔多液中含CuSO4 , Fe比Cu活泼,能将Cu从CuSO4溶液中置换出来, Fe参加了反应,容器被腐蚀。Fe + CuSO4 = FeSO4 + Cu思考:为什么铜离子会从溶液中析出变成金属铜,而金属锌则变成新离子进入溶液? 在上述的化学反应中,金属锌失去电子变成新离子进入溶液,而铜离子从金属锌表面得到了电子变成了金属铜,上述反应的过程实际上是电子转移的过程。Zn + CuSO4 = Zn SO4 + Cu 2e金属越活泼,越容易失去电子。四、防止金属腐蚀的常用方法金属腐蚀现象 金属腐蚀的危害 据有关专家介绍,全球每一分钟就有1吨钢腐蚀成铁锈,每年由于锈蚀而直接损失的钢铁材料大约占年产钢铁量的1/4。目前我国由于金属材料的腐蚀损失每年大约5000亿元人民币,约占我国国民生产总值的6%左右。 各种铁制品的锈蚀 为了减少损失,需要探究钢铁锈蚀的原因、防护的方法钢铁是应用最普遍且最容易被锈蚀的金属材料金属产生锈蚀的条件有哪些?活动1、材料准备2、设计实验方案——控制变量法 ①取3支试管:A试管中是水和空气;B试管中是装有干燥剂的干燥空气;C试管中是煮沸过的蒸馏水。
②3支试管中各放入一枚铁钉,并用塞子塞紧试管口。
③几天后,观察实验现象。A:普通铁片,水、空气
B:普通铁片,空气。(内有干燥剂)
C:普通铁片,蒸馏水。(无空气)3、实验装置图几天后4、实验现象5、分析得出结论通过A.B的比较可知铁的锈蚀与 有关,通过 的比较可知铁的锈蚀与空气有关;本实验中 为对照组。水A.CA结论:金属的锈蚀与水、空气等物质接触有关6、继续探究取一支试管D,装入一半水和一半空气中,放入一枚纯铁钉,几天后,观察:__________________________。铁钉没有生锈。结论:金属的锈蚀与金属内部的结构有关结论:铁锈蚀的外部条件:同时具备空气和水。铁锈蚀的内部条件:与内部结构有关。思考:金属防锈的方法有哪些?防锈 方法保护膜法改变内部结构法(加Cr.Ni制不锈钢)非金属覆盖层(如搪瓷等)金属镀层(如镀锌等)自身氧化膜保护层(Fe3O4)最常用最理想防止铁制品生锈的具体方法为:
保持铁制品表面干燥和洁净
在钢铁表面涂一层保护膜如:涂刷矿物油、油漆;覆盖搪瓷塑料)
镀上一层不易锈蚀的金属或通过化学反应使表面生成一层致密的氧化膜如 “烤蓝”
改变组成结构,制成合金,如不锈钢小结:同学们,今天你都学了哪些?1、设计实验除去杂质:
?铜粉中含有的少量铁粉; ?FeCl2溶液中含有的少量CuCl2 。a.用稀盐酸 b.用铁粉2、把铁片分别放入下列各物质的溶液中,片刻后取出,溶液的质量增加的是( )
A.硫酸铝 B.硫酸铜 C.硫酸 D.硝酸银C3. 已知排在金属活动性顺序表最前几位的活泼金属能与水反应生成碱和氢气。请写出下列反应的化学方程式,并推测可能产生的实验现象。
(1) 把1 块绿豆大的金属钠放入1 小杯滴有酚酞的水中。
(2) 把1 块绿豆大的金属钾放入1 小杯硫酸铜溶液中。4、有X、Y、Z三种金属,将X、Y、Z分别浸入稀硫酸中,Z溶解,X和Y不溶解;将X浸入Y的硫酸盐溶液中,在X的表面由Y析出。则X、Y、Z的金属活动性由强到弱的顺序为(?????? ) A.Z、Y、X???? B.Y、Z、X???
C.Z、X、Y??? D.Y、X、ZC5、已知甲、乙、丙三种不同的金属,甲在空气中缓慢氧化而腐蚀,乙在空气中加热后仍保持金属光泽,丙需保存在煤油中,以防止氧化,则甲、乙、丙三种
金属的活泼性强弱关系为(????? ) A.甲>乙>丙? B.乙>丙>甲?
C.丙>甲>乙? D.丙>乙>甲C6.在下列情况下,埋在地下的铸铁管道腐蚀最慢的是( )
A.在干燥、致密、不透气的土壤中
B.在潮湿、疏松、透气的土壤中
C.在潮湿、致密、不透气的土壤中
D.在潮湿、疏松、透气的酸性土壤中A
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
