2024-2025学年北京市西城区北京师范大学附属实验中学高二上学期开学考试化学试题(含答案)
文档属性
| 名称 | 2024-2025学年北京市西城区北京师范大学附属实验中学高二上学期开学考试化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1003.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-29 20:17:40 | ||
图片预览



文档简介
2024-2025学年北京师范大学附属实验中学高二上学期开学考试
化学试题
一、单选题:本大题共15小题,共45分。
1.工业上常采用热分解法冶炼的金属是
A. B. C. D.
2.下列用于航天领域的材料中,属于合成有机高分子材料的是
A. 火箭壳体铝合金 B. 航天服锦纶
C. 航天器大型天线碳纤维 D. 航天器隔热瓦陶瓷
3.下列反应中,属于吸热反应的是
A. 锌和稀硫酸反应 B. 氢气和氯气反应
C. 炭和二氧化碳反应 D. 盐酸和烧碱溶液反应
4.下列物质中,既含有离子键又含有共价键的是
A. B. C. D.
5.下列说法中,不正确的是
A. 和互为同位素
B. 和互为同系物
C. 和是同一种物质
D. 金刚石和石墨是同素异形体
6.下列物质的颜色变化与氧化还原反应无关的是
A. 浓硝酸久置后,显黄色
B. 将粉末露置在空气中,固体由淡黄色变为白色
C. 新制的白色氢氧化亚铁放置在空气中,最终变为红褐色
D. 向黄色的铬酸钾溶液中加入硫酸,溶液变为橙红色
7.用表示阿伏加德罗常数的值。下列说法正确的是
A. 的摩尔质量是
B. 分子中含有的电子数目为
C. 溶液中数目为
D. 标准状况下,的物质的量为
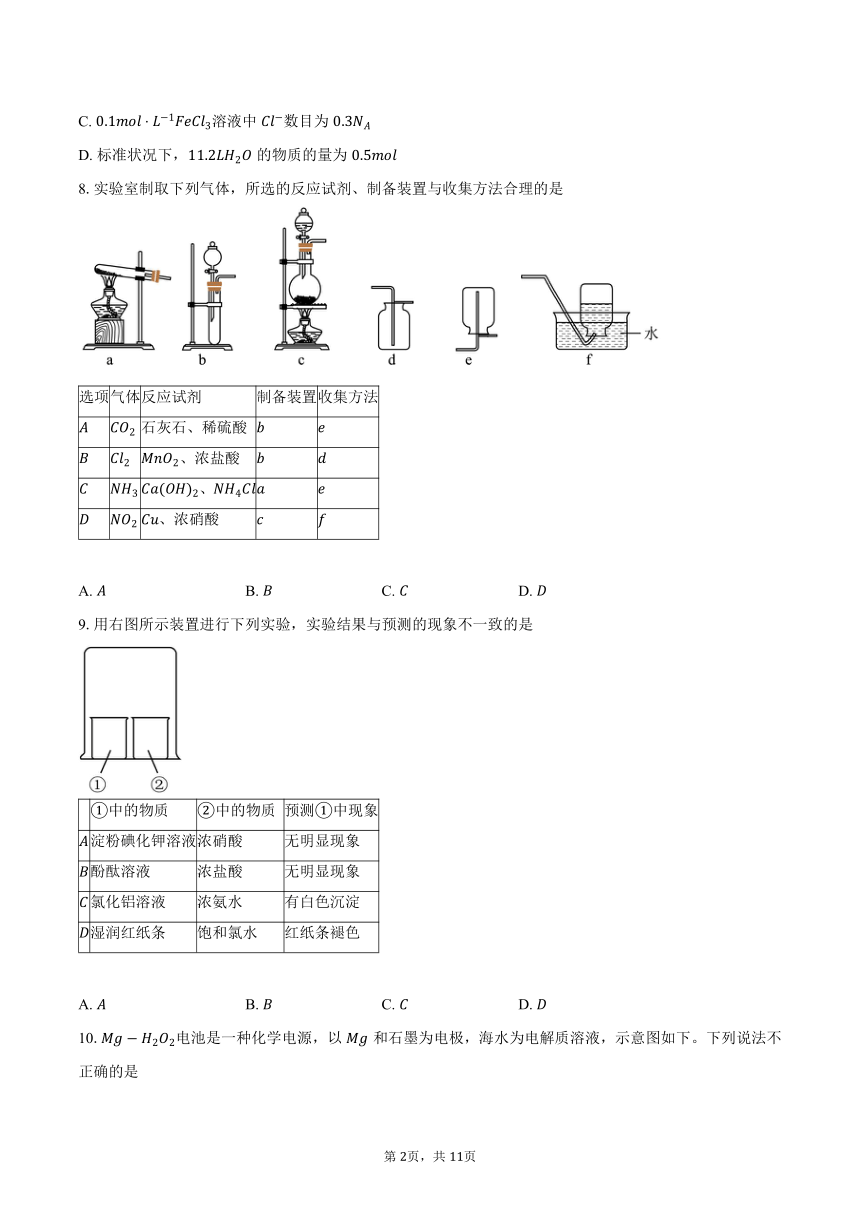
8.实验室制取下列气体,所选的反应试剂、制备装置与收集方法合理的是
选项 气体 反应试剂 制备装置 收集方法
石灰石、稀硫酸
、浓盐酸
、
、浓硝酸
A. B. C. D.
9.用右图所示装置进行下列实验,实验结果与预测的现象不一致的是
中的物质 中的物质 预测中现象
淀粉碘化钾溶液 浓硝酸 无明显现象
酚酞溶液 浓盐酸 无明显现象
氯化铝溶液 浓氨水 有白色沉淀
湿润红纸条 饱和氯水 红纸条褪色
A. B. C. D.
10.电池是一种化学电源,以和石墨为电极,海水为电解质溶液,示意图如下。下列说法不正确的是
A. 镁电极是该电池的负极
B. 石墨电极上发生还原反应
C. 发生的电极反应为:
D. 电池工作时,电子从石墨电极经导线流向电极,溶液中阳离子流向正极
11.下列离子方程式正确的是
A. 向溶液中通入少量
B. 过量的与稀硝酸反应:
C. 溶于氢碘酸:
D. 向硫酸氢钠溶液中滴加溶液至完全沉淀:
12.由和反应生成和的能量变化如图所示。说法不正确的是
A. 正反应的活化能大于逆反应的活化能
B. 反应生成时转移
C. 反应物的总能量大于生成物的总能量
D. 与反应的化学方程式为
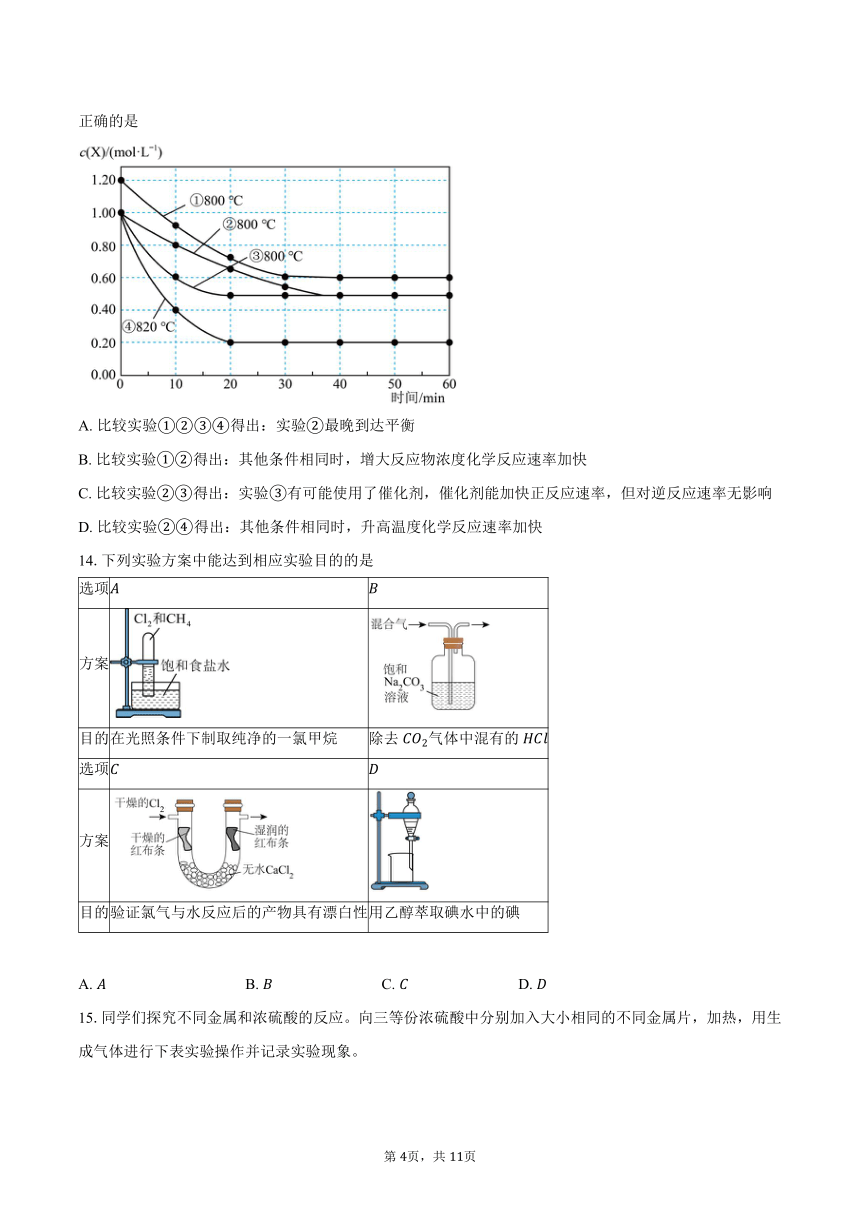
13.研究反应的速率影响因素,在不同条件下进行组实验,,的起始浓度均为,反应物的浓度随反应时间的变化情况如图所示。每组实验只改变一个条件。下列说法不正确的是
A. 比较实验得出:实验最晚到达平衡
B. 比较实验得出:其他条件相同时,增大反应物浓度化学反应速率加快
C. 比较实验得出:实验有可能使用了催化剂,催化剂能加快正反应速率,但对逆反应速率无影响
D. 比较实验得出:其他条件相同时,升高温度化学反应速率加快
14.下列实验方案中能达到相应实验目的的是
选项
方案
目的 在光照条件下制取纯净的一氯甲烷 除去气体中混有的
选项
方案
目的 验证氯气与水反应后的产物具有漂白性 用乙醇萃取碘水中的碘
A. B. C. D.
15.同学们探究不同金属和浓硫酸的反应。向三等份浓硫酸中分别加入大小相同的不同金属片,加热,用生成气体进行下表实验操作并记录实验现象。
实验操作 实验现象
金属为铜 金属为锌 金属为铝
点燃 不燃烧 燃烧 燃烧
通入酸性溶液 褪色 褪色 褪色
通入溶液 无明显变化 无明显变化 出现黑色沉淀
通入品红溶液 褪色 褪色 不褪色
已知:为黑色固体;可燃
下列说法不正确的是
A. 加入铜片的实验中,使酸性溶液褪色的气体是
B. 加入铝片的实验中,燃烧现象能证明生成气体中一定含
C. 加入锌片的实验中,生成的气体一定是混合气体
D. 金属与浓硫酸反应的还原产物与金属活动性强弱有关
二、综合题:本大题共5小题,共40分。
16.年是元素周期表诞生周年,元素周期表律在学习、研究和生产实践中有很重要的作用。下表为元素周期表的一部分,回答下列问题。
族周期
元素中,金属性最强的是__________填元素符号。
中国青年化学家姜雪峰被国际组织推选为“元素代言人”,元素的原子结构示意图是__________,其氢化物的电子式是__________。
元素和可以形成多种化合物。下图模型表示的分子中,不可能由和形成的是__________填序号。
比较元素、的最高价氧化物对应水化物的酸性:____________________填化学式。
主族元素砷的部分信息如图所示。
砷在周期表中的位置是__________。
下列说法正确的是__________填序号。
砷元素的最高化合价为
推测砷有多种氧化物
的气态氢化物的还原性大于砷的气态氢化物的还原性
17.实验小组同学用下图所示装置进行实验探究夹持装置略。
用上述装置探究的性质。
Ⅰ中为紫色石蕊溶液,观察到溶液变红,发生反应的化学方程式是__________。
Ⅱ中为酸性溶液,现象为__________。
Ⅲ中为溶液,可产生淡黄色浑浊,体现了的__________性。
Ⅲ后需用足量的浓溶液吸收剩余的,发生反应的离子方程式是__________。
实验室制取的乙烯中常混有少量,用上述装置证明混合气体中含有乙烯。其中 Ⅱ中为品红溶液,Ⅲ中为溴的四氯化碳溶液。
Ⅰ中的试剂可以为__________填字母。
酸性溶液 .溶液 .溶液
证明含有乙烯的现象是__________。
18.乙烯是来自石油的重要有机化工原料。结合以下路线回答:
已知:
是高分子,用来制造包装材料,其结构简式是__________。
反应的化学方程式是__________。
有香味,实验室用和反应制取的装置如图所示。
反应的化学方程式是__________。
分离出试管乙中油状液体需要用到的仪器是__________填序号。
漏斗 分液漏斗 长颈漏斗
实验结束,振荡试管乙,有无色气泡产生,其主要原因是__________用化学方程式表示。
产物可能发生的反应有__________填序号。
加成反应 取代反应 氧化反应 中和反应
19.的捕集、利用和封存技术是践行低碳发展战略的重要技术选择。甲烷化是利用的重要途径,反应如下。
反应:
反应:
反应: __________。
恒温恒容条件下,向容器中充入一定量的和发生反应,下列能说明反应达到平衡状态的是__________填序号。
相同时间内,每断裂的同时形成
浓度不再改变
容器内气体密度不再改变
之比不再改变
向体积为的容器中充入和,发生反应、.的平衡转化率和的选择性指生成所消耗的量与总消耗量的比值随温度变化的曲线如图所示:
选择性随温度的变化曲线是__________填“”或“”;的平衡转化率随温度发生这种变化的主要原因是__________。
时,反应的平衡常数__________写出计算式即可。
资源化利用的另一个路径是与在催化剂的作用下合成甲醇,发生的主反应如下:
反应:
在相同反应时间下,测得种不同催化剂作用下的转化率随温度变化的曲线如图所示。
到段随温度升高,转化率降低且曲线一致的原因为__________。
20.工业上利用锌焙砂主要成分为,含有少量、、等生产高纯的流程示意图如下。
用足量溶液和氨水“浸出”锌焙砂。
“浸出”前,锌焙砂预先粉碎的目的是__________。
通过“浸出”步骤,锌焙砂中的转化为,该反应的离子方程式为__________。
“浸出”时转化为。“除砷”步骤中用作氧化剂,步骤反应的离子方程式为__________。
“除重金属”时加入溶液。滤渣中含有的主要物质是__________和。
“蒸氨”时会出现白色固体,“沉锌”步骤中加入足量溶液将该白色固体转化为的离子方程式为__________。
“煅烧”步骤中,不同温度下,分解的失重曲线和产品的比表面积变化情况如图、图所示。
已知:固体失重质量分数。
比表面积指单位质量固体所具有的总面积;比表面积越大,产品的活性越高。
时煅烧,后固体失重质量分数为,则的分解率为__________保留到小数点后一位。
根据图和图,获得高产率分解率、高活性比表面积产品的最佳条件是__________填字母序号。
恒温, 恒温,
恒温, 恒温,
参考答案
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
第四周期第Ⅴ族
17. 紫色溶液褪色 氧化
Ⅱ中品红溶液不褪色,Ⅲ中溴的四氯化碳溶液褪色
18.
19.
反应Ⅰ为放热反应,反应Ⅱ为吸热反应,温度较低时,以反应Ⅰ为主,随温度升高,反应Ⅱ变为主反应
点反应达到平衡后,温度升高,反应向逆向移动,转化率降低;点反应达到平衡后,催化剂不影响平衡移动
20.增大反应物的接触面积,增大反应速率,提高浸出率
第1页,共1页
化学试题
一、单选题:本大题共15小题,共45分。
1.工业上常采用热分解法冶炼的金属是
A. B. C. D.
2.下列用于航天领域的材料中,属于合成有机高分子材料的是
A. 火箭壳体铝合金 B. 航天服锦纶
C. 航天器大型天线碳纤维 D. 航天器隔热瓦陶瓷
3.下列反应中,属于吸热反应的是
A. 锌和稀硫酸反应 B. 氢气和氯气反应
C. 炭和二氧化碳反应 D. 盐酸和烧碱溶液反应
4.下列物质中,既含有离子键又含有共价键的是
A. B. C. D.
5.下列说法中,不正确的是
A. 和互为同位素
B. 和互为同系物
C. 和是同一种物质
D. 金刚石和石墨是同素异形体
6.下列物质的颜色变化与氧化还原反应无关的是
A. 浓硝酸久置后,显黄色
B. 将粉末露置在空气中,固体由淡黄色变为白色
C. 新制的白色氢氧化亚铁放置在空气中,最终变为红褐色
D. 向黄色的铬酸钾溶液中加入硫酸,溶液变为橙红色
7.用表示阿伏加德罗常数的值。下列说法正确的是
A. 的摩尔质量是
B. 分子中含有的电子数目为
C. 溶液中数目为
D. 标准状况下,的物质的量为
8.实验室制取下列气体,所选的反应试剂、制备装置与收集方法合理的是
选项 气体 反应试剂 制备装置 收集方法
石灰石、稀硫酸
、浓盐酸
、
、浓硝酸
A. B. C. D.
9.用右图所示装置进行下列实验,实验结果与预测的现象不一致的是
中的物质 中的物质 预测中现象
淀粉碘化钾溶液 浓硝酸 无明显现象
酚酞溶液 浓盐酸 无明显现象
氯化铝溶液 浓氨水 有白色沉淀
湿润红纸条 饱和氯水 红纸条褪色
A. B. C. D.
10.电池是一种化学电源,以和石墨为电极,海水为电解质溶液,示意图如下。下列说法不正确的是
A. 镁电极是该电池的负极
B. 石墨电极上发生还原反应
C. 发生的电极反应为:
D. 电池工作时,电子从石墨电极经导线流向电极,溶液中阳离子流向正极
11.下列离子方程式正确的是
A. 向溶液中通入少量
B. 过量的与稀硝酸反应:
C. 溶于氢碘酸:
D. 向硫酸氢钠溶液中滴加溶液至完全沉淀:
12.由和反应生成和的能量变化如图所示。说法不正确的是
A. 正反应的活化能大于逆反应的活化能
B. 反应生成时转移
C. 反应物的总能量大于生成物的总能量
D. 与反应的化学方程式为
13.研究反应的速率影响因素,在不同条件下进行组实验,,的起始浓度均为,反应物的浓度随反应时间的变化情况如图所示。每组实验只改变一个条件。下列说法不正确的是
A. 比较实验得出:实验最晚到达平衡
B. 比较实验得出:其他条件相同时,增大反应物浓度化学反应速率加快
C. 比较实验得出:实验有可能使用了催化剂,催化剂能加快正反应速率,但对逆反应速率无影响
D. 比较实验得出:其他条件相同时,升高温度化学反应速率加快
14.下列实验方案中能达到相应实验目的的是
选项
方案
目的 在光照条件下制取纯净的一氯甲烷 除去气体中混有的
选项
方案
目的 验证氯气与水反应后的产物具有漂白性 用乙醇萃取碘水中的碘
A. B. C. D.
15.同学们探究不同金属和浓硫酸的反应。向三等份浓硫酸中分别加入大小相同的不同金属片,加热,用生成气体进行下表实验操作并记录实验现象。
实验操作 实验现象
金属为铜 金属为锌 金属为铝
点燃 不燃烧 燃烧 燃烧
通入酸性溶液 褪色 褪色 褪色
通入溶液 无明显变化 无明显变化 出现黑色沉淀
通入品红溶液 褪色 褪色 不褪色
已知:为黑色固体;可燃
下列说法不正确的是
A. 加入铜片的实验中,使酸性溶液褪色的气体是
B. 加入铝片的实验中,燃烧现象能证明生成气体中一定含
C. 加入锌片的实验中,生成的气体一定是混合气体
D. 金属与浓硫酸反应的还原产物与金属活动性强弱有关
二、综合题:本大题共5小题,共40分。
16.年是元素周期表诞生周年,元素周期表律在学习、研究和生产实践中有很重要的作用。下表为元素周期表的一部分,回答下列问题。
族周期
元素中,金属性最强的是__________填元素符号。
中国青年化学家姜雪峰被国际组织推选为“元素代言人”,元素的原子结构示意图是__________,其氢化物的电子式是__________。
元素和可以形成多种化合物。下图模型表示的分子中,不可能由和形成的是__________填序号。
比较元素、的最高价氧化物对应水化物的酸性:____________________填化学式。
主族元素砷的部分信息如图所示。
砷在周期表中的位置是__________。
下列说法正确的是__________填序号。
砷元素的最高化合价为
推测砷有多种氧化物
的气态氢化物的还原性大于砷的气态氢化物的还原性
17.实验小组同学用下图所示装置进行实验探究夹持装置略。
用上述装置探究的性质。
Ⅰ中为紫色石蕊溶液,观察到溶液变红,发生反应的化学方程式是__________。
Ⅱ中为酸性溶液,现象为__________。
Ⅲ中为溶液,可产生淡黄色浑浊,体现了的__________性。
Ⅲ后需用足量的浓溶液吸收剩余的,发生反应的离子方程式是__________。
实验室制取的乙烯中常混有少量,用上述装置证明混合气体中含有乙烯。其中 Ⅱ中为品红溶液,Ⅲ中为溴的四氯化碳溶液。
Ⅰ中的试剂可以为__________填字母。
酸性溶液 .溶液 .溶液
证明含有乙烯的现象是__________。
18.乙烯是来自石油的重要有机化工原料。结合以下路线回答:
已知:
是高分子,用来制造包装材料,其结构简式是__________。
反应的化学方程式是__________。
有香味,实验室用和反应制取的装置如图所示。
反应的化学方程式是__________。
分离出试管乙中油状液体需要用到的仪器是__________填序号。
漏斗 分液漏斗 长颈漏斗
实验结束,振荡试管乙,有无色气泡产生,其主要原因是__________用化学方程式表示。
产物可能发生的反应有__________填序号。
加成反应 取代反应 氧化反应 中和反应
19.的捕集、利用和封存技术是践行低碳发展战略的重要技术选择。甲烷化是利用的重要途径,反应如下。
反应:
反应:
反应: __________。
恒温恒容条件下,向容器中充入一定量的和发生反应,下列能说明反应达到平衡状态的是__________填序号。
相同时间内,每断裂的同时形成
浓度不再改变
容器内气体密度不再改变
之比不再改变
向体积为的容器中充入和,发生反应、.的平衡转化率和的选择性指生成所消耗的量与总消耗量的比值随温度变化的曲线如图所示:
选择性随温度的变化曲线是__________填“”或“”;的平衡转化率随温度发生这种变化的主要原因是__________。
时,反应的平衡常数__________写出计算式即可。
资源化利用的另一个路径是与在催化剂的作用下合成甲醇,发生的主反应如下:
反应:
在相同反应时间下,测得种不同催化剂作用下的转化率随温度变化的曲线如图所示。
到段随温度升高,转化率降低且曲线一致的原因为__________。
20.工业上利用锌焙砂主要成分为,含有少量、、等生产高纯的流程示意图如下。
用足量溶液和氨水“浸出”锌焙砂。
“浸出”前,锌焙砂预先粉碎的目的是__________。
通过“浸出”步骤,锌焙砂中的转化为,该反应的离子方程式为__________。
“浸出”时转化为。“除砷”步骤中用作氧化剂,步骤反应的离子方程式为__________。
“除重金属”时加入溶液。滤渣中含有的主要物质是__________和。
“蒸氨”时会出现白色固体,“沉锌”步骤中加入足量溶液将该白色固体转化为的离子方程式为__________。
“煅烧”步骤中,不同温度下,分解的失重曲线和产品的比表面积变化情况如图、图所示。
已知:固体失重质量分数。
比表面积指单位质量固体所具有的总面积;比表面积越大,产品的活性越高。
时煅烧,后固体失重质量分数为,则的分解率为__________保留到小数点后一位。
根据图和图,获得高产率分解率、高活性比表面积产品的最佳条件是__________填字母序号。
恒温, 恒温,
恒温, 恒温,
参考答案
1.
2.
3.
4.
5.
6.
7.
8.
9.
10.
11.
12.
13.
14.
15.
16.
第四周期第Ⅴ族
17. 紫色溶液褪色 氧化
Ⅱ中品红溶液不褪色,Ⅲ中溴的四氯化碳溶液褪色
18.
19.
反应Ⅰ为放热反应,反应Ⅱ为吸热反应,温度较低时,以反应Ⅰ为主,随温度升高,反应Ⅱ变为主反应
点反应达到平衡后,温度升高,反应向逆向移动,转化率降低;点反应达到平衡后,催化剂不影响平衡移动
20.增大反应物的接触面积,增大反应速率,提高浸出率
第1页,共1页
同课章节目录
