江西省宜春第三中学2015-2016学年高中化学《第三章 金属及其化合物》单元练习 新人教版必修1
文档属性
| 名称 | 江西省宜春第三中学2015-2016学年高中化学《第三章 金属及其化合物》单元练习 新人教版必修1 |  | |
| 格式 | zip | ||
| 文件大小 | 91.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-02-09 17:39:00 | ||
图片预览


文档简介
1.下列有关说法正确的是
A.太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置
B.天然气、沼气和水煤气均属于可再生能源
C.硫酸、纯碱、醋酸钠分别属于酸、碱、盐
D.生铁、普通钢和不锈钢中的碳含量依次增加
2.下列各组物质中,因为反应条件或用量不同而发生不同化学反应的是 ( )
① C与O2 ② Na与O2 ③ Fe与Cl2
④ AlCl3溶液与NaOH溶液 ⑤ CO2与NaOH溶液 ⑥ Cu与硝酸
A.除③外 B.除③⑤外 C.除③④外 D.除⑥外
3.跟氨分子所含的质子总数和电子总数都相同的粒子是( )
A.Na+ B.Mg2+ C.HCl D.HF
4.可作为防毒面具或潜水艇里氧气来源的物质是
A.Na2O B.Na2O2 C.NaOH D.NaHCO3
5.一定物质的量的Cl2与NaOH溶液反 ( http: / / www.21cnjy.com )应,所得产物中含NaClO和NaClO3物质的量之比为3∶5,则参加反应的Cl2与NaOH物质的量之比为( )
A.8∶11 B.3∶5 C.1∶2 D.18∶8
6.下列叙述正确的是
A. 硫在过量的氧气中燃烧生成三氧化硫
B.二氧化硫通入BaCl2溶液中生成BaSO3白色沉淀
C.二氧化硫通入滴有酚酞的NaOH溶液中,红色褪去,说明二氧化硫具有漂白性
D.二氧化硫和二氧化碳都能使澄清的石灰水变浑浊
7.只用试管和胶头滴管而不用其它试剂无法区分的一组试剂是
A.KOH溶液和AlCl3溶液 B.Na2CO3溶液和HCl溶液
C.MgCl2溶液和氨水 D.盐酸和NaAlO2溶液
8.下列溶液中能用来区别SO2和CO2气体的是
①澄清的石灰水 ②氢硫酸 ③氯水 ④酸性高锰酸钾溶液 ⑤氯化钡溶液 ⑥品红溶液
A.①⑤ B.③④⑤ C.②⑥ D.②③④⑥
9.航天科学技术测得,三氧化二碳(C2O3)是金星大气层的成分之一。下列有关C2O3的说法不正确的是( )
A.C2O3和CO2都属于非金属氧化物
B.C2O3和CO的燃烧产物都是CO2
C.C2O3和CO都是酸性氧化物
D.C2O3和CO都具有还原性
10.将a g铁和氧化铁的混合物加入足量的 ( http: / / www.21cnjy.com )盐酸中充分反应后,固体无剩余,测得参加反应的HCl为0.08 mol,放出标准状况下的气体0.224 L。则下列判断中正确的是
A.原混合物中n(Fe)∶n(Fe2O3)=2∶1
B.向溶液中滴入KSCN溶液,显血红色
C.无法计算原混合物的质量
D.此时溶液中Fe2+和Fe3+的物质的量之比为3∶1
11.(7分)下图所表示的是中学化学中一类常见的物质转化关系(反应生成的H2O均略去),试按要求回答问题:
(1)若A为空气中含量最多的单质,C为一种红棕色的气体,则B与X的反应方程式为
(2)若A为有臭鸡蛋气味的气体,C为H2S ( http: / / www.21cnjy.com )O3的酸酐,则B为: ,1molA与a molX充分燃烧,若要求既生成B又生成C,则a的取值范围为
12.(13分)短周期元素 ( http: / / www.21cnjy.com )A、B、C、D、E的原子序数依次增大, A元素阳离子的原子核外没有电子,B是空气中含量最多的元素;C元素原子最外层电子数是其电子层数的三倍;C与D可形成两种常见的离子化合物;工业上常用电解C与E的化合物来制备E单质。
(1)写出D元素的基态原子电子排布式 ( http: / / www.21cnjy.com ) 。C、D、E的简单离子半径由小到大的顺序 ( 用离子符号表示)。
(2)工业上常用A和B的单质合成一种常见气体,该气体的电子式 。
检验该气体的常用方法是 。
(3)D2C2与H2O反应的化学方程式是 ,D2C2与CuSO4溶液反应的现象是 。
(4)A、B、C三种元素可组成一种 ( http: / / www.21cnjy.com )常见离子化合物,其水溶液呈酸性,该溶液中离子浓度由大到小的顺序是 。
(5)电动汽车的某种燃料电池,通常 ( http: / / www.21cnjy.com )用NaOH作电解质,用E单质、石墨作电极,在石墨电极一侧通入空气,该电池的正极反应: 。
13.某反应体系中的物质有:NF3、HF、NO、HNO3、H2O。请根据要求回答下列问题:
(1)请将NF3、HF之外的反应物与生成物分别填如以下空格内。
NF3+→HF ++
(2)反应过程中,被氧化与被还原的元素的物质的量之比为_______________;
(3)写出该反应的化学方程式:___________________________________________________________;
(4)NF3是一种无色、无 ( http: / / www.21cnjy.com )臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是_____________________ ;一旦NF3泄漏,可以用 ___________(填化学式)溶液喷淋的方法减少污染。
14.已知A、B、C、D、E五种物质,且A、B、C、D的焰色反应呈黄色,它们的关系如下图所示,已知E为气体单质,能使带火星的木条复燃。
( http: / / www.21cnjy.com )
(1)写出下列物质的化学 ( http: / / www.21cnjy.com )式:A____________,B____________,C____________,D____________,E____________。
(2)写出A受热分解的化学方程式:____________________________________________。
15.请完成有关氨气的问题。
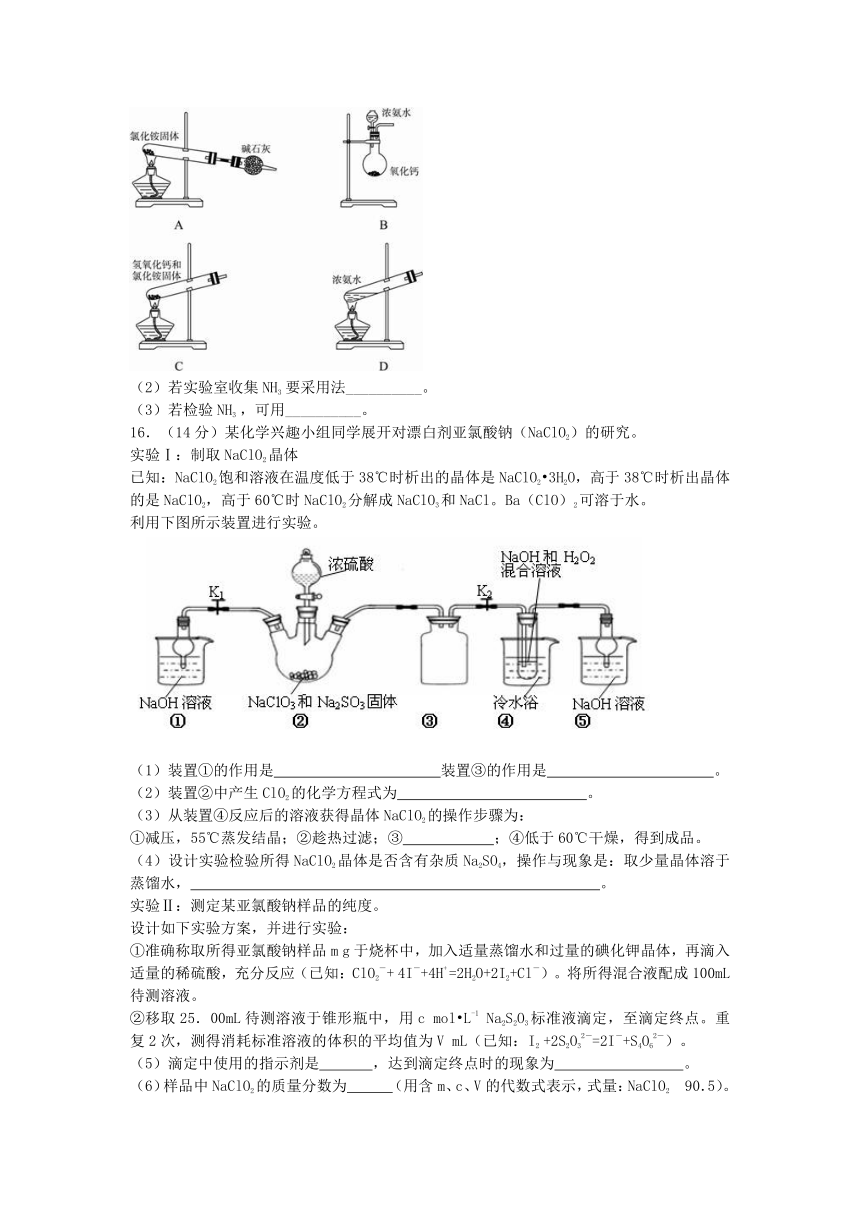
(1)实验室常用下列装置和选用的试剂制取NH3,其中正确的是__________(填序号)。
( http: / / www.21cnjy.com )
(2)若实验室收集NH3 要采用法__________。
(3)若检验NH3 ,可用__________。
16.(14分)某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于3 ( http: / / www.21cnjy.com )8℃时析出的晶体是NaClO2 3H2O,高于38℃时析出晶体的是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。Ba(ClO)2可溶于水。
利用下图所示装置进行实验。
( http: / / www.21cnjy.com )
(1)装置①的作用是 装置③的作用是 。
(2)装置②中产生ClO2的化学方程式为 。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③ ;④低于60℃干燥,得到成品。
(4)设计实验检验所得NaClO2晶体 ( http: / / www.21cnjy.com )是否含有杂质Na2SO4,操作与现象是:取少量晶体溶于蒸馏水, 。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于 ( http: / / www.21cnjy.com )烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中, ( http: / / www.21cnjy.com )用c mol L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
(5)滴定中使用的指示剂是 ,达到滴定终点时的现象为 。
(6)样品中NaClO2的质量分数为 (用含m、c、V的代数式表示,式量:NaClO2 90.5)。
17.将质量为100克的铁棒插入硫酸铜溶液中,过一会儿取出,烘干,称量,棒的质量变为100.8克。求有多少克铁参加了反应。
18.用Cu与浓硫酸反应,得到SO2的体积为4.48L(标准状况)。请计算:
(1)被还原的硫酸的物质的量。
(2)将得到的溶液稀释到50mL,求溶液中CuSO4的物质的量浓度。
参考答案
1.A
【解析】
2.A
【解析】
试题分析:① C与少量O2 反应产生 ( http: / / www.21cnjy.com )CO,与足量的氧气反应产生CO2, 用量不同发生反应不同,正确;② Na与O2在室温下反应产生Na2O,与氧气在点燃时反应产生Na2O2,反应条件不同,产物不同,正确;③ Fe与Cl2 发生反应产生FeCl3,与反应条件或用量无关,错误;④ AlCl3溶液与少量的NaOH溶液反应产生Al(OH)3沉淀,与过量的NaOH发生反应,产生NaAlO2,用量不同,反应的产物不同,正确。⑤ CO2与少量NaOH溶液,产生NaHCO3,与足量的NaOH发生反应,产生Na2CO3, 用量不同,反应的产物不同,正确, ⑥ Cu与稀硝酸反应产生NO,与浓硝酸发生反应产生NO2,浓度不同,反应的产物不同,正确。故符合题意的是除③外,选项是A。
考点:考查反应条件或用量不同对化学反应产生的影响的知识。
3.D
【解析】Na+、Mg2+、HCl、HF质子总数分别为11、12、18、10;电子总数分别为10、10、18、10。
4.B
【解析】
试题分析:过氧化钠能够和水和CO2 反应生成氢气,因此过氧化钠的用途之一是作为防毒面具或潜水艇里氧气的来源,选B。
考点:考查过氧化钠的性质。
5.C
【解析】
试题分析:根据所得产物中含NaClO和 ( http: / / www.21cnjy.com )NaClO3物质的量之比为3∶5,氯原子共8个,钠离子个8个,所以氯气的物质的量是氢氧化钠的一半,答案选C。
考点:考查元素守恒法的应用
6.D
【解析】
7.C
【解析】
试题分析:A.当AlCl3溶液 ( http: / / www.21cnjy.com )过量时,反应离子方程式为:Al3++3OH-=Al(OH)3↓,当氯化铝少量时,离子反应方程式为Al3++4OH-=AlO2-+2H2O,所以反应现象不同,可以区分;B.当盐酸少量时,离子反应方程式为CO32-+H+=HCO3-,当盐酸过量时,离子反应方程式为2H++CO32-=CO2↑+H2O,所以反应现象不同,可以区分;C.无论氨水是否过量,都发生的离子反应方程式为Mg2++2NH3.H2O=Mg(OH)2 ↓+2NH4+,无法区分;D.当盐酸少量时,离子反应方程式为H++AlO2-+H2O=Al(OH)3↓,当盐酸过量时,离子反应方程式为:4H++AlO2-=Al3++2H2O,所以反应现象不同,可以区分。
考点:考查物质的检验和鉴别的基本方法选择及应用。
8.D
【解析】
试题分析:①SO2和CO2气体都能使澄 ( http: / / www.21cnjy.com )清的石灰水变浑浊,则不能区分,故①错误;②只有SO2能与氢硫酸反应生成S沉淀,则可以区分,故②正确;③二者中只有SO2能与氯水反应生成盐酸和硫酸,使颜色消失,则可以区分,故③正确;④二者中只有SO2能与酸性高锰酸钾反应,使颜色消失,则可以区分,故④正确;⑤SO2和CO2气体都不与氯化钡反应,则无法区别,故⑤错误;⑥二者中只有SO2能使品红溶液褪色,则可以区分,故⑥正确;故答案为D、②③④⑥。
考点:二氧化硫的性质
9.C
【解析】略
10.A
【解析】
11.(1)2NO+O2= 2NO2(2分)
(2)S(或硫)(2分) 0.5<a<1.5(3分)
【解析】
12.(1)1s22s22p63s1 , Al3+ Na+ O2- 2分
(2) 1分, 用润湿的红色石蕊试纸接近该气体,若试纸变红,证明氨气存在 2分
(3) 2Na2O2 + 2H2O = 4NaOH + O2↑ 2分 、 产生蓝色沉淀并有气泡放出 2分
(4) NO3->NH4+>H+ >OH- 2分 (5)O2+ 2H2O +4e- = 4 OH- 2分
【解析】根据元素的结构及性质可知,A是H,B是N,C是O,D是Na,E是Al。
(1)根据构造原理可知,Na元素的基态原子 ( http: / / www.21cnjy.com )电子排布式为1s22s22p63s1。核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,因此离子半径由小到大的顺序是Al3+ Na+ O2-。
(2)该气体是氨气,含有极性键的共价化合物,电子式为。氨气是一种碱性气体,据此可以检验。即用润湿的红色石蕊试纸接近该气体,若试纸变红,证明氨气存在。
(3)过氧化钠溶于水生成氢氧 ( http: / / www.21cnjy.com )化钠和氧气,方程式为2Na2O2 + 2H2O = 4NaOH + O2↑。产生的氢氧化钠再和硫酸铜反应生成氢氧化铜沉淀,
(4)该离子化合物是硝酸铵,NH4+水解显酸性,所以离子浓度大小顺序是NO3->NH4+>H+ >OH-。
(5)氧气是得到电子的,所以空气再正极通入,电极反应式为O2+ 2H2O +4e- = 4 OH-。
13.(1)H2O,NO、HNO3(2 ( http: / / www.21cnjy.com ))1:2 (3)3NF3 + 5 H2O=2NO + HNO3+9HF (4)产生红棕色气体,产生刺激性气体,产生白雾。NaOH
【解析】
试题分析:(1)依据N的价态变化,产物 ( http: / / www.21cnjy.com )有NO、HNO3,利用H原子守恒,反应物有H2O。(2)利用电子得失相等,可以推出被氧化与被还原的物质的量之比为1:2.(3)利用电子得失,原子守恒可以配平方程式。(4)NF3接触空气中的水,发生反应。生成的NO气体接触空气变成红棕色。HNO3、HF溶解于空气中的水蒸气,有白雾。产物均可使用NaOH溶液吸收。
考点:化学方程式的配平。
14.(1)NaHCO3 Na2CO3 Na2O2 NaOH O2(2)2NaHCO3Na2CO3+CO2↑+H2O
【解析】本题首先确定E为O2,由于A、B ( http: / / www.21cnjy.com )、C、D的焰色反应呈黄色,故A、B、C、D为钠或钠的化合物。进一步确定C为Na2O2,X为CO2,Y为H2O,D为NaOH,A为NaHCO3,B为Na2CO3。
15.(1)B、D
(2)向下排空气
(3)湿润的红色石蕊试纸变蓝(或用蘸取浓盐酸的玻璃棒,接近容器口,将产生大量的白烟)
【解析】
试题分析:(1)题中A项直接加热NH4 Cl ( http: / / www.21cnjy.com )分解为NH3和HCl,NH3和HCl在管口冷却重新化合为NH4 Cl,故A项不能用于制取氨气;B项CaO会和浓氨水中的水结合: CaO+ H2O==Ca(OH)2,反应放热,有利于氨气挥发制取氨气;C项装置错误,大试管应口略向下倾斜,故C项错误;D项加热浓氨水有利于氨气挥发制取氨气,故D项正确。因为氨气极易溶于水且氨气密度小于空气,所以实验室制取氨气收集一般采取向下排空气法收集。检验氨气可利用氨气溶于水呈碱性,故可用湿润的红色石蕊试纸检验,现象是试纸变蓝;或用沾有浓盐酸的玻璃很棒靠近,产生大量的白烟检验。
考点:实验室制取氨气。
16.(14分)(1)吸收多余的ClO2气体,防止污染环境(1分)
防止倒吸(或作安全瓶等其它正确说法) (1分)
(2)2NaClO3+Na2SO3+H2SO4(浓)==2ClO2↑+2Na2SO4+H2O(2分)
(3)用38℃~60℃的温水洗涤(2分,仅写“洗涤”给1分)
(4)滴加几滴BaCl2溶液,若有白色沉淀出现,则含有Na2SO4,若无白色沉淀出现,则不含Na2SO4。 (2分,答一方面扣1分)
(5)淀粉溶液(1分);溶液由蓝色变为无色且半分钟不变色 (2分,“半分钟”不写扣1)
(6) 或 (3分)
【解析】
试题分析:(1)分析题给实验装置图知装置①的作用是吸收多余的ClO2气体,防止污染环境;装置③的作用是防止倒吸。(2)装置②中氯酸钠、亚硫酸钠和浓硫酸反应生成硫酸钠、ClO2和水,化学方程式为2NaClO3+Na2SO3+H2SO4(浓)==2ClO2↑+2Na2SO4+H2O。(3)从溶液中制取晶体,一般采用蒸发浓缩、冷却结晶、过滤、洗涤、干燥的方法,根据题给信息NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2 3H2O,高于38℃时析出晶体的是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl知从装置④反应后的溶液获得晶体NaClO2的操作步骤为:①减压,55℃蒸发结晶;②趁热过滤;③用38℃~60℃的温水洗涤;④低于60℃干燥,得到成品。(4)检验所得NaClO2晶体是否含有杂质Na2SO4,操作与现象是:取少量晶体溶于蒸馏水,滴加几滴BaCl2溶液,若有白色沉淀出现,则含有Na2SO4,若无白色沉淀出现,则不含Na2SO4。(5)根据题给信息知待测夜中含有碘单质,滴定中使用的指示剂是淀粉溶液,达到滴定终点时的现象为溶液由蓝色变为无色且半分钟不变色。(6)根据关系式NaClO2~2I2~4S2O32-进行计算;令样品中NaClO2的质量分数为x,则:90.5g:mxg=4mol:c mol L-1×V×10-3L×4,解得x=。
考点:考查化学实验方案的分析、评价,化学实验基本操作,化学方程式的书写及相关计算。
17.设参加反应的铁的质量为x。
Fe+CuSO4=FeSO4+Cu 棒的质量增加(差量)
56 64 64-56=8
x 100.8克-100克=0.8克
56∶8=x∶0.8克
有5.6克铁参加了反应。
【解析】Fe+CuSO4=FeSO4+Cu
56 64
(离开铁棒) (回到铁棒)
由化学方程式可知,影响棒的质量变化的 ( http: / / www.21cnjy.com )因素是参加反应的铁和生成的铜。每有56份质量的铁参加反应离开铁棒的同时,就有64份质量的铜回到铁棒上,则使棒的质量增加64-56=8(份)。现已知棒的质量增加100.8克-100克=0.8克,则可列比例求解。
18.(1)被还原的硫酸的物擀的量=生成的二氧化硫的物质的量
=4.48L/22.4L/mol=0.2mol(1分)
(2)设生成硫酸铜的物质的量为x
Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O(1分)
1mol 22.4L
X 4.48L
解之得X=0.2mol(1分)
所以所得溶液中溶质硫酸铜的物质的量浓度=0.2mol÷0.5L=0.4mol/L(1分)
答:被还原的硫酸的物质的量为0.2mol,所得溶液中溶质的物质的量浓度为0.4mol/L。
A.太阳能电池板中的硅在元素周期表中处于金属与非金属的交界位置
B.天然气、沼气和水煤气均属于可再生能源
C.硫酸、纯碱、醋酸钠分别属于酸、碱、盐
D.生铁、普通钢和不锈钢中的碳含量依次增加
2.下列各组物质中,因为反应条件或用量不同而发生不同化学反应的是 ( )
① C与O2 ② Na与O2 ③ Fe与Cl2
④ AlCl3溶液与NaOH溶液 ⑤ CO2与NaOH溶液 ⑥ Cu与硝酸
A.除③外 B.除③⑤外 C.除③④外 D.除⑥外
3.跟氨分子所含的质子总数和电子总数都相同的粒子是( )
A.Na+ B.Mg2+ C.HCl D.HF
4.可作为防毒面具或潜水艇里氧气来源的物质是
A.Na2O B.Na2O2 C.NaOH D.NaHCO3
5.一定物质的量的Cl2与NaOH溶液反 ( http: / / www.21cnjy.com )应,所得产物中含NaClO和NaClO3物质的量之比为3∶5,则参加反应的Cl2与NaOH物质的量之比为( )
A.8∶11 B.3∶5 C.1∶2 D.18∶8
6.下列叙述正确的是
A. 硫在过量的氧气中燃烧生成三氧化硫
B.二氧化硫通入BaCl2溶液中生成BaSO3白色沉淀
C.二氧化硫通入滴有酚酞的NaOH溶液中,红色褪去,说明二氧化硫具有漂白性
D.二氧化硫和二氧化碳都能使澄清的石灰水变浑浊
7.只用试管和胶头滴管而不用其它试剂无法区分的一组试剂是
A.KOH溶液和AlCl3溶液 B.Na2CO3溶液和HCl溶液
C.MgCl2溶液和氨水 D.盐酸和NaAlO2溶液
8.下列溶液中能用来区别SO2和CO2气体的是
①澄清的石灰水 ②氢硫酸 ③氯水 ④酸性高锰酸钾溶液 ⑤氯化钡溶液 ⑥品红溶液
A.①⑤ B.③④⑤ C.②⑥ D.②③④⑥
9.航天科学技术测得,三氧化二碳(C2O3)是金星大气层的成分之一。下列有关C2O3的说法不正确的是( )
A.C2O3和CO2都属于非金属氧化物
B.C2O3和CO的燃烧产物都是CO2
C.C2O3和CO都是酸性氧化物
D.C2O3和CO都具有还原性
10.将a g铁和氧化铁的混合物加入足量的 ( http: / / www.21cnjy.com )盐酸中充分反应后,固体无剩余,测得参加反应的HCl为0.08 mol,放出标准状况下的气体0.224 L。则下列判断中正确的是
A.原混合物中n(Fe)∶n(Fe2O3)=2∶1
B.向溶液中滴入KSCN溶液,显血红色
C.无法计算原混合物的质量
D.此时溶液中Fe2+和Fe3+的物质的量之比为3∶1
11.(7分)下图所表示的是中学化学中一类常见的物质转化关系(反应生成的H2O均略去),试按要求回答问题:
(1)若A为空气中含量最多的单质,C为一种红棕色的气体,则B与X的反应方程式为
(2)若A为有臭鸡蛋气味的气体,C为H2S ( http: / / www.21cnjy.com )O3的酸酐,则B为: ,1molA与a molX充分燃烧,若要求既生成B又生成C,则a的取值范围为
12.(13分)短周期元素 ( http: / / www.21cnjy.com )A、B、C、D、E的原子序数依次增大, A元素阳离子的原子核外没有电子,B是空气中含量最多的元素;C元素原子最外层电子数是其电子层数的三倍;C与D可形成两种常见的离子化合物;工业上常用电解C与E的化合物来制备E单质。
(1)写出D元素的基态原子电子排布式 ( http: / / www.21cnjy.com ) 。C、D、E的简单离子半径由小到大的顺序 ( 用离子符号表示)。
(2)工业上常用A和B的单质合成一种常见气体,该气体的电子式 。
检验该气体的常用方法是 。
(3)D2C2与H2O反应的化学方程式是 ,D2C2与CuSO4溶液反应的现象是 。
(4)A、B、C三种元素可组成一种 ( http: / / www.21cnjy.com )常见离子化合物,其水溶液呈酸性,该溶液中离子浓度由大到小的顺序是 。
(5)电动汽车的某种燃料电池,通常 ( http: / / www.21cnjy.com )用NaOH作电解质,用E单质、石墨作电极,在石墨电极一侧通入空气,该电池的正极反应: 。
13.某反应体系中的物质有:NF3、HF、NO、HNO3、H2O。请根据要求回答下列问题:
(1)请将NF3、HF之外的反应物与生成物分别填如以下空格内。
NF3+→HF ++
(2)反应过程中,被氧化与被还原的元素的物质的量之比为_______________;
(3)写出该反应的化学方程式:___________________________________________________________;
(4)NF3是一种无色、无 ( http: / / www.21cnjy.com )臭的气体,但一旦NF3在空气中泄漏,还是易于发现。你判断该气体泄漏时的现象是_____________________ ;一旦NF3泄漏,可以用 ___________(填化学式)溶液喷淋的方法减少污染。
14.已知A、B、C、D、E五种物质,且A、B、C、D的焰色反应呈黄色,它们的关系如下图所示,已知E为气体单质,能使带火星的木条复燃。
( http: / / www.21cnjy.com )
(1)写出下列物质的化学 ( http: / / www.21cnjy.com )式:A____________,B____________,C____________,D____________,E____________。
(2)写出A受热分解的化学方程式:____________________________________________。
15.请完成有关氨气的问题。
(1)实验室常用下列装置和选用的试剂制取NH3,其中正确的是__________(填序号)。
( http: / / www.21cnjy.com )
(2)若实验室收集NH3 要采用法__________。
(3)若检验NH3 ,可用__________。
16.(14分)某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验Ⅰ:制取NaClO2晶体
已知:NaClO2饱和溶液在温度低于3 ( http: / / www.21cnjy.com )8℃时析出的晶体是NaClO2 3H2O,高于38℃时析出晶体的是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。Ba(ClO)2可溶于水。
利用下图所示装置进行实验。
( http: / / www.21cnjy.com )
(1)装置①的作用是 装置③的作用是 。
(2)装置②中产生ClO2的化学方程式为 。
(3)从装置④反应后的溶液获得晶体NaClO2的操作步骤为:
①减压,55℃蒸发结晶;②趁热过滤;③ ;④低于60℃干燥,得到成品。
(4)设计实验检验所得NaClO2晶体 ( http: / / www.21cnjy.com )是否含有杂质Na2SO4,操作与现象是:取少量晶体溶于蒸馏水, 。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品m g于 ( http: / / www.21cnjy.com )烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+ 4I-+4H+ =2H2O+2I2+Cl-)。将所得混合液配成100mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中, ( http: / / www.21cnjy.com )用c mol L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得消耗标准溶液的体积的平均值为V mL(已知:I2 +2S2O32-=2I-+S4O62-)。
(5)滴定中使用的指示剂是 ,达到滴定终点时的现象为 。
(6)样品中NaClO2的质量分数为 (用含m、c、V的代数式表示,式量:NaClO2 90.5)。
17.将质量为100克的铁棒插入硫酸铜溶液中,过一会儿取出,烘干,称量,棒的质量变为100.8克。求有多少克铁参加了反应。
18.用Cu与浓硫酸反应,得到SO2的体积为4.48L(标准状况)。请计算:
(1)被还原的硫酸的物质的量。
(2)将得到的溶液稀释到50mL,求溶液中CuSO4的物质的量浓度。
参考答案
1.A
【解析】
2.A
【解析】
试题分析:① C与少量O2 反应产生 ( http: / / www.21cnjy.com )CO,与足量的氧气反应产生CO2, 用量不同发生反应不同,正确;② Na与O2在室温下反应产生Na2O,与氧气在点燃时反应产生Na2O2,反应条件不同,产物不同,正确;③ Fe与Cl2 发生反应产生FeCl3,与反应条件或用量无关,错误;④ AlCl3溶液与少量的NaOH溶液反应产生Al(OH)3沉淀,与过量的NaOH发生反应,产生NaAlO2,用量不同,反应的产物不同,正确。⑤ CO2与少量NaOH溶液,产生NaHCO3,与足量的NaOH发生反应,产生Na2CO3, 用量不同,反应的产物不同,正确, ⑥ Cu与稀硝酸反应产生NO,与浓硝酸发生反应产生NO2,浓度不同,反应的产物不同,正确。故符合题意的是除③外,选项是A。
考点:考查反应条件或用量不同对化学反应产生的影响的知识。
3.D
【解析】Na+、Mg2+、HCl、HF质子总数分别为11、12、18、10;电子总数分别为10、10、18、10。
4.B
【解析】
试题分析:过氧化钠能够和水和CO2 反应生成氢气,因此过氧化钠的用途之一是作为防毒面具或潜水艇里氧气的来源,选B。
考点:考查过氧化钠的性质。
5.C
【解析】
试题分析:根据所得产物中含NaClO和 ( http: / / www.21cnjy.com )NaClO3物质的量之比为3∶5,氯原子共8个,钠离子个8个,所以氯气的物质的量是氢氧化钠的一半,答案选C。
考点:考查元素守恒法的应用
6.D
【解析】
7.C
【解析】
试题分析:A.当AlCl3溶液 ( http: / / www.21cnjy.com )过量时,反应离子方程式为:Al3++3OH-=Al(OH)3↓,当氯化铝少量时,离子反应方程式为Al3++4OH-=AlO2-+2H2O,所以反应现象不同,可以区分;B.当盐酸少量时,离子反应方程式为CO32-+H+=HCO3-,当盐酸过量时,离子反应方程式为2H++CO32-=CO2↑+H2O,所以反应现象不同,可以区分;C.无论氨水是否过量,都发生的离子反应方程式为Mg2++2NH3.H2O=Mg(OH)2 ↓+2NH4+,无法区分;D.当盐酸少量时,离子反应方程式为H++AlO2-+H2O=Al(OH)3↓,当盐酸过量时,离子反应方程式为:4H++AlO2-=Al3++2H2O,所以反应现象不同,可以区分。
考点:考查物质的检验和鉴别的基本方法选择及应用。
8.D
【解析】
试题分析:①SO2和CO2气体都能使澄 ( http: / / www.21cnjy.com )清的石灰水变浑浊,则不能区分,故①错误;②只有SO2能与氢硫酸反应生成S沉淀,则可以区分,故②正确;③二者中只有SO2能与氯水反应生成盐酸和硫酸,使颜色消失,则可以区分,故③正确;④二者中只有SO2能与酸性高锰酸钾反应,使颜色消失,则可以区分,故④正确;⑤SO2和CO2气体都不与氯化钡反应,则无法区别,故⑤错误;⑥二者中只有SO2能使品红溶液褪色,则可以区分,故⑥正确;故答案为D、②③④⑥。
考点:二氧化硫的性质
9.C
【解析】略
10.A
【解析】
11.(1)2NO+O2= 2NO2(2分)
(2)S(或硫)(2分) 0.5<a<1.5(3分)
【解析】
12.(1)1s22s22p63s1 , Al3+ Na+ O2- 2分
(2) 1分, 用润湿的红色石蕊试纸接近该气体,若试纸变红,证明氨气存在 2分
(3) 2Na2O2 + 2H2O = 4NaOH + O2↑ 2分 、 产生蓝色沉淀并有气泡放出 2分
(4) NO3->NH4+>H+ >OH- 2分 (5)O2+ 2H2O +4e- = 4 OH- 2分
【解析】根据元素的结构及性质可知,A是H,B是N,C是O,D是Na,E是Al。
(1)根据构造原理可知,Na元素的基态原子 ( http: / / www.21cnjy.com )电子排布式为1s22s22p63s1。核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,因此离子半径由小到大的顺序是Al3+ Na+ O2-。
(2)该气体是氨气,含有极性键的共价化合物,电子式为。氨气是一种碱性气体,据此可以检验。即用润湿的红色石蕊试纸接近该气体,若试纸变红,证明氨气存在。
(3)过氧化钠溶于水生成氢氧 ( http: / / www.21cnjy.com )化钠和氧气,方程式为2Na2O2 + 2H2O = 4NaOH + O2↑。产生的氢氧化钠再和硫酸铜反应生成氢氧化铜沉淀,
(4)该离子化合物是硝酸铵,NH4+水解显酸性,所以离子浓度大小顺序是NO3->NH4+>H+ >OH-。
(5)氧气是得到电子的,所以空气再正极通入,电极反应式为O2+ 2H2O +4e- = 4 OH-。
13.(1)H2O,NO、HNO3(2 ( http: / / www.21cnjy.com ))1:2 (3)3NF3 + 5 H2O=2NO + HNO3+9HF (4)产生红棕色气体,产生刺激性气体,产生白雾。NaOH
【解析】
试题分析:(1)依据N的价态变化,产物 ( http: / / www.21cnjy.com )有NO、HNO3,利用H原子守恒,反应物有H2O。(2)利用电子得失相等,可以推出被氧化与被还原的物质的量之比为1:2.(3)利用电子得失,原子守恒可以配平方程式。(4)NF3接触空气中的水,发生反应。生成的NO气体接触空气变成红棕色。HNO3、HF溶解于空气中的水蒸气,有白雾。产物均可使用NaOH溶液吸收。
考点:化学方程式的配平。
14.(1)NaHCO3 Na2CO3 Na2O2 NaOH O2(2)2NaHCO3Na2CO3+CO2↑+H2O
【解析】本题首先确定E为O2,由于A、B ( http: / / www.21cnjy.com )、C、D的焰色反应呈黄色,故A、B、C、D为钠或钠的化合物。进一步确定C为Na2O2,X为CO2,Y为H2O,D为NaOH,A为NaHCO3,B为Na2CO3。
15.(1)B、D
(2)向下排空气
(3)湿润的红色石蕊试纸变蓝(或用蘸取浓盐酸的玻璃棒,接近容器口,将产生大量的白烟)
【解析】
试题分析:(1)题中A项直接加热NH4 Cl ( http: / / www.21cnjy.com )分解为NH3和HCl,NH3和HCl在管口冷却重新化合为NH4 Cl,故A项不能用于制取氨气;B项CaO会和浓氨水中的水结合: CaO+ H2O==Ca(OH)2,反应放热,有利于氨气挥发制取氨气;C项装置错误,大试管应口略向下倾斜,故C项错误;D项加热浓氨水有利于氨气挥发制取氨气,故D项正确。因为氨气极易溶于水且氨气密度小于空气,所以实验室制取氨气收集一般采取向下排空气法收集。检验氨气可利用氨气溶于水呈碱性,故可用湿润的红色石蕊试纸检验,现象是试纸变蓝;或用沾有浓盐酸的玻璃很棒靠近,产生大量的白烟检验。
考点:实验室制取氨气。
16.(14分)(1)吸收多余的ClO2气体,防止污染环境(1分)
防止倒吸(或作安全瓶等其它正确说法) (1分)
(2)2NaClO3+Na2SO3+H2SO4(浓)==2ClO2↑+2Na2SO4+H2O(2分)
(3)用38℃~60℃的温水洗涤(2分,仅写“洗涤”给1分)
(4)滴加几滴BaCl2溶液,若有白色沉淀出现,则含有Na2SO4,若无白色沉淀出现,则不含Na2SO4。 (2分,答一方面扣1分)
(5)淀粉溶液(1分);溶液由蓝色变为无色且半分钟不变色 (2分,“半分钟”不写扣1)
(6) 或 (3分)
【解析】
试题分析:(1)分析题给实验装置图知装置①的作用是吸收多余的ClO2气体,防止污染环境;装置③的作用是防止倒吸。(2)装置②中氯酸钠、亚硫酸钠和浓硫酸反应生成硫酸钠、ClO2和水,化学方程式为2NaClO3+Na2SO3+H2SO4(浓)==2ClO2↑+2Na2SO4+H2O。(3)从溶液中制取晶体,一般采用蒸发浓缩、冷却结晶、过滤、洗涤、干燥的方法,根据题给信息NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2 3H2O,高于38℃时析出晶体的是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl知从装置④反应后的溶液获得晶体NaClO2的操作步骤为:①减压,55℃蒸发结晶;②趁热过滤;③用38℃~60℃的温水洗涤;④低于60℃干燥,得到成品。(4)检验所得NaClO2晶体是否含有杂质Na2SO4,操作与现象是:取少量晶体溶于蒸馏水,滴加几滴BaCl2溶液,若有白色沉淀出现,则含有Na2SO4,若无白色沉淀出现,则不含Na2SO4。(5)根据题给信息知待测夜中含有碘单质,滴定中使用的指示剂是淀粉溶液,达到滴定终点时的现象为溶液由蓝色变为无色且半分钟不变色。(6)根据关系式NaClO2~2I2~4S2O32-进行计算;令样品中NaClO2的质量分数为x,则:90.5g:mxg=4mol:c mol L-1×V×10-3L×4,解得x=。
考点:考查化学实验方案的分析、评价,化学实验基本操作,化学方程式的书写及相关计算。
17.设参加反应的铁的质量为x。
Fe+CuSO4=FeSO4+Cu 棒的质量增加(差量)
56 64 64-56=8
x 100.8克-100克=0.8克
56∶8=x∶0.8克
有5.6克铁参加了反应。
【解析】Fe+CuSO4=FeSO4+Cu
56 64
(离开铁棒) (回到铁棒)
由化学方程式可知,影响棒的质量变化的 ( http: / / www.21cnjy.com )因素是参加反应的铁和生成的铜。每有56份质量的铁参加反应离开铁棒的同时,就有64份质量的铜回到铁棒上,则使棒的质量增加64-56=8(份)。现已知棒的质量增加100.8克-100克=0.8克,则可列比例求解。
18.(1)被还原的硫酸的物擀的量=生成的二氧化硫的物质的量
=4.48L/22.4L/mol=0.2mol(1分)
(2)设生成硫酸铜的物质的量为x
Cu+2H2SO4(浓)=CuSO4+SO2↑+2H2O(1分)
1mol 22.4L
X 4.48L
解之得X=0.2mol(1分)
所以所得溶液中溶质硫酸铜的物质的量浓度=0.2mol÷0.5L=0.4mol/L(1分)
答:被还原的硫酸的物质的量为0.2mol,所得溶液中溶质的物质的量浓度为0.4mol/L。
