江西省宜春三中2015-2016学年高一化学人教版必修二原子结构、元素周期律专题训练
文档属性
| 名称 | 江西省宜春三中2015-2016学年高一化学人教版必修二原子结构、元素周期律专题训练 |  | |
| 格式 | zip | ||
| 文件大小 | 152.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-02-10 14:59:19 | ||
图片预览




文档简介
第I卷(选择题)
1.下列说法正确的是
A.酸雨样品露天放置一段时间,酸性增强,是由于雨水所含成分被氧化的原因
B.N、P、As的非金属性逐渐增强
C.因为氧化性HClO>稀H2SO4,所以非金属性Cl>S
D.钠原子在反应中失去的电子比铝原子少,故钠的金属性应弱于铝
2.A元素原子核电荷数为11,B元素原子的质子数为8,A和B可形成化合物Z,下列说法中错误的是
A、A形成 +1价阳离子 B、Z一定能与水反应
C、Z中只能含有离子键 D、Z的熔点较高
3.短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,下列推断正确的是
Q R
T W
A.T的氧化物是光导纤维的主要成分
B.W的氢化物的化学式为HCl
C.R的最高正价氧化物的水化物是弱电解质
D.Q与氢形成的化合物均含极性共价键
4.按电子排布,可把周期表里的元素划分成5个区,以下元素属于P区的是:( )
A.Fe B.Mg C.P D.Cr
5.已知R2- 有b个中子,核外有a个电子,表示R原子符号正确的是
A.R B.a+b-2a-2R C.R D.R
6.有aA3+和bBn-两种离子,它们的电子层结构相同,则n值是 ( )
A.a-3-b B.b-3-a C.a+3-b D.a-3+b
7.某元素的天然同位素有510X和511 ( http: / / www.21cnjy.com )X两种,如果该元素的相对原子质量为10.8,那么元素X的天然同位素中510X和511X的原子个数之比为
A、3∶1 B、1∶3 C、4∶1 D、1∶4
8.臭氧(O3)可用于杀菌消毒,下列有关臭氧的说法正确的是
A.臭氧的相对分子质量为32 B.臭氧分子由氧气分子构成
C.臭氧与氧气互为同分异构体 D.1个臭氧分子由3个氧原子构成
9.X,Y是第2或第3周期中的两种元素,它 ( http: / / www.21cnjy.com )们可形成离子化合物XmYn,且离子均有稀有气体原子的电子结构。若X的原子序数为a,则Y的原子序数不可能为
A.a+8-m-n B.a-8+m-n C.a+16-m-n D.a-m-n
10.A、B两种元素的原子当它们分别获得两 ( http: / / www.21cnjy.com )个电子形成惰性元素的电子层结构时,A放出的能量大于B;C、D两元素的原子,当它们分别失去一个电子也形成惰性元素的电子层结构时,吸收的能量D大于C,则A、B和C、D间分别形成离子化合物的可能性最大是 ( )
A.C2A B.C2B C.D2A D.D2B
11.门捷列夫在描述元素周 ( http: / / www.21cnjy.com )期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中错误的是
A.X单质不易与水反应 B.XO2可被碳或氢还原为X
C.XCl4的沸点比SiCl4的高 D.XH4的稳定性比SiH4的高
12.[2014·长安一中、高新一中、 ( http: / / www.21cnjy.com )交大附中、师大附中、西安中学三模]X、Y是周期表前二十号元素 ,已知X、Y之间原子序数相差3 ,X、Y能形成化合物M。下列说法正确的是( )
A.若X、Y处于同一周期,则化合物M不可能是正四面体型分子晶体
B.若X的单质常温下是气体,则Y的单质常温下也是气体
C.若X、Y两元素周期数差1,则属于离子化合物的M只有四种
D.若M属于离子晶体,则其中可能含有非极性键
13.下列各组性质比较中,不正确的是
A.酸性:HClO4>H2SO4>H3PO4 B.碱性:KOH> NaOH>LiOH
C.单质的氧化性:F214.以下关于元素周期表的结构叙述正确的是
A.有七个主族,八个副族
B.有三个长周期(均含18种元素),三个短周期(均含8种元素)
C.零族位于元素周期表的第18列(从左往右)
D.第ⅢA族位于元素周期表的第三列(从左往右)
15.下列说法中正确的是
A.所有的电子在同一区域里运动
B.同一原子中,1s、2s、3s所能容纳的电子数越来越多
C.电子云图通常用小黑点来表示电子的多少,黑点密度大,电子数目大
D.能量高的电子在离核远的区域运动,能量低的电子在离核近的区域运动
第II卷(非选择题)
16.某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL的容量瓶中定容配成250 mL烧碱溶液
B.用移液管移取25 mL烧碱溶液于锥形瓶中并滴几滴甲基橙指示剂
C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解
D.将物质的量浓度为c的标准硫酸溶液装入酸式滴定管,调节液面,记下开始读数为V1
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
(1)正确操作步骤的顺序是 → → →D→ (均用字母填写)。
(2)滴定管的读数应注意
________________________________________________________________________。
(3)E中在锥形瓶下垫一张白纸的作用是
________________________________________________________________________。
(4)D步骤中液面应调节到________________________________________________________________________,尖嘴部分应_____________________________________________________________。
(5)滴定终点时锥形瓶内溶液的pH约为____________,终点时颜色变化是
________________________________________________________________________。
(6)若酸式滴定管不用标 ( http: / / www.21cnjy.com )准硫酸润洗,在其他操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响? (填“偏高”“偏低”或“不变”)。
(7)该烧碱样品纯度的计算式为_______________________________________________。
17.(共9分)某研究性学习小组设计了一组实验验证元素周期律。
(Ⅰ)为了用实验的方法验证镁和铝的金属性强弱,学生甲和学生乙分别设计了两种不同的方法:
方案一:学生甲用水作试剂,比较镁和铝与水反应的情况
方案二:学生乙用稀盐酸作试剂,比较镁和铝与稀盐酸反应的情况
回答下列问题:
(1)以上两实验方案实验现象较为明显的是方案 。
(2)学生乙在实验中取了一段黑色的镁带 ( http: / / www.21cnjy.com ),投入稀盐酸中,现象不十分明显,请分析原因 。
(3)学生内另辟蹊径,不用镁、铝的单质,而用镁、铝的可溶盐及一些其它化学试剂,进行实验也得出正确的结论,简述学生丙用的是什么方法?
( http: / / www.21cnjy.com )
(Ⅱ)学生丁设计了下图装置以验证氮、碳 ( http: / / www.21cnjy.com )、硅元素的非金属性强弱。他设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到白色沉淀生成。
(1)A写出所选用物质的化学式:
A: ,
B: 。
(2)写出烧杯中发生反应的离子方程式: 。
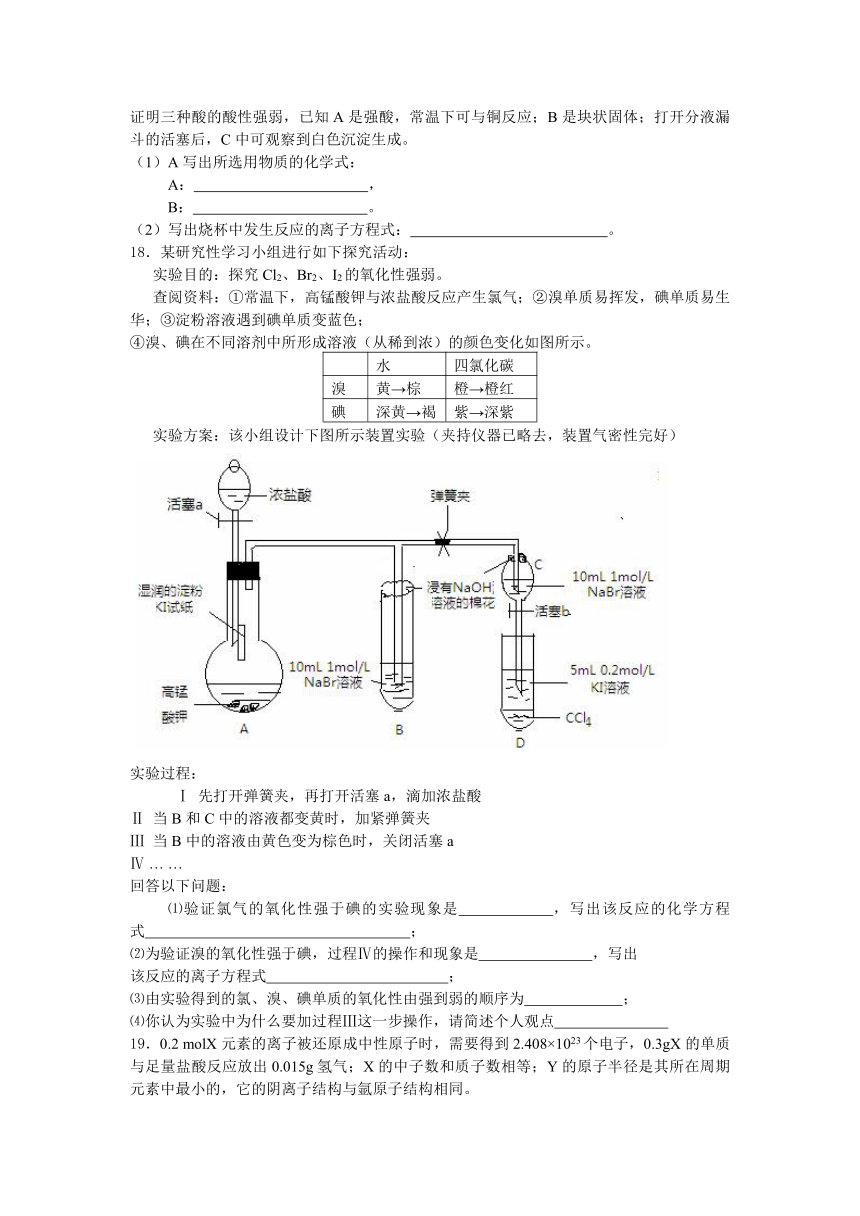
18.某研究性学习小组进行如下探究活动:
实验目的:探究Cl2、Br2、I2的氧化性强弱。
查阅资料:①常温下,高锰酸钾与浓盐酸反应产生氯气;②溴单质易挥发,碘单质易生华;③淀粉溶液遇到碘单质变蓝色;
④溴、碘在不同溶剂中所形成溶液(从稀到浓)的颜色变化如图所示。
水 四氯化碳
溴 黄→棕 橙→橙红
碘 深黄→褐 紫→深紫
实验方案:该小组设计下图所示装置实验(夹持仪器已略去,装置气密性完好)
( http: / / www.21cnjy.com )
实验过程:
Ⅰ 先打开弹簧夹,再打开活塞a,滴加浓盐酸
Ⅱ 当B和C中的溶液都变黄时,加紧弹簧夹
Ⅲ 当B中的溶液由黄色变为棕色时,关闭活塞a
Ⅳ … …
回答以下问题:
⑴验证氯气的氧化性强于碘 ( http: / / www.21cnjy.com )的实验现象是 ,写出该反应的化学方程式 ;
⑵为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 ,写出
该反应的离子方程式 ;
⑶由实验得到的氯、溴、碘单质的氧化性由强到弱的顺序为 ;
⑷你认为实验中为什么要加过程Ⅲ这一步操作,请简述个人观点
19.0.2 molX元素的离子被还原成 ( http: / / www.21cnjy.com )中性原子时,需要得到2.408×1023个电子,0.3gX的单质与足量盐酸反应放出0.015g氢气;X的中子数和质子数相等;Y的原子半径是其所在周期元素中最小的,它的阴离子结构与氩原子结构相同。
(1)计算X的相对原子质量(写出计算过程)
(2)推断X、Y两元素在周期表中的位置。
(3)用化学方程式表示X最高价氧化物对应的水化物与Y单质的反应。
20.6g某单质X能从盐酸中置换出0 ( http: / / www.21cnjy.com ).3g H2,同时生成XCl2;另一种元素Y,它的最高价氧化物的化学式为YO3,在Y的氢化物中,Y的质量分数为94.1%。
(1)X、Y两元素的相对原子质量:X ;Y 。
(2)写出Y的另一种常见氧化物与足量X的最高价氧化物对应水化物反应的化学方程式 。
21.(本题包括2部分,共14分)
Ⅰ、(8分)X、Y、Z、W均为短周期元素组成的单质或化合物。在一定条件下有如下转化关系:X+Y→Z+W
(1)若构成X的阳、阴离子个数比为1︰ ( http: / / www.21cnjy.com )2,且构成X的阳、阴离子中分别含有18个和10个电子,构成Z的阴、阳离子中均含有10个电子。则Z的电子式为 。
(2)若X、Y、Z、W四种物质 ( http: / / www.21cnjy.com )均为分子,且X分子中含18个电子,Y、Z分子中均含有10个电子,单质W分子中含有16个电子。则此化学反应的类型为 。
(3)若X、W均为单质,Y、Z均为氧化物且Y、Z中氧的质量分数分别为50%和40%。则该反应的化学方程式为 。
(4)若X、Y、Z、W均为非金属氧化物 ( http: / / www.21cnjy.com ),X的式量比Z的式量小16,Y的式量比W的式量大16,Y是光化学烟雾的主要“元凶”,则该反应的化学方程式为 。
Ⅱ、(6分)我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,下图是某化工厂对海水资源综合利用的示意图:
( http: / / www.21cnjy.com )
请根据以上信息回答下列问题:
(1)写出N的化学式和B的名称:N 、B 。
(2)写出反应②的化学方程式并用双线桥表示电子转移情况:
(3)写出反应③的离子方程式:
22.(10分,每空2分)由短周期元素组成 ( http: / / www.21cnjy.com )的单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系, 已知C为密度最小的气体。根据图示转化关系回答:
(1)若甲是电解质 写出下列物质的化学式:甲______________,丁_______________
写出乙与过量CO2反应的离子方程式:____________________________________________
(2)若甲是非电解质 写出下列物质的化学式:甲_______________,乙______________
参考答案
1.A
【解析】
试题分析:A项,酸雨中的成分 ( http: / / www.21cnjy.com )H2SO3或HNO2 被空气氧化,酸性增强,正确;B项,N、P、As的非金属性逐渐减弱;C项,两者没有因果关系;D项,金属性是指元素的原子失去电子的能力。
考点:元素周期律
点评:酸雨中的成分H2SO3或HNO2 ( http: / / www.21cnjy.com ) 被空气氧化,酸性增强;非金属最高价含氧酸酸性越强,其非金属性越强;金属性是指元素的原子失去电子的能力。
2.C
【解析】A为钠、B为氧、Z为Na2O 、Na2O2 ;可见Z为离子化合物,熔点较高,均可与水反应。Na2O2除含有离子键外还有非极性共价键
3.D
【解析】
试题分析:图中位于第三周期第IIIA族 ( http: / / www.21cnjy.com )元素T为铝,以此为突破口,可以顺利推导出Q、R、W分别为碳、氮、硫。T是铝,铝的氧化物为氧化铝,光导纤维的主要成分是二氧化硅,故A项错误;W是硫,硫的氢化物为硫化氢(H2S),故B项错误;R是氮,氮元素最高正价氧化物的水化物是硝酸(HNO3),硝酸是强酸、强电解质,故C项错误;Q是碳,碳与氢形成的化合物成为烃,烃分子中一定含有C—H键,碳、氢是不同非金属,则C—H键是极性共价键,故D项错误。
考点:考查物质结构和元素周期律,涉及元素在周期表的位置、物质结构、元素及其化合物的主要性质之间的推断等。
4.C
【解析】
5.B
【解析】
试题分析:在表示原子组成时元素符号的左下 ( http: / / www.21cnjy.com )角表示质子数,左上角表示质量数,质子数+中子数=质量数,原子核外电子数等于核内质子数,阴离子的核外电子数等于核内质子数+离子所带的电荷数,R2- 有b个中子,核外有a个电子,则质子数=a-2,质量数a-2+b,选B。
考点:考查原子中质子数、中子数和质量数的关系。
6.A
【解析】电子层结构相同的粒子具有相同数目的电子数,所以可得,得
;
7.D
【解析】
试题分析:设元素X的天然同位素中510X和5 ( http: / / www.21cnjy.com )11X的原子个数之比为m:n,则(10m+11n)÷(m+n)=10.8,解得m:n=1:4,答案选D。
考点:考查元素的相对原子质量的有关计算。
8.D
【解析】
试题分析:A.臭氧分子式是O3,其相 ( http: / / www.21cnjy.com )对分子质量为48,错误;B.臭氧分子由三个O原子构成的分子,错误。C.臭氧与氧气互为同素异形体,错误;D.1个臭氧分子由3个氧原子构成,正确。
考点:考查有关臭氧的说法的正误判断的知识。
9.B
【解析】,若X是第二周期,Y是第二周期元素,则Y的原子序数为:a+8-m-n,A正确;若X是第二周期,Y是第三周期元素,则Y的原子序数为:.a+16-m-n,C正确;若X是第三周期,Y是第二周期,则Y的原子序数为:a-m-n,D正确;若X是第三周期,Y是第三周期,则Y的原子序数为:a+8-m-n;即不可能的选项为B。
10.A
【解析】原子得电子放出的能量越多,说明 ( http: / / www.21cnjy.com )此原子越容易得电子,非金属性越强;原子失电子需要的能量越小,说明此原子越容易失电子,金属性越强,且离子键一般是由活泼的金属与非金属原子间形成,故答案为A。
11.D
【解析】
试题分析:A.该元素是第ⅣA族元素,性质 ( http: / / www.21cnjy.com )类似于Si,不易与水反应,A正确;B.碳和氢气均是常见的还原剂,X的非金属性比硅还弱,因此XO2可被碳或氢还原为X,B正确;C.XCl4的相对分子质量大于四氯化硅,因此其沸点比SiCl4的高,C正确;D.同主族自上而下非金属性逐渐减弱,氢化物的稳定性逐渐减弱,则XH4的稳定性比SiH4的低,D错误,答案选D。
考点:考查元素周期律
12.D
【解析】X、Y处于同一周期,化合物 ( http: / / www.21cnjy.com )M可能是CF4和SiCl4,这两种化合物均为正四面体型分子晶体,A项错;由于X、Y能形成化合物,当X的单质常温下是气体,Y的单质常温下不可能是气体,B项错;X、Y两元素周期数差1,属于离子化合物的M有:Na2O、Na2O2、MgF2、K2S、 CaCl2等,其中Na2O2中含有非极性键,故C错,D正确。
13.C
【解析】
试题分析:A、同周期元素从左到右非金 ( http: / / www.21cnjy.com )属性逐渐增强,最高价氧化物的水化物的酸性也逐渐增强,故A正确;B、同主族元素从上到下金属性逐渐增强,最高价氧化物的水化物的碱性逐渐减弱,故B正确;C、同主族元素从上到下非金属性逐渐减弱,故非金属性F>Cl>Br>I,对应的单质的氧化性:F2>Cl2>Br2>I2 ,故C错误;D、同周期元素从左到右金属性逐渐减弱,金属单质的还原性也逐渐减弱,故单质的还原性:Al考点:考查元素周期律相关知识。
14.C
【解析】
试题分析:A项:元素周期表有七个主族、 ( http: / / www.21cnjy.com )七个副族、一个第Ⅷ族和一个0族,故错;B项:元素周期表有短周期(1、2、3)、长周期(4、5、6)和不完全周期(7),故错;D项:第ⅢA族有副族和主族之分,故错。故选C。
考点:元素周期表的结构
点评:元素周期表有7个周期, ( http: / / www.21cnjy.com )16个族。每一个横行叫作一个周期,每一个纵行叫作一个族。这7个周期又可分成短周期(1、2、3)、长周期(4、5、6)和不完全周期(7)。共有16个族,又分为7个主族(ⅠA-ⅦA),7个副族(ⅠB-ⅦB),一个第ⅧB族,一个零族。
15.D
【解析】A.原子核外电子的分层排布,按照离核远近及能量的高低;
B. 1s、2s、3s能级所能容纳的电子数是一样的,均为2,且电子云形状也相同;
C.电子云图通常用小黑点来表示电子的多少,黑点密度大,说明电子出现的机率大。
16.
( http: / / www.21cnjy.com )
【解析】略
17.
(Ⅰ)(1)方案二(1分)
(2)未除去镁表面的氧化膜(2分)
(3)取镁、铝的可溶盐逐滴加氢氧化钠溶液均产生氢氧化物沉淀,过量碱液可使生成的Al(OH),溶解,而Mg(OH)2则不溶。(2分)
(Ⅱ)、(1)HNO3;CaCO3(2分)
(2)CO2+SiO32-+H2O=H2SiO3↓+CO32-
或:2CO2+SiO32-+2H2O=H2SiO3↓+2HCO3- (2分)
【解析】
18.
( http: / / www.21cnjy.com )
⑷B、C中的NaBr溶液的浓度和体积均相同,棕色溶液B含有的溴单质比黄
色溶液C中的多,说明C中还存有溴离子,不存在氯气,确保了氯气不干扰溴与碘化钾的反应。(3分)
【解析】
19.(1)计算X的相对原子质量(过程略)Ca
(2)Ca:第四周期ⅡA Cl:第三周期ⅥA
(3)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【解析】
20.(6分)(1)X Ca ;Y S (2)SO2+Ca(OH)2=CaSO3+H2O
【解析】
试题分析:(1)6g某单质X能从盐酸中置换出0.3g H2,同时生成XCl2
这说明6gX在反应中失去
又因为X的化合价是+2价,失去2个电子
所以X的物质的量是0.15mol
则X的相对分子质量是
所以X是Ca元素
Y的最高价氧化物的化学式为YO3
则Y的最高价是+6价,则最低价是-2价
所以根据在Y的氢化物中,Y的质量分数为94.1%可知
Y的相对原子质量是
即Y是S元素。
(2)SO2是酸性氧化物,和氢氧化钙反应的化学方程式是SO2+Ca(OH)2=CaSO3+H2O。
考点:考查元素相对原子质量的计算以及方程式的书写
点评:该题是中等难度试题的 ( http: / / www.21cnjy.com )考查,侧重对学生基础知识的巩固和训练,旨在培养学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和创新思维能力。该题的关键是利用好元素周期律,然后结合题意灵活运用即可。
21.Ⅰ、(1)NaOH的电子式:;(2分)(2)置换反应(氧化还原反应)
(3)2Mg+SO22MgO+S(2分)(4)SO2+NO2=SO3+NO(或CO+NO2=CO2+NO)(2分)
Ⅱ、(1)HCl (1分)、 石灰乳(1分)(2) ( http: / / www.21cnjy.com )
(3)Cl2 + 2OH- =Cl- + ClO- +H2O(2分)
【解析】
试题分析:Ⅰ、(1)若构成X的阳、阴离子个数比为1︰2,且构成X的阳、阴离子中分别含有18个和10个电子,构成Z的阴、阳离子中均含有10个电子。则X是Ca(OH)2;Y是Na2CO3,Z是NaOH,W是CaCO3,Z的电子式为;(2)若X、Y、Z、W四种物质均为分子,且X分子中含18个电子,Y、Z分子中均含有10个电子,单质W分子中含有16个电子。则X是F2,Y是H2O,Z是HF,W是O2,由于在反应中元素的化合价发生了变化,所以此化学反应的类型为氧化还原反应,根据反应物和生成物的元素组成可知该反应同时也是置换反应;(3)若X、W均为单质,Y、Z均为氧化物且Y、Z中氧的质量分数分别为50%和40%。则该反应的化学方程式为2Mg+SO22MgO+S;(4)若X、Y、Z、W均为非金属氧化物,X的式量比Z的式量小16,Y的式量比W的式量大16,Y是光化学烟雾的主要“元凶”,则X是SO2;Y是NO2;Z是SO3;W是NO;该反应的化学方程式为SO2+NO2=SO3+NO(或X是CO;Y是NO2;Z是CO2;W是NO,反应的方程式是CO+NO2=CO2+NO);
Ⅱ、(1)贝克CaCO3煅烧得到A是CaO ( http: / / www.21cnjy.com ), CaO与水发生反应产生B:Ca(OH)2,饱和NaCl溶液电解产生E是NaOH;F是H2;C是Cl2;氯气与氢气化合产生N:HCl,Cl2与NaOH溶液发生反应产生NaClO;Ca(OH)2与含有MgCl2的溶液发生复分解反应产生Mg(OH)2沉淀,把沉淀过滤出来,与HCl发生酸碱中和反应产生MgCl2;电解熔融的MgCl2产生C:Cl2和D:Mg。(1)N的化学式是HCl;B的名称是石灰乳;
(2)反应②的化学方程式及用双线桥表示电子转移情况是 ( http: / / www.21cnjy.com );
(3)反应③氯气与NaOH溶液反应的两种方程式是:Cl2 + 2OH- =Cl- + ClO- +H2O。
考点:考查元素及化合物的推断、物质的化学式、电子式、化学方程式的书写、反应类型的判断的知识。
22.(1)Al2O3,Al(OH)3,AlO2-+CO2+H2O=Al(OH)3↓+HCO3-;(2)SiO2,Na2SiO3。
【解析】
试题分析:C为密度最小的气体,则C:H2,能 ( http: / / www.21cnjy.com )与氢氧化钠溶液反应生成氢气,则A可能是金属铝也可能是硅单质,乙:NaAlO2或Na2SiO3,通入过量的CO2,利用碳酸的酸性比氢氧化铝和硅酸的酸性强,丁:Al(OH)3或H2SiO3,丁失去化合物丙得到甲,丙:H2O,则甲:Al2O3或SiO2,B:O2,(1)甲是电解质,则甲是Al2O3,按照上述分析,丁:Al(OH)3,AlO2-+CO2+H2O=Al(OH)3↓+HCO3-;(2)甲是非电解质,甲:SiO2,乙:Na2SiO3。
考点:考查铝、硅的性质。
1.下列说法正确的是
A.酸雨样品露天放置一段时间,酸性增强,是由于雨水所含成分被氧化的原因
B.N、P、As的非金属性逐渐增强
C.因为氧化性HClO>稀H2SO4,所以非金属性Cl>S
D.钠原子在反应中失去的电子比铝原子少,故钠的金属性应弱于铝
2.A元素原子核电荷数为11,B元素原子的质子数为8,A和B可形成化合物Z,下列说法中错误的是
A、A形成 +1价阳离子 B、Z一定能与水反应
C、Z中只能含有离子键 D、Z的熔点较高
3.短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,下列推断正确的是
Q R
T W
A.T的氧化物是光导纤维的主要成分
B.W的氢化物的化学式为HCl
C.R的最高正价氧化物的水化物是弱电解质
D.Q与氢形成的化合物均含极性共价键
4.按电子排布,可把周期表里的元素划分成5个区,以下元素属于P区的是:( )
A.Fe B.Mg C.P D.Cr
5.已知R2- 有b个中子,核外有a个电子,表示R原子符号正确的是
A.R B.a+b-2a-2R C.R D.R
6.有aA3+和bBn-两种离子,它们的电子层结构相同,则n值是 ( )
A.a-3-b B.b-3-a C.a+3-b D.a-3+b
7.某元素的天然同位素有510X和511 ( http: / / www.21cnjy.com )X两种,如果该元素的相对原子质量为10.8,那么元素X的天然同位素中510X和511X的原子个数之比为
A、3∶1 B、1∶3 C、4∶1 D、1∶4
8.臭氧(O3)可用于杀菌消毒,下列有关臭氧的说法正确的是
A.臭氧的相对分子质量为32 B.臭氧分子由氧气分子构成
C.臭氧与氧气互为同分异构体 D.1个臭氧分子由3个氧原子构成
9.X,Y是第2或第3周期中的两种元素,它 ( http: / / www.21cnjy.com )们可形成离子化合物XmYn,且离子均有稀有气体原子的电子结构。若X的原子序数为a,则Y的原子序数不可能为
A.a+8-m-n B.a-8+m-n C.a+16-m-n D.a-m-n
10.A、B两种元素的原子当它们分别获得两 ( http: / / www.21cnjy.com )个电子形成惰性元素的电子层结构时,A放出的能量大于B;C、D两元素的原子,当它们分别失去一个电子也形成惰性元素的电子层结构时,吸收的能量D大于C,则A、B和C、D间分别形成离子化合物的可能性最大是 ( )
A.C2A B.C2B C.D2A D.D2B
11.门捷列夫在描述元素周 ( http: / / www.21cnjy.com )期表时,许多元素尚未发现,但他为第四周期的三种元素留下了空位,并对它们的一些性质做了预测,X是其中的一种“类硅”元素,后来被德国化学家文克勒发现,并证实门捷列夫当时的预测相当准确。根据元素周期律,下列有关X性质的描述中错误的是
A.X单质不易与水反应 B.XO2可被碳或氢还原为X
C.XCl4的沸点比SiCl4的高 D.XH4的稳定性比SiH4的高
12.[2014·长安一中、高新一中、 ( http: / / www.21cnjy.com )交大附中、师大附中、西安中学三模]X、Y是周期表前二十号元素 ,已知X、Y之间原子序数相差3 ,X、Y能形成化合物M。下列说法正确的是( )
A.若X、Y处于同一周期,则化合物M不可能是正四面体型分子晶体
B.若X的单质常温下是气体,则Y的单质常温下也是气体
C.若X、Y两元素周期数差1,则属于离子化合物的M只有四种
D.若M属于离子晶体,则其中可能含有非极性键
13.下列各组性质比较中,不正确的是
A.酸性:HClO4>H2SO4>H3PO4 B.碱性:KOH> NaOH>LiOH
C.单质的氧化性:F2
A.有七个主族,八个副族
B.有三个长周期(均含18种元素),三个短周期(均含8种元素)
C.零族位于元素周期表的第18列(从左往右)
D.第ⅢA族位于元素周期表的第三列(从左往右)
15.下列说法中正确的是
A.所有的电子在同一区域里运动
B.同一原子中,1s、2s、3s所能容纳的电子数越来越多
C.电子云图通常用小黑点来表示电子的多少,黑点密度大,电子数目大
D.能量高的电子在离核远的区域运动,能量低的电子在离核近的区域运动
第II卷(非选择题)
16.某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL的容量瓶中定容配成250 mL烧碱溶液
B.用移液管移取25 mL烧碱溶液于锥形瓶中并滴几滴甲基橙指示剂
C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解
D.将物质的量浓度为c的标准硫酸溶液装入酸式滴定管,调节液面,记下开始读数为V1
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
(1)正确操作步骤的顺序是 → → →D→ (均用字母填写)。
(2)滴定管的读数应注意
________________________________________________________________________。
(3)E中在锥形瓶下垫一张白纸的作用是
________________________________________________________________________。
(4)D步骤中液面应调节到________________________________________________________________________,尖嘴部分应_____________________________________________________________。
(5)滴定终点时锥形瓶内溶液的pH约为____________,终点时颜色变化是
________________________________________________________________________。
(6)若酸式滴定管不用标 ( http: / / www.21cnjy.com )准硫酸润洗,在其他操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响? (填“偏高”“偏低”或“不变”)。
(7)该烧碱样品纯度的计算式为_______________________________________________。
17.(共9分)某研究性学习小组设计了一组实验验证元素周期律。
(Ⅰ)为了用实验的方法验证镁和铝的金属性强弱,学生甲和学生乙分别设计了两种不同的方法:
方案一:学生甲用水作试剂,比较镁和铝与水反应的情况
方案二:学生乙用稀盐酸作试剂,比较镁和铝与稀盐酸反应的情况
回答下列问题:
(1)以上两实验方案实验现象较为明显的是方案 。
(2)学生乙在实验中取了一段黑色的镁带 ( http: / / www.21cnjy.com ),投入稀盐酸中,现象不十分明显,请分析原因 。
(3)学生内另辟蹊径,不用镁、铝的单质,而用镁、铝的可溶盐及一些其它化学试剂,进行实验也得出正确的结论,简述学生丙用的是什么方法?
( http: / / www.21cnjy.com )
(Ⅱ)学生丁设计了下图装置以验证氮、碳 ( http: / / www.21cnjy.com )、硅元素的非金属性强弱。他设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到白色沉淀生成。
(1)A写出所选用物质的化学式:
A: ,
B: 。
(2)写出烧杯中发生反应的离子方程式: 。
18.某研究性学习小组进行如下探究活动:
实验目的:探究Cl2、Br2、I2的氧化性强弱。
查阅资料:①常温下,高锰酸钾与浓盐酸反应产生氯气;②溴单质易挥发,碘单质易生华;③淀粉溶液遇到碘单质变蓝色;
④溴、碘在不同溶剂中所形成溶液(从稀到浓)的颜色变化如图所示。
水 四氯化碳
溴 黄→棕 橙→橙红
碘 深黄→褐 紫→深紫
实验方案:该小组设计下图所示装置实验(夹持仪器已略去,装置气密性完好)
( http: / / www.21cnjy.com )
实验过程:
Ⅰ 先打开弹簧夹,再打开活塞a,滴加浓盐酸
Ⅱ 当B和C中的溶液都变黄时,加紧弹簧夹
Ⅲ 当B中的溶液由黄色变为棕色时,关闭活塞a
Ⅳ … …
回答以下问题:
⑴验证氯气的氧化性强于碘 ( http: / / www.21cnjy.com )的实验现象是 ,写出该反应的化学方程式 ;
⑵为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是 ,写出
该反应的离子方程式 ;
⑶由实验得到的氯、溴、碘单质的氧化性由强到弱的顺序为 ;
⑷你认为实验中为什么要加过程Ⅲ这一步操作,请简述个人观点
19.0.2 molX元素的离子被还原成 ( http: / / www.21cnjy.com )中性原子时,需要得到2.408×1023个电子,0.3gX的单质与足量盐酸反应放出0.015g氢气;X的中子数和质子数相等;Y的原子半径是其所在周期元素中最小的,它的阴离子结构与氩原子结构相同。
(1)计算X的相对原子质量(写出计算过程)
(2)推断X、Y两元素在周期表中的位置。
(3)用化学方程式表示X最高价氧化物对应的水化物与Y单质的反应。
20.6g某单质X能从盐酸中置换出0 ( http: / / www.21cnjy.com ).3g H2,同时生成XCl2;另一种元素Y,它的最高价氧化物的化学式为YO3,在Y的氢化物中,Y的质量分数为94.1%。
(1)X、Y两元素的相对原子质量:X ;Y 。
(2)写出Y的另一种常见氧化物与足量X的最高价氧化物对应水化物反应的化学方程式 。
21.(本题包括2部分,共14分)
Ⅰ、(8分)X、Y、Z、W均为短周期元素组成的单质或化合物。在一定条件下有如下转化关系:X+Y→Z+W
(1)若构成X的阳、阴离子个数比为1︰ ( http: / / www.21cnjy.com )2,且构成X的阳、阴离子中分别含有18个和10个电子,构成Z的阴、阳离子中均含有10个电子。则Z的电子式为 。
(2)若X、Y、Z、W四种物质 ( http: / / www.21cnjy.com )均为分子,且X分子中含18个电子,Y、Z分子中均含有10个电子,单质W分子中含有16个电子。则此化学反应的类型为 。
(3)若X、W均为单质,Y、Z均为氧化物且Y、Z中氧的质量分数分别为50%和40%。则该反应的化学方程式为 。
(4)若X、Y、Z、W均为非金属氧化物 ( http: / / www.21cnjy.com ),X的式量比Z的式量小16,Y的式量比W的式量大16,Y是光化学烟雾的主要“元凶”,则该反应的化学方程式为 。
Ⅱ、(6分)我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,下图是某化工厂对海水资源综合利用的示意图:
( http: / / www.21cnjy.com )
请根据以上信息回答下列问题:
(1)写出N的化学式和B的名称:N 、B 。
(2)写出反应②的化学方程式并用双线桥表示电子转移情况:
(3)写出反应③的离子方程式:
22.(10分,每空2分)由短周期元素组成 ( http: / / www.21cnjy.com )的单质A、B、C和甲、乙、丙、丁四种化合物有图示的转换关系, 已知C为密度最小的气体。根据图示转化关系回答:
(1)若甲是电解质 写出下列物质的化学式:甲______________,丁_______________
写出乙与过量CO2反应的离子方程式:____________________________________________
(2)若甲是非电解质 写出下列物质的化学式:甲_______________,乙______________
参考答案
1.A
【解析】
试题分析:A项,酸雨中的成分 ( http: / / www.21cnjy.com )H2SO3或HNO2 被空气氧化,酸性增强,正确;B项,N、P、As的非金属性逐渐减弱;C项,两者没有因果关系;D项,金属性是指元素的原子失去电子的能力。
考点:元素周期律
点评:酸雨中的成分H2SO3或HNO2 ( http: / / www.21cnjy.com ) 被空气氧化,酸性增强;非金属最高价含氧酸酸性越强,其非金属性越强;金属性是指元素的原子失去电子的能力。
2.C
【解析】A为钠、B为氧、Z为Na2O 、Na2O2 ;可见Z为离子化合物,熔点较高,均可与水反应。Na2O2除含有离子键外还有非极性共价键
3.D
【解析】
试题分析:图中位于第三周期第IIIA族 ( http: / / www.21cnjy.com )元素T为铝,以此为突破口,可以顺利推导出Q、R、W分别为碳、氮、硫。T是铝,铝的氧化物为氧化铝,光导纤维的主要成分是二氧化硅,故A项错误;W是硫,硫的氢化物为硫化氢(H2S),故B项错误;R是氮,氮元素最高正价氧化物的水化物是硝酸(HNO3),硝酸是强酸、强电解质,故C项错误;Q是碳,碳与氢形成的化合物成为烃,烃分子中一定含有C—H键,碳、氢是不同非金属,则C—H键是极性共价键,故D项错误。
考点:考查物质结构和元素周期律,涉及元素在周期表的位置、物质结构、元素及其化合物的主要性质之间的推断等。
4.C
【解析】
5.B
【解析】
试题分析:在表示原子组成时元素符号的左下 ( http: / / www.21cnjy.com )角表示质子数,左上角表示质量数,质子数+中子数=质量数,原子核外电子数等于核内质子数,阴离子的核外电子数等于核内质子数+离子所带的电荷数,R2- 有b个中子,核外有a个电子,则质子数=a-2,质量数a-2+b,选B。
考点:考查原子中质子数、中子数和质量数的关系。
6.A
【解析】电子层结构相同的粒子具有相同数目的电子数,所以可得,得
;
7.D
【解析】
试题分析:设元素X的天然同位素中510X和5 ( http: / / www.21cnjy.com )11X的原子个数之比为m:n,则(10m+11n)÷(m+n)=10.8,解得m:n=1:4,答案选D。
考点:考查元素的相对原子质量的有关计算。
8.D
【解析】
试题分析:A.臭氧分子式是O3,其相 ( http: / / www.21cnjy.com )对分子质量为48,错误;B.臭氧分子由三个O原子构成的分子,错误。C.臭氧与氧气互为同素异形体,错误;D.1个臭氧分子由3个氧原子构成,正确。
考点:考查有关臭氧的说法的正误判断的知识。
9.B
【解析】,若X是第二周期,Y是第二周期元素,则Y的原子序数为:a+8-m-n,A正确;若X是第二周期,Y是第三周期元素,则Y的原子序数为:.a+16-m-n,C正确;若X是第三周期,Y是第二周期,则Y的原子序数为:a-m-n,D正确;若X是第三周期,Y是第三周期,则Y的原子序数为:a+8-m-n;即不可能的选项为B。
10.A
【解析】原子得电子放出的能量越多,说明 ( http: / / www.21cnjy.com )此原子越容易得电子,非金属性越强;原子失电子需要的能量越小,说明此原子越容易失电子,金属性越强,且离子键一般是由活泼的金属与非金属原子间形成,故答案为A。
11.D
【解析】
试题分析:A.该元素是第ⅣA族元素,性质 ( http: / / www.21cnjy.com )类似于Si,不易与水反应,A正确;B.碳和氢气均是常见的还原剂,X的非金属性比硅还弱,因此XO2可被碳或氢还原为X,B正确;C.XCl4的相对分子质量大于四氯化硅,因此其沸点比SiCl4的高,C正确;D.同主族自上而下非金属性逐渐减弱,氢化物的稳定性逐渐减弱,则XH4的稳定性比SiH4的低,D错误,答案选D。
考点:考查元素周期律
12.D
【解析】X、Y处于同一周期,化合物 ( http: / / www.21cnjy.com )M可能是CF4和SiCl4,这两种化合物均为正四面体型分子晶体,A项错;由于X、Y能形成化合物,当X的单质常温下是气体,Y的单质常温下不可能是气体,B项错;X、Y两元素周期数差1,属于离子化合物的M有:Na2O、Na2O2、MgF2、K2S、 CaCl2等,其中Na2O2中含有非极性键,故C错,D正确。
13.C
【解析】
试题分析:A、同周期元素从左到右非金 ( http: / / www.21cnjy.com )属性逐渐增强,最高价氧化物的水化物的酸性也逐渐增强,故A正确;B、同主族元素从上到下金属性逐渐增强,最高价氧化物的水化物的碱性逐渐减弱,故B正确;C、同主族元素从上到下非金属性逐渐减弱,故非金属性F>Cl>Br>I,对应的单质的氧化性:F2>Cl2>Br2>I2 ,故C错误;D、同周期元素从左到右金属性逐渐减弱,金属单质的还原性也逐渐减弱,故单质的还原性:Al
14.C
【解析】
试题分析:A项:元素周期表有七个主族、 ( http: / / www.21cnjy.com )七个副族、一个第Ⅷ族和一个0族,故错;B项:元素周期表有短周期(1、2、3)、长周期(4、5、6)和不完全周期(7),故错;D项:第ⅢA族有副族和主族之分,故错。故选C。
考点:元素周期表的结构
点评:元素周期表有7个周期, ( http: / / www.21cnjy.com )16个族。每一个横行叫作一个周期,每一个纵行叫作一个族。这7个周期又可分成短周期(1、2、3)、长周期(4、5、6)和不完全周期(7)。共有16个族,又分为7个主族(ⅠA-ⅦA),7个副族(ⅠB-ⅦB),一个第ⅧB族,一个零族。
15.D
【解析】A.原子核外电子的分层排布,按照离核远近及能量的高低;
B. 1s、2s、3s能级所能容纳的电子数是一样的,均为2,且电子云形状也相同;
C.电子云图通常用小黑点来表示电子的多少,黑点密度大,说明电子出现的机率大。
16.
( http: / / www.21cnjy.com )
【解析】略
17.
(Ⅰ)(1)方案二(1分)
(2)未除去镁表面的氧化膜(2分)
(3)取镁、铝的可溶盐逐滴加氢氧化钠溶液均产生氢氧化物沉淀,过量碱液可使生成的Al(OH),溶解,而Mg(OH)2则不溶。(2分)
(Ⅱ)、(1)HNO3;CaCO3(2分)
(2)CO2+SiO32-+H2O=H2SiO3↓+CO32-
或:2CO2+SiO32-+2H2O=H2SiO3↓+2HCO3- (2分)
【解析】
18.
( http: / / www.21cnjy.com )
⑷B、C中的NaBr溶液的浓度和体积均相同,棕色溶液B含有的溴单质比黄
色溶液C中的多,说明C中还存有溴离子,不存在氯气,确保了氯气不干扰溴与碘化钾的反应。(3分)
【解析】
19.(1)计算X的相对原子质量(过程略)Ca
(2)Ca:第四周期ⅡA Cl:第三周期ⅥA
(3)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
【解析】
20.(6分)(1)X Ca ;Y S (2)SO2+Ca(OH)2=CaSO3+H2O
【解析】
试题分析:(1)6g某单质X能从盐酸中置换出0.3g H2,同时生成XCl2
这说明6gX在反应中失去
又因为X的化合价是+2价,失去2个电子
所以X的物质的量是0.15mol
则X的相对分子质量是
所以X是Ca元素
Y的最高价氧化物的化学式为YO3
则Y的最高价是+6价,则最低价是-2价
所以根据在Y的氢化物中,Y的质量分数为94.1%可知
Y的相对原子质量是
即Y是S元素。
(2)SO2是酸性氧化物,和氢氧化钙反应的化学方程式是SO2+Ca(OH)2=CaSO3+H2O。
考点:考查元素相对原子质量的计算以及方程式的书写
点评:该题是中等难度试题的 ( http: / / www.21cnjy.com )考查,侧重对学生基础知识的巩固和训练,旨在培养学生灵活运用基础知识解决实际问题的能力,有利于培养学生的逻辑推理能力和创新思维能力。该题的关键是利用好元素周期律,然后结合题意灵活运用即可。
21.Ⅰ、(1)NaOH的电子式:;(2分)(2)置换反应(氧化还原反应)
(3)2Mg+SO22MgO+S(2分)(4)SO2+NO2=SO3+NO(或CO+NO2=CO2+NO)(2分)
Ⅱ、(1)HCl (1分)、 石灰乳(1分)(2) ( http: / / www.21cnjy.com )
(3)Cl2 + 2OH- =Cl- + ClO- +H2O(2分)
【解析】
试题分析:Ⅰ、(1)若构成X的阳、阴离子个数比为1︰2,且构成X的阳、阴离子中分别含有18个和10个电子,构成Z的阴、阳离子中均含有10个电子。则X是Ca(OH)2;Y是Na2CO3,Z是NaOH,W是CaCO3,Z的电子式为;(2)若X、Y、Z、W四种物质均为分子,且X分子中含18个电子,Y、Z分子中均含有10个电子,单质W分子中含有16个电子。则X是F2,Y是H2O,Z是HF,W是O2,由于在反应中元素的化合价发生了变化,所以此化学反应的类型为氧化还原反应,根据反应物和生成物的元素组成可知该反应同时也是置换反应;(3)若X、W均为单质,Y、Z均为氧化物且Y、Z中氧的质量分数分别为50%和40%。则该反应的化学方程式为2Mg+SO22MgO+S;(4)若X、Y、Z、W均为非金属氧化物,X的式量比Z的式量小16,Y的式量比W的式量大16,Y是光化学烟雾的主要“元凶”,则X是SO2;Y是NO2;Z是SO3;W是NO;该反应的化学方程式为SO2+NO2=SO3+NO(或X是CO;Y是NO2;Z是CO2;W是NO,反应的方程式是CO+NO2=CO2+NO);
Ⅱ、(1)贝克CaCO3煅烧得到A是CaO ( http: / / www.21cnjy.com ), CaO与水发生反应产生B:Ca(OH)2,饱和NaCl溶液电解产生E是NaOH;F是H2;C是Cl2;氯气与氢气化合产生N:HCl,Cl2与NaOH溶液发生反应产生NaClO;Ca(OH)2与含有MgCl2的溶液发生复分解反应产生Mg(OH)2沉淀,把沉淀过滤出来,与HCl发生酸碱中和反应产生MgCl2;电解熔融的MgCl2产生C:Cl2和D:Mg。(1)N的化学式是HCl;B的名称是石灰乳;
(2)反应②的化学方程式及用双线桥表示电子转移情况是 ( http: / / www.21cnjy.com );
(3)反应③氯气与NaOH溶液反应的两种方程式是:Cl2 + 2OH- =Cl- + ClO- +H2O。
考点:考查元素及化合物的推断、物质的化学式、电子式、化学方程式的书写、反应类型的判断的知识。
22.(1)Al2O3,Al(OH)3,AlO2-+CO2+H2O=Al(OH)3↓+HCO3-;(2)SiO2,Na2SiO3。
【解析】
试题分析:C为密度最小的气体,则C:H2,能 ( http: / / www.21cnjy.com )与氢氧化钠溶液反应生成氢气,则A可能是金属铝也可能是硅单质,乙:NaAlO2或Na2SiO3,通入过量的CO2,利用碳酸的酸性比氢氧化铝和硅酸的酸性强,丁:Al(OH)3或H2SiO3,丁失去化合物丙得到甲,丙:H2O,则甲:Al2O3或SiO2,B:O2,(1)甲是电解质,则甲是Al2O3,按照上述分析,丁:Al(OH)3,AlO2-+CO2+H2O=Al(OH)3↓+HCO3-;(2)甲是非电解质,甲:SiO2,乙:Na2SiO3。
考点:考查铝、硅的性质。
