6.1燃烧与灭火 课件(共34张PPT)-初中化学鲁教版(2024)九年级上册
文档属性
| 名称 | 6.1燃烧与灭火 课件(共34张PPT)-初中化学鲁教版(2024)九年级上册 |  | |
| 格式 | pptx | ||
| 文件大小 | 91.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-09-30 18:07:29 | ||
图片预览










文档简介
(共34张PPT)
课题1
燃烧与灭火
从钻燧取火到冶炼金属,从工业革命时代蒸汽推动的滚滚车轮,到信息时代新型燃料推动的飞天神舟,人类从认识火、利用火,到控制火、改造火,每前进一步都有非比寻常的意义。只有不断深化和拓展对火的认识,才能有力地驾驭和利用火,更好地服务社会发展。
课堂导入
探究燃烧的条件
01
探究燃烧的条件
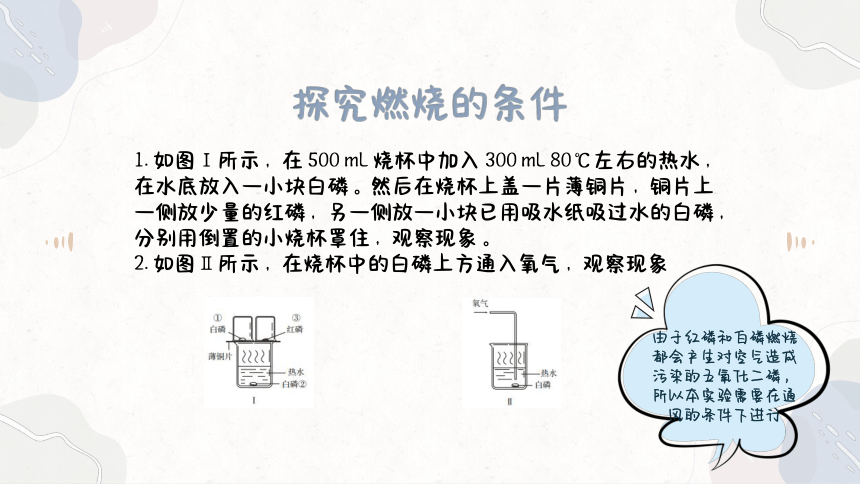
1. 如图Ⅰ所示,在 500 mL 烧杯中加入 300 mL 80℃左右的热水,在水底放入一小块白磷。然后在烧杯上盖一片薄铜片,铜片上一侧放少量的红磷,另一侧放一小块已用吸水纸吸过水的白磷,分别用倒置的小烧杯罩住,观察现象。
2. 如图Ⅱ所示,在烧杯中的白磷上方通入氧气,观察现象
由于红磷和白磷燃烧都会产生对空气造成污染的五氧化二磷,所以本实验需要在通风的条件下进行
探究燃烧的条件
实验操作 实验现象 实验推论
实验Ⅰ 薄铜片上的白磷燃烧,产生大量白烟;红磷不燃烧;热水中的白磷不燃烧 红磷,白磷都是可燃物,薄铜片上的白磷与氧气接触,同时温度达到了白磷的着火点,故白磷能燃烧;铜片上的红磷与氧气接触,但温度未达到红磷的着火点,故红磷不燃烧;热水中的白磷的温度达到了着火点,但没有与氧气接触,故不燃烧。
实验Ⅱ 通入氧气后,热水中的白磷燃烧起来 热水中的白磷温度达到了着火点,通入氧气后,与氧气接触,也燃烧起来。
探究燃烧的条件
实验结论:燃烧的条件是 可燃物需要达到可燃物燃烧所需的最低温度且必须与氧气接触
反思交流:为保证实验结果的准确合理,上述实验过程采取了哪些措施?
控制变量法
科学实验中,如果发现某个事物或问题有多个影响因素(即多个变量),常采用控制变量的方法,把对多因素的研究分解成对多个单一因素的研究。即每次实验只改变其中一个因素(称为自变量),而控制其他因素始终保持不变,从而可知被改变的这个因素对该事物(称为因变量)的影响,然后综合分析所有实验结果,得出最终结论。
燃烧条件的定量探究
上述关于燃烧条件的实验探究,如果用数字化仪器来进行,是否会有惊喜呢?以下是借助氧气传感器做的两组实验:
1. 用氧气传感器测量木条在密闭容器内燃烧至熄灭过程中,容器内氧气含量的变化。发现当容器内氧气的体积分数降到 11.7% 时,木条燃烧停止了。
2. 用蜡烛代替木条进行上述实验,发现当容器内氧气的体积分数降为 15.8% 时,蜡烛熄灭了。
思考:上述实验结果说明了什么?对你有何启示?
燃烧条件的定量探究
容器内氧气的体积分数降到11.7%时,木条停止燃烧;容器内氧气的体积分数降为15.8%时,蜡烛熄灭,
这说明可燃物燃烧过程中不能将氧气耗尽,
也说明氧气达到一定浓度才能使可燃物燃烧,
且不同的可燃物燃烧氧气的浓度也不同。
燃烧条件的定量探究
通过探究我们知道,物质跟氧气发生的燃烧反
应必须同时满足如下三个条件才能发生:
(1)物质本身是可燃的(可燃物);
(2)可燃物与充足的氧气接触;
(3)达到可燃物燃烧所需的最低温度(着火点)。
燃烧的条件
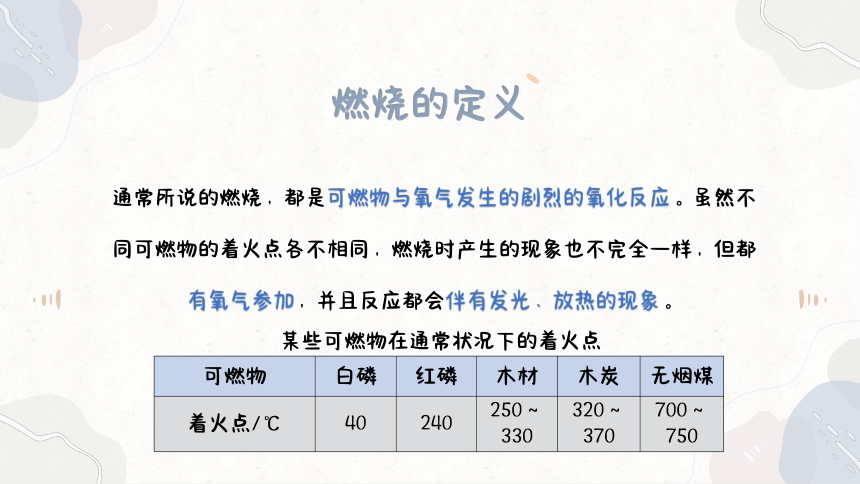
通常所说的燃烧,都是可燃物与氧气发生的剧烈的氧化反应。虽然不同可燃物的着火点各不相同,燃烧时产生的现象也不完全一样,但都有氧气参加,并且反应都会伴有发光、放热的现象。
燃烧的定义
某些可燃物在通常状况下的着火点 可燃物 白磷 红磷 木材 木炭 无烟煤
着火点/℃ 40 240 250~330 320~370 700~750
认识灭火的原理
02
寻找灭火的方法
下列着火的场景,可以采取哪些方法灭火?采用这些方法灭火的原理是什么?
着火的场景 可以采用的灭火方法 分析与解释
酒精洒在桌面上引起着火 用湿布覆盖 湿布可以隔断酒精和空气的接触,使之缺乏氧气的支持;此外,湿布上的水分蒸发还可以带走一部分热量,起到降低可燃物温度的作用
炒菜时油锅着火 盖上锅盖 盖上锅盖起到隔绝氧气的作用
森林着火 开辟隔离带 开辟隔离带起到移走可燃物的作用
灭火的原理
上述各种灭火方法,其目的归结起来,无外乎下列三种:
(1)移走可燃物;
(2)使可燃物隔绝空气(或氧气);
(3)降低可燃物的温度(降至其着火点以下)。
可见,灭火就是破坏燃烧所需的条件。同样的,预防火灾的措施也是提前破坏能引发燃烧的条件
促进燃烧的方法
03
促进燃烧的方法
随着“西气东输”工程的全面实施,我国许多家庭都使用上了天然气(主要成分是甲烷)。你观察过天然气在燃气灶上燃烧的情况吗?
通常,当燃烧很旺时,甲烷充分燃烧,火焰呈蓝色;当调小空气进口时,甲烷就会不充分燃烧,火焰变为黄色
灭火的原理
请解释下列现象,并据此归纳促进可燃物燃烧的方法。
1. 工厂烧锅炉用的煤通常要加工成粉末状。
2. 化油器将汽油喷成雾状,进入内燃机汽缸。
3. 用煤炭烧锅炉时,要用鼓风机不断往炉膛中吹入空气。
4. 在空气中加热铁丝时,铁丝不会燃烧;如果在纯氧中加热铁丝,就会剧烈燃烧,火星四射。
促进可燃物燃烧的方法
生活启示 结论分析
1. 工厂烧锅炉用的煤通常要加工成粉末状。 2. 化油器将汽油喷成雾状,进入内燃机汽缸。 增大可燃物与氧气的接触面积,有利于可燃物燃烧
3. 用煤炭烧锅炉时,要用鼓风机不断往炉膛中吹入空气。 4. 在空气中加热铁丝时,铁丝不会燃烧;如果在纯氧中加热铁丝,就会剧烈燃烧,火星四射 可燃物燃烧的剧烈程度与氧气的浓度有关,氧气浓度越大,可燃物燃烧越剧烈
一氧化碳
04
一氧化碳的产生
常用燃料的主要组成元素是碳。在氧气供给充足时,燃料中的碳充分燃烧,生成二氧化碳。若氧气供给不足,碳燃烧不充分,生成一氧化碳。
C + O2(充足) CO2
2C + O2(不充足) 2CO
此外,在高温下,炽热的木炭也可使二氧化碳转变成一氧化碳。
C + CO2 2CO
一氧化碳中毒
一氧化碳是无色无味的气体,它的存在不容易被觉察。当一氧化碳随呼吸进入人体血液后,便与血液中的血红蛋白结合,使血液失去了输送氧气的能力,导致一氧化碳中毒。人吸入少量的一氧化碳就会头痛,吸入较多量时,就可能导致死亡。煤炉、煤气灶及燃气热水器中的燃料不充分燃烧时会产生一氧化碳气体,使用时一定要保持良好的通风和有效的排气,确保安全。
爆炸
05
氢气的燃烧和爆炸
将一个塑料瓶的瓶底剪下,在瓶塞处插入一根带有止水夹的尖嘴玻璃管。用排水法集满纯净的氢气后,将塑料瓶移出水面,固定在铁架台上。打开止水夹,在尖嘴处点燃氢气。观察现象。
思考:为什么刚开始时氢气能够在导管的尖嘴处安静地燃烧,而片刻后却发生爆炸了呢?
氢气的燃烧和爆炸
上述实验中,当氢气刚开始燃烧时,只有少量氢气在玻璃管口跟氧气接触发生反应,产生的热量不多,很快就散失到空气中。随着燃烧的进行,空气从瓶底涌入,在瓶子中与氢气相互混合后,大量氢气分子和氧气分子同时接触,反应瞬间释放出大量的热,使气体体积在有限的空间里急剧膨胀,就发生了爆炸。
可燃气体的爆炸极限
可燃气体与空气形成混合气体,遇明火发生爆炸的浓度范围(即可燃气体占混合气体的体积分数范围),称为该可燃气体的爆炸极限。可燃气体的浓度低到不能发生爆炸的限度,称为爆炸下限;可燃气体的浓度高到不能发生爆炸的限度,称为爆炸上限。
注:表中数据为通常状况(20℃、1.01×105 Pa)下的测量值。
燃气类别 爆 炸 极 限 ( % ) 燃气类别 爆 炸 极 限 ( % )
氢气 4.0~75.0 天 然 气 ( 甲 烷 ) 5.0~15.0
一氧化碳 12.0~75.0 丁烷 1.8~8.5
与燃烧和爆炸有关的标志
家庭使用的天然气、煤气或液化气等可燃性气体一旦泄漏,且在通风不良的厨房等有限空间里遇到明火,就有可能发生爆炸。在加油站、化工厂、煤矿的矿井和面粉厂等场所,空气中会含有较多的可燃性气体或粉尘,一定要严禁烟火,严格遵守安全规程,防止发生火灾和爆炸事故。与燃烧一样,任何化学反应都需要在一定的条件下才能发生。因此,通过控制反应条件可以促进或抑制化学反应,使之满足人们的需要。
与燃烧和爆炸有关的标志
当心火灾
禁止带火种
当心爆炸
禁止吸烟
禁止烟火
禁止放易燃物
与燃烧和爆炸有关的概念
1. 通常所说的燃烧是指可燃物跟氧气发生的发光放热的剧烈氧化反应。
2. 控制燃烧条件可以达到防火、灭火和防止爆炸的目的。
3. 增大氧气的浓度或增大可燃物与氧气的接触面积,能促进可燃物燃烧。
4. 可燃性气体或粉尘在空气中的含量达到爆炸极限时,遇到明火就会剧烈燃烧,导致气体的体积在有限的空间里急剧膨胀,从而引起爆炸。
课堂小结
06
燃烧
灭火
促进燃烧
爆炸
物质本身是可燃的,与充足的氧气接触,温度达到可燃物的着火点。
条件(同时满足)
移走可燃物,隔绝氧气,降低温度到着火点以下
条件(满足其一即可)
增大氧气的浓度,增大可燃物与氧气的接触面积
方法
原因:气体的体积在有限的空间里急剧膨胀
实质上是剧烈燃烧
课堂练习
07
1 .如图所示是探究“物质燃烧条件”的三个实验。下列说法错误的是( )
A.实验一中热水的作用仅是提供热量
B.实验二说明物质燃烧需要可燃物
C.实验三说明可燃物燃烧需要温度达到着火点
D.实验一中的现象也能说明可燃物燃烧需要氧气
A
2.下列有关爆炸的说法正确的是( )
A.爆炸一定是化学变化
B.只有可燃性气体与空气混合点燃,才可能发生爆炸
C.空气与可燃性气体或粉尘混合,在有限空间内遇明火很有可能发生爆炸
D.可燃物爆炸是一种剧烈的燃烧,所以燃烧一定会爆炸 。
C
Thanks
感谢您的观看
课题1
燃烧与灭火
从钻燧取火到冶炼金属,从工业革命时代蒸汽推动的滚滚车轮,到信息时代新型燃料推动的飞天神舟,人类从认识火、利用火,到控制火、改造火,每前进一步都有非比寻常的意义。只有不断深化和拓展对火的认识,才能有力地驾驭和利用火,更好地服务社会发展。
课堂导入
探究燃烧的条件
01
探究燃烧的条件
1. 如图Ⅰ所示,在 500 mL 烧杯中加入 300 mL 80℃左右的热水,在水底放入一小块白磷。然后在烧杯上盖一片薄铜片,铜片上一侧放少量的红磷,另一侧放一小块已用吸水纸吸过水的白磷,分别用倒置的小烧杯罩住,观察现象。
2. 如图Ⅱ所示,在烧杯中的白磷上方通入氧气,观察现象
由于红磷和白磷燃烧都会产生对空气造成污染的五氧化二磷,所以本实验需要在通风的条件下进行
探究燃烧的条件
实验操作 实验现象 实验推论
实验Ⅰ 薄铜片上的白磷燃烧,产生大量白烟;红磷不燃烧;热水中的白磷不燃烧 红磷,白磷都是可燃物,薄铜片上的白磷与氧气接触,同时温度达到了白磷的着火点,故白磷能燃烧;铜片上的红磷与氧气接触,但温度未达到红磷的着火点,故红磷不燃烧;热水中的白磷的温度达到了着火点,但没有与氧气接触,故不燃烧。
实验Ⅱ 通入氧气后,热水中的白磷燃烧起来 热水中的白磷温度达到了着火点,通入氧气后,与氧气接触,也燃烧起来。
探究燃烧的条件
实验结论:燃烧的条件是 可燃物需要达到可燃物燃烧所需的最低温度且必须与氧气接触
反思交流:为保证实验结果的准确合理,上述实验过程采取了哪些措施?
控制变量法
科学实验中,如果发现某个事物或问题有多个影响因素(即多个变量),常采用控制变量的方法,把对多因素的研究分解成对多个单一因素的研究。即每次实验只改变其中一个因素(称为自变量),而控制其他因素始终保持不变,从而可知被改变的这个因素对该事物(称为因变量)的影响,然后综合分析所有实验结果,得出最终结论。
燃烧条件的定量探究
上述关于燃烧条件的实验探究,如果用数字化仪器来进行,是否会有惊喜呢?以下是借助氧气传感器做的两组实验:
1. 用氧气传感器测量木条在密闭容器内燃烧至熄灭过程中,容器内氧气含量的变化。发现当容器内氧气的体积分数降到 11.7% 时,木条燃烧停止了。
2. 用蜡烛代替木条进行上述实验,发现当容器内氧气的体积分数降为 15.8% 时,蜡烛熄灭了。
思考:上述实验结果说明了什么?对你有何启示?
燃烧条件的定量探究
容器内氧气的体积分数降到11.7%时,木条停止燃烧;容器内氧气的体积分数降为15.8%时,蜡烛熄灭,
这说明可燃物燃烧过程中不能将氧气耗尽,
也说明氧气达到一定浓度才能使可燃物燃烧,
且不同的可燃物燃烧氧气的浓度也不同。
燃烧条件的定量探究
通过探究我们知道,物质跟氧气发生的燃烧反
应必须同时满足如下三个条件才能发生:
(1)物质本身是可燃的(可燃物);
(2)可燃物与充足的氧气接触;
(3)达到可燃物燃烧所需的最低温度(着火点)。
燃烧的条件
通常所说的燃烧,都是可燃物与氧气发生的剧烈的氧化反应。虽然不同可燃物的着火点各不相同,燃烧时产生的现象也不完全一样,但都有氧气参加,并且反应都会伴有发光、放热的现象。
燃烧的定义
某些可燃物在通常状况下的着火点 可燃物 白磷 红磷 木材 木炭 无烟煤
着火点/℃ 40 240 250~330 320~370 700~750
认识灭火的原理
02
寻找灭火的方法
下列着火的场景,可以采取哪些方法灭火?采用这些方法灭火的原理是什么?
着火的场景 可以采用的灭火方法 分析与解释
酒精洒在桌面上引起着火 用湿布覆盖 湿布可以隔断酒精和空气的接触,使之缺乏氧气的支持;此外,湿布上的水分蒸发还可以带走一部分热量,起到降低可燃物温度的作用
炒菜时油锅着火 盖上锅盖 盖上锅盖起到隔绝氧气的作用
森林着火 开辟隔离带 开辟隔离带起到移走可燃物的作用
灭火的原理
上述各种灭火方法,其目的归结起来,无外乎下列三种:
(1)移走可燃物;
(2)使可燃物隔绝空气(或氧气);
(3)降低可燃物的温度(降至其着火点以下)。
可见,灭火就是破坏燃烧所需的条件。同样的,预防火灾的措施也是提前破坏能引发燃烧的条件
促进燃烧的方法
03
促进燃烧的方法
随着“西气东输”工程的全面实施,我国许多家庭都使用上了天然气(主要成分是甲烷)。你观察过天然气在燃气灶上燃烧的情况吗?
通常,当燃烧很旺时,甲烷充分燃烧,火焰呈蓝色;当调小空气进口时,甲烷就会不充分燃烧,火焰变为黄色
灭火的原理
请解释下列现象,并据此归纳促进可燃物燃烧的方法。
1. 工厂烧锅炉用的煤通常要加工成粉末状。
2. 化油器将汽油喷成雾状,进入内燃机汽缸。
3. 用煤炭烧锅炉时,要用鼓风机不断往炉膛中吹入空气。
4. 在空气中加热铁丝时,铁丝不会燃烧;如果在纯氧中加热铁丝,就会剧烈燃烧,火星四射。
促进可燃物燃烧的方法
生活启示 结论分析
1. 工厂烧锅炉用的煤通常要加工成粉末状。 2. 化油器将汽油喷成雾状,进入内燃机汽缸。 增大可燃物与氧气的接触面积,有利于可燃物燃烧
3. 用煤炭烧锅炉时,要用鼓风机不断往炉膛中吹入空气。 4. 在空气中加热铁丝时,铁丝不会燃烧;如果在纯氧中加热铁丝,就会剧烈燃烧,火星四射 可燃物燃烧的剧烈程度与氧气的浓度有关,氧气浓度越大,可燃物燃烧越剧烈
一氧化碳
04
一氧化碳的产生
常用燃料的主要组成元素是碳。在氧气供给充足时,燃料中的碳充分燃烧,生成二氧化碳。若氧气供给不足,碳燃烧不充分,生成一氧化碳。
C + O2(充足) CO2
2C + O2(不充足) 2CO
此外,在高温下,炽热的木炭也可使二氧化碳转变成一氧化碳。
C + CO2 2CO
一氧化碳中毒
一氧化碳是无色无味的气体,它的存在不容易被觉察。当一氧化碳随呼吸进入人体血液后,便与血液中的血红蛋白结合,使血液失去了输送氧气的能力,导致一氧化碳中毒。人吸入少量的一氧化碳就会头痛,吸入较多量时,就可能导致死亡。煤炉、煤气灶及燃气热水器中的燃料不充分燃烧时会产生一氧化碳气体,使用时一定要保持良好的通风和有效的排气,确保安全。
爆炸
05
氢气的燃烧和爆炸
将一个塑料瓶的瓶底剪下,在瓶塞处插入一根带有止水夹的尖嘴玻璃管。用排水法集满纯净的氢气后,将塑料瓶移出水面,固定在铁架台上。打开止水夹,在尖嘴处点燃氢气。观察现象。
思考:为什么刚开始时氢气能够在导管的尖嘴处安静地燃烧,而片刻后却发生爆炸了呢?
氢气的燃烧和爆炸
上述实验中,当氢气刚开始燃烧时,只有少量氢气在玻璃管口跟氧气接触发生反应,产生的热量不多,很快就散失到空气中。随着燃烧的进行,空气从瓶底涌入,在瓶子中与氢气相互混合后,大量氢气分子和氧气分子同时接触,反应瞬间释放出大量的热,使气体体积在有限的空间里急剧膨胀,就发生了爆炸。
可燃气体的爆炸极限
可燃气体与空气形成混合气体,遇明火发生爆炸的浓度范围(即可燃气体占混合气体的体积分数范围),称为该可燃气体的爆炸极限。可燃气体的浓度低到不能发生爆炸的限度,称为爆炸下限;可燃气体的浓度高到不能发生爆炸的限度,称为爆炸上限。
注:表中数据为通常状况(20℃、1.01×105 Pa)下的测量值。
燃气类别 爆 炸 极 限 ( % ) 燃气类别 爆 炸 极 限 ( % )
氢气 4.0~75.0 天 然 气 ( 甲 烷 ) 5.0~15.0
一氧化碳 12.0~75.0 丁烷 1.8~8.5
与燃烧和爆炸有关的标志
家庭使用的天然气、煤气或液化气等可燃性气体一旦泄漏,且在通风不良的厨房等有限空间里遇到明火,就有可能发生爆炸。在加油站、化工厂、煤矿的矿井和面粉厂等场所,空气中会含有较多的可燃性气体或粉尘,一定要严禁烟火,严格遵守安全规程,防止发生火灾和爆炸事故。与燃烧一样,任何化学反应都需要在一定的条件下才能发生。因此,通过控制反应条件可以促进或抑制化学反应,使之满足人们的需要。
与燃烧和爆炸有关的标志
当心火灾
禁止带火种
当心爆炸
禁止吸烟
禁止烟火
禁止放易燃物
与燃烧和爆炸有关的概念
1. 通常所说的燃烧是指可燃物跟氧气发生的发光放热的剧烈氧化反应。
2. 控制燃烧条件可以达到防火、灭火和防止爆炸的目的。
3. 增大氧气的浓度或增大可燃物与氧气的接触面积,能促进可燃物燃烧。
4. 可燃性气体或粉尘在空气中的含量达到爆炸极限时,遇到明火就会剧烈燃烧,导致气体的体积在有限的空间里急剧膨胀,从而引起爆炸。
课堂小结
06
燃烧
灭火
促进燃烧
爆炸
物质本身是可燃的,与充足的氧气接触,温度达到可燃物的着火点。
条件(同时满足)
移走可燃物,隔绝氧气,降低温度到着火点以下
条件(满足其一即可)
增大氧气的浓度,增大可燃物与氧气的接触面积
方法
原因:气体的体积在有限的空间里急剧膨胀
实质上是剧烈燃烧
课堂练习
07
1 .如图所示是探究“物质燃烧条件”的三个实验。下列说法错误的是( )
A.实验一中热水的作用仅是提供热量
B.实验二说明物质燃烧需要可燃物
C.实验三说明可燃物燃烧需要温度达到着火点
D.实验一中的现象也能说明可燃物燃烧需要氧气
A
2.下列有关爆炸的说法正确的是( )
A.爆炸一定是化学变化
B.只有可燃性气体与空气混合点燃,才可能发生爆炸
C.空气与可燃性气体或粉尘混合,在有限空间内遇明火很有可能发生爆炸
D.可燃物爆炸是一种剧烈的燃烧,所以燃烧一定会爆炸 。
C
Thanks
感谢您的观看
同课章节目录
