北京北师大实验中学2024届高三(上)统练一化学(PDF版,无答案)
文档属性
| 名称 | 北京北师大实验中学2024届高三(上)统练一化学(PDF版,无答案) |  | |
| 格式 | |||
| 文件大小 | 750.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-02 16:14:23 | ||
图片预览



文档简介
2024 北京北师大实验中学高三(上)统练一
化 学
教学班:______ 姓名:______ 学号:______
相对原子质量 H 1 O 16 Ca 40 F 19
1.化学与生活密切相关,下列说法正确的是( )
A.苯甲酸钠可作为食品防腐剂是由于其具有酸性
B.豆浆能产生丁达尔效应是由于胶体粒子对光线的散射
C.SO2 可用于丝织品漂白是由于其能氧化丝织品中有色成分
D.维生素C 可用作水果罐头的抗氧化剂是由于其难以被氧化
2.下列离子方程式正确的是( )
A.用CuSO 2+ 2 4 溶液除H2S气体:Cu +S = CuS
2+ +
B. H2SO3 溶液中滴加Ba (NO3 ) 溶液:H2SO3 +Ba = BaSO3 +2H 2
C. NaHCO 3溶液中通入少量Cl2 : 2HCO3 +Cl2 = 2CO2 +Cl +ClO +H2O
3+
D.用FeCl3 溶液刻蚀覆铜板制作印刷电路板: 2Fe +Cu = 2Fe
2+ +Cu2+
3.下列化学用语或图示表达正确的是( )
2+
A.甲醇的空间填充模型: B. Cu 的离子结构示意图:
2
¨ ¨
3 +
C. sp 杂化轨道示意图: D.过氧化氢的电子式:H : O : O : H
+
4.下列说法正确的是( )
A.化合物H2S2O8中S 为+7 价
B.第一电离能:P S
3
C. CH CHO 的沸点高于CO2 是因为存在分子间氢键
D.酸性:HF HCl
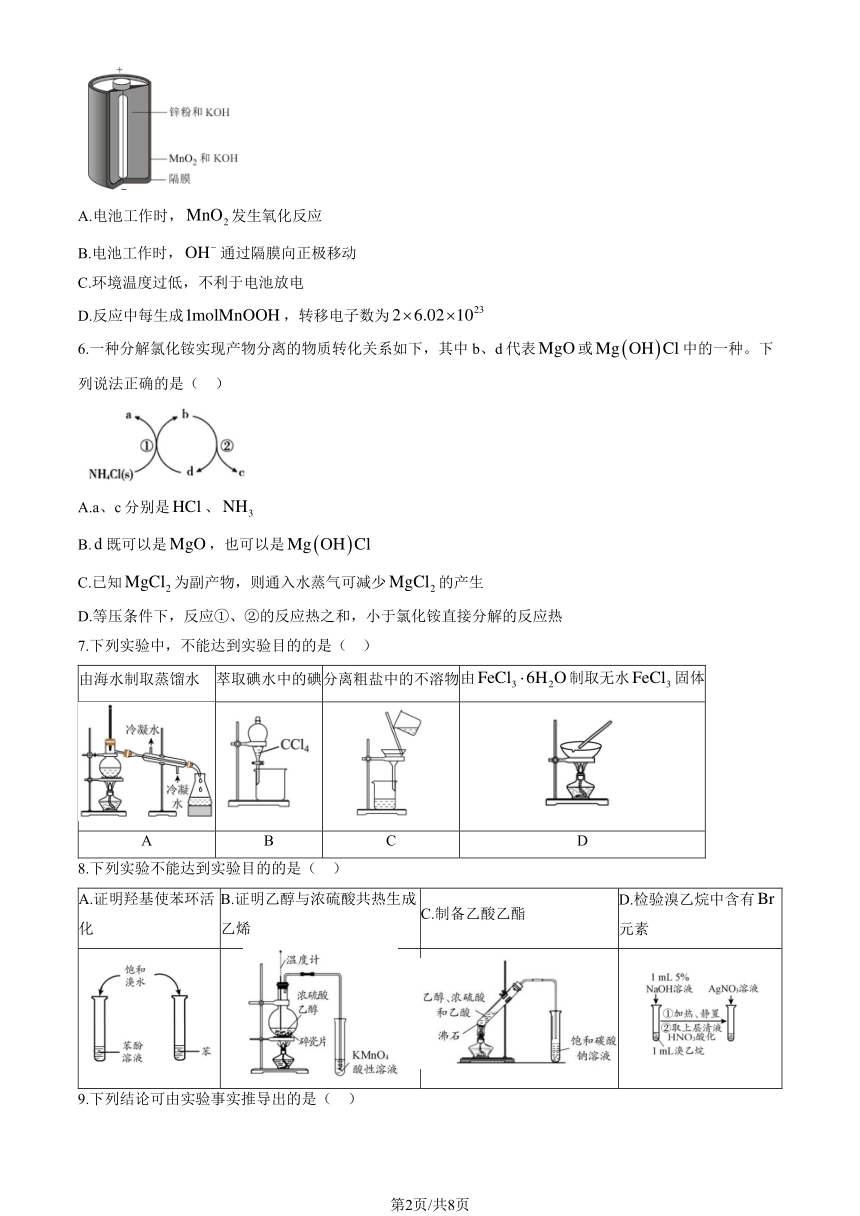
5.碱性锌锰电池的总反应为Zn + 2MnO2 +H2O = ZnO + 2MnOOH ,电池构造示意图如图所示。下列有
关说法正确的是( )
第1页/共8页
A.电池工作时,MnO2 发生氧化反应
B.电池工作时,OH 通过隔膜向正极移动
C.环境温度过低,不利于电池放电
23
D.反应中每生成1molMnOOH ,转移电子数为 2 6.02 10
6.一种分解氯化铵实现产物分离的物质转化关系如下,其中 b、d 代表MgO或Mg (OH)Cl 中的一种。下
列说法正确的是( )
A.a、c 分别是HCl 、 NH3
B. d 既可以是MgO,也可以是Mg (OH)Cl
C.已知MgCl2 为副产物,则通入水蒸气可减少MgCl2 的产生
D.等压条件下,反应①、②的反应热之和,小于氯化铵直接分解的反应热
7.下列实验中,不能达到实验目的的是( )
由海水制取蒸馏水 萃取碘水中的碘 分离粗盐中的不溶物 由FeCl3 6H2O制取无水FeCl3 固体
A B C D
8.下列实验不能达到实验目的的是( )
A.证明羟基使苯环活 B.证明乙醇与浓硫酸共热生成 D.检验溴乙烷中含有Br
C.制备乙酸乙酯
化 乙烯 元素
9.下列结论可由实验事实推导出的是( )
第2页/共8页
选项 实验事实(均为室温) 结论
浓度均为0.1mol L
1
的 NaClO 溶液和 NaNO2溶液的 pH :
A Ka (HClO) Ka (HNO2 )
NaClO NaNO2
B 向BaSO4固体中加入过量饱和 Na 2CO3溶液,有BaCO3生成 Ksp (BaSO4 ) Ksp (BaCO3 )
向苯酚钠溶液中通入过量CO2 ,发生反应:
C
Ka2 (H2CO3 ) Ka ( )
2Fe3+ + 2I 向平衡体系: 2Fe
2+ + I2中加入AgNO3溶液,平 3+
D 该条件下氧化性: I2 Fe
衡向左移动
10.莲藕含多酚类物质,其典型结构简式如图所示。下列有关该类物质的说法错误的是( )
A.能与溴水反应 B.可用作抗氧化剂
C.1mol该物质最多能与3molNaOH
3+
反应 D.能与Fe 发生显色反应
11.在光照下,螺呲喃发生开、闭环转换而变色,过程如下。下列关于开、闭环螺呲喃说法正确的是( )
A.均有手性碳原子 B.互为同分异构体
C. N 原子杂化方式相同 D.闭环螺吡喃亲水性更好
12.某小组探究 NH3的催化氧化,实验装置图如下。③中气体颜色无明显变化,④中收集到红棕色气体,
一段时间后,④中产生白烟。
下列分析不正确( )
A.若②中只有 NH4Cl不能制备 NH3
催化剂
B.③、④中现象说明③中的反应是 4NH3 +5O2 4NO+6H2O
△
第3页/共8页
C.④中白烟的主要成分是 NH4Cl
D.一段时间后,⑤中溶液可能变蓝
13.一种以锰尘(主要成分为Mn2O3 ,杂质为铝、镁、钙、铁的氧化物)为原料制备高纯MnCO3 的清洁
生产新工艺流程如下:
已知:室温下相关物质的Ksp 如下表。
Al(OH) Mg (OH) Ca (OH) Fe(OH) Fe(OH) Mn (OH) MgF CaF
3 2 2 2 3 2 2 2
10 32.9 10 11.3 10 5.3 –16.3 10 38.6 10 12.7 10 10.3 8.3 10 10
下列说法错误的是( )
A.酸浸工序中产生的气体①为氯气
B.滤渣①主要成分为Al(OH) 和Fe(OH)
3 3
2+ 2+
C.除杂 2 工序中逐渐加入 NaF 溶液时,若Ca 、Mg 浓度接近,则CaF2 先析出
2+
D.沉淀工序中发生反应的离子方程式为Mn + 2HCO
3 = MnCO3 +CO2 +H2O
14.为探究 Na2SO3 的性质,实验小组同学进行了如下实验:
下列说法一定正确的是( )
A.③和④中产生的气体成分完全相同
B.②和⑥中沉淀的主要成分不同
C.①→②和④→⑥均只发生了复分解反应
D.SO
2
3 的还原性在酸性条件下增强
第二部分 本部分共 5 题,共 58 分。
15.(10 分)氟在已知元素中电负性最大、非金属性最强,其单质在 1886 年才被首次分离出来。
(1)基态F原子的核外电子排布式为______。
(2)氟氧化物O2F2 、OF2 的结构已经确定。
第4页/共8页
O2F2 H2O2
O—O 键长/pm 121 148
①依据数据推测O O键的稳定性:O2F2 ______ H2O2 (填“>”或“<”)。
②OF2 中 F-O-F 的键角小于H2O 中H O H 的键角,解释原因:________________________。
(3)HF 是一种有特殊性质的氢化物。
①已知:氢键 (X H Y)中三原子在一条直线上时,作用力最强。测定结果表明, (HF) 固体中HF 分
n
子排列成锯齿形。画出含 2 个 HF 的重复单元结构:______。
②HF
+
中加入BF3 可以解离出H2F 和具有正四面体形结构的阴离子,写出该过程的离子方程式:
__________________。
(4)工业上用萤石(主要成分CaF2 )制备HF 。CaF2 晶体的一种立方晶胞如图所示。
CaF 2+ ① 2 晶体中距离Ca 最近的F 有______个。
②晶胞边长为 dnm (1cm =107 nm) 3,阿伏加德罗常数的值为 NA 。该晶体的密度 = ______ g cm (列
出计算式)。
16.(12 分)制备纳米Fe 并对其还原去除水中的硝酸盐污染物进行研究。
已知:i.纳米Fe 具有很高的活性,易被氧化使表面形成氧化层
+
ii.纳米Fe 将 NO3 还原为 NH4 的转化关系如图:
NO Fe3 →NO
Fe →NH+
反应① 2 反应② 4
(1)纳米Fe 的制备原理:FeSO4 + 2NaBH4 + 6H2O = 2B(OH) + Fe+ 7H2 +Na2SO4 ,其中电负3
性H B 。反应中,氧化剂是______。
2+ +
(2)酸性条件下,纳米Fe 和 NO3 反应生成Fe 和 NH4 的离子方程式是__________________。
+
(3)检验溶液中 NH4 的操作和现象是________________________。
(4)水体中含有的HCO
3 与Fe
2+
反应,会降低 NO
2+
3 的去除率。HCO3 与Fe 反应的离子方程式是
__________________。
(5)溶液初始 pH 较低有利于 NO3 的去除,可能的原因是________________________(答 1 条)。
(6)反应结束时,溶液的 pH 升高至 10 左右。一段时间内,纳米Fe 还原 NO3 的产物分析如图。
第5页/共8页
+
注:i.氨氮包括 NH 、 NH 和 NH3 H O3 4 2
ii.总氮包括硝态氮、亚硝态氮和氨氮
iii. c / c0 为溶液中粒子的物质的量浓度与初始 c (NO 3 )的比值
①溶液中只检出少量 NO2 ,从化学反应速率的角度解释原因:________________________。
②反应结束时,溶液中的总氮量小于初始时的总氮量,可能的原因是________________________。
17.(12 分)某粗铜精炼得到的阳极泥主要成分为:Cu 、Se、Ag2Se 等,从中提取Se的工艺流程如下:
已知:
化学式 Ag2Se AgCl
Ksp (常温) 2.0 10
64 1.8 10 10
(1)酸浸过程,通入稀硫酸和空气的目的是________________________。
(2)“氯化”过程中发生如下转化:
①Se转化为H2SeO3 ,反应方程式为__________________。
②Ag2Se 转化为AgCl ,从化学平衡的角度解释原因________________________。
(3)①“还原”过程中发生反应的化学方程式为__________________。
②Cl2 、SO 、H SeO2 2 3 氧化性由强到弱的顺序为____________。
(4)滴定法测定CuSO4 溶液的浓度,其基本原理为:
第一步: 2Cu
2+ + 4I = 2CuI +I2
2S O 2 (无色)+ I = S O 2 第二步: 2 3 2 4 6 (无色)+ 2I
①由此可知滴定所用的指示剂为__________________。
②若CuSO4 溶液体积为 25mL,滴定至终点时消耗 cmol / LNa2S2O3 溶液VmL ,则CuSO4 溶液的物质
的量浓度为______ mol / L 。
第6页/共8页
③若使用的 KI 溶液过量,对滴定结果的影响是______。(填“偏大”或“偏小”或“不影响”)
18.(12 分)多聚二磷酸腺苷核糖聚合酶抑制剂奥拉帕尼(J)的合成路线如下
已知:i.
ii.
(1)A 为芳香族酯类化合物,A → B的化学方程式为__________________。
(2)B→C 的化学方程式为__________________。
(3)C→D 发生了两步反应,反应类型依次为加成反应、______。
(4)试剂 a 中含有的官能团有—CN、______。
(5)下列说法正确的是______。
a.A 的一种同分异构体既能发生银镜反应,又能遇FeCl3 溶液发生显色反应
b. H 能与 NaHCO3溶液反应
c. H → I 的过程可能生成一种分子内含有 7 个六元环的副产物
d. I → J 的过程利用了 N (CH2CH3 ) 的碱性 3
(6)E 经多步转化可得到G ,路线如下。
M 分子中含有 2 个六元环,P 分子中含有 3 个六元环。M 和P 的结构简式分别为______、______。
19.(12 分)某小组实验探究不同条件下KMnO4 溶液与 Na2SO3 溶液的反应。
2 2+
已知:i. MnO4 在一定条件下可被还原为:MnO (绿色)、Mn4 (无色)、MnO2 (棕黑色)。
ii. MnO
2
4 在中性、酸性溶液中不稳定,易发生歧化反应,产生棕黑色沉淀,溶液变为紫色。
第7页/共8页
实验 序号 物质 a 实验现象
3mol L 1H2SO4 溶
I 紫色溶液变浅至几乎无色
液
II H2O 紫色褪去,产生棕黑色沉淀
溶液变绿,一段时间后绿色消失,产生棕黑色
III 6mol L 1 NaOH 溶液
沉淀
(1)实验 I~III 的操作过程中,加入 Na2SO3 溶液和物质 a 的顺序,应先加______。
(2)实验 I 中,MnO4 的还原产物为______。
(3)实验 II 中发生反应的离子方程式为__________________。
(4)已知:可从电极反应角度分析物质氧化性和还原性的变化。用电极反应式表示实验 III 中溶液变绿时
发生的氧化反应____________。
(5)解释实验 III 中“一段时间后绿色消失,产生棕黑色沉淀”的原因________________________。
(6)若想观察KMnO4 溶液与 Na2SO3 溶液反应后溶液为持续稳定的绿色,设计实验方案。
0.1mol L 1(7)改用 KMnO4 溶液重复实验 I,观察到紫色溶液变浅,随后产生棕黑色沉淀,写出产生棕
黑色沉淀的离子方程式__________________。
第8页/共8页
化 学
教学班:______ 姓名:______ 学号:______
相对原子质量 H 1 O 16 Ca 40 F 19
1.化学与生活密切相关,下列说法正确的是( )
A.苯甲酸钠可作为食品防腐剂是由于其具有酸性
B.豆浆能产生丁达尔效应是由于胶体粒子对光线的散射
C.SO2 可用于丝织品漂白是由于其能氧化丝织品中有色成分
D.维生素C 可用作水果罐头的抗氧化剂是由于其难以被氧化
2.下列离子方程式正确的是( )
A.用CuSO 2+ 2 4 溶液除H2S气体:Cu +S = CuS
2+ +
B. H2SO3 溶液中滴加Ba (NO3 ) 溶液:H2SO3 +Ba = BaSO3 +2H 2
C. NaHCO 3溶液中通入少量Cl2 : 2HCO3 +Cl2 = 2CO2 +Cl +ClO +H2O
3+
D.用FeCl3 溶液刻蚀覆铜板制作印刷电路板: 2Fe +Cu = 2Fe
2+ +Cu2+
3.下列化学用语或图示表达正确的是( )
2+
A.甲醇的空间填充模型: B. Cu 的离子结构示意图:
2
¨ ¨
3 +
C. sp 杂化轨道示意图: D.过氧化氢的电子式:H : O : O : H
+
4.下列说法正确的是( )
A.化合物H2S2O8中S 为+7 价
B.第一电离能:P S
3
C. CH CHO 的沸点高于CO2 是因为存在分子间氢键
D.酸性:HF HCl
5.碱性锌锰电池的总反应为Zn + 2MnO2 +H2O = ZnO + 2MnOOH ,电池构造示意图如图所示。下列有
关说法正确的是( )
第1页/共8页
A.电池工作时,MnO2 发生氧化反应
B.电池工作时,OH 通过隔膜向正极移动
C.环境温度过低,不利于电池放电
23
D.反应中每生成1molMnOOH ,转移电子数为 2 6.02 10
6.一种分解氯化铵实现产物分离的物质转化关系如下,其中 b、d 代表MgO或Mg (OH)Cl 中的一种。下
列说法正确的是( )
A.a、c 分别是HCl 、 NH3
B. d 既可以是MgO,也可以是Mg (OH)Cl
C.已知MgCl2 为副产物,则通入水蒸气可减少MgCl2 的产生
D.等压条件下,反应①、②的反应热之和,小于氯化铵直接分解的反应热
7.下列实验中,不能达到实验目的的是( )
由海水制取蒸馏水 萃取碘水中的碘 分离粗盐中的不溶物 由FeCl3 6H2O制取无水FeCl3 固体
A B C D
8.下列实验不能达到实验目的的是( )
A.证明羟基使苯环活 B.证明乙醇与浓硫酸共热生成 D.检验溴乙烷中含有Br
C.制备乙酸乙酯
化 乙烯 元素
9.下列结论可由实验事实推导出的是( )
第2页/共8页
选项 实验事实(均为室温) 结论
浓度均为0.1mol L
1
的 NaClO 溶液和 NaNO2溶液的 pH :
A Ka (HClO) Ka (HNO2 )
NaClO NaNO2
B 向BaSO4固体中加入过量饱和 Na 2CO3溶液,有BaCO3生成 Ksp (BaSO4 ) Ksp (BaCO3 )
向苯酚钠溶液中通入过量CO2 ,发生反应:
C
Ka2 (H2CO3 ) Ka ( )
2Fe3+ + 2I 向平衡体系: 2Fe
2+ + I2中加入AgNO3溶液,平 3+
D 该条件下氧化性: I2 Fe
衡向左移动
10.莲藕含多酚类物质,其典型结构简式如图所示。下列有关该类物质的说法错误的是( )
A.能与溴水反应 B.可用作抗氧化剂
C.1mol该物质最多能与3molNaOH
3+
反应 D.能与Fe 发生显色反应
11.在光照下,螺呲喃发生开、闭环转换而变色,过程如下。下列关于开、闭环螺呲喃说法正确的是( )
A.均有手性碳原子 B.互为同分异构体
C. N 原子杂化方式相同 D.闭环螺吡喃亲水性更好
12.某小组探究 NH3的催化氧化,实验装置图如下。③中气体颜色无明显变化,④中收集到红棕色气体,
一段时间后,④中产生白烟。
下列分析不正确( )
A.若②中只有 NH4Cl不能制备 NH3
催化剂
B.③、④中现象说明③中的反应是 4NH3 +5O2 4NO+6H2O
△
第3页/共8页
C.④中白烟的主要成分是 NH4Cl
D.一段时间后,⑤中溶液可能变蓝
13.一种以锰尘(主要成分为Mn2O3 ,杂质为铝、镁、钙、铁的氧化物)为原料制备高纯MnCO3 的清洁
生产新工艺流程如下:
已知:室温下相关物质的Ksp 如下表。
Al(OH) Mg (OH) Ca (OH) Fe(OH) Fe(OH) Mn (OH) MgF CaF
3 2 2 2 3 2 2 2
10 32.9 10 11.3 10 5.3 –16.3 10 38.6 10 12.7 10 10.3 8.3 10 10
下列说法错误的是( )
A.酸浸工序中产生的气体①为氯气
B.滤渣①主要成分为Al(OH) 和Fe(OH)
3 3
2+ 2+
C.除杂 2 工序中逐渐加入 NaF 溶液时,若Ca 、Mg 浓度接近,则CaF2 先析出
2+
D.沉淀工序中发生反应的离子方程式为Mn + 2HCO
3 = MnCO3 +CO2 +H2O
14.为探究 Na2SO3 的性质,实验小组同学进行了如下实验:
下列说法一定正确的是( )
A.③和④中产生的气体成分完全相同
B.②和⑥中沉淀的主要成分不同
C.①→②和④→⑥均只发生了复分解反应
D.SO
2
3 的还原性在酸性条件下增强
第二部分 本部分共 5 题,共 58 分。
15.(10 分)氟在已知元素中电负性最大、非金属性最强,其单质在 1886 年才被首次分离出来。
(1)基态F原子的核外电子排布式为______。
(2)氟氧化物O2F2 、OF2 的结构已经确定。
第4页/共8页
O2F2 H2O2
O—O 键长/pm 121 148
①依据数据推测O O键的稳定性:O2F2 ______ H2O2 (填“>”或“<”)。
②OF2 中 F-O-F 的键角小于H2O 中H O H 的键角,解释原因:________________________。
(3)HF 是一种有特殊性质的氢化物。
①已知:氢键 (X H Y)中三原子在一条直线上时,作用力最强。测定结果表明, (HF) 固体中HF 分
n
子排列成锯齿形。画出含 2 个 HF 的重复单元结构:______。
②HF
+
中加入BF3 可以解离出H2F 和具有正四面体形结构的阴离子,写出该过程的离子方程式:
__________________。
(4)工业上用萤石(主要成分CaF2 )制备HF 。CaF2 晶体的一种立方晶胞如图所示。
CaF 2+ ① 2 晶体中距离Ca 最近的F 有______个。
②晶胞边长为 dnm (1cm =107 nm) 3,阿伏加德罗常数的值为 NA 。该晶体的密度 = ______ g cm (列
出计算式)。
16.(12 分)制备纳米Fe 并对其还原去除水中的硝酸盐污染物进行研究。
已知:i.纳米Fe 具有很高的活性,易被氧化使表面形成氧化层
+
ii.纳米Fe 将 NO3 还原为 NH4 的转化关系如图:
NO Fe3 →NO
Fe →NH+
反应① 2 反应② 4
(1)纳米Fe 的制备原理:FeSO4 + 2NaBH4 + 6H2O = 2B(OH) + Fe+ 7H2 +Na2SO4 ,其中电负3
性H B 。反应中,氧化剂是______。
2+ +
(2)酸性条件下,纳米Fe 和 NO3 反应生成Fe 和 NH4 的离子方程式是__________________。
+
(3)检验溶液中 NH4 的操作和现象是________________________。
(4)水体中含有的HCO
3 与Fe
2+
反应,会降低 NO
2+
3 的去除率。HCO3 与Fe 反应的离子方程式是
__________________。
(5)溶液初始 pH 较低有利于 NO3 的去除,可能的原因是________________________(答 1 条)。
(6)反应结束时,溶液的 pH 升高至 10 左右。一段时间内,纳米Fe 还原 NO3 的产物分析如图。
第5页/共8页
+
注:i.氨氮包括 NH 、 NH 和 NH3 H O3 4 2
ii.总氮包括硝态氮、亚硝态氮和氨氮
iii. c / c0 为溶液中粒子的物质的量浓度与初始 c (NO 3 )的比值
①溶液中只检出少量 NO2 ,从化学反应速率的角度解释原因:________________________。
②反应结束时,溶液中的总氮量小于初始时的总氮量,可能的原因是________________________。
17.(12 分)某粗铜精炼得到的阳极泥主要成分为:Cu 、Se、Ag2Se 等,从中提取Se的工艺流程如下:
已知:
化学式 Ag2Se AgCl
Ksp (常温) 2.0 10
64 1.8 10 10
(1)酸浸过程,通入稀硫酸和空气的目的是________________________。
(2)“氯化”过程中发生如下转化:
①Se转化为H2SeO3 ,反应方程式为__________________。
②Ag2Se 转化为AgCl ,从化学平衡的角度解释原因________________________。
(3)①“还原”过程中发生反应的化学方程式为__________________。
②Cl2 、SO 、H SeO2 2 3 氧化性由强到弱的顺序为____________。
(4)滴定法测定CuSO4 溶液的浓度,其基本原理为:
第一步: 2Cu
2+ + 4I = 2CuI +I2
2S O 2 (无色)+ I = S O 2 第二步: 2 3 2 4 6 (无色)+ 2I
①由此可知滴定所用的指示剂为__________________。
②若CuSO4 溶液体积为 25mL,滴定至终点时消耗 cmol / LNa2S2O3 溶液VmL ,则CuSO4 溶液的物质
的量浓度为______ mol / L 。
第6页/共8页
③若使用的 KI 溶液过量,对滴定结果的影响是______。(填“偏大”或“偏小”或“不影响”)
18.(12 分)多聚二磷酸腺苷核糖聚合酶抑制剂奥拉帕尼(J)的合成路线如下
已知:i.
ii.
(1)A 为芳香族酯类化合物,A → B的化学方程式为__________________。
(2)B→C 的化学方程式为__________________。
(3)C→D 发生了两步反应,反应类型依次为加成反应、______。
(4)试剂 a 中含有的官能团有—CN、______。
(5)下列说法正确的是______。
a.A 的一种同分异构体既能发生银镜反应,又能遇FeCl3 溶液发生显色反应
b. H 能与 NaHCO3溶液反应
c. H → I 的过程可能生成一种分子内含有 7 个六元环的副产物
d. I → J 的过程利用了 N (CH2CH3 ) 的碱性 3
(6)E 经多步转化可得到G ,路线如下。
M 分子中含有 2 个六元环,P 分子中含有 3 个六元环。M 和P 的结构简式分别为______、______。
19.(12 分)某小组实验探究不同条件下KMnO4 溶液与 Na2SO3 溶液的反应。
2 2+
已知:i. MnO4 在一定条件下可被还原为:MnO (绿色)、Mn4 (无色)、MnO2 (棕黑色)。
ii. MnO
2
4 在中性、酸性溶液中不稳定,易发生歧化反应,产生棕黑色沉淀,溶液变为紫色。
第7页/共8页
实验 序号 物质 a 实验现象
3mol L 1H2SO4 溶
I 紫色溶液变浅至几乎无色
液
II H2O 紫色褪去,产生棕黑色沉淀
溶液变绿,一段时间后绿色消失,产生棕黑色
III 6mol L 1 NaOH 溶液
沉淀
(1)实验 I~III 的操作过程中,加入 Na2SO3 溶液和物质 a 的顺序,应先加______。
(2)实验 I 中,MnO4 的还原产物为______。
(3)实验 II 中发生反应的离子方程式为__________________。
(4)已知:可从电极反应角度分析物质氧化性和还原性的变化。用电极反应式表示实验 III 中溶液变绿时
发生的氧化反应____________。
(5)解释实验 III 中“一段时间后绿色消失,产生棕黑色沉淀”的原因________________________。
(6)若想观察KMnO4 溶液与 Na2SO3 溶液反应后溶液为持续稳定的绿色,设计实验方案。
0.1mol L 1(7)改用 KMnO4 溶液重复实验 I,观察到紫色溶液变浅,随后产生棕黑色沉淀,写出产生棕
黑色沉淀的离子方程式__________________。
第8页/共8页
同课章节目录
