第03讲 物质的量在化学方程式计算中的应用(课件)-2025年高考化学一轮复习讲练测(新教材新高考)
文档属性
| 名称 | 第03讲 物质的量在化学方程式计算中的应用(课件)-2025年高考化学一轮复习讲练测(新教材新高考) |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-06 00:00:00 | ||
图片预览






文档简介
(共48张PPT)
第03讲
讲师:xxx
物质的量在化学方程式计算中的应用
目录
CONTENTS
01
考情透视
02
知识导图
03
考点突破
04
真题练习
考点要求 考题统计 考情分析
无机计算 2022 浙江6月30题,4分;2022 浙江1月30题,4分;2021 浙江1月30题,4分;2020 浙江7月,4分;2022 浙江1月30题,4分; 近年来高考中考查化学计算的试题主要分成两类:一类是以选择题形式出现的小计算题,一类是以填空题出现的小综合计算题,一般意在考查元素化合物与化学实验、有机化合物基础知识相联系的综合问题。高考试题将以化工生产、科学实验为背景,强调计算与化学基本理论、化学变化过程、工业流程、化学实验等结合,突出思维能力的考查和数学工具的应用,体现计算为化学应用服务,强化对化学方程式的量化理解。
有机计算 2021 浙江6月30题,4分;2019 浙江4月30题,4分;
复习目标: 1.通过对化学方程式化学计量数意义的重新认识,完成对化学反应从微观到宏观认知的转变,明确化学计量数在不同层次的运算中的使用。 2.通过对物质的量在化学方程式中的应用,理解物质的量在高中化学计算的应用,建立高中使用物质的量及相关概念在方程式计算中的基本运用模型。 3.通过运用物质的量及相关物理量根据化学方程式进行简单计算,感受定量研究对化学科学的重要作用。
考情透视·目标导航
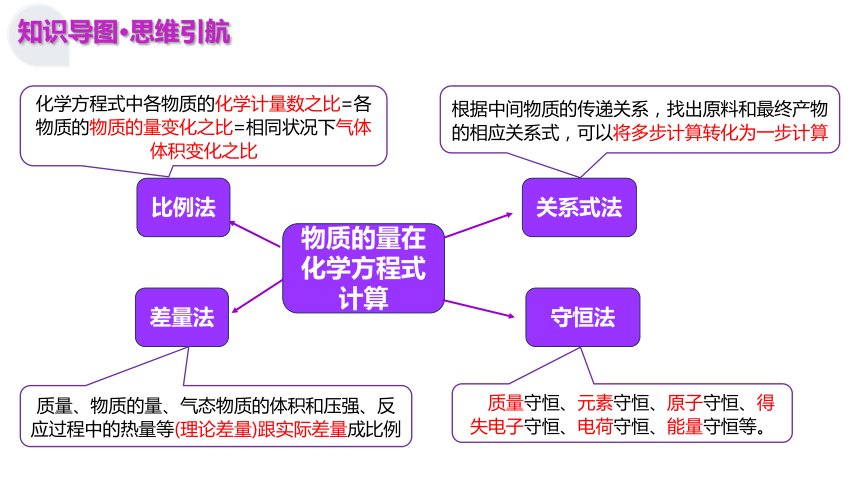
物质的量在化学方程式计算
差量法
知识导图·思维引航
根据中间物质的传递关系,找出原料和最终产物的相应关系式,可以将多步计算转化为一步计算
守恒法
比例法
关系式法
质量、物质的量、气态物质的体积和压强、反应过程中的热量等(理论差量)跟实际差量成比例
如质量守恒、元素守恒、原子守恒、得失电子守恒、电荷守恒、能量守恒等。
化学方程式中各物质的化学计量数之比=各物质的物质的量变化之比=相同状况下气体体积变化之比
1
2
考点一 物质的量在化学方程式计算中应用
考点二 化学计算的常用方法
考点突破·考法探究
考点一 物质的量在化学方程式计算中应用
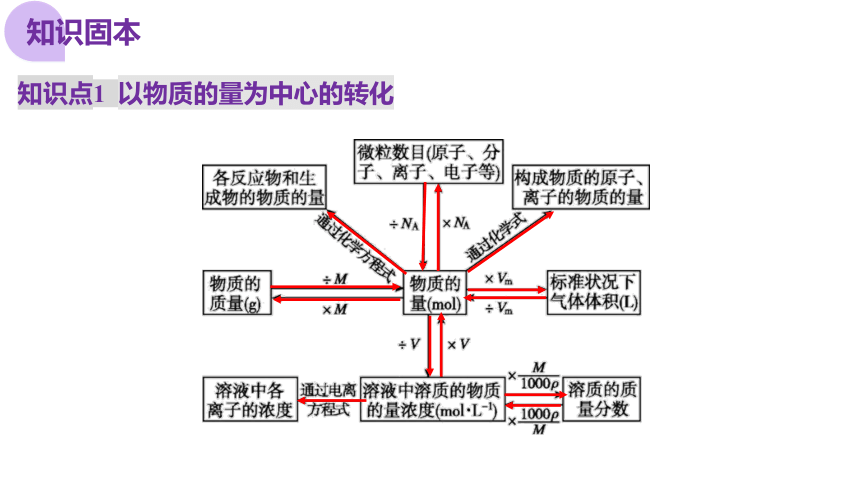
知识点1 以物质的量为中心的转化
知识固本
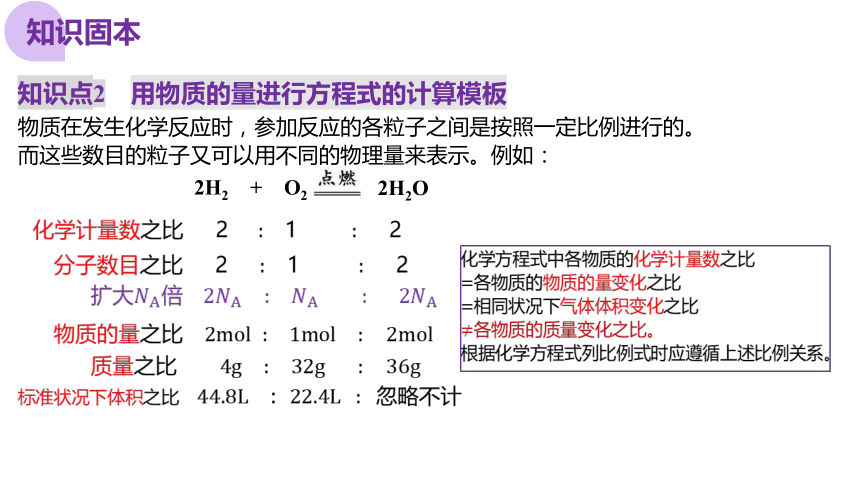
知识点2 用物质的量进行方程式的计算模板
知识固本
物质在发生化学反应时,参加反应的各粒子之间是按照一定比例进行的。
而这些数目的粒子又可以用不同的物理量来表示。例如:
2H2 + O2
2H2O
化学计量数之比 2 1 2
分子数目之比 2 1 2
扩大倍
物质的量之比
质量之比
标准状况下体积之比
化学方程式中各物质的化学计量数之比
各物质的物质的量变化之比
相同状况下气体体积变化之比
各物质的质量变化之比。
根据化学方程式列比例式时应遵循上述比例关系。
知识固本
【方法技巧】
物质的量应用于化学方程式计算类的解题步骤
(1)“审”:审清题目条件和题目要求。
(2)“设”:设出的未知数直接用各物理量的符号表示,并且不带单位。
(3)“写”:依据题意写出并配平化学方程式。
(4)“标”:在化学方程式中有关物质的化学式下面标出已知物质和所求物质有关物
理量的关系,并代入已知量和未知量。比较复杂的数量关系可先化简。
(5)“列”:将有关的几个量列出比例式。
(6)“解”:根据上述比例式求解未知数。
(7)“答”:根据题目要求简明地写出答案。
考向 根据化学方程式进行计算
考向洞察
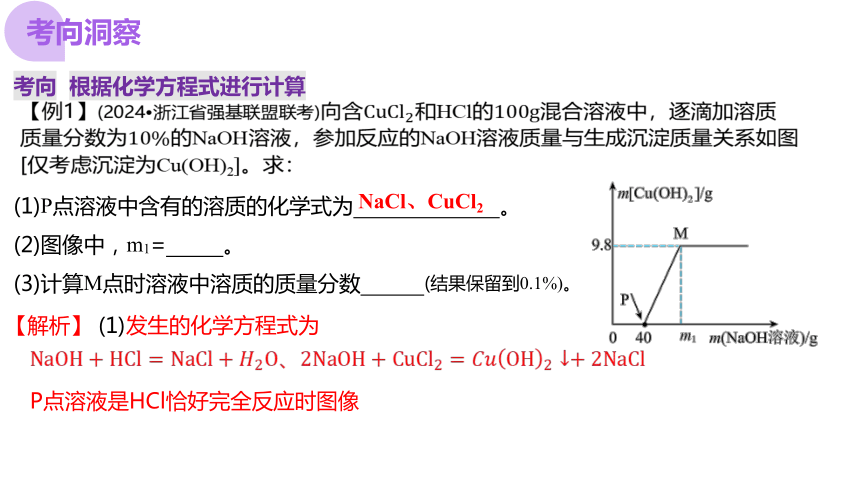
【例1】(2024 浙江省强基联盟联考)向含和HCl的混合溶液中,逐滴加溶质
质量分数为的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图
[仅考虑沉淀为 。求:
(1)P点溶液中含有的溶质的化学式为 。
(2)图像中,m1= 。
(3)计算M点时溶液中溶质的质量分数 (结果保留到0.1%)。
NaCl、CuCl2
【解析】 (1)
发生的化学方程式为
P点溶液是HCl恰好完全反应时图像
考向 根据化学方程式进行计算
考向洞察
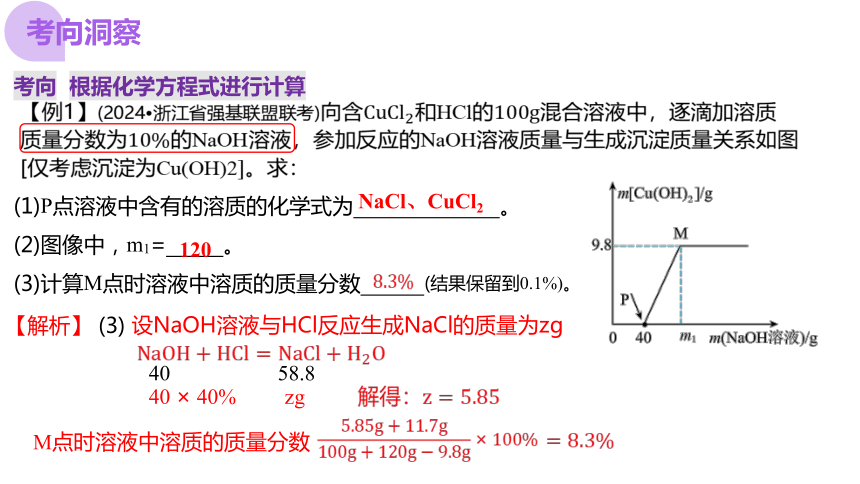
【例1】(2024 浙江省强基联盟联考)向含和HCl的混合溶液中,逐滴加溶质
质量分数为的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图
[仅考虑沉淀为 。求:
(1)P点溶液中含有的溶质的化学式为 。
(2)图像中,m1= 。
(3)计算M点时溶液中溶质的质量分数 (结果保留到0.1%)。
NaCl、CuCl2
120
【解析】 (2)
设与溶液反应的NaOH的质量为xg,生成NaCl的质量为yg
80 98 117
xg 9.8g yg
解得:
考向 根据化学方程式进行计算
考向洞察
【例1】(2024 浙江省强基联盟联考)向含和HCl的混合溶液中,逐滴加溶质
质量分数为的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图
[仅考虑沉淀为 。求:
(1)P点溶液中含有的溶质的化学式为 。
(2)图像中,m1= 。
(3)计算M点时溶液中溶质的质量分数 (结果保留到0.1%)。
NaCl、CuCl2
120
【解析】 (3)
40 58.8
40 × 40% zg
解得:
设NaOH溶液与HCl反应生成NaCl的质量为zg
M点时溶液中溶质的质量分数
考向洞察
【名师点睛】
1.书写格式规范化:在根据化学方程式计算的过程中,各物理量、物质名称、公式
等尽量用符号表示,且数据的运算要公式化并带单位。
如“M”表示摩尔质量,而“m”表示质量,“N”表示微粒数,而“n”表示物质的量。
2.单位运用对应化:根据化学方程式计算时,如果题目所给的两个量单位不一致,
要注意两个量的单位要“上下一致,左右相当”。
3.如果两种反应物的量都是已知的,求解某种产物的量时,必须先判断哪种过量。
考向洞察
【变式训练】一块表面已被氧化为氧化钠的钠块,投入水中,
最多能产生气体,则:
(1)涉及的化学方程式为 , 。
(2)钠块中钠的质量是 g。
(3)钠块中氧化钠的质量是 g。
(4)原来钠块中被氧化的钠的质量是 g。
(5)设所得溶液的体积为50 mL,求所得溶液溶质物质的量浓度是 。
2Na+2H2O=2NaOH+H2↑ Na2O+H2O=2NaOH
2Na+2H2O=2NaOH+H2↑
【解析】(2)
46 2
m(Na) 0.2 g
解得m(Na)=4.6 g
m(Na2O)=17.0 g-4.6 g=12.4 g
4.6
12.4
考向洞察
【变式训练】一块表面已被氧化为氧化钠的钠块,投入水中,
最多能产生气体,则:
(1)涉及的化学方程式为 , 。
(2)钠块中钠的质量是 g。
(3)钠块中氧化钠的质量是 g。
(4)原来钠块中被氧化的钠的质量是 g。
(5)设所得溶液的体积为50 mL,求所得溶液溶质物质的量浓度是 。
2Na+2H2O=2NaOH+H2↑ Na2O+H2O=2NaOH
【解析】(4)
4.6
12.4
,则被氧化成氧化钠的金属钠的质量;
9.2
【解析】(5)
原样品中钠元素的质量
合
根据钠守恒得,溶液中NaOH的物质的量
c(NaOH)=
考点二 化学计算的常用方法
知识固本
知识点1 守恒法
1.含义:所谓“守恒”就是物质在发生“变化”或两物质在发生“相互作用”的过程中
某些物理量的总量保持“不变”。
在化学变化中的各种各样的守恒,
如质量守恒、元素守恒、原子守恒、得失电子守恒、电荷守恒、能量守恒等。
知识固本
知识点1 守恒法
2.守恒类型
解题时可利用 ①整体守恒:即反应中反应物的总质量与生成物的总质量守恒;
②局部守恒:即反应中反应物与产物中某元素的原子或离子守恒或元素守恒。
→ 依据电解质溶液呈电中性,即阳离子所带正电荷总数等于阴离子所带负电荷总数
或离子方程式前后离子所带电荷总数不变。
(1)质量守恒(原子守恒)
→ 依据化学反应的实质是原子的重新组合,因而反应前后原子的总数和质量保持不变。
(2)电荷守恒
利用电荷守恒法可以①配平离子方程式;②巧解某些化学计算题。
知识固本
知识点1 守恒法
2.守恒类型
(3)得失电子守恒关系式
→依据氧化还原反应中电子得失数目相等,
即氧化剂得到的电子总数目等于还原剂失去的电子总数目。
利用得失电子守恒法可以
①计算元素的化合价;②计算氧化(或还原)产物的量;
③计算氧化剂、还原剂的消耗量;④计算混合物的组成。
【思维建模】
第一步:明确题目要求解的量;
第二步:根据题目要求解的量,分析反应过程中物质的变化,找出守恒类型及相关的量;
第三步:根据守恒原理,梳理出反应前后守恒的量,列式求解。
知识固本
知识点2 差量法
1.含义:差量法是指根据化学反应前后有关物理量发生的变化,找出“理论差量”。
这种物理量可以是质量、物质的量、气态物质的体积和压强、反应过程中的热量等。
用差量法解题时先把化学方程式中的对应差量(理论差量)跟实际差量列成比例,然后求解。
2.差量类型
(1)气体体积差量
(2)气体质量差量
(3)液-液质量差量
(4)固-液质量差量
(5)气-液质量差量
(6)气-固质量差量
(7)溶解度差量
知识固本
知识点2 差量法
【注意事项】
①可表示物质的质量、物质的量、气体体积等,
因而差量可指质量之差、物质的量之差或气体体积之差等。
②分清“差量”是增还是减。在较复杂的情况,存在多个反应,可能差量的增减方向
并不一致,这就要取其代数和。若方向相同,则总差量等于各个分差量之和。
③正确分析形成差量的原因,找出对应的根据方程式得出的“理论差量”是差量法解题的关键。
知识固本
知识点2 差量法
【思维建模】
第一步:准确写出有关反应的化学方程式;
第三步:根据反应方程式,从“实际差量”寻找比例关系,列比例式求解。
第二步:深入细致地分析题意,关键在于有针对性地找出产生差量的“对象”及“理论差量”。该“理论差量”可以是质量、物质的量、气体体积、压强等,且该差量的大小与参加反应的物质的有关量成正比;
知识固本
知识点3 关系式法
1.含义:关系式法是一种巧妙利用已知量与未知量之间关系进行解题的一种方法。
→ 利用关系式法免去逐步计算中的麻烦,简化解题步骤,减少运算量,且计算结果不易出错,准确率高。
→ 一般适用于多步进行的连续反应,因前一个反应的产物是后一个反应的反应物,可以根据中间物质的传递关系,找出原料和最终产物的相应关系式。
知识固本
知识点3 关系式法
2.关系式建立的类型
(1)有关化学方程式的计量数关系式:
(2)原子守恒关系式:
(3)得失电子守恒关系式:根据氧化剂和还原剂得失守恒建立关系式,再进行一步计算。
在化学反应中,任何一种元素的总质量是守恒的,即最初反应物中该元素的质量等于最终产物中该元素的质量。
各步反应的化学方程式,找出最初反应物与最终生成物的物质的量的关系式,再进行一步计算。
知识固本
知识点3 关系式法
3.一般解题步骤如下:
【思维建模】
方法1:
第一步:准确写出各步反应的化学方程式;
第二步:找出“中介”的物质,并确定最初反应物、中介物质、最终生成物之间量的关系;
第三步:确定最初反应物和最终生成物之间量的关系;
方法2:利用电子守恒或原子守恒直接确定关系式,然后列比例进行求算。
第四步:根据已知条件及关系式列出比例式计算求解。
考向洞察
考向1 守恒法在化学计算中的应用
【例1】大气污染物中的氮氧化物可用NaOH溶液吸收,发生如下反应:
NO2+NO+2NaOH=2NaNO2+H2O
2NO2+2NaOH=NaNO2+NaNO3+H2O
请计算:
(1)若33.6 mL(折算为标准状况下)氮氧化物(只含NO和NO2)与V mL 0.500 mol·L-1 NaOH溶液恰好完全反应,则V=______mL。
(2)若V(NO)∶V(NO2)=5∶1,与x mol O2混合,能与60.0 mL 1.00 mol·L-1 NaOH溶液恰好完全反应全部转变成NaNO3,则x=______。
1.5×10-3 mol
产物中N和Na原子的个数比1:1
→则消耗NaOH的物质的量为1.5×10-3 mol
3.00
n(NaOH)=0.06 mol
①元素质量守恒有n(NO)+n(NO2)=n(NaNO3)=0.06 mol,
→n(NO)∶n(NO2)=V(NO)∶V(NO2)=5∶1
故n(NO)=0.05 mol,n(NO2)=0.01 mol
②得失电子守恒
0.05 mol×3+0.01 mol×1=x mol×4
则x mol=0.04 mol
0.04
失电子:NO N、 N;
得电子: 2
考向洞察
【思维建模】
原理 所谓“守恒”就是物质在发生“变化”或两物质在发生“相互作用”的过程中,某些物理量的总量保持“不变”。 在化学变化中有各种各样的守恒,如质量守恒、原子守恒、得失电子守恒、电荷守恒等
步骤 第一步 明确题目要求解的量
第二步 根据题目中要求解的量,分析反应过程中物
质的变化,找出守恒类型及相关的量
第三步 根据守恒原理,梳理出反应前后守恒的量,
列式计算求解
考向洞察
【变式训练】将13.6gFe、Fe2O3和CuO的混合粉末加入到100ml一定物质的量浓度
的盐酸中,充分反应,生成标准状况下的氢气为896ml,过滤、滤渣经洗涤、干燥
后得到1.28g固体纯净物,经检验滤液中只含有一种溶质,请回答:
(1)固体中混合物中CuO的质量为______。
(2)盐酸的浓度为_____________。
1.60g
因反应后滤液中只含有一种溶质,应为FeCl2
【解析】(1)
得到的1.28g固体纯净物为Cu
n(Cu)=0.02mol
由CuO~Cu,得CuO的质量为1.60g
应为FeCl2
0.04molH2
考向洞察
【变式训练】将13.6gFe、Fe2O3和CuO的混合粉末加入到100ml一定物质的量浓度
的盐酸中,充分反应,生成标准状况下的氢气为896ml,过滤、滤渣经洗涤、干燥
后得到1.28g固体纯净物,经检验滤液中只含有一种溶质,请回答:
(1)固体中混合物中CuO的质量为______。
(2)盐酸的浓度为_____________。
3.60mol·L-1
1.60g
【解析】(2)
0.04molH2
设Fe、Fe2O3物质的量分别为xmol、ymol
①质量关系:56x+160y+1.60=13.6
②电子得失守恒:2x=2y+2×0.02+0.04×2
解得 x=0.10mol、y=0.04mol
应为FeCl2
反应后滤液中n(FeCl2)= x+2y =0.18mol
根据FeCl2~2HCl得,n(HCl)=0.36mol,
→c(HCl)=0.36mol/0.10L=3.60mol·L-1。
考向洞察
考向2 差量法在化学计算中的应用
【例2】取7.90 g KMnO4,加热分解后剩余固体7.42 g。该剩余固体与足量的浓盐酸在
加热条件下充分反应,生成单质气体A,产物中锰元素以Mn2+形式存在。请计算:
(1)的分解率为_______。
2KMnO4 K2MnO4+MnO2+O2↑ Δm(固)
(2×158) g 32 g
m 7.90 g-7.42 g
【解析】
解得m=4.74 g
即KMnO4的分解率为
60.0%
Cl2
KMnO4、K2MnO4、MnO2
考向洞察
考向2 差量法在化学计算中的应用
【例2】取7.90 g KMnO4,加热分解后剩余固体7.42 g。该剩余固体与足量的浓盐酸在
加热条件下充分反应,生成单质气体A,产物中锰元素以Mn2+形式存在。请计算:
(2)气体A的物质的量为_______。
【解析】
根据上述反应可知剩余固体中含 KMnO4 为
生成K2MnO4、MnO2均为0.015 mol
关系式 2KMnO4~5Cl2、K2MnO4~2Cl2、MnO2~Cl2
Cl2
KMnO4、K2MnO4、MnO2
0.05 mol、0.03 mol和0.015 mol
0.015
0.015
与浓盐酸反应生成的Cl2分别为
合0.095 mol
0.095 mol
考向洞察
【思维建模】
差量法是指根据化学反应前后物质的相关量发生的变化,找出“理论差量”。
这种差量可以是质量、物质的量、气态物质的体积和压强、反应过程中的热量等。
用差量法解题时先把化学方程式中对应的理论差量跟实际差量列成比例,然后求解。如:
2C(s)+ O2(g) 2CO(g) Δm(固) Δn(气) ΔV(气)
2 mol 1 mol 2 mol 24 g 1 mol 22.4 L(标准状况)
【变式训练】200℃时将 16.0g NaOH 和 NaHCO3 的混合物放在密闭容器中加热到质量不再减少为止,称得剩余固体质量为 14.8g,试回答:
(1)剩余固体的化学式是 。
(2)原混合物中 NaOH 的质量分数 。
NaOH 、Na2CO3
可能的反应有:NaOH+NaHCO3 Na2CO3+H2O、2NaHCO3 Na2CO3+CO2↑+H2O
假设NaOH与NaHCO3恰好完全反应,则:
NaOH+NaHCO3 Na2CO3+H2O
40 84 18
△m
x y 16g-14.8g=1.2g
x=2.67g
y=5.6g
因x+y<16g,故16gNaOH和NaHCO3固体混合物不能恰好反应
由于NaHCO3受热能分解,NaOH不能,因而过量物质为NaOH
由上述分析可知剩余固体物质是NaOH 、Na2CO3
考向洞察
,存在过量问题
【变式训练】200℃时将 16.0g NaOH 和 NaHCO3 的混合物放在密闭容器中加热到质量不再减少为止,称得剩余固体质量为 14.8g,试回答:
(1)剩余固体的化学式是 。
(2)原混合物中 NaOH 的质量分数 。
65%
NaOH 、Na2CO3
考向洞察
→原混合物中,
因此原混合物中NaOH的质量分数为10.4g/16g×100%=65%
【解析】(2)
由上述分析可知只发生反应:
NaOH+NaHCO3 Na2CO3+H2O
且NaHCO3质量为5.6g
考向洞察
考向3 关系式法在化学计算中的应用
【例3】称取CuO和Fe2O3固体混合物,加入的硫酸充分溶解,
往所得溶液中加入铁粉,充分反应后,得固体的质量为。请计算:
(1)加入铁粉充分反应后,溶液中溶质的物质的量__________。
(2)固体混合物中CuO的质量______。
0.100 mol
0.100 mol
0.100 mol
Fe2O3、CuO混合物加入硫酸充分反应后,再加入铁粉,剩余固体有两种可能
【解析】
第1种为单质,第2种为 Fe、Cu 混合物
根据溶液中SO42-守恒,所得溶质的物质的量为0.100 mol
而加入溶液体系中的铁元素(氧化铁、铁粉)总物质的量大于0.100 mol,
故可以判断加入铁粉有剩余,
剩余固体为 Fe、Cu 混合物
溶质为单一的FeSO4溶液
且n(FeSO4)=n(H2SO4)=0.100 mol
考向洞察
考向3 关系式法在化学计算中的应用
【例3】称取CuO和Fe2O3固体混合物,加入的硫酸充分溶解,
往所得溶液中加入铁粉,充分反应后,得固体的质量为。请计算:
(1)加入铁粉充分反应后,溶液中溶质的物质的量__________。
(2)固体混合物中CuO的质量______。
2.40 g
0.100 mol
0.100 mol
0.100 mol
【解析】
(2)设Fe2O3为x mol,CuO为y mol
①质量守恒:160x+80y=4.00
②整个体系中金属元素守恒:56×2x+64y+5.60=0.100×56+3.04
解方程得x=0.01,y=0.03
故CuO质量为2.40 g
考向洞察
【思维建模】
考向洞察
【变式训练】铜是人类发现最早并广泛使用的一种金属。溶液中Cu2+的浓度可采用
碘量法测得:
①2Cu2++5I-=2CuI↓+I3-,②I3-+2S2O32-=S4O62-+3I-
现取20.00 mL某含 Cu2+ 的溶液。加入足量的 KI 充分反应后,用0.100 0 mo1·L-1
的 Na2S2O3 标准溶液滴定至终点,消耗 Na2S2O3 溶液的体积如表所示。
序号 滴定前读数/mL 滴定终点读数/mL
1 0.00 25.10
2 1.26 26.16
3 1.54 27.74
(1)溶液中Cu2+的浓度为_________mol·L-1。
实验误差大,舍去
平均值是25.00 mL
消耗Na2S2O3溶液体积
关系式: 2C~~2S2
0.002 5 mol
0.002 5 mol
0.125 0
(2)用移液管量取20.00 mL Cu2+的溶液时俯视刻度线,最终测得的Cu2+的浓度将_______ (填“偏高”“偏低”或“无影响”)。
导致消耗Na2S2O3溶液的体积偏小
偏低
合0.002 5 mol
真题练习·命题洞见
1.(2022·浙江省6月选考, 联合生产是化学综合利用资源的有效方法。煅烧石灰石反应:
CaCO3 (s) =CaO (s)+CO2(g) ΔH=+1.8×102kJ·mol 1,石灰石分解需要的能量由焦炭燃烧
提供。将石灰石与焦炭按一定比例混合于石灰窑中,连续鼓入空气,使焦炭完全燃烧
生成CO2,其热量有效利用率为。石灰窑中产生的富含CO2的窑气通入氨的氯化钠
饱和溶液中,40%的CO2最终转化为纯碱。已知:焦炭的热值为30 kJ·g-l (假设焦炭不含杂质)。
请回答:
(1)每完全分解100kg石灰石(含CaCO3 90%,杂质不参与反应),需要投料______kg焦炭。
【解析】
完全分解上述石灰石需要吸收的热量是
=162000kJ
所以需要投料焦炭的质量是
=10800g=10.8kg
10.8
真题练习·命题洞见
1.(2022·浙江省6月选考, 联合生产是化学综合利用资源的有效方法。煅烧石灰石反应:
CaCO3 (s) =CaO (s)+CO2(g) ΔH=+1.8×102kJ·mol 1,石灰石分解需要的能量由焦炭燃烧
提供。将石灰石与焦炭按一定比例混合于石灰窑中,连续鼓入空气,使焦炭完全燃烧
生成CO2,其热量有效利用率为。石灰窑中产生的富含CO2的窑气通入氨的氯化钠
饱和溶液中,40%的CO2最终转化为纯碱。已知:焦炭的热值为30 kJ·g-l (假设焦炭不含杂质)。
请回答:
【解析】
(2)每生产106kg纯碱,同时可获得____kgCaO(列式计算)。
根据(1)中计算可知消耗焦炭的物质的量是
=900mol
参加反应的 CaCO3物质的量是 900mol
即,参加反应的 CaCO3 和焦炭的物质的量之比为1:1
根据原子守恒可知生成CaO的质量是
=70kg
70
2.(2021·浙江1月选考, 玻璃仪器内壁残留的硫单质可用热KOH溶液洗涤除去,
发生如下反应
真题练习·命题洞见
3S+6KOH 2K2S+K2SO3+3H2O
(x-1)S+K2S K2Sx(x=2~6)
S+ K2SO3 K2S2O3
(1)0.480 g硫单质与V mL 1.00 mol·L-1热KOH溶液恰好完全反应,只生成K2S和K2SO3,则V=______。
请计算:
3S+6KOH 2K2S+K2SO3+3H2O
【解析】
0.015mol
则需要消耗KOH的物质的量n=2n(S)=0.03mol
30.0
故需要KOH溶液的体积
(2)2.560 g硫单质与60.0 mL 1.00 mol·L-1热KOH溶液恰好完全反应,只生成K2Sx和K2S2O3,则x=____。(写出计算过程)
2.(2021·浙江1月选考, 玻璃仪器内壁残留的硫单质可用热KOH溶液洗涤除去,
发生如下反应
真题练习·命题洞见
3S+6KOH 2K2S+K2SO3+3H2O
(x-1)S+K2S K2Sx(x=2~6)
S+ K2SO3 K2S2O3
请计算:
【解析】
(2x+2)S+6KOH 2K2Sx+K2S2O3+3H2O
2x+2
6
解得x=3
3
真题练习·命题洞见
3.(2020·浙江1月选考,为测定样品的纯度,用
硫酸溶解样品,定容至。取溶液,用标
准溶液滴定至终点。重复实验,数据如下:
序号 滴定前读数 滴定终点读数
1 0.00 19.98
2 1.26 22.40
3 1.54 21.56
已知:3MnO4-+5FeC2O4·2H2O+24H+=3Mn2++5Fe3++10CO2↑+22H2O
假设杂质不参加反应。
该样品中的质量分数是______保留小数点后一位);
写出简要计算过程:____________________________________________________
95.2
19.98mL
所用标准液
20.14mL
20.02mL
实验误差大,舍去
平均20.00mL
解析:根据关系式 3MnO4-~5FeC2O4·2H2O
。
真题练习·命题洞见
4.(2023 湖北省选择性考试, 学习小组探究了铜的氧化过程及铜的氧化物的组成。
回答下列问题:
(1)铜与浓硝酸反应的装置如下图,仪器A的名称为_________,装置B的作用为_______。
①具支试管
②防倒吸
铜和浓硝酸反应生成硝酸铜和NO2,
其中NO2易溶于水,需要防倒吸,
则装置B的作用为防倒吸;
【解析】
真题练习·命题洞见
4.(2023 湖北省选择性考试, 学习小组探究了铜的氧化过程及铜的氧化物的组成。
回答下列问题:
(2)铜与过量反应的探究如下:
实验②中 Cu 溶解的离子方程式为____________________________;产生的气体为_____。比较实验①和②,从氧化还原角度说明的作用是_______________________________。
Cu+H2O2+2H+= Cu2++2H2O
硫酸铜可以催化分解生成O2,则产生的气体为O2
【解析】
O2
既不是氧化剂,又不是还原剂
真题练习·命题洞见
4.(2023 湖北省选择性考试, 学习小组探究了铜的氧化过程及铜的氧化物的组成。
回答下列问题:
(2)铜与过量反应的探究如下:
(3)用足量NaOH处理实验②新制的溶液得到沉淀X,元素分析表明X为铜的氧化物,
提纯干燥后的X在惰性氛围下加热,完全分解为ng黑色氧化物Y,。X的化
学式为______。
【解析】在该反应中铜的质量
m(Cu)=n×
Y:CuO
因为
则
则X的化学式中:
则X为
CuO2
真题练习·命题洞见
4.(2023 湖北省选择性考试, 学习小组探究了铜的氧化过程及铜的氧化物的组成。
回答下列问题:
(4)取含X粗品杂质不参加反应)与过量的酸性KI完全反应后,调节溶液至弱酸性。
以淀粉为指示剂,用标准溶液滴定,滴定终点时消耗标准
溶液。(已知:标志滴定终点的现象
是 ,
粗品中X的相对含量为 。
X:CuO2
(1)滴定结束的时候,单质碘消耗完
【解析】
当滴加最后半滴标准溶液,溶液蓝色消失,且半分钟不恢复原来的颜色
关系式:CuO2~2I2~4S2O32-
(2)
n(CuO2)
=0.000375mol
粗品中X的相对含量为
。
72%
第03讲
讲师:xxx
物质的量在化学方程式计算中的应用
目录
CONTENTS
01
考情透视
02
知识导图
03
考点突破
04
真题练习
考点要求 考题统计 考情分析
无机计算 2022 浙江6月30题,4分;2022 浙江1月30题,4分;2021 浙江1月30题,4分;2020 浙江7月,4分;2022 浙江1月30题,4分; 近年来高考中考查化学计算的试题主要分成两类:一类是以选择题形式出现的小计算题,一类是以填空题出现的小综合计算题,一般意在考查元素化合物与化学实验、有机化合物基础知识相联系的综合问题。高考试题将以化工生产、科学实验为背景,强调计算与化学基本理论、化学变化过程、工业流程、化学实验等结合,突出思维能力的考查和数学工具的应用,体现计算为化学应用服务,强化对化学方程式的量化理解。
有机计算 2021 浙江6月30题,4分;2019 浙江4月30题,4分;
复习目标: 1.通过对化学方程式化学计量数意义的重新认识,完成对化学反应从微观到宏观认知的转变,明确化学计量数在不同层次的运算中的使用。 2.通过对物质的量在化学方程式中的应用,理解物质的量在高中化学计算的应用,建立高中使用物质的量及相关概念在方程式计算中的基本运用模型。 3.通过运用物质的量及相关物理量根据化学方程式进行简单计算,感受定量研究对化学科学的重要作用。
考情透视·目标导航
物质的量在化学方程式计算
差量法
知识导图·思维引航
根据中间物质的传递关系,找出原料和最终产物的相应关系式,可以将多步计算转化为一步计算
守恒法
比例法
关系式法
质量、物质的量、气态物质的体积和压强、反应过程中的热量等(理论差量)跟实际差量成比例
如质量守恒、元素守恒、原子守恒、得失电子守恒、电荷守恒、能量守恒等。
化学方程式中各物质的化学计量数之比=各物质的物质的量变化之比=相同状况下气体体积变化之比
1
2
考点一 物质的量在化学方程式计算中应用
考点二 化学计算的常用方法
考点突破·考法探究
考点一 物质的量在化学方程式计算中应用
知识点1 以物质的量为中心的转化
知识固本
知识点2 用物质的量进行方程式的计算模板
知识固本
物质在发生化学反应时,参加反应的各粒子之间是按照一定比例进行的。
而这些数目的粒子又可以用不同的物理量来表示。例如:
2H2 + O2
2H2O
化学计量数之比 2 1 2
分子数目之比 2 1 2
扩大倍
物质的量之比
质量之比
标准状况下体积之比
化学方程式中各物质的化学计量数之比
各物质的物质的量变化之比
相同状况下气体体积变化之比
各物质的质量变化之比。
根据化学方程式列比例式时应遵循上述比例关系。
知识固本
【方法技巧】
物质的量应用于化学方程式计算类的解题步骤
(1)“审”:审清题目条件和题目要求。
(2)“设”:设出的未知数直接用各物理量的符号表示,并且不带单位。
(3)“写”:依据题意写出并配平化学方程式。
(4)“标”:在化学方程式中有关物质的化学式下面标出已知物质和所求物质有关物
理量的关系,并代入已知量和未知量。比较复杂的数量关系可先化简。
(5)“列”:将有关的几个量列出比例式。
(6)“解”:根据上述比例式求解未知数。
(7)“答”:根据题目要求简明地写出答案。
考向 根据化学方程式进行计算
考向洞察
【例1】(2024 浙江省强基联盟联考)向含和HCl的混合溶液中,逐滴加溶质
质量分数为的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图
[仅考虑沉淀为 。求:
(1)P点溶液中含有的溶质的化学式为 。
(2)图像中,m1= 。
(3)计算M点时溶液中溶质的质量分数 (结果保留到0.1%)。
NaCl、CuCl2
【解析】 (1)
发生的化学方程式为
P点溶液是HCl恰好完全反应时图像
考向 根据化学方程式进行计算
考向洞察
【例1】(2024 浙江省强基联盟联考)向含和HCl的混合溶液中,逐滴加溶质
质量分数为的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图
[仅考虑沉淀为 。求:
(1)P点溶液中含有的溶质的化学式为 。
(2)图像中,m1= 。
(3)计算M点时溶液中溶质的质量分数 (结果保留到0.1%)。
NaCl、CuCl2
120
【解析】 (2)
设与溶液反应的NaOH的质量为xg,生成NaCl的质量为yg
80 98 117
xg 9.8g yg
解得:
考向 根据化学方程式进行计算
考向洞察
【例1】(2024 浙江省强基联盟联考)向含和HCl的混合溶液中,逐滴加溶质
质量分数为的NaOH溶液,参加反应的NaOH溶液质量与生成沉淀质量关系如图
[仅考虑沉淀为 。求:
(1)P点溶液中含有的溶质的化学式为 。
(2)图像中,m1= 。
(3)计算M点时溶液中溶质的质量分数 (结果保留到0.1%)。
NaCl、CuCl2
120
【解析】 (3)
40 58.8
40 × 40% zg
解得:
设NaOH溶液与HCl反应生成NaCl的质量为zg
M点时溶液中溶质的质量分数
考向洞察
【名师点睛】
1.书写格式规范化:在根据化学方程式计算的过程中,各物理量、物质名称、公式
等尽量用符号表示,且数据的运算要公式化并带单位。
如“M”表示摩尔质量,而“m”表示质量,“N”表示微粒数,而“n”表示物质的量。
2.单位运用对应化:根据化学方程式计算时,如果题目所给的两个量单位不一致,
要注意两个量的单位要“上下一致,左右相当”。
3.如果两种反应物的量都是已知的,求解某种产物的量时,必须先判断哪种过量。
考向洞察
【变式训练】一块表面已被氧化为氧化钠的钠块,投入水中,
最多能产生气体,则:
(1)涉及的化学方程式为 , 。
(2)钠块中钠的质量是 g。
(3)钠块中氧化钠的质量是 g。
(4)原来钠块中被氧化的钠的质量是 g。
(5)设所得溶液的体积为50 mL,求所得溶液溶质物质的量浓度是 。
2Na+2H2O=2NaOH+H2↑ Na2O+H2O=2NaOH
2Na+2H2O=2NaOH+H2↑
【解析】(2)
46 2
m(Na) 0.2 g
解得m(Na)=4.6 g
m(Na2O)=17.0 g-4.6 g=12.4 g
4.6
12.4
考向洞察
【变式训练】一块表面已被氧化为氧化钠的钠块,投入水中,
最多能产生气体,则:
(1)涉及的化学方程式为 , 。
(2)钠块中钠的质量是 g。
(3)钠块中氧化钠的质量是 g。
(4)原来钠块中被氧化的钠的质量是 g。
(5)设所得溶液的体积为50 mL,求所得溶液溶质物质的量浓度是 。
2Na+2H2O=2NaOH+H2↑ Na2O+H2O=2NaOH
【解析】(4)
4.6
12.4
,则被氧化成氧化钠的金属钠的质量;
9.2
【解析】(5)
原样品中钠元素的质量
合
根据钠守恒得,溶液中NaOH的物质的量
c(NaOH)=
考点二 化学计算的常用方法
知识固本
知识点1 守恒法
1.含义:所谓“守恒”就是物质在发生“变化”或两物质在发生“相互作用”的过程中
某些物理量的总量保持“不变”。
在化学变化中的各种各样的守恒,
如质量守恒、元素守恒、原子守恒、得失电子守恒、电荷守恒、能量守恒等。
知识固本
知识点1 守恒法
2.守恒类型
解题时可利用 ①整体守恒:即反应中反应物的总质量与生成物的总质量守恒;
②局部守恒:即反应中反应物与产物中某元素的原子或离子守恒或元素守恒。
→ 依据电解质溶液呈电中性,即阳离子所带正电荷总数等于阴离子所带负电荷总数
或离子方程式前后离子所带电荷总数不变。
(1)质量守恒(原子守恒)
→ 依据化学反应的实质是原子的重新组合,因而反应前后原子的总数和质量保持不变。
(2)电荷守恒
利用电荷守恒法可以①配平离子方程式;②巧解某些化学计算题。
知识固本
知识点1 守恒法
2.守恒类型
(3)得失电子守恒关系式
→依据氧化还原反应中电子得失数目相等,
即氧化剂得到的电子总数目等于还原剂失去的电子总数目。
利用得失电子守恒法可以
①计算元素的化合价;②计算氧化(或还原)产物的量;
③计算氧化剂、还原剂的消耗量;④计算混合物的组成。
【思维建模】
第一步:明确题目要求解的量;
第二步:根据题目要求解的量,分析反应过程中物质的变化,找出守恒类型及相关的量;
第三步:根据守恒原理,梳理出反应前后守恒的量,列式求解。
知识固本
知识点2 差量法
1.含义:差量法是指根据化学反应前后有关物理量发生的变化,找出“理论差量”。
这种物理量可以是质量、物质的量、气态物质的体积和压强、反应过程中的热量等。
用差量法解题时先把化学方程式中的对应差量(理论差量)跟实际差量列成比例,然后求解。
2.差量类型
(1)气体体积差量
(2)气体质量差量
(3)液-液质量差量
(4)固-液质量差量
(5)气-液质量差量
(6)气-固质量差量
(7)溶解度差量
知识固本
知识点2 差量法
【注意事项】
①可表示物质的质量、物质的量、气体体积等,
因而差量可指质量之差、物质的量之差或气体体积之差等。
②分清“差量”是增还是减。在较复杂的情况,存在多个反应,可能差量的增减方向
并不一致,这就要取其代数和。若方向相同,则总差量等于各个分差量之和。
③正确分析形成差量的原因,找出对应的根据方程式得出的“理论差量”是差量法解题的关键。
知识固本
知识点2 差量法
【思维建模】
第一步:准确写出有关反应的化学方程式;
第三步:根据反应方程式,从“实际差量”寻找比例关系,列比例式求解。
第二步:深入细致地分析题意,关键在于有针对性地找出产生差量的“对象”及“理论差量”。该“理论差量”可以是质量、物质的量、气体体积、压强等,且该差量的大小与参加反应的物质的有关量成正比;
知识固本
知识点3 关系式法
1.含义:关系式法是一种巧妙利用已知量与未知量之间关系进行解题的一种方法。
→ 利用关系式法免去逐步计算中的麻烦,简化解题步骤,减少运算量,且计算结果不易出错,准确率高。
→ 一般适用于多步进行的连续反应,因前一个反应的产物是后一个反应的反应物,可以根据中间物质的传递关系,找出原料和最终产物的相应关系式。
知识固本
知识点3 关系式法
2.关系式建立的类型
(1)有关化学方程式的计量数关系式:
(2)原子守恒关系式:
(3)得失电子守恒关系式:根据氧化剂和还原剂得失守恒建立关系式,再进行一步计算。
在化学反应中,任何一种元素的总质量是守恒的,即最初反应物中该元素的质量等于最终产物中该元素的质量。
各步反应的化学方程式,找出最初反应物与最终生成物的物质的量的关系式,再进行一步计算。
知识固本
知识点3 关系式法
3.一般解题步骤如下:
【思维建模】
方法1:
第一步:准确写出各步反应的化学方程式;
第二步:找出“中介”的物质,并确定最初反应物、中介物质、最终生成物之间量的关系;
第三步:确定最初反应物和最终生成物之间量的关系;
方法2:利用电子守恒或原子守恒直接确定关系式,然后列比例进行求算。
第四步:根据已知条件及关系式列出比例式计算求解。
考向洞察
考向1 守恒法在化学计算中的应用
【例1】大气污染物中的氮氧化物可用NaOH溶液吸收,发生如下反应:
NO2+NO+2NaOH=2NaNO2+H2O
2NO2+2NaOH=NaNO2+NaNO3+H2O
请计算:
(1)若33.6 mL(折算为标准状况下)氮氧化物(只含NO和NO2)与V mL 0.500 mol·L-1 NaOH溶液恰好完全反应,则V=______mL。
(2)若V(NO)∶V(NO2)=5∶1,与x mol O2混合,能与60.0 mL 1.00 mol·L-1 NaOH溶液恰好完全反应全部转变成NaNO3,则x=______。
1.5×10-3 mol
产物中N和Na原子的个数比1:1
→则消耗NaOH的物质的量为1.5×10-3 mol
3.00
n(NaOH)=0.06 mol
①元素质量守恒有n(NO)+n(NO2)=n(NaNO3)=0.06 mol,
→n(NO)∶n(NO2)=V(NO)∶V(NO2)=5∶1
故n(NO)=0.05 mol,n(NO2)=0.01 mol
②得失电子守恒
0.05 mol×3+0.01 mol×1=x mol×4
则x mol=0.04 mol
0.04
失电子:NO N、 N;
得电子: 2
考向洞察
【思维建模】
原理 所谓“守恒”就是物质在发生“变化”或两物质在发生“相互作用”的过程中,某些物理量的总量保持“不变”。 在化学变化中有各种各样的守恒,如质量守恒、原子守恒、得失电子守恒、电荷守恒等
步骤 第一步 明确题目要求解的量
第二步 根据题目中要求解的量,分析反应过程中物
质的变化,找出守恒类型及相关的量
第三步 根据守恒原理,梳理出反应前后守恒的量,
列式计算求解
考向洞察
【变式训练】将13.6gFe、Fe2O3和CuO的混合粉末加入到100ml一定物质的量浓度
的盐酸中,充分反应,生成标准状况下的氢气为896ml,过滤、滤渣经洗涤、干燥
后得到1.28g固体纯净物,经检验滤液中只含有一种溶质,请回答:
(1)固体中混合物中CuO的质量为______。
(2)盐酸的浓度为_____________。
1.60g
因反应后滤液中只含有一种溶质,应为FeCl2
【解析】(1)
得到的1.28g固体纯净物为Cu
n(Cu)=0.02mol
由CuO~Cu,得CuO的质量为1.60g
应为FeCl2
0.04molH2
考向洞察
【变式训练】将13.6gFe、Fe2O3和CuO的混合粉末加入到100ml一定物质的量浓度
的盐酸中,充分反应,生成标准状况下的氢气为896ml,过滤、滤渣经洗涤、干燥
后得到1.28g固体纯净物,经检验滤液中只含有一种溶质,请回答:
(1)固体中混合物中CuO的质量为______。
(2)盐酸的浓度为_____________。
3.60mol·L-1
1.60g
【解析】(2)
0.04molH2
设Fe、Fe2O3物质的量分别为xmol、ymol
①质量关系:56x+160y+1.60=13.6
②电子得失守恒:2x=2y+2×0.02+0.04×2
解得 x=0.10mol、y=0.04mol
应为FeCl2
反应后滤液中n(FeCl2)= x+2y =0.18mol
根据FeCl2~2HCl得,n(HCl)=0.36mol,
→c(HCl)=0.36mol/0.10L=3.60mol·L-1。
考向洞察
考向2 差量法在化学计算中的应用
【例2】取7.90 g KMnO4,加热分解后剩余固体7.42 g。该剩余固体与足量的浓盐酸在
加热条件下充分反应,生成单质气体A,产物中锰元素以Mn2+形式存在。请计算:
(1)的分解率为_______。
2KMnO4 K2MnO4+MnO2+O2↑ Δm(固)
(2×158) g 32 g
m 7.90 g-7.42 g
【解析】
解得m=4.74 g
即KMnO4的分解率为
60.0%
Cl2
KMnO4、K2MnO4、MnO2
考向洞察
考向2 差量法在化学计算中的应用
【例2】取7.90 g KMnO4,加热分解后剩余固体7.42 g。该剩余固体与足量的浓盐酸在
加热条件下充分反应,生成单质气体A,产物中锰元素以Mn2+形式存在。请计算:
(2)气体A的物质的量为_______。
【解析】
根据上述反应可知剩余固体中含 KMnO4 为
生成K2MnO4、MnO2均为0.015 mol
关系式 2KMnO4~5Cl2、K2MnO4~2Cl2、MnO2~Cl2
Cl2
KMnO4、K2MnO4、MnO2
0.05 mol、0.03 mol和0.015 mol
0.015
0.015
与浓盐酸反应生成的Cl2分别为
合0.095 mol
0.095 mol
考向洞察
【思维建模】
差量法是指根据化学反应前后物质的相关量发生的变化,找出“理论差量”。
这种差量可以是质量、物质的量、气态物质的体积和压强、反应过程中的热量等。
用差量法解题时先把化学方程式中对应的理论差量跟实际差量列成比例,然后求解。如:
2C(s)+ O2(g) 2CO(g) Δm(固) Δn(气) ΔV(气)
2 mol 1 mol 2 mol 24 g 1 mol 22.4 L(标准状况)
【变式训练】200℃时将 16.0g NaOH 和 NaHCO3 的混合物放在密闭容器中加热到质量不再减少为止,称得剩余固体质量为 14.8g,试回答:
(1)剩余固体的化学式是 。
(2)原混合物中 NaOH 的质量分数 。
NaOH 、Na2CO3
可能的反应有:NaOH+NaHCO3 Na2CO3+H2O、2NaHCO3 Na2CO3+CO2↑+H2O
假设NaOH与NaHCO3恰好完全反应,则:
NaOH+NaHCO3 Na2CO3+H2O
40 84 18
△m
x y 16g-14.8g=1.2g
x=2.67g
y=5.6g
因x+y<16g,故16gNaOH和NaHCO3固体混合物不能恰好反应
由于NaHCO3受热能分解,NaOH不能,因而过量物质为NaOH
由上述分析可知剩余固体物质是NaOH 、Na2CO3
考向洞察
,存在过量问题
【变式训练】200℃时将 16.0g NaOH 和 NaHCO3 的混合物放在密闭容器中加热到质量不再减少为止,称得剩余固体质量为 14.8g,试回答:
(1)剩余固体的化学式是 。
(2)原混合物中 NaOH 的质量分数 。
65%
NaOH 、Na2CO3
考向洞察
→原混合物中,
因此原混合物中NaOH的质量分数为10.4g/16g×100%=65%
【解析】(2)
由上述分析可知只发生反应:
NaOH+NaHCO3 Na2CO3+H2O
且NaHCO3质量为5.6g
考向洞察
考向3 关系式法在化学计算中的应用
【例3】称取CuO和Fe2O3固体混合物,加入的硫酸充分溶解,
往所得溶液中加入铁粉,充分反应后,得固体的质量为。请计算:
(1)加入铁粉充分反应后,溶液中溶质的物质的量__________。
(2)固体混合物中CuO的质量______。
0.100 mol
0.100 mol
0.100 mol
Fe2O3、CuO混合物加入硫酸充分反应后,再加入铁粉,剩余固体有两种可能
【解析】
第1种为单质,第2种为 Fe、Cu 混合物
根据溶液中SO42-守恒,所得溶质的物质的量为0.100 mol
而加入溶液体系中的铁元素(氧化铁、铁粉)总物质的量大于0.100 mol,
故可以判断加入铁粉有剩余,
剩余固体为 Fe、Cu 混合物
溶质为单一的FeSO4溶液
且n(FeSO4)=n(H2SO4)=0.100 mol
考向洞察
考向3 关系式法在化学计算中的应用
【例3】称取CuO和Fe2O3固体混合物,加入的硫酸充分溶解,
往所得溶液中加入铁粉,充分反应后,得固体的质量为。请计算:
(1)加入铁粉充分反应后,溶液中溶质的物质的量__________。
(2)固体混合物中CuO的质量______。
2.40 g
0.100 mol
0.100 mol
0.100 mol
【解析】
(2)设Fe2O3为x mol,CuO为y mol
①质量守恒:160x+80y=4.00
②整个体系中金属元素守恒:56×2x+64y+5.60=0.100×56+3.04
解方程得x=0.01,y=0.03
故CuO质量为2.40 g
考向洞察
【思维建模】
考向洞察
【变式训练】铜是人类发现最早并广泛使用的一种金属。溶液中Cu2+的浓度可采用
碘量法测得:
①2Cu2++5I-=2CuI↓+I3-,②I3-+2S2O32-=S4O62-+3I-
现取20.00 mL某含 Cu2+ 的溶液。加入足量的 KI 充分反应后,用0.100 0 mo1·L-1
的 Na2S2O3 标准溶液滴定至终点,消耗 Na2S2O3 溶液的体积如表所示。
序号 滴定前读数/mL 滴定终点读数/mL
1 0.00 25.10
2 1.26 26.16
3 1.54 27.74
(1)溶液中Cu2+的浓度为_________mol·L-1。
实验误差大,舍去
平均值是25.00 mL
消耗Na2S2O3溶液体积
关系式: 2C~~2S2
0.002 5 mol
0.002 5 mol
0.125 0
(2)用移液管量取20.00 mL Cu2+的溶液时俯视刻度线,最终测得的Cu2+的浓度将_______ (填“偏高”“偏低”或“无影响”)。
导致消耗Na2S2O3溶液的体积偏小
偏低
合0.002 5 mol
真题练习·命题洞见
1.(2022·浙江省6月选考, 联合生产是化学综合利用资源的有效方法。煅烧石灰石反应:
CaCO3 (s) =CaO (s)+CO2(g) ΔH=+1.8×102kJ·mol 1,石灰石分解需要的能量由焦炭燃烧
提供。将石灰石与焦炭按一定比例混合于石灰窑中,连续鼓入空气,使焦炭完全燃烧
生成CO2,其热量有效利用率为。石灰窑中产生的富含CO2的窑气通入氨的氯化钠
饱和溶液中,40%的CO2最终转化为纯碱。已知:焦炭的热值为30 kJ·g-l (假设焦炭不含杂质)。
请回答:
(1)每完全分解100kg石灰石(含CaCO3 90%,杂质不参与反应),需要投料______kg焦炭。
【解析】
完全分解上述石灰石需要吸收的热量是
=162000kJ
所以需要投料焦炭的质量是
=10800g=10.8kg
10.8
真题练习·命题洞见
1.(2022·浙江省6月选考, 联合生产是化学综合利用资源的有效方法。煅烧石灰石反应:
CaCO3 (s) =CaO (s)+CO2(g) ΔH=+1.8×102kJ·mol 1,石灰石分解需要的能量由焦炭燃烧
提供。将石灰石与焦炭按一定比例混合于石灰窑中,连续鼓入空气,使焦炭完全燃烧
生成CO2,其热量有效利用率为。石灰窑中产生的富含CO2的窑气通入氨的氯化钠
饱和溶液中,40%的CO2最终转化为纯碱。已知:焦炭的热值为30 kJ·g-l (假设焦炭不含杂质)。
请回答:
【解析】
(2)每生产106kg纯碱,同时可获得____kgCaO(列式计算)。
根据(1)中计算可知消耗焦炭的物质的量是
=900mol
参加反应的 CaCO3物质的量是 900mol
即,参加反应的 CaCO3 和焦炭的物质的量之比为1:1
根据原子守恒可知生成CaO的质量是
=70kg
70
2.(2021·浙江1月选考, 玻璃仪器内壁残留的硫单质可用热KOH溶液洗涤除去,
发生如下反应
真题练习·命题洞见
3S+6KOH 2K2S+K2SO3+3H2O
(x-1)S+K2S K2Sx(x=2~6)
S+ K2SO3 K2S2O3
(1)0.480 g硫单质与V mL 1.00 mol·L-1热KOH溶液恰好完全反应,只生成K2S和K2SO3,则V=______。
请计算:
3S+6KOH 2K2S+K2SO3+3H2O
【解析】
0.015mol
则需要消耗KOH的物质的量n=2n(S)=0.03mol
30.0
故需要KOH溶液的体积
(2)2.560 g硫单质与60.0 mL 1.00 mol·L-1热KOH溶液恰好完全反应,只生成K2Sx和K2S2O3,则x=____。(写出计算过程)
2.(2021·浙江1月选考, 玻璃仪器内壁残留的硫单质可用热KOH溶液洗涤除去,
发生如下反应
真题练习·命题洞见
3S+6KOH 2K2S+K2SO3+3H2O
(x-1)S+K2S K2Sx(x=2~6)
S+ K2SO3 K2S2O3
请计算:
【解析】
(2x+2)S+6KOH 2K2Sx+K2S2O3+3H2O
2x+2
6
解得x=3
3
真题练习·命题洞见
3.(2020·浙江1月选考,为测定样品的纯度,用
硫酸溶解样品,定容至。取溶液,用标
准溶液滴定至终点。重复实验,数据如下:
序号 滴定前读数 滴定终点读数
1 0.00 19.98
2 1.26 22.40
3 1.54 21.56
已知:3MnO4-+5FeC2O4·2H2O+24H+=3Mn2++5Fe3++10CO2↑+22H2O
假设杂质不参加反应。
该样品中的质量分数是______保留小数点后一位);
写出简要计算过程:____________________________________________________
95.2
19.98mL
所用标准液
20.14mL
20.02mL
实验误差大,舍去
平均20.00mL
解析:根据关系式 3MnO4-~5FeC2O4·2H2O
。
真题练习·命题洞见
4.(2023 湖北省选择性考试, 学习小组探究了铜的氧化过程及铜的氧化物的组成。
回答下列问题:
(1)铜与浓硝酸反应的装置如下图,仪器A的名称为_________,装置B的作用为_______。
①具支试管
②防倒吸
铜和浓硝酸反应生成硝酸铜和NO2,
其中NO2易溶于水,需要防倒吸,
则装置B的作用为防倒吸;
【解析】
真题练习·命题洞见
4.(2023 湖北省选择性考试, 学习小组探究了铜的氧化过程及铜的氧化物的组成。
回答下列问题:
(2)铜与过量反应的探究如下:
实验②中 Cu 溶解的离子方程式为____________________________;产生的气体为_____。比较实验①和②,从氧化还原角度说明的作用是_______________________________。
Cu+H2O2+2H+= Cu2++2H2O
硫酸铜可以催化分解生成O2,则产生的气体为O2
【解析】
O2
既不是氧化剂,又不是还原剂
真题练习·命题洞见
4.(2023 湖北省选择性考试, 学习小组探究了铜的氧化过程及铜的氧化物的组成。
回答下列问题:
(2)铜与过量反应的探究如下:
(3)用足量NaOH处理实验②新制的溶液得到沉淀X,元素分析表明X为铜的氧化物,
提纯干燥后的X在惰性氛围下加热,完全分解为ng黑色氧化物Y,。X的化
学式为______。
【解析】在该反应中铜的质量
m(Cu)=n×
Y:CuO
因为
则
则X的化学式中:
则X为
CuO2
真题练习·命题洞见
4.(2023 湖北省选择性考试, 学习小组探究了铜的氧化过程及铜的氧化物的组成。
回答下列问题:
(4)取含X粗品杂质不参加反应)与过量的酸性KI完全反应后,调节溶液至弱酸性。
以淀粉为指示剂,用标准溶液滴定,滴定终点时消耗标准
溶液。(已知:标志滴定终点的现象
是 ,
粗品中X的相对含量为 。
X:CuO2
(1)滴定结束的时候,单质碘消耗完
【解析】
当滴加最后半滴标准溶液,溶液蓝色消失,且半分钟不恢复原来的颜色
关系式:CuO2~2I2~4S2O32-
(2)
n(CuO2)
=0.000375mol
粗品中X的相对含量为
。
72%
同课章节目录
