江西宜丰2015-2016学年化学必修一第四章《第一节 无机非金属材料的主角——硅》PPT课件(共71张PPT)
文档属性
| 名称 | 江西宜丰2015-2016学年化学必修一第四章《第一节 无机非金属材料的主角——硅》PPT课件(共71张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 4.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2016-02-14 16:22:12 | ||
图片预览










文档简介
(共71张PPT)
学习目标:
1、了解二氧化硅及硅酸的性质与应用
2、认识物质间既有相似性,又有各自的特性
重点: 二氧化硅的性质和硅酸的制备
难点: 二氧化硅的结构
价值5元的沙子
SiO2
Si
点沙成金
价值5000元的芯片
无机非金属材料的主角——硅(第一课时)
地球生物生存的根基——空气、水、阳、 硅酸盐
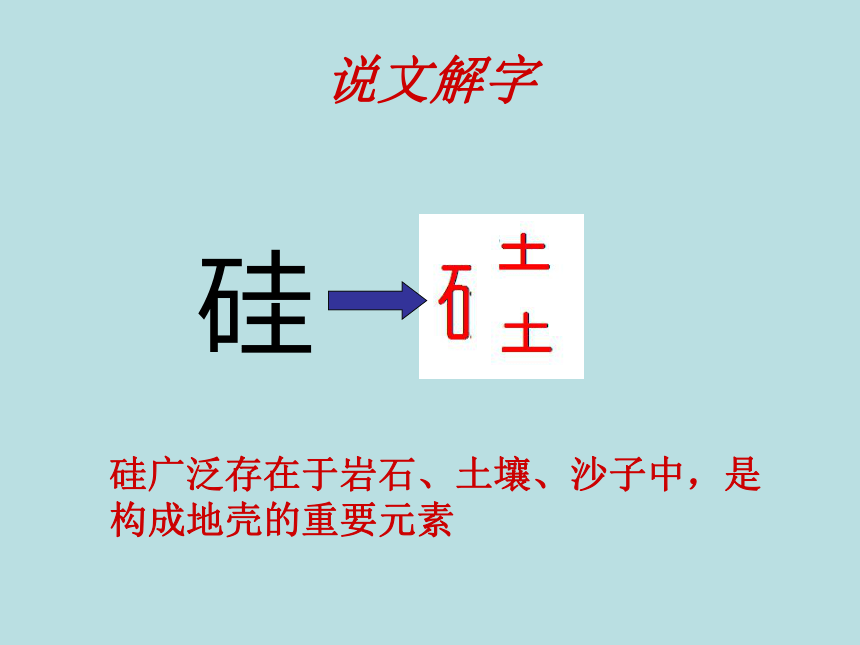
说文解字
硅
硅广泛存在于岩石、土壤、沙子中,是构成地壳的重要元素
秦砖汉瓦
秦始皇陵兵马俑
瓷器是中国最伟大的创造之一
美丽的玻璃雕花艺术
水
晶
玛瑙
现代建筑离不开玻璃的装饰和采光
东方明珠
为什么是主角呢?
含量高,仅次于氧
用途广泛
核心元素
?
硅
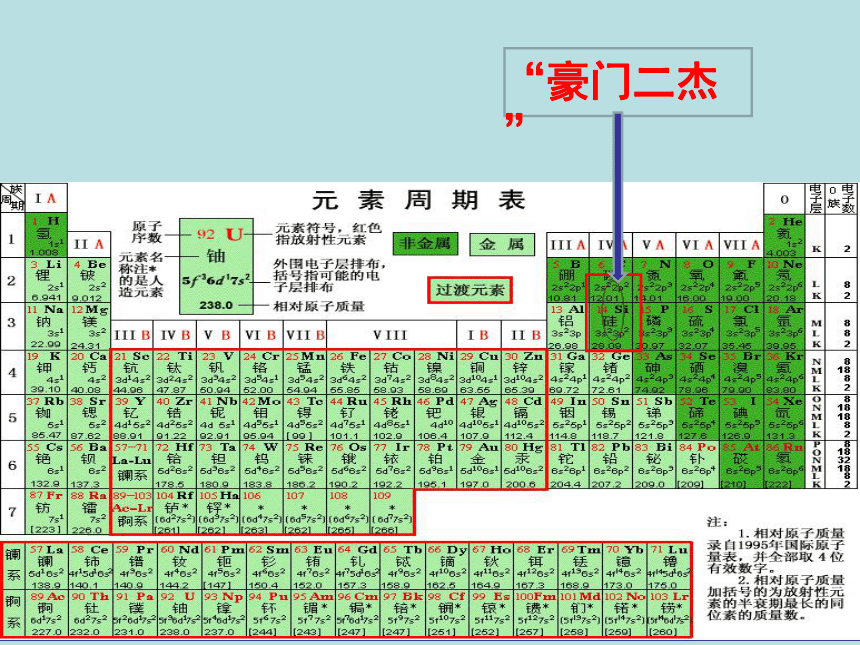
“豪门二杰”
C、Si 的原子结构示意图。
+14
+6
C
Si
硅原子既不易失去又不易得到电子,主要形成四价的化合物。
碳和硅都是亲氧元素,但是硅的亲氧能力更强
存在:没有游离态,只有化合态——二氧化硅、硅酸盐。
1、硅的工业制法 :
粗硅:
纯硅:
2C+ SiO2=== Si+2CO↑
高温
Si+2Cl2====SiCl4
SiCl4+2H2===Si+4HCl
高温
一、硅单质
2.物理性质
结构类似金刚石,为硬而脆的灰黑色固体, 熔点高,硬度大。
3.化学性质
在常温下化学性质不活泼
Si + O2 === SiO2
Si+2F2==SiF4
Si+4HF==SiF4↑+2H2↑
Si+2NaOH+H2O=Na2SiO3 +2H2↑
Si+2Cl2==SiCl4
4.用途
晶体硅的导电性介于导体和半导体之间,是良好的半导体材料,硅是信息技术的关键材料
硅太阳能电池
利用硅的半导体性能,制成光电池 ,将光能转化为电能。
太阳能电池
电脑的中央处理器(CPU)
硅芯片的使用,使计算机的体积已缩小到笔记本一样大小了。
大规模集成电路
硅的用途非常广泛,可用来制造集成电路、晶体管、硅整流器等半导体器件,还可以制太阳能电池,制铝合金、铁合金等多种合金。
硅芯片
在美国旧金山,有个最大的高科技工业园区,称之为“硅谷”,它是现代电子工业和计算机发展的基地。这说明硅在电子工业革命中起着非常重要作用。以硅为基础而制成的晶体管是计算机的心脏。
硅在电子工业中重要作用
二氧化硅(SiO2)
二氧化硅广泛存在于自然界中,与其他矿物共同构成了岩石。是一种坚硬难熔的固体。
硅石
硅矿山
二、二氧化硅和硅酸
结晶形(石英晶体)
无定形——硅藻土
水晶
玛瑙
二氧化硅( SiO2 )
1、存在:
硅石
无色透明
彩色环带或层状
水晶
玛瑙
SiO2是自然界中沙子、石英的主要成分。天然二氧化硅叫硅石;结晶的二氧化硅叫石英。
固体
熔点高
难溶于水
硬度大
联想-------沙子
思考与交流
二氧化硅具有哪些物理性质 SiO2的这些性质是由什么决定的?
2、物理性质
二氧化碳CO2 二氧化硅SiO2
状 态
硬 度
水溶性
熔沸点
气 态
固态
很小
很大
可溶于水
难溶于水
很 低
很 高
物理性质:(与CO2 作比较)
思考交流:为什么SiO2和CO2的物理性质差异很大?
二氧化硅(SiO2) 二氧化(CO2)
物理性质 熔沸点高、硬度大 熔沸点低硬度小
与水反应 不反应 CO2+H2O=H2CO3
与碱反应 SiO2+2NaOH=Na2SiO3+H2O CO2+2NaOH=Na2CO3+H2O
与碱性氧化物反应
SiO2+CaO== Ca SiO3
CO2+Na2O= Na2CO3
与酸反应 SiO2+4HF=SiF4↑+2H2O 不反应
与碳反应
SiO2+2C== Si+2CO
CO2+C== 2CO
高温
高温
高温
硅原子——
二氧化硅中没有单个分子,用SiO2来表示二氧化硅的组成,
表示Si与O的原子个数比为1:2,所以不是分子式而是化学式。
[SiO4]四面体结构
立体网状结构决定了SiO2具有优良的物理和化学性质
3、结构
思考:为什么不能用玻璃瓶保存氢氟酸 那用什么瓶保存 为什么能用氢氟酸来刻蚀玻璃?
原因:玻璃中含有SiO2会与HF反应生成SiF4
用塑料瓶盛装氢氟酸。
SiO2 + 4HF == SiF4 + 2H2O
用氢氟酸“刻”出的玻璃工艺品
思考: 实验室盛装NaOH溶液的试剂瓶用橡皮塞而不用玻璃塞,你知道为什么吗?
原因: 防止玻璃中的SiO2与NaOH溶液反应生成粘稠的Na2SiO3 ,使瓶塞和瓶口粘在一起 ( SiO2+2NaOH=Na2SiO3+H2O )
加热熔融烧碱时应使用下列哪种坩埚( )
A.石英坩埚 B.普通玻璃坩埚
C.铁坩埚 D.氧化铝坩埚
C
解释:石英坩埚、玻璃坩埚中均含有SiO2,在加热的情况下会与NaOH发生反应:SiO2+2NaOH Na2SiO3+H2O,因此应当选用铁坩埚。
5、二氧化硅的用途
二氧化硅
石英玻璃
玛瑙首饰
石英手表
石英钟
高级工艺品
眼镜
精密仪器轴承
光导纤维
玛瑙
思考: CO2+H2O=H2CO3 ,但是SiO2不能与水直接化合成H2SiO3。
那怎样制备H2SiO3呢?
硅酸是一种怎样的物质呢?
硅酸凝胶经干燥脱水就形成干胶,称为“硅胶”。
酸性较弱,比碳酸的酸性还弱。
三、硅酸(H2SiO3)
干燥硅胶
湿硅胶
(1)硅酸的制备
Na2SiO3+2HCl=2NaCl+H2SiO3↓
(2)硅酸的性质
①不稳定性
②弱酸性
H2SiO3+2NaOH=2 H2O +Na2SiO3
H2SiO3===H2O+SiO2
加热
Na2SiO3 + H2O + CO2 == Na2CO3 + H2SiO3↓
(3)硅胶(SiO2)
制备:
H2SiO3 硅酸凝胶 硅酸干凝胶 “硅胶”
用途:
硅胶多孔,吸附水份能力强,常用作实验室和袋装食品,瓶装药品等的干燥剂,也可以用作催化剂的载体。
1、下列各组物质有关性质关系的比较,正确的是( )
A.溶解性:CO2 H2CO3
C.熔点:SiO2 > CO2(干冰) D.硬度: SiO2C
2、下列物质中,不能用玻璃瓶来盛装的是( )
A.烧碱溶液
B.浓硫酸
C.氢氟酸
D.碳酸钠溶液
C
3、要除去SiO2中的CaO杂质,最适宜的试剂是( )
A.纯碱溶液
B 盐酸
C 硫酸
D 苛性钠溶液
B
四、硅酸盐
硅酸盐结构复杂的固态化合物,
一般都不溶于水。
1.含义:硅酸盐是由硅、氧和金属元素组成的化合物的总称
2.硅酸盐的表示方法:
①化学式法:
②氧化物法:
硅酸钠:Na2SiO3
硅酸钙:CaSiO3
硅酸钠:Na2O · SiO2
硅酸钙: CaO· SiO2
高岭石:Al2O3 · 2SiO2 ·2H2O
石棉:CaO · 3MgO· 4SiO2
沸石:Na2 O · Al2O3 · 3SiO2· 2H2O
云母: K2O· 3Al2O3 · 6SiO2· 2H2O
长石:K2O · Al2O3 · 6SiO2
水泥:3CaO · SiO2 · 2CaO· SiO2
玻璃:Na2 O · CaO· 6SiO2
粘土: Al2O3 · 2SiO2· 2H2O
最简单的硅酸盐是硅酸钠(Na2SiO3),
其水溶液俗称为水玻璃,
硅酸钠不能燃烧且不易受腐蚀,
可用作肥皂填料、木材防火剂等 。
3.硅酸钠
(Na2SiO3)
关于硅酸盐说明:
1.除硅酸钾、硅酸钠、硅酸铵以外均难溶于水
2.硅酸钠是常见的可溶性硅酸盐之一,俗称泡花碱;它的水溶液俗称水玻璃,是一种粘合剂;
硅酸和二氧化硅的制备:
[水玻璃可保存玻璃瓶中,但不能使用玻璃塞,要用橡胶塞]
较强酸和可溶性硅酸盐反应制硅酸
2HCl + Na2SiO3 + H2O == H4SiO4↓+ 2NaCl
H4SiO4 H2SiO3 SiO2
常温分解
受热分解
无机非金属材料
硅酸盐产品
陶瓷
水泥
玻璃
四、硅酸盐工业
t
水泥是一种非常重要的建筑材料。万丈高楼平地起,穿针引线是水泥。
⑵生产过程:
黏土和石灰石
两磨、一烧。
研磨→煅烧→再磨成细粉;
硅酸三钙(3CaO·SiO2)
硅酸二钙(2CaO·SiO2) 混合物
铝酸三钙(3CaO·Al2O3)
⑴水泥的生产原料:
⑶普通硅酸盐水泥的成分:
1 、水泥
⑷水泥的性能:
水泥具有水硬性。
水泥、沙子和水的混合物——建筑黏合剂。
水泥、沙子和碎石的混合物。
混凝土:
水泥砂浆:
2、玻璃:
⑵生产过程:
纯碱、石灰石和石英。
Na2CO3+SiO2===Na2SiO3+CO2↑
CaCO3 +SiO2===CaSiO3 + CO2↑
高温
高温
⑴玻璃的生产原料:
⑶普通玻璃的成分:
Na2SiO3、CaSiO3和SiO2组成
的混合物。
或Na2O·CaO·6SiO2;
玻璃无固定的熔沸点,
在一定温度范围内软化。
⑷玻璃的性能:
3、陶瓷:
陶瓷具有抗氧化、抗酸碱腐蚀、耐高温、绝缘、易成型等许多优点,因此,陶瓷制品一直为人们所喜爱。
家用陶瓷
江苏宜兴,
有陶都之称。
隋带烧制的三彩陶骆驼
瓷器是中华文明的象征。在许多拉丁语系国家中,“瓷器”和“中国”都以“CHINA”用同一字母拼音表示。
江西景德镇。
江西景德镇所烧制的薄胎瓷器被誉为:“洁如玉、明如镜、薄如纸、声如罄。”
我国素有“瓷都”之称的地方
江西景德镇所烧制的瓷器
传统无机非金属材料:
陶瓷、玻璃、水泥
新型无机非金属材料:
新型陶瓷
高温结构陶瓷、压电陶瓷
透明陶瓷、超导陶瓷等
新型无机非金属材料:
1、新型无机非金属材料的特征:
(1)耐高温、强度高;
(2)具有电学性质;
(3)具有光学性质;
(4)具有生物功能;
2、结构材料——高温结构陶瓷:
(1)氧化铝陶瓷(人造刚玉):
氧化铝透明陶瓷管
氧化铝陶瓷制品
高压钠灯的灯管就是用氧化铝陶瓷制作的。高压钠灯是发光效率很高的一种电光源,光色金白,在它的灯光下看物清晰,不刺眼。平均寿命长达1万小时~2万小时,比高压汞灯寿命长2倍,是白炽灯寿命的10倍,是目前寿命最长的灯。
高压钠灯
透明氧化铝陶瓷
注:钠蒸气放电发光问题早在1950年就得以解决,由于没有一种能抵御高温钠蒸气(1400℃)强烈腐蚀的特殊材料,所以,直到1965年才制取第一支高压钠灯。
用高温结构陶瓷做的发动机叶片
1.下列物质中属于纯净物的是( )
A.Na2CO3·10H2O B.水泥
C.纯净的盐酸 D.普通玻璃
3.下列物质有固定熔点的是( )
A.水泥 B.玻璃 C.Na2O·SiO2 D.水玻璃
2.下列叙述正确的是( )
A.酸均不能与酸性氧化物反应
B.玻璃、陶瓷、水泥容器都不能贮存氢氟酸
C.石灰抹墙、水泥砌墙过程的硬化原理相同
D.石灰窑、玻璃熔炉出来的气体主要成分相同
A
BD
C
小结:硅酸(H2SiO3)
(1)硅酸制取:
Na2SiO3+2HCl=2NaCl+H2SiO3↓
白色胶状
强酸制弱酸
(2)硅酸性质:
① 白色胶状,难溶
② 弱酸性(酸性 H2SiO3 < H2CO3)
③ 脱水形成硅胶
Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3
(用作干燥剂)
原理
练习1
为确认HCl、H2CO3、H2SiO3的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。请据此回答:
思考:直接将A中产生的二氧化碳通入到C中的硅酸钠溶中,能否证明H2CO3强于H2SiO3?
盐酸
饱和NaHCO3溶液
吸收HCl气体
Na2SiO3溶液
HCl
H2CO3
H2SiO3
本节小结
1、学习了非金属元素硅的重要化合物
二氧化硅和硅酸。
2、学习了二氧化硅的重要
性质及硅酸的制备。
巩固小练:
写出下列的化学方程式:
1、二氧化硅和氢氟酸反应
2、二氧化硅和氧化钙反应
3、二氧化硅和氢氧化钠溶液
4、实验室制取硅酸
5、二氧化碳通入氢氧化钠溶液
SiO2+4HF==SiF4↑+2H2O
SiO2+CaO=高温=CaSiO3
SiO2+2NaOH==Na2SiO3+H2O
Na2SiO3+2HCl=H2SiO3+2NaCl
CO2+2NaOH=Na2CO3+H2O
学习目标:
1、了解二氧化硅及硅酸的性质与应用
2、认识物质间既有相似性,又有各自的特性
重点: 二氧化硅的性质和硅酸的制备
难点: 二氧化硅的结构
价值5元的沙子
SiO2
Si
点沙成金
价值5000元的芯片
无机非金属材料的主角——硅(第一课时)
地球生物生存的根基——空气、水、阳、 硅酸盐
说文解字
硅
硅广泛存在于岩石、土壤、沙子中,是构成地壳的重要元素
秦砖汉瓦
秦始皇陵兵马俑
瓷器是中国最伟大的创造之一
美丽的玻璃雕花艺术
水
晶
玛瑙
现代建筑离不开玻璃的装饰和采光
东方明珠
为什么是主角呢?
含量高,仅次于氧
用途广泛
核心元素
?
硅
“豪门二杰”
C、Si 的原子结构示意图。
+14
+6
C
Si
硅原子既不易失去又不易得到电子,主要形成四价的化合物。
碳和硅都是亲氧元素,但是硅的亲氧能力更强
存在:没有游离态,只有化合态——二氧化硅、硅酸盐。
1、硅的工业制法 :
粗硅:
纯硅:
2C+ SiO2=== Si+2CO↑
高温
Si+2Cl2====SiCl4
SiCl4+2H2===Si+4HCl
高温
一、硅单质
2.物理性质
结构类似金刚石,为硬而脆的灰黑色固体, 熔点高,硬度大。
3.化学性质
在常温下化学性质不活泼
Si + O2 === SiO2
Si+2F2==SiF4
Si+4HF==SiF4↑+2H2↑
Si+2NaOH+H2O=Na2SiO3 +2H2↑
Si+2Cl2==SiCl4
4.用途
晶体硅的导电性介于导体和半导体之间,是良好的半导体材料,硅是信息技术的关键材料
硅太阳能电池
利用硅的半导体性能,制成光电池 ,将光能转化为电能。
太阳能电池
电脑的中央处理器(CPU)
硅芯片的使用,使计算机的体积已缩小到笔记本一样大小了。
大规模集成电路
硅的用途非常广泛,可用来制造集成电路、晶体管、硅整流器等半导体器件,还可以制太阳能电池,制铝合金、铁合金等多种合金。
硅芯片
在美国旧金山,有个最大的高科技工业园区,称之为“硅谷”,它是现代电子工业和计算机发展的基地。这说明硅在电子工业革命中起着非常重要作用。以硅为基础而制成的晶体管是计算机的心脏。
硅在电子工业中重要作用
二氧化硅(SiO2)
二氧化硅广泛存在于自然界中,与其他矿物共同构成了岩石。是一种坚硬难熔的固体。
硅石
硅矿山
二、二氧化硅和硅酸
结晶形(石英晶体)
无定形——硅藻土
水晶
玛瑙
二氧化硅( SiO2 )
1、存在:
硅石
无色透明
彩色环带或层状
水晶
玛瑙
SiO2是自然界中沙子、石英的主要成分。天然二氧化硅叫硅石;结晶的二氧化硅叫石英。
固体
熔点高
难溶于水
硬度大
联想-------沙子
思考与交流
二氧化硅具有哪些物理性质 SiO2的这些性质是由什么决定的?
2、物理性质
二氧化碳CO2 二氧化硅SiO2
状 态
硬 度
水溶性
熔沸点
气 态
固态
很小
很大
可溶于水
难溶于水
很 低
很 高
物理性质:(与CO2 作比较)
思考交流:为什么SiO2和CO2的物理性质差异很大?
二氧化硅(SiO2) 二氧化(CO2)
物理性质 熔沸点高、硬度大 熔沸点低硬度小
与水反应 不反应 CO2+H2O=H2CO3
与碱反应 SiO2+2NaOH=Na2SiO3+H2O CO2+2NaOH=Na2CO3+H2O
与碱性氧化物反应
SiO2+CaO== Ca SiO3
CO2+Na2O= Na2CO3
与酸反应 SiO2+4HF=SiF4↑+2H2O 不反应
与碳反应
SiO2+2C== Si+2CO
CO2+C== 2CO
高温
高温
高温
硅原子——
二氧化硅中没有单个分子,用SiO2来表示二氧化硅的组成,
表示Si与O的原子个数比为1:2,所以不是分子式而是化学式。
[SiO4]四面体结构
立体网状结构决定了SiO2具有优良的物理和化学性质
3、结构
思考:为什么不能用玻璃瓶保存氢氟酸 那用什么瓶保存 为什么能用氢氟酸来刻蚀玻璃?
原因:玻璃中含有SiO2会与HF反应生成SiF4
用塑料瓶盛装氢氟酸。
SiO2 + 4HF == SiF4 + 2H2O
用氢氟酸“刻”出的玻璃工艺品
思考: 实验室盛装NaOH溶液的试剂瓶用橡皮塞而不用玻璃塞,你知道为什么吗?
原因: 防止玻璃中的SiO2与NaOH溶液反应生成粘稠的Na2SiO3 ,使瓶塞和瓶口粘在一起 ( SiO2+2NaOH=Na2SiO3+H2O )
加热熔融烧碱时应使用下列哪种坩埚( )
A.石英坩埚 B.普通玻璃坩埚
C.铁坩埚 D.氧化铝坩埚
C
解释:石英坩埚、玻璃坩埚中均含有SiO2,在加热的情况下会与NaOH发生反应:SiO2+2NaOH Na2SiO3+H2O,因此应当选用铁坩埚。
5、二氧化硅的用途
二氧化硅
石英玻璃
玛瑙首饰
石英手表
石英钟
高级工艺品
眼镜
精密仪器轴承
光导纤维
玛瑙
思考: CO2+H2O=H2CO3 ,但是SiO2不能与水直接化合成H2SiO3。
那怎样制备H2SiO3呢?
硅酸是一种怎样的物质呢?
硅酸凝胶经干燥脱水就形成干胶,称为“硅胶”。
酸性较弱,比碳酸的酸性还弱。
三、硅酸(H2SiO3)
干燥硅胶
湿硅胶
(1)硅酸的制备
Na2SiO3+2HCl=2NaCl+H2SiO3↓
(2)硅酸的性质
①不稳定性
②弱酸性
H2SiO3+2NaOH=2 H2O +Na2SiO3
H2SiO3===H2O+SiO2
加热
Na2SiO3 + H2O + CO2 == Na2CO3 + H2SiO3↓
(3)硅胶(SiO2)
制备:
H2SiO3 硅酸凝胶 硅酸干凝胶 “硅胶”
用途:
硅胶多孔,吸附水份能力强,常用作实验室和袋装食品,瓶装药品等的干燥剂,也可以用作催化剂的载体。
1、下列各组物质有关性质关系的比较,正确的是( )
A.溶解性:CO2
C.熔点:SiO2 > CO2(干冰) D.硬度: SiO2
2、下列物质中,不能用玻璃瓶来盛装的是( )
A.烧碱溶液
B.浓硫酸
C.氢氟酸
D.碳酸钠溶液
C
3、要除去SiO2中的CaO杂质,最适宜的试剂是( )
A.纯碱溶液
B 盐酸
C 硫酸
D 苛性钠溶液
B
四、硅酸盐
硅酸盐结构复杂的固态化合物,
一般都不溶于水。
1.含义:硅酸盐是由硅、氧和金属元素组成的化合物的总称
2.硅酸盐的表示方法:
①化学式法:
②氧化物法:
硅酸钠:Na2SiO3
硅酸钙:CaSiO3
硅酸钠:Na2O · SiO2
硅酸钙: CaO· SiO2
高岭石:Al2O3 · 2SiO2 ·2H2O
石棉:CaO · 3MgO· 4SiO2
沸石:Na2 O · Al2O3 · 3SiO2· 2H2O
云母: K2O· 3Al2O3 · 6SiO2· 2H2O
长石:K2O · Al2O3 · 6SiO2
水泥:3CaO · SiO2 · 2CaO· SiO2
玻璃:Na2 O · CaO· 6SiO2
粘土: Al2O3 · 2SiO2· 2H2O
最简单的硅酸盐是硅酸钠(Na2SiO3),
其水溶液俗称为水玻璃,
硅酸钠不能燃烧且不易受腐蚀,
可用作肥皂填料、木材防火剂等 。
3.硅酸钠
(Na2SiO3)
关于硅酸盐说明:
1.除硅酸钾、硅酸钠、硅酸铵以外均难溶于水
2.硅酸钠是常见的可溶性硅酸盐之一,俗称泡花碱;它的水溶液俗称水玻璃,是一种粘合剂;
硅酸和二氧化硅的制备:
[水玻璃可保存玻璃瓶中,但不能使用玻璃塞,要用橡胶塞]
较强酸和可溶性硅酸盐反应制硅酸
2HCl + Na2SiO3 + H2O == H4SiO4↓+ 2NaCl
H4SiO4 H2SiO3 SiO2
常温分解
受热分解
无机非金属材料
硅酸盐产品
陶瓷
水泥
玻璃
四、硅酸盐工业
t
水泥是一种非常重要的建筑材料。万丈高楼平地起,穿针引线是水泥。
⑵生产过程:
黏土和石灰石
两磨、一烧。
研磨→煅烧→再磨成细粉;
硅酸三钙(3CaO·SiO2)
硅酸二钙(2CaO·SiO2) 混合物
铝酸三钙(3CaO·Al2O3)
⑴水泥的生产原料:
⑶普通硅酸盐水泥的成分:
1 、水泥
⑷水泥的性能:
水泥具有水硬性。
水泥、沙子和水的混合物——建筑黏合剂。
水泥、沙子和碎石的混合物。
混凝土:
水泥砂浆:
2、玻璃:
⑵生产过程:
纯碱、石灰石和石英。
Na2CO3+SiO2===Na2SiO3+CO2↑
CaCO3 +SiO2===CaSiO3 + CO2↑
高温
高温
⑴玻璃的生产原料:
⑶普通玻璃的成分:
Na2SiO3、CaSiO3和SiO2组成
的混合物。
或Na2O·CaO·6SiO2;
玻璃无固定的熔沸点,
在一定温度范围内软化。
⑷玻璃的性能:
3、陶瓷:
陶瓷具有抗氧化、抗酸碱腐蚀、耐高温、绝缘、易成型等许多优点,因此,陶瓷制品一直为人们所喜爱。
家用陶瓷
江苏宜兴,
有陶都之称。
隋带烧制的三彩陶骆驼
瓷器是中华文明的象征。在许多拉丁语系国家中,“瓷器”和“中国”都以“CHINA”用同一字母拼音表示。
江西景德镇。
江西景德镇所烧制的薄胎瓷器被誉为:“洁如玉、明如镜、薄如纸、声如罄。”
我国素有“瓷都”之称的地方
江西景德镇所烧制的瓷器
传统无机非金属材料:
陶瓷、玻璃、水泥
新型无机非金属材料:
新型陶瓷
高温结构陶瓷、压电陶瓷
透明陶瓷、超导陶瓷等
新型无机非金属材料:
1、新型无机非金属材料的特征:
(1)耐高温、强度高;
(2)具有电学性质;
(3)具有光学性质;
(4)具有生物功能;
2、结构材料——高温结构陶瓷:
(1)氧化铝陶瓷(人造刚玉):
氧化铝透明陶瓷管
氧化铝陶瓷制品
高压钠灯的灯管就是用氧化铝陶瓷制作的。高压钠灯是发光效率很高的一种电光源,光色金白,在它的灯光下看物清晰,不刺眼。平均寿命长达1万小时~2万小时,比高压汞灯寿命长2倍,是白炽灯寿命的10倍,是目前寿命最长的灯。
高压钠灯
透明氧化铝陶瓷
注:钠蒸气放电发光问题早在1950年就得以解决,由于没有一种能抵御高温钠蒸气(1400℃)强烈腐蚀的特殊材料,所以,直到1965年才制取第一支高压钠灯。
用高温结构陶瓷做的发动机叶片
1.下列物质中属于纯净物的是( )
A.Na2CO3·10H2O B.水泥
C.纯净的盐酸 D.普通玻璃
3.下列物质有固定熔点的是( )
A.水泥 B.玻璃 C.Na2O·SiO2 D.水玻璃
2.下列叙述正确的是( )
A.酸均不能与酸性氧化物反应
B.玻璃、陶瓷、水泥容器都不能贮存氢氟酸
C.石灰抹墙、水泥砌墙过程的硬化原理相同
D.石灰窑、玻璃熔炉出来的气体主要成分相同
A
BD
C
小结:硅酸(H2SiO3)
(1)硅酸制取:
Na2SiO3+2HCl=2NaCl+H2SiO3↓
白色胶状
强酸制弱酸
(2)硅酸性质:
① 白色胶状,难溶
② 弱酸性(酸性 H2SiO3 < H2CO3)
③ 脱水形成硅胶
Na2SiO3+CO2+H2O=H2SiO3↓+Na2CO3
(用作干燥剂)
原理
练习1
为确认HCl、H2CO3、H2SiO3的酸性强弱,某学生设计了如图所示的装置,一次实验即可达到目的(不必选其他酸性物质)。请据此回答:
思考:直接将A中产生的二氧化碳通入到C中的硅酸钠溶中,能否证明H2CO3强于H2SiO3?
盐酸
饱和NaHCO3溶液
吸收HCl气体
Na2SiO3溶液
HCl
H2CO3
H2SiO3
本节小结
1、学习了非金属元素硅的重要化合物
二氧化硅和硅酸。
2、学习了二氧化硅的重要
性质及硅酸的制备。
巩固小练:
写出下列的化学方程式:
1、二氧化硅和氢氟酸反应
2、二氧化硅和氧化钙反应
3、二氧化硅和氢氧化钠溶液
4、实验室制取硅酸
5、二氧化碳通入氢氧化钠溶液
SiO2+4HF==SiF4↑+2H2O
SiO2+CaO=高温=CaSiO3
SiO2+2NaOH==Na2SiO3+H2O
Na2SiO3+2HCl=H2SiO3+2NaCl
CO2+2NaOH=Na2CO3+H2O
