第1章 化学反应与能量转化-章节测试--2025年高考化学选择性必修第一册(鲁科版)
文档属性
| 名称 | 第1章 化学反应与能量转化-章节测试--2025年高考化学选择性必修第一册(鲁科版) |  | |
| 格式 | pptx | ||
| 文件大小 | 8.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-06 20:39:58 | ||
图片预览







文档简介
(共70张PPT)
第1章 化学反应与能量转化
2025年高考化学一轮复习
选择性必修第一册鲁科版
章节测试
一、选择题(本题包括10小题,每小题只有1个选项符合题意)
1.(2024北京二中期中)下列事实与电化学无关的是( )
D
A.暖宝宝(含铁粉、碳、氯化钠等)发热 B.海沙比河沙混凝土更易使钢筋生锈 C.家用铁锅生锈 D.铁罐运输浓硫酸
【解析】 A(×)暖宝宝中铁粉、碳在氯化钠溶液中构成原电池,铁发生吸氧腐蚀放出
热量,与电化学有关,不符合题意。
B(×)海沙中电解质的量大于河沙,钢筋在海沙中构成原电池时,由于电解质溶液浓
度大,腐蚀速率快,则海沙比河沙混凝土更易使钢筋生锈与电化学有关,不符合题意。
C(×)家用铁锅生锈是因为铁锅与锅中残留溶液构成原电池,发生吸氧腐蚀,则家用
铁锅生锈与电化学有关,不符合题意。
D(√)铁遇冷的浓硫酸发生钝化,则铁罐运输浓硫酸与铁的钝化有关,与电化学无关,
符合题意。
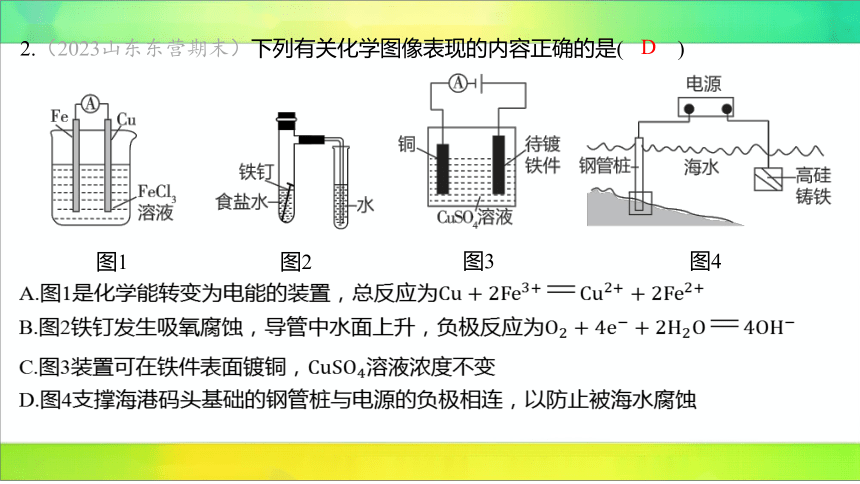
2.(2023山东东营期末)下列有关化学图像表现的内容正确的是( )
D
图1
图2
图3
图4
A.图1是化学能转变为电能的装置,总反应为
B.图2铁钉发生吸氧腐蚀,导管中水面上升,负极反应为
C.图3装置可在铁件表面镀铜, 溶液浓度不变
D.图4支撑海港码头基础的钢管桩与电源的负极相连,以防止被海水腐蚀
【解析】 A(×)图1为原电池装置,化学能转变为电能,金属活动性:,故
作负极,总反应为 。
B(×)食盐水呈中性,图2铁钉发生吸氧腐蚀,负极失电子,电极反应为
,正极得电子,电极反应为 ,具支试管中
气体压强减小,导管中水面上升。
C(×)电镀时,镀件作阴极,镀层金属作阳极,因此待镀铁件应与电源负极相连,铜
应与电源正极相连。
D(√)图4属于外加电流阴极保护法,根据电解原理,钢管桩应与电源的负极相连,以
防止被海水腐蚀。
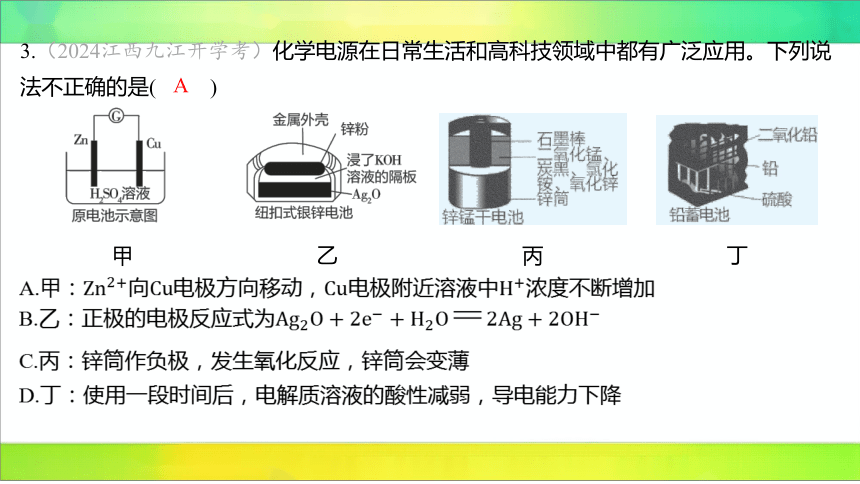
3.(2024江西九江开学考)化学电源在日常生活和高科技领域中都有广泛应用。下列说
法不正确的是( )
A
甲
乙
丙
丁
A.甲:向电极方向移动,电极附近溶液中 浓度不断增加
B.乙:正极的电极反应式为
C.丙:锌筒作负极,发生氧化反应,锌筒会变薄
D.丁:使用一段时间后,电解质溶液的酸性减弱,导电能力下降
【解析】
A(×)
(阳离子)向电极(正极)方向移动,正极上放电,故电极附近溶液中
浓度减小。
B(√) 为正极,电解质溶液显碱性,正极的电极反应式为
。(链接大招10)
C(√)图丙为锌锰干电池, 为负极,失电子发生氧化反应,锌筒逐渐变薄。
D(√)图丁为铅蓄电池,放电时的总反应为 ,
实际使用中,电解质溶液硫酸的浓度逐渐降低,导电能力下降。
4.(2024上海吴淞中学阶段考试)氢能的低成本、低温、高效率制取一直是亟待解决的
关键难题。实验室用计算机模拟在催化剂表面水煤气变换低温产氢反应
过程中能量的变化如图所示,下列说法不正确的是( )
A
A.水煤气变换产氢反应是吸热反应 B.过程Ⅰ、Ⅱ均需要吸收能量
C.过程Ⅲ形成了新的非极性键 D.每生成转移
【解析】 A(×)图中生成物的总能量低于反应物的总能量,故水煤气变
换产氢反应是放热反应。
B(√)根据题图知,过程Ⅰ、Ⅱ中断裂 键,需要吸收能量。
C(√)过程Ⅲ形成了 非极性键。
D(√)生成的过程中,元素由价变为0价,每生成转移 。
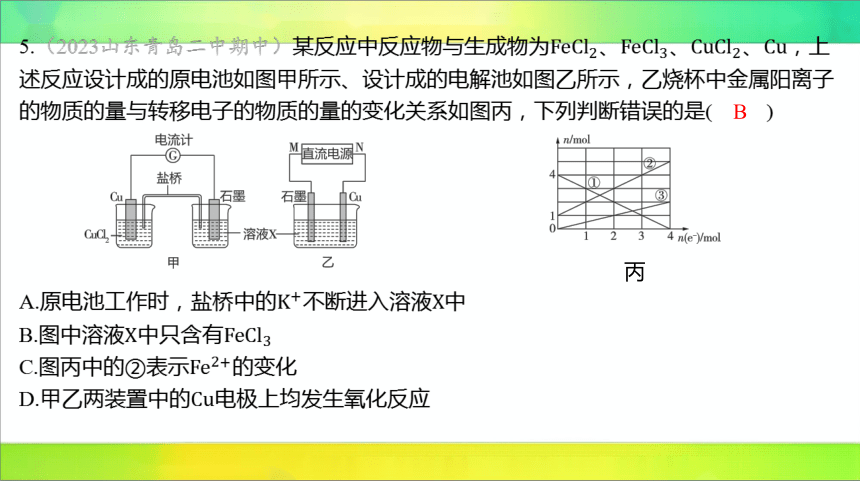
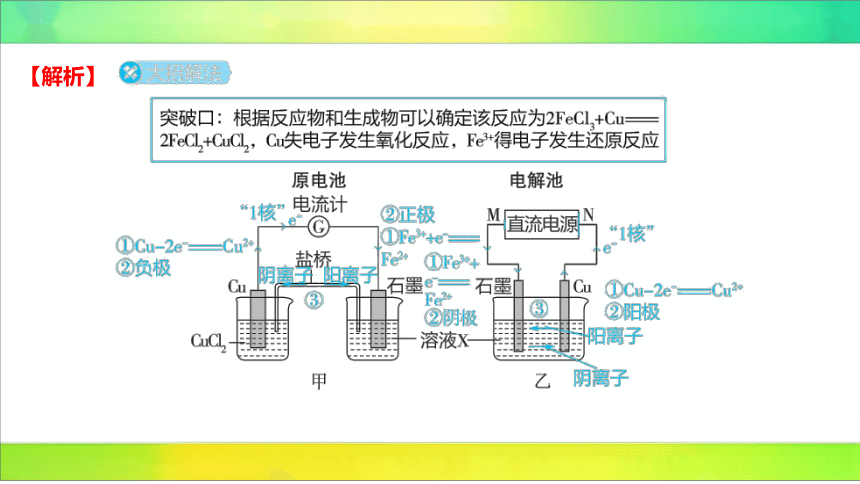
5.(2023山东青岛二中期中)某反应中反应物与生成物为、、、 ,上
述反应设计成的原电池如图甲所示、设计成的电解池如图乙所示,乙烧杯中金属阳离子
的物质的量与转移电子的物质的量的变化关系如图丙,下列判断错误的是( )
B
丙
A.原电池工作时,盐桥中的不断进入溶液 中
B.图中溶液中只含有
C.图丙中的②表示 的变化
D.甲乙两装置中的 电极上均发生氧化反应
【解析】
A(√)作负极,石墨作正极,盐桥中阳离子向正极移动,则 不断移向正极即进入
溶液 中。
B(×)C(√)、,通过相同电荷时,生成的 的
物质的量是的物质的量的2倍,故丙图中①表示的变化,②表示 的变化,
③表示的变化,初始时溶液中含有、 。
D(√)甲装置中铜作负极,乙装置中铜作阳极,甲乙两装置中的 电极均失电子,发
生氧化反应。
6.(2023福建龙岩一级校联盟期中)锂-氟化碳(氟气与碳生
成的夹层化合物)电池因在质量比能量、体积比能量、工作
温度范围等方面具有明显优势而应用广泛。电解液为丙烯碳
酸酯的溶液,总反应为 ,放电
产物 易沉积,工作原理如图所示。下列说法正确的是
( )
C
A.电池工作时,电子流动方向:电极负载 电极离子交换膜电极
B.负极反应式为
C.为了提高电池放电性能,在电解液中添加合适的试剂溶解沉积在极区的
D.电池工作一段时间, 极区的电解液质量增大
【解析】
A(×)“电子不下水”,电子不能进入电解质溶液中。
B(×)金属锂为负极,电极反应式为 。
C(√)放电产物 易沉积,故为了提高电池放电性能,在电解液中添加合适的试剂溶
解沉积在极区的 。
D(×)负极生成的穿过离子交换膜,与正极得电子生成的反应生成,
极区电解液质量不变。
7.(新装置)(2024中国人民大学附属中学
阶段练习)在载人航天器舱内利用氢氧燃料
电池进行二氧化碳浓缩富集的装置如图所示。
下列说法正确的是( )
B
A. 极为电池的正极
B. 极的电极反应:
C.该装置工作时电能转化成化学能
D.向 极移动
【解析】
A(×) 极为电池的负极。
B(√)结合上图分析配平得,极的电极反应为 。
C(×)该装置为原电池,工作时化学能转化成电能。
D(×)(阴离子)向 极移动。
8.(2024浙江温州期中)如图是金属镁和卤素单质 反应
的能量变化示意图。下列说法正确的是( )
D
A.稳定性:
B.与足量的充分反应,放热
C.工业上可由电解溶液冶炼金属 ,该过程需要吸
收能量
D.由图可知: 发生反应需要吸收 能量
【解析】 A(×)“能量越低越稳定”,根据题
图可知,物质的稳定性 。
B(×)未指明气体所处的条件,不能由体积计算 的物质
的量,因此不能计算反应放出的热量。
C(×)电解溶液不能得到金属 ,工业上可采用电
解熔融的方法冶炼金属, 的能量比
、 的总能量低,故该过程需要吸收热量。
D(√)根据图示可知 ,
的物质的量为,故 发生反应
需要吸收能量 。
9.(2024四川成都树德中学开学考)光催化钠离子二次
电池的应用研究取得重大进展,该电池工作原理如图
所示。下列有关说法不正确的是( )
C
A.充电时,电子从光催化电极流出,通过导线流向石
墨电极
B.放电时,每消耗 ,离子交换膜左室电解质
溶液质量减少
C.充电时, 通过离子交换膜进入右室
D.放电时,石墨电极的电极反应式为
【解析】
A(√)充电时,电子从光催化电极流出,通过导线流向石墨
电极。
B(√)放电时,光催化电极为正极,电极反应式为
,每消耗,转移 电子,有
从左室迁移到右室,则离子交换膜左室电解质溶液
质量减少 。
C(×)离子交换膜为阳离子交换膜。
D(√)放电时,石墨电极为负极, 失去电子发生氧化反
应生成,电极反应式为 。
10.(2024甘肃张掖高台一中月考)我国在电催化固氮领域取得重要进展,为解决当前
严峻的能源和环境问题提供了新的思路,其装置如图所示。下列说法不正确的是( )
D
A.该装置工作时电子流入 电极
B.双极膜中的解离为和,向 移动
C.阳极的反应式为
D.该装置工作时,阴、阳两极消耗的体积比为
【解析】
A(√)B(√)据图分析知A、B项正确。
C(√)为阳极,失电子转化为 ,电极的反应式为
(链接大招13)。
D(×)阴极,,化合价共降低6,阳极, ,化合价共升高10,
由转移电子数相等可知,阴、阳两极消耗的体积比为 。
二、选择题(本题包括5小题,每小题有1个或2个选项符合题意)
11.(2024河北正定中学月考)我国科学家研究出一种新
型水系 电池,其结构如图所示,该电池既能
实现乙炔加氢又能提供电能,下列说法正确的是( )
C
A.通过阴离子交换膜向 电极移动
B.左侧极室中 减小
C. 极的电极反应式为
D.每转移,右侧极室中溶液质量增大
【解析】
A(×)通过阴离子交换膜向 电极移动。
B(×)C(√)电极为正极,得电子发生还原反应生成 ,碱性溶液中电极反
应式为(链接大招10),当有 电子转移时,
生成,有从左室迁移到右室,则左室中数目不变,但 电极反
应消耗水,左室中溶液体积减小, 增大。
D(×)电极为负极,电极反应式为 (链接大招10),
每转移,有 从左室迁移到右室,则右侧极室中溶液质量增大
。
12.(2023山东枣庄三中月考) 是一种常见的
绿色氧化剂,可由臭氧发生器(原理如图)电
解稀硫酸制得。下列说法错误的是( )
CD
A.电极 为阴极
B.电极上的反应为
C.电解一段时间后电极周围溶液的 增大
D.标准状况下,当有反应时,收集到
和混合气体,的体积分数为
【解析】
A(√)据图分析知A项正确。
B(√)电极上得电子发生还原反应,在酸性环境中生成 ,电极反应式为
。
C(×)据图分析知电极为阳极,水电离出的失电子生成、 的混合气体,电
极反应式为、,同时有等量的
通过质子交换膜进入阴极室,但阳极室中的量减少,故电解一段时间后电极 周围
溶液的 减小。
D(×)标准状况下,当有反应时,转移电子的物质的量为,电极 上收集
到和的混合气体,设生成臭氧,则电极 上收集到的氧气为
,根据转移电子数相等得 ,解得
,所以的体积分数为 。
13.(2024山东青岛第二中学期中)已知:由最稳定的单质合成 某物质的反应焓变
叫做该物质的摩尔生成焓,用 表示,最稳定的单质的摩尔生成焓为0。有关物质的
如图所示,下列有关判断正确的是( )
B
A.的摩尔生成焓
B.相同状况下,比 稳定
C.依据上图所给数据,可求得 的摩尔燃
烧焓
D.与 充分反应,放出 的热量
【解析】 A(×)气态水变为液态水释放能量,
放热焓变为负值,则 的摩尔生成焓
。
B(√)根据题干信息知, 的相对能量为
, 的相对能量为
,“能量越低越稳定”,故相同状况
下,比 稳定。
C(×)摩尔燃烧焓指在一定反应温度和压强条件
下, 纯物质完全燃烧生成同温度下的指定产
物时的焓变,、的指定产物为 、缺
少液态水的摩尔生成焓数据,不能求得 的摩尔燃烧焓。
D(×)氮气和氢气生成氨气的反应为可逆反应,反应进行不彻底,
则 与充分反应,放出的热量小于 。
14.(2024福建福州格致中学月考)利用热再生氨电池可
实现 电镀废液的浓缩再生。电池装置如图所示,
甲、乙两室均预加相同的 电镀废液,向甲室加入
足量氨水后电池开始工作,一段时间后乙室电极质量增
加。已知电池总反应为 。
下列说法正确的是( )
CD
A.甲室 电极为正极
B.隔膜为阳离子膜
C.甲室电极反应式为
D. 扩散到乙室将对电池电动势产生影响
【解析】
A(×)甲室 电极为负极。
B(×)隔膜为阴离子膜。
C(√)甲室电极为负极,失电子结合形成 ,故甲室电极反应式
为 。
D(√)扩散到乙室会与反应生成, 浓度降低,对电池电动
势产生影响。
15.(2023河南洛阳月考)双极电化学法
(装置如图)是在传统电解装置中放置了导
电性电极,通电时, 两端界面产生
电势差,生成梯度合金。下列有关说法错误
的是( )
C
A. 为电源负极
B.的端比 端的电势高
C.的端发生的反应为
D.的 端到中心的不同位置,能形成组成不同的铜镍合金
【解析】
A(√) 为电源负极。
B(√)端靠近阴极,端靠近阳极,则的端比 端的电势高(【口诀】电势接力,
即为电源正极相连的阳极 与电源负极相连的阴极在溶液中电势逐渐降低)。
C(×)端为阳极(【口诀】阴阳交替),水电离出的失电子生成 ,电极反应为
。
D(√)的 端到中心的不同位置,电势不同,电极反应:
中的 不同,能形成组成不同的铜镍合金。
三、非选择题(本题包括5小题)
16.(2024陕西汉中开学考)氮是地球上含量丰富的一种元素,氮及其化合物对我们的
生产、生活有重要的影响。回答下列问题:
(1) 机动车发动机工作时会引发与的反应,该反应是吸热反应, 与
的总能量比 的总能量____(填“高”或“低”)。
低
【解析】 与 的反应是吸热反应,故生成物的总能量高,反应物的总能
量低,即与的总能量比 的总能量低。
(2) 已知:①, ②。下列能
量变化示意图中,正确的是___(填字母)。
A
A. B.
C. D.
【解析】 根据题干信息知,反应①、②均为放热反应,反应物的能量高,生成物的能
量低,排除C、D项; 液化释放能量,故反应②释放的能量多,A项符合题意。
(3) 是一种温室气体,其存储能量的能力是 的上万倍,在大气中的寿命可长
达740年。如表所示是断裂 某些化学键所需要的能量数据:
化学键
能量/ 946 154.8 283
写出和生成 的热化学方程式:
__________________________________________________________________。
(或其他合理答案)
【解析】 。
(4) 火箭的常规燃料是液态四氧化二氮和液态肼, 作氧化剂。用氟气代
替四氧化二氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
已知:①
②
③
请写出液态肼和氟气反应的热化学方程式:
_________________________________________________________________________。
(或其他合理答案)
【解析】 根据题干信息写出待求热化学方程
式: 。
故 。
17.(2024河南南阳第一中学开学考)某研究性学习小组同学根据反应
设计如下原电
池,其中甲、乙两烧杯中各物质的物质的量浓度均为 ,溶液的体积均为
,盐桥中装有饱和 溶液。回答下列问题:
(1) 此原电池的正极是石墨__(填“”或“ ”),发生______反应。
还原
【解析】 石墨 为正极,得电子发生还原反应。
(2) 电池工作时,盐桥中的 移向____(填“甲”或“乙”)烧杯。
乙
【解析】 电池工作时,盐桥中的 移向乙烧杯。
(3) 两烧杯中的电极反应式分别为:甲__________________________________;乙
__________________。
【解析】 甲烧杯中的 发生还原反应,电极反应式为
;乙烧杯中的 发生氧化反应,电极反应式为
(链接大招10)。
(4) 若不考虑溶液的体积变化,当的浓度变为 时,反应中转移的
电子为____ 。
0.5
【解析】 若不考虑溶液的体积变化,溶液中的浓度由 变为
时,生成的物质的量为 ,则转移电子的
物质的量为 。
【解析】
18.(2024四川绵阳南山中学实验学校月考)化学电源广泛地应用于现代社会的生产和
生活。请回答下列问题:
(1) 原电池是一种将化学能转变为电能的装置,所以原电池的设计原理与某类化学反
应有关。你认为下列化学反应,可以设计成原电池的是___(填字母)。
D
A. B.
C. D.
【解析】 A(×) 是非氧化还原反应,不能设计为原电池。
B(×) 不能自发进行,不能设计为原电池。
C(×) 是非氧化还原反应,不能设计为原电池。
D(√) 是氧化还原反应,且反应能够自发进行,故可以
设计为原电池。
(2) 化学反应均涉及相应的能量变化,为探究这些能量变化,某同学设计了如图两个
实验,已知两个实验除了是否有导线连接两个金属棒外,其余均相同。
图1
图2
① 该同学设计这两个实验的目的是_____________________________________________
_________。
通过对比实验探究与稀硫酸在不同条件下反应的能量变化
【解析】 图1中与稀硫酸反应时将化学能转化为热能,图2构成原电池, 与稀硫酸
反应时将化学能主要转化为电能,设计这两个实验的目的是通过对比实验探究 与稀硫
酸在不同条件下反应的能量变化。
② 有关反应一段时间后的实验现象,下列说法正确的是___(填字母)。
A
A.图1中温度计的示数高于图2的示数
B.图1和图2中温度计的示数相等,且均高于室温
C.图1和图2的气泡均产生于锌棒表面
D.图2中产生气体的速率比图1慢
【解析】 A(√)B(×)图1中化学能转化为热能,而图2中化学能大部分转化为电能,
只有很少一部分能量转化为热能,故图1和图2中温度计的示数均高于室温,根据能量守
恒可知,图1中温度计的示数高于图2的示数。
C(×)图1中未构成原电池, 棒上产生气泡,而图2构成了原电池,在铜棒上产生气
泡。
D(×)原电池反应能够加快反应速率,使金属与酸反应放出氢气的速率比不构成原电
池的快,故图2中产生气体的速率比图1快。
(3) 若将两个金属棒用导线连在一起,将总质量为 的锌片和银片同时浸入稀
硫酸中,工作一段时间后,取出金属片,进行洗涤、干燥、称量,得金属片的总质量为
,则装置工作时锌片上的电极反应式为_________________,工作时间内装置所
产生氢气的体积为____ (标准状况)。
5.6
【解析】 金属活动性:,为负极,为正极。负极上 失去电子,发生氧
化反应,电极反应式为,正极上溶液中的 得到电子发生还原反应,
电极反应式为 ,总反应方程式为 。反应
消耗的质量为, ,
故产生的物质的量为 ,其在标准状况下的体积
。
19.(2023河北承德期末改编)根据电化学原理回答下列问题:
(1) 一种电化学装置如图所示,能溶解辉铜矿石(主要成分是 )制得硫酸铜。其
电池总反应为 。
【解析】
① 电极的电极反应式为_________________________________________,电极 上发
生______(填“氧化”或“还原”)反应。
还原
【解析】
负极( 极)
第1步 根据题目信息补全负极“ ”的反应物和生成物,通 过化合价变化确认得失电子数, 并先搞定“变价元素的原子守恒”
(2个价变成2个价,1个价 变
成1个价,共失去 )
第2步 根据信息用 调平电荷
第3步 看补,用 检查
极为正极,得电子发生还原反应。
② 交换膜为____(填“阳”或“阴”)离子交换膜。工作过程中,左室溶液质量______
(填“增大”或“减小”),电路中每转移电子,右室溶液质量变化____ 。
阴
增大
96
【解析】 交换膜为阴离子交换膜。工作过程中,左室发生反应
,且硫酸根离子从右室进入左室,则左室
溶液质量增大;右室发生反应,电路中每转移电子,会有
硫酸根离子进入左室,则右室溶液质量减小 。
(2) 锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,
其中电解质溶于混合有机溶剂中,通过电解质迁移入 晶格中,生成
。
【解析】
① 电池的负极电极反应式为______________。
【解析】 为负极,电极反应式为 。
② 组装该电池必须在无水、无氧条件下进行,其原因是_________________________。
负极材料为,可与水反应
【解析】 负极材料为 ,可与水反应,故不能用水代替电池中的混合有机溶剂。
(3)一种将废水中的氯乙烯 转化成对环境无害的物质的微生物电池装置如图,
同时利用此装置在铁上镀铜。
【解析】
① Ⅰ极为______(填“正极”“负极”“阴极”或“阳极”);镀铜时,___(填“”或“ ”)与铁
电极相连。
负极
【解析】Ⅰ极为负极。镀铜时,铁作阴极,与原电池的负极相连,即铁电极与 相连。
② 若Ⅰ极消耗氯乙烯(反应中生成、、),则铁电极增重____ ,硫酸
铜溶液的浓度______(填“增大”“减小”或“不变”)。
32
不变
【解析】 氯乙烯中C的化合价可看作,若Ⅰ极消耗氯乙烯(反应中生成 、
、,C的化合价升高5),转移 电子,铁电极发生反应
,则析出铜,故铁电极增重 ,阳
极发生反应 ,则硫酸铜溶液的浓度不变。
20.(2024山东新泰一中质检)按照要求回答下列问题。
(1) 工业上,在强碱性(加入 )条
件下用电解法除去废水中的 ,装置如图
所示,依次发生的反应有:
ⅰ.
ⅱ.
ⅲ.
① 除去 ,外电路中至少需要转移
___ 电子。
5
【解析】 ⅰⅱ ⅲ得,
除去 的总反应为
,故除去 ,外电路中至少需要转移 电子。
② 为了使电解池连续工作,需要不断补充_____________。
和
【解析】 由反应ⅰ和反应ⅲ可知,电解池工作时消耗,反应ⅱ消耗 ,所以电解
池工作时,需补充和 。
(2) 我国力争2030年前实现碳达峰,2060年前实现碳中和。某高校研究团队提出,利
用基催化剂光催化还原转化为甲醇 ,并利用产生的电能进一步电解制
备新型高效净水剂 ,其原理如图所示。
【解析】
① 负极的电极反应式为________________
_______________________________,阳极
的电极反应式为___________________
_______________________。
【解析】 电极为负极,失电子转化为 ,酸性环境中电极反应式为
, 为阳极,电极反应式为
。
② 电极的电势较 电极的电势____(填“高”或“低”)。
高
【解析】 为阴极,为阳极,则电极的电势高于 电极的电势。
③ 离子交换膜 为____(填“阴”或“阳”)
离子交换膜,离子交换膜 为____
(填“阴”或“阳”)离子交换膜, 溶液
的浓度___(填“ ”“ ”或“”) 。
阴
阳
【解析】 阳极室消耗大量,则通过离子交换膜进入阳极室,故离子交换膜
为阴离子交换膜。为阴极,电极反应式为 ,阴极室生成
,则通过离子交换膜进入阴极室,故离子交换膜 为阳离子交换膜。工作过程
中阴极室溶液变浓,即 。
(3) 用零价铁去除水体中的硝酸盐已成为环境修复研究的热点之一。 还
原水体中的 的反应原理如图所示。
① 作负极的物质是_______。
铁
【解析】 根据题图知, 失电子作负极。
② 正极的电极反应式是_________________________________。
【解析】 根据题图知,正极:得电子发生还原反应生成 ,反应式为
。
第1章 化学反应与能量转化
2025年高考化学一轮复习
选择性必修第一册鲁科版
章节测试
一、选择题(本题包括10小题,每小题只有1个选项符合题意)
1.(2024北京二中期中)下列事实与电化学无关的是( )
D
A.暖宝宝(含铁粉、碳、氯化钠等)发热 B.海沙比河沙混凝土更易使钢筋生锈 C.家用铁锅生锈 D.铁罐运输浓硫酸
【解析】 A(×)暖宝宝中铁粉、碳在氯化钠溶液中构成原电池,铁发生吸氧腐蚀放出
热量,与电化学有关,不符合题意。
B(×)海沙中电解质的量大于河沙,钢筋在海沙中构成原电池时,由于电解质溶液浓
度大,腐蚀速率快,则海沙比河沙混凝土更易使钢筋生锈与电化学有关,不符合题意。
C(×)家用铁锅生锈是因为铁锅与锅中残留溶液构成原电池,发生吸氧腐蚀,则家用
铁锅生锈与电化学有关,不符合题意。
D(√)铁遇冷的浓硫酸发生钝化,则铁罐运输浓硫酸与铁的钝化有关,与电化学无关,
符合题意。
2.(2023山东东营期末)下列有关化学图像表现的内容正确的是( )
D
图1
图2
图3
图4
A.图1是化学能转变为电能的装置,总反应为
B.图2铁钉发生吸氧腐蚀,导管中水面上升,负极反应为
C.图3装置可在铁件表面镀铜, 溶液浓度不变
D.图4支撑海港码头基础的钢管桩与电源的负极相连,以防止被海水腐蚀
【解析】 A(×)图1为原电池装置,化学能转变为电能,金属活动性:,故
作负极,总反应为 。
B(×)食盐水呈中性,图2铁钉发生吸氧腐蚀,负极失电子,电极反应为
,正极得电子,电极反应为 ,具支试管中
气体压强减小,导管中水面上升。
C(×)电镀时,镀件作阴极,镀层金属作阳极,因此待镀铁件应与电源负极相连,铜
应与电源正极相连。
D(√)图4属于外加电流阴极保护法,根据电解原理,钢管桩应与电源的负极相连,以
防止被海水腐蚀。
3.(2024江西九江开学考)化学电源在日常生活和高科技领域中都有广泛应用。下列说
法不正确的是( )
A
甲
乙
丙
丁
A.甲:向电极方向移动,电极附近溶液中 浓度不断增加
B.乙:正极的电极反应式为
C.丙:锌筒作负极,发生氧化反应,锌筒会变薄
D.丁:使用一段时间后,电解质溶液的酸性减弱,导电能力下降
【解析】
A(×)
(阳离子)向电极(正极)方向移动,正极上放电,故电极附近溶液中
浓度减小。
B(√) 为正极,电解质溶液显碱性,正极的电极反应式为
。(链接大招10)
C(√)图丙为锌锰干电池, 为负极,失电子发生氧化反应,锌筒逐渐变薄。
D(√)图丁为铅蓄电池,放电时的总反应为 ,
实际使用中,电解质溶液硫酸的浓度逐渐降低,导电能力下降。
4.(2024上海吴淞中学阶段考试)氢能的低成本、低温、高效率制取一直是亟待解决的
关键难题。实验室用计算机模拟在催化剂表面水煤气变换低温产氢反应
过程中能量的变化如图所示,下列说法不正确的是( )
A
A.水煤气变换产氢反应是吸热反应 B.过程Ⅰ、Ⅱ均需要吸收能量
C.过程Ⅲ形成了新的非极性键 D.每生成转移
【解析】 A(×)图中生成物的总能量低于反应物的总能量,故水煤气变
换产氢反应是放热反应。
B(√)根据题图知,过程Ⅰ、Ⅱ中断裂 键,需要吸收能量。
C(√)过程Ⅲ形成了 非极性键。
D(√)生成的过程中,元素由价变为0价,每生成转移 。
5.(2023山东青岛二中期中)某反应中反应物与生成物为、、、 ,上
述反应设计成的原电池如图甲所示、设计成的电解池如图乙所示,乙烧杯中金属阳离子
的物质的量与转移电子的物质的量的变化关系如图丙,下列判断错误的是( )
B
丙
A.原电池工作时,盐桥中的不断进入溶液 中
B.图中溶液中只含有
C.图丙中的②表示 的变化
D.甲乙两装置中的 电极上均发生氧化反应
【解析】
A(√)作负极,石墨作正极,盐桥中阳离子向正极移动,则 不断移向正极即进入
溶液 中。
B(×)C(√)、,通过相同电荷时,生成的 的
物质的量是的物质的量的2倍,故丙图中①表示的变化,②表示 的变化,
③表示的变化,初始时溶液中含有、 。
D(√)甲装置中铜作负极,乙装置中铜作阳极,甲乙两装置中的 电极均失电子,发
生氧化反应。
6.(2023福建龙岩一级校联盟期中)锂-氟化碳(氟气与碳生
成的夹层化合物)电池因在质量比能量、体积比能量、工作
温度范围等方面具有明显优势而应用广泛。电解液为丙烯碳
酸酯的溶液,总反应为 ,放电
产物 易沉积,工作原理如图所示。下列说法正确的是
( )
C
A.电池工作时,电子流动方向:电极负载 电极离子交换膜电极
B.负极反应式为
C.为了提高电池放电性能,在电解液中添加合适的试剂溶解沉积在极区的
D.电池工作一段时间, 极区的电解液质量增大
【解析】
A(×)“电子不下水”,电子不能进入电解质溶液中。
B(×)金属锂为负极,电极反应式为 。
C(√)放电产物 易沉积,故为了提高电池放电性能,在电解液中添加合适的试剂溶
解沉积在极区的 。
D(×)负极生成的穿过离子交换膜,与正极得电子生成的反应生成,
极区电解液质量不变。
7.(新装置)(2024中国人民大学附属中学
阶段练习)在载人航天器舱内利用氢氧燃料
电池进行二氧化碳浓缩富集的装置如图所示。
下列说法正确的是( )
B
A. 极为电池的正极
B. 极的电极反应:
C.该装置工作时电能转化成化学能
D.向 极移动
【解析】
A(×) 极为电池的负极。
B(√)结合上图分析配平得,极的电极反应为 。
C(×)该装置为原电池,工作时化学能转化成电能。
D(×)(阴离子)向 极移动。
8.(2024浙江温州期中)如图是金属镁和卤素单质 反应
的能量变化示意图。下列说法正确的是( )
D
A.稳定性:
B.与足量的充分反应,放热
C.工业上可由电解溶液冶炼金属 ,该过程需要吸
收能量
D.由图可知: 发生反应需要吸收 能量
【解析】 A(×)“能量越低越稳定”,根据题
图可知,物质的稳定性 。
B(×)未指明气体所处的条件,不能由体积计算 的物质
的量,因此不能计算反应放出的热量。
C(×)电解溶液不能得到金属 ,工业上可采用电
解熔融的方法冶炼金属, 的能量比
、 的总能量低,故该过程需要吸收热量。
D(√)根据图示可知 ,
的物质的量为,故 发生反应
需要吸收能量 。
9.(2024四川成都树德中学开学考)光催化钠离子二次
电池的应用研究取得重大进展,该电池工作原理如图
所示。下列有关说法不正确的是( )
C
A.充电时,电子从光催化电极流出,通过导线流向石
墨电极
B.放电时,每消耗 ,离子交换膜左室电解质
溶液质量减少
C.充电时, 通过离子交换膜进入右室
D.放电时,石墨电极的电极反应式为
【解析】
A(√)充电时,电子从光催化电极流出,通过导线流向石墨
电极。
B(√)放电时,光催化电极为正极,电极反应式为
,每消耗,转移 电子,有
从左室迁移到右室,则离子交换膜左室电解质溶液
质量减少 。
C(×)离子交换膜为阳离子交换膜。
D(√)放电时,石墨电极为负极, 失去电子发生氧化反
应生成,电极反应式为 。
10.(2024甘肃张掖高台一中月考)我国在电催化固氮领域取得重要进展,为解决当前
严峻的能源和环境问题提供了新的思路,其装置如图所示。下列说法不正确的是( )
D
A.该装置工作时电子流入 电极
B.双极膜中的解离为和,向 移动
C.阳极的反应式为
D.该装置工作时,阴、阳两极消耗的体积比为
【解析】
A(√)B(√)据图分析知A、B项正确。
C(√)为阳极,失电子转化为 ,电极的反应式为
(链接大招13)。
D(×)阴极,,化合价共降低6,阳极, ,化合价共升高10,
由转移电子数相等可知,阴、阳两极消耗的体积比为 。
二、选择题(本题包括5小题,每小题有1个或2个选项符合题意)
11.(2024河北正定中学月考)我国科学家研究出一种新
型水系 电池,其结构如图所示,该电池既能
实现乙炔加氢又能提供电能,下列说法正确的是( )
C
A.通过阴离子交换膜向 电极移动
B.左侧极室中 减小
C. 极的电极反应式为
D.每转移,右侧极室中溶液质量增大
【解析】
A(×)通过阴离子交换膜向 电极移动。
B(×)C(√)电极为正极,得电子发生还原反应生成 ,碱性溶液中电极反
应式为(链接大招10),当有 电子转移时,
生成,有从左室迁移到右室,则左室中数目不变,但 电极反
应消耗水,左室中溶液体积减小, 增大。
D(×)电极为负极,电极反应式为 (链接大招10),
每转移,有 从左室迁移到右室,则右侧极室中溶液质量增大
。
12.(2023山东枣庄三中月考) 是一种常见的
绿色氧化剂,可由臭氧发生器(原理如图)电
解稀硫酸制得。下列说法错误的是( )
CD
A.电极 为阴极
B.电极上的反应为
C.电解一段时间后电极周围溶液的 增大
D.标准状况下,当有反应时,收集到
和混合气体,的体积分数为
【解析】
A(√)据图分析知A项正确。
B(√)电极上得电子发生还原反应,在酸性环境中生成 ,电极反应式为
。
C(×)据图分析知电极为阳极,水电离出的失电子生成、 的混合气体,电
极反应式为、,同时有等量的
通过质子交换膜进入阴极室,但阳极室中的量减少,故电解一段时间后电极 周围
溶液的 减小。
D(×)标准状况下,当有反应时,转移电子的物质的量为,电极 上收集
到和的混合气体,设生成臭氧,则电极 上收集到的氧气为
,根据转移电子数相等得 ,解得
,所以的体积分数为 。
13.(2024山东青岛第二中学期中)已知:由最稳定的单质合成 某物质的反应焓变
叫做该物质的摩尔生成焓,用 表示,最稳定的单质的摩尔生成焓为0。有关物质的
如图所示,下列有关判断正确的是( )
B
A.的摩尔生成焓
B.相同状况下,比 稳定
C.依据上图所给数据,可求得 的摩尔燃
烧焓
D.与 充分反应,放出 的热量
【解析】 A(×)气态水变为液态水释放能量,
放热焓变为负值,则 的摩尔生成焓
。
B(√)根据题干信息知, 的相对能量为
, 的相对能量为
,“能量越低越稳定”,故相同状况
下,比 稳定。
C(×)摩尔燃烧焓指在一定反应温度和压强条件
下, 纯物质完全燃烧生成同温度下的指定产
物时的焓变,、的指定产物为 、缺
少液态水的摩尔生成焓数据,不能求得 的摩尔燃烧焓。
D(×)氮气和氢气生成氨气的反应为可逆反应,反应进行不彻底,
则 与充分反应,放出的热量小于 。
14.(2024福建福州格致中学月考)利用热再生氨电池可
实现 电镀废液的浓缩再生。电池装置如图所示,
甲、乙两室均预加相同的 电镀废液,向甲室加入
足量氨水后电池开始工作,一段时间后乙室电极质量增
加。已知电池总反应为 。
下列说法正确的是( )
CD
A.甲室 电极为正极
B.隔膜为阳离子膜
C.甲室电极反应式为
D. 扩散到乙室将对电池电动势产生影响
【解析】
A(×)甲室 电极为负极。
B(×)隔膜为阴离子膜。
C(√)甲室电极为负极,失电子结合形成 ,故甲室电极反应式
为 。
D(√)扩散到乙室会与反应生成, 浓度降低,对电池电动
势产生影响。
15.(2023河南洛阳月考)双极电化学法
(装置如图)是在传统电解装置中放置了导
电性电极,通电时, 两端界面产生
电势差,生成梯度合金。下列有关说法错误
的是( )
C
A. 为电源负极
B.的端比 端的电势高
C.的端发生的反应为
D.的 端到中心的不同位置,能形成组成不同的铜镍合金
【解析】
A(√) 为电源负极。
B(√)端靠近阴极,端靠近阳极,则的端比 端的电势高(【口诀】电势接力,
即为电源正极相连的阳极 与电源负极相连的阴极在溶液中电势逐渐降低)。
C(×)端为阳极(【口诀】阴阳交替),水电离出的失电子生成 ,电极反应为
。
D(√)的 端到中心的不同位置,电势不同,电极反应:
中的 不同,能形成组成不同的铜镍合金。
三、非选择题(本题包括5小题)
16.(2024陕西汉中开学考)氮是地球上含量丰富的一种元素,氮及其化合物对我们的
生产、生活有重要的影响。回答下列问题:
(1) 机动车发动机工作时会引发与的反应,该反应是吸热反应, 与
的总能量比 的总能量____(填“高”或“低”)。
低
【解析】 与 的反应是吸热反应,故生成物的总能量高,反应物的总能
量低,即与的总能量比 的总能量低。
(2) 已知:①, ②。下列能
量变化示意图中,正确的是___(填字母)。
A
A. B.
C. D.
【解析】 根据题干信息知,反应①、②均为放热反应,反应物的能量高,生成物的能
量低,排除C、D项; 液化释放能量,故反应②释放的能量多,A项符合题意。
(3) 是一种温室气体,其存储能量的能力是 的上万倍,在大气中的寿命可长
达740年。如表所示是断裂 某些化学键所需要的能量数据:
化学键
能量/ 946 154.8 283
写出和生成 的热化学方程式:
__________________________________________________________________。
(或其他合理答案)
【解析】 。
(4) 火箭的常规燃料是液态四氧化二氮和液态肼, 作氧化剂。用氟气代
替四氧化二氮作氧化剂,反应释放的能量更大(两者反应生成氮气和氟化氢气体)。
已知:①
②
③
请写出液态肼和氟气反应的热化学方程式:
_________________________________________________________________________。
(或其他合理答案)
【解析】 根据题干信息写出待求热化学方程
式: 。
故 。
17.(2024河南南阳第一中学开学考)某研究性学习小组同学根据反应
设计如下原电
池,其中甲、乙两烧杯中各物质的物质的量浓度均为 ,溶液的体积均为
,盐桥中装有饱和 溶液。回答下列问题:
(1) 此原电池的正极是石墨__(填“”或“ ”),发生______反应。
还原
【解析】 石墨 为正极,得电子发生还原反应。
(2) 电池工作时,盐桥中的 移向____(填“甲”或“乙”)烧杯。
乙
【解析】 电池工作时,盐桥中的 移向乙烧杯。
(3) 两烧杯中的电极反应式分别为:甲__________________________________;乙
__________________。
【解析】 甲烧杯中的 发生还原反应,电极反应式为
;乙烧杯中的 发生氧化反应,电极反应式为
(链接大招10)。
(4) 若不考虑溶液的体积变化,当的浓度变为 时,反应中转移的
电子为____ 。
0.5
【解析】 若不考虑溶液的体积变化,溶液中的浓度由 变为
时,生成的物质的量为 ,则转移电子的
物质的量为 。
【解析】
18.(2024四川绵阳南山中学实验学校月考)化学电源广泛地应用于现代社会的生产和
生活。请回答下列问题:
(1) 原电池是一种将化学能转变为电能的装置,所以原电池的设计原理与某类化学反
应有关。你认为下列化学反应,可以设计成原电池的是___(填字母)。
D
A. B.
C. D.
【解析】 A(×) 是非氧化还原反应,不能设计为原电池。
B(×) 不能自发进行,不能设计为原电池。
C(×) 是非氧化还原反应,不能设计为原电池。
D(√) 是氧化还原反应,且反应能够自发进行,故可以
设计为原电池。
(2) 化学反应均涉及相应的能量变化,为探究这些能量变化,某同学设计了如图两个
实验,已知两个实验除了是否有导线连接两个金属棒外,其余均相同。
图1
图2
① 该同学设计这两个实验的目的是_____________________________________________
_________。
通过对比实验探究与稀硫酸在不同条件下反应的能量变化
【解析】 图1中与稀硫酸反应时将化学能转化为热能,图2构成原电池, 与稀硫酸
反应时将化学能主要转化为电能,设计这两个实验的目的是通过对比实验探究 与稀硫
酸在不同条件下反应的能量变化。
② 有关反应一段时间后的实验现象,下列说法正确的是___(填字母)。
A
A.图1中温度计的示数高于图2的示数
B.图1和图2中温度计的示数相等,且均高于室温
C.图1和图2的气泡均产生于锌棒表面
D.图2中产生气体的速率比图1慢
【解析】 A(√)B(×)图1中化学能转化为热能,而图2中化学能大部分转化为电能,
只有很少一部分能量转化为热能,故图1和图2中温度计的示数均高于室温,根据能量守
恒可知,图1中温度计的示数高于图2的示数。
C(×)图1中未构成原电池, 棒上产生气泡,而图2构成了原电池,在铜棒上产生气
泡。
D(×)原电池反应能够加快反应速率,使金属与酸反应放出氢气的速率比不构成原电
池的快,故图2中产生气体的速率比图1快。
(3) 若将两个金属棒用导线连在一起,将总质量为 的锌片和银片同时浸入稀
硫酸中,工作一段时间后,取出金属片,进行洗涤、干燥、称量,得金属片的总质量为
,则装置工作时锌片上的电极反应式为_________________,工作时间内装置所
产生氢气的体积为____ (标准状况)。
5.6
【解析】 金属活动性:,为负极,为正极。负极上 失去电子,发生氧
化反应,电极反应式为,正极上溶液中的 得到电子发生还原反应,
电极反应式为 ,总反应方程式为 。反应
消耗的质量为, ,
故产生的物质的量为 ,其在标准状况下的体积
。
19.(2023河北承德期末改编)根据电化学原理回答下列问题:
(1) 一种电化学装置如图所示,能溶解辉铜矿石(主要成分是 )制得硫酸铜。其
电池总反应为 。
【解析】
① 电极的电极反应式为_________________________________________,电极 上发
生______(填“氧化”或“还原”)反应。
还原
【解析】
负极( 极)
第1步 根据题目信息补全负极“ ”的反应物和生成物,通 过化合价变化确认得失电子数, 并先搞定“变价元素的原子守恒”
(2个价变成2个价,1个价 变
成1个价,共失去 )
第2步 根据信息用 调平电荷
第3步 看补,用 检查
极为正极,得电子发生还原反应。
② 交换膜为____(填“阳”或“阴”)离子交换膜。工作过程中,左室溶液质量______
(填“增大”或“减小”),电路中每转移电子,右室溶液质量变化____ 。
阴
增大
96
【解析】 交换膜为阴离子交换膜。工作过程中,左室发生反应
,且硫酸根离子从右室进入左室,则左室
溶液质量增大;右室发生反应,电路中每转移电子,会有
硫酸根离子进入左室,则右室溶液质量减小 。
(2) 锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,
其中电解质溶于混合有机溶剂中,通过电解质迁移入 晶格中,生成
。
【解析】
① 电池的负极电极反应式为______________。
【解析】 为负极,电极反应式为 。
② 组装该电池必须在无水、无氧条件下进行,其原因是_________________________。
负极材料为,可与水反应
【解析】 负极材料为 ,可与水反应,故不能用水代替电池中的混合有机溶剂。
(3)一种将废水中的氯乙烯 转化成对环境无害的物质的微生物电池装置如图,
同时利用此装置在铁上镀铜。
【解析】
① Ⅰ极为______(填“正极”“负极”“阴极”或“阳极”);镀铜时,___(填“”或“ ”)与铁
电极相连。
负极
【解析】Ⅰ极为负极。镀铜时,铁作阴极,与原电池的负极相连,即铁电极与 相连。
② 若Ⅰ极消耗氯乙烯(反应中生成、、),则铁电极增重____ ,硫酸
铜溶液的浓度______(填“增大”“减小”或“不变”)。
32
不变
【解析】 氯乙烯中C的化合价可看作,若Ⅰ极消耗氯乙烯(反应中生成 、
、,C的化合价升高5),转移 电子,铁电极发生反应
,则析出铜,故铁电极增重 ,阳
极发生反应 ,则硫酸铜溶液的浓度不变。
20.(2024山东新泰一中质检)按照要求回答下列问题。
(1) 工业上,在强碱性(加入 )条
件下用电解法除去废水中的 ,装置如图
所示,依次发生的反应有:
ⅰ.
ⅱ.
ⅲ.
① 除去 ,外电路中至少需要转移
___ 电子。
5
【解析】 ⅰⅱ ⅲ得,
除去 的总反应为
,故除去 ,外电路中至少需要转移 电子。
② 为了使电解池连续工作,需要不断补充_____________。
和
【解析】 由反应ⅰ和反应ⅲ可知,电解池工作时消耗,反应ⅱ消耗 ,所以电解
池工作时,需补充和 。
(2) 我国力争2030年前实现碳达峰,2060年前实现碳中和。某高校研究团队提出,利
用基催化剂光催化还原转化为甲醇 ,并利用产生的电能进一步电解制
备新型高效净水剂 ,其原理如图所示。
【解析】
① 负极的电极反应式为________________
_______________________________,阳极
的电极反应式为___________________
_______________________。
【解析】 电极为负极,失电子转化为 ,酸性环境中电极反应式为
, 为阳极,电极反应式为
。
② 电极的电势较 电极的电势____(填“高”或“低”)。
高
【解析】 为阴极,为阳极,则电极的电势高于 电极的电势。
③ 离子交换膜 为____(填“阴”或“阳”)
离子交换膜,离子交换膜 为____
(填“阴”或“阳”)离子交换膜, 溶液
的浓度___(填“ ”“ ”或“”) 。
阴
阳
【解析】 阳极室消耗大量,则通过离子交换膜进入阳极室,故离子交换膜
为阴离子交换膜。为阴极,电极反应式为 ,阴极室生成
,则通过离子交换膜进入阴极室,故离子交换膜 为阳离子交换膜。工作过程
中阴极室溶液变浓,即 。
(3) 用零价铁去除水体中的硝酸盐已成为环境修复研究的热点之一。 还
原水体中的 的反应原理如图所示。
① 作负极的物质是_______。
铁
【解析】 根据题图知, 失电子作负极。
② 正极的电极反应式是_________________________________。
【解析】 根据题图知,正极:得电子发生还原反应生成 ,反应式为
。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
