第2章 化学反应的方向、限度与速率--章节复习测试-(共74张PPT)-2025年高考化学选择性必修第一册(鲁科版).pptx
文档属性
| 名称 | 第2章 化学反应的方向、限度与速率--章节复习测试-(共74张PPT)-2025年高考化学选择性必修第一册(鲁科版).pptx |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-06 00:00:00 | ||
图片预览










文档简介
(共74张PPT)
第2章 化学反应的方向、限度与速率
2025年高考化学一轮复习
选择性必修第一册鲁科版
章节测试复习
一、选择题(本题包括7小题,每小题只有1个选项符合题意)
1.(2024山东滕州一中月考)在, 气体通过铁管时,发生腐蚀反应
,下列分析不正确的是( )
D
A.降低反应温度,可减缓反应 的速率
B.在气体中加入一定量 能起到防护铁管的作用
C.反应的可通过如下反应获得: 、
D.时,若气体混合物中 ,铁管易被腐蚀
【解析】 A(√) “两个核心”之能量,降低温度 活化分子百分数减小
单位体积内活化分子数减少,单位时间内有效碰撞次数减少,化学反应速率减慢。
B(√)在气体中加入一定量 ,氢气浓度增大,可以抑制平衡正向移动,能起到防
护铁管的作用。
(√)、 ,根据盖斯定
律得 。
D(×)时,若气体混合物中 ,则
,反应逆向移动,铁管不易腐蚀。
2.(2024辽宁六校期中)已知:氧化制 的主反应热化学方程式为
。
该反应的历程分为如下两步:
反应① (快反应)
反应② (慢反应)
下列说法正确的是( )
C
A.反应①的活化能 反应②的活化能
B.其他条件相同时,同等程度增大、,增大 对主反应速率影响更大
C.将 液化分离,可以提高反应物的转化率
D.若反应①的,则该反应自发进行的最高温度
【解析】 A(×)通常反应的活化能较低时,反应速率较大,反应①为快反应,反应②
为慢反应,说明活化能 。
B(×)反应②为慢反应,则总反应的反应速率取决于反应②,提高 对提高反应
②的反应速率影响较小,故对主反应的速率影响较小,提高 对提高反应②的反应
速率影响较大,进而对提高主反应的反应速率影响较大。
C(√)将 液化分离,根据主反应可知,生成物浓度减小,则主反应化学平衡正
向移动,提高反应物的转化率。
D(×)反应①的 ,反应①的
,根据反应自发进行的条件
,得到 ,因此反应自发进行的最低温度为
。
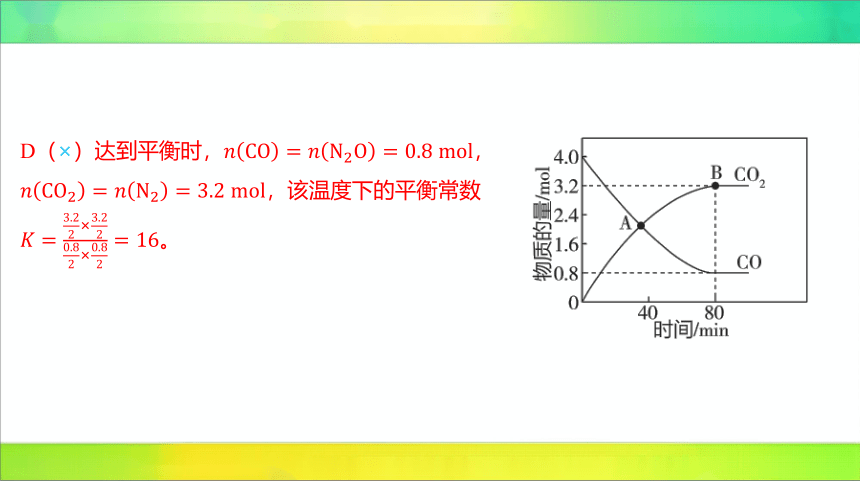
3.(2023重庆一中考试)时,在体积为 的恒
温恒容密闭容器中充入和 ,发
生反应 ,测得
和 的物质的量随时间的变化如图所示。
该反应的正、逆反应速率分别可表示为
,,
分别为正、逆反应速率常数,只受温度影响。
B
A.从反应开始至达到平衡时,用表示的平均反应速率为
B.该反应在A、B两点的正反应速率之比为
C.当容器中混合气体的密度不随时间变化时,该反应达到平衡状态
D.时,该反应的平衡常数
下列说法正确的是 ( )
【解析】 A(×)
。
B(√)点处和 的物质的量相等,均为
,的物质的量也为 ,此时
,B点达到平
衡, ,此时
,故 。
C(×)该反应中物质全为气体,气体总质量保持不变,容器的体积不变,则混合气体
的密度始终不变。
D(×)达到平衡时, ,
,该温度下的平衡常数
。
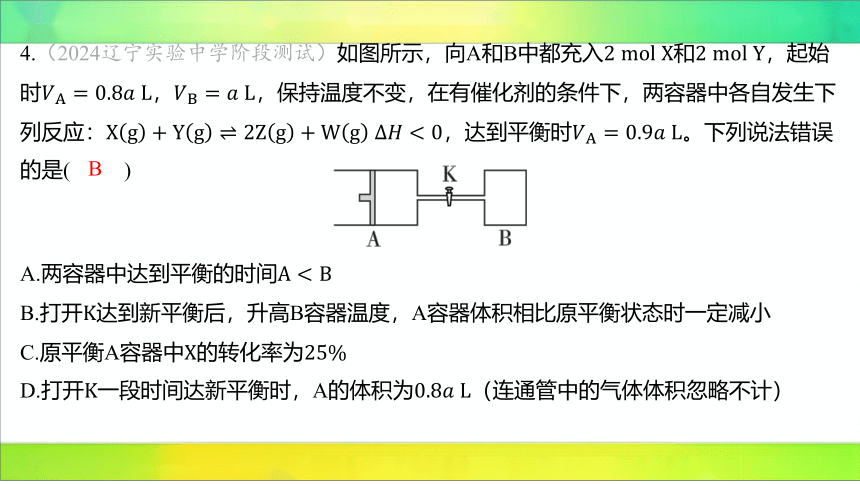
4.(2024辽宁实验中学阶段测试)如图所示,向A和B中都充入和 ,起始
时, ,保持温度不变,在有催化剂的条件下,两容器中各自发生下
列反应:,达到平衡时 。下列说法错误
的是( )
B
A.两容器中达到平衡的时间
B.打开 达到新平衡后,升高B容器温度,A容器体积相比原平衡状态时一定减小
C.原平衡A容器中的转化率为
D.打开一段时间达新平衡时,A的体积为 (连通管中的气体体积忽略不计)
【解析】 A(√)起始时、 ,A中物质的浓度
大于B中物质的浓度,随着反应的进行,最终 ,A中物
质的浓度仍大于B中物质的浓度,所以两容器中达到平衡的时间
。
B(×)反应 放热,所以升高温度,平衡逆向移动,气体体
积减小,但升高温度,气体膨胀,体积增大,所以A容器的体积可能增大,也可能减小。
C(√)达到平衡时, ,恒压恒温条件下,气体的体积之比等于气体的物质
的量之比,所以平衡后混合气体的物质的量是 ,设参加反
应的A的物质的量为 ,则:
,解得,所以 的转化率
为 。
D(√) “三段式”法,打开 一段时间达到的新平衡等效为A中达到的平衡
(【提醒】A为恒温恒压状态,打开 之后整个体系也为恒温恒压状态,且投料量成比
例),的转化率为,参加反应的的总的物质的量为 ,则:
平衡后容器内总的物质的量为
,气体的体积之比等于物
质的量之比,则总容器的体积为 ,A的体积
为 。
有“化”好说
等效平衡的判断方法
类型 等效条件 结果
恒温 恒容 反应前后气体分子 数目不相等 投料换算成相同物质表 示时量相同 两次平衡时各组分百分含量、 、
均相同
反应前后气体分子 数目相等 投料换算成相同物质表 示时等比例 两次平衡时各组分百分含量相
同,、 同比例变化
恒温恒压 投料换算成相同物质表 示时等比例 两次平衡时各组分百分含量、 相
同, 同比例变化
5.(新概念)(2023湖南长沙浏阳一中检测)已知反应 ,速
率方程为。在金 表面分解的实验数据如表所示。
0 20 40 60 80 100
0.100 0.080 0.060 0.020 0
已知:为速率常数,只与温度、催化剂有关,与浓度无关; 时,该反应为0
级反应,时,该反应为1级反应,以此类推, 可以为整数,也可以为分数;③浓
度消耗一半所用的时间叫半衰期 。下列说法正确的是( )
C
A.表格中
B.该反应为2级反应
C.保持其他条件不变,若的起始浓度为,则半衰期为
D.该反应的速率常数
【解析】 A(×)由表中数据可知,相同时间内的浓度变化相同,则 。
B(×)由A项分析可知,该反应是匀速反应,由得 ,该反应是0级
反应。
C(√)设的起始浓度为,,则 ,半衰期与起始浓度成正比,根据
表格数据知,的起始浓度为时半衰期为 ,温度不变,速率常数
不变,则起始浓度为时,半衰期为 。
D(×)该反应是0级反应, ,可根据任何一段时间求速率和速率常数,
时,
。
6.(2024河北保定定州中学月考)二甲醚 催化制备乙醇主要涉及以下两个反
应:
反应Ⅰ:
反应Ⅱ:
在固定、、 的原料比及体系压强不变的条件
下,同时发生反应Ⅰ、Ⅱ,平衡时部分物质的物质的量分数
随温度的变化如图所示。下列说法正确的是( )
A.反应 一定可以自发进行
B.温度高于 时,温度对反应Ⅰ的影响大于对反应Ⅱ的影响
C.由图可知随着温度的升高, 的平衡转化率先下降后升高
D.其他条件不变,延长反应时间或选用对反应Ⅱ催化性能
更好的催化剂都能提高平衡混合物中乙醇含量
√
【解析】 A(×)根据盖斯定律,由反应Ⅰ 反应Ⅱ可得
,该反应为气体分
子数减小的反应,,在高温下 ,反应不能自发进行。
B(√)温度高于时, 的物质的量分数急剧下降,说明反应Ⅰ平衡左
移的程度超过反应Ⅱ平衡左移的程度,即温度升高对反应Ⅰ的影响程度大于反应Ⅱ。
C(×) 只存在于反应Ⅱ中,反应Ⅱ为放热反应,因此,随着温度升高,反应Ⅱ逆向进
行, 的平衡转化率始终下降。
D(×)温度不变时,平衡常数不变,延长反应时间不会影响平衡状态,平衡混合物中
乙醇的含量不变,选用对反应Ⅱ催化性能更好的催化剂只会加快反应速率,不影响平衡
混合物中乙醇的含量。
7.(2024安徽安庆期中)在体积均为 的恒容密闭容器甲、乙中,起始投料量如表,
在不同温度下发生反应:, 的平衡浓度随温度的变化如图所
示。下列说法正确的是( )
容器
甲 0.1 0.3 0
乙 0 0 0.4
A.曲线Ⅰ对应的是容器甲
B.、两点所处状态的压强大小关系:
C.点:的体积分数
D.时,若起始时向容器乙中加入、、C各,则(正) (逆)
√
【解析】 A(×)固体物质的量不影响平衡移动,
乙中投入一氧化碳,相当于投入 二氧
化碳,则乙相当于两个容器甲加压,无论平衡如何
移动,乙中一氧化碳浓度一定大于甲,故图中曲线Ⅰ
对应的是容器乙。
B(×) “三段式”法,曲线Ⅱ对应容器甲,
根据 点数据计算:
曲线Ⅰ对应容器乙,根据 点数据计算:
若、 两点所处温度相同,恒温恒容下,气体的压
强之比等于物质的量之比,则
,即
,由于点温度更高,故、 两点所处状态的压强: 。
C(√)点时 的体积分数为
,点相当于 点减压,平衡正
向移动,的体积分数变大,故点处 的体积分
数大于 。
D(×)点温度为,此时 ,
降温减小(【点拨】温度升高, 的平衡浓度增
大,说明升温,平衡正向移动,反应吸热, 增
大),时 ,若起始向容器乙中加入
、、C各,则 ,平衡逆向移动,故(正) (逆)。
二、选择题(本题包括4小题,每小题有1个或2个选项符合题意)
8.(2023山东威海期末)实验室模拟利用工业废气
合成甲醇,反应为
。
在密闭容器中按照不同氢碳比 投料
(曲线①~③),测得 平衡转化率与温度的关系
如图所示。已知该反应速率
,其中、 分别为正、
逆反应速率常数。下列说法正确的是( )
A.氢碳比由大到小的顺序是:
B.、、处
C.、处
D.时,若按曲线③的氢碳比充入 和
达到平衡,则点处
√
√
【解析】 A(×)相同温度下,氢碳比越大,氢气
的平衡转化率越小,则氢碳比由大到小的顺序为
。
B(√)、、 三点都处于平衡状态,
,则有
,
, ,
点温度相同,相同,点温度较低,且该反应正反应为放热反应,故点大于 、
点。
C(×)点相对于点温度升高,温度升高反应速率增大,点小于 点。
D(√) 时,按曲线③氢碳比充入
和,平衡时氢气转化率为 ,
设反应消耗的物质的量为 ,则有
,解得 ,则平衡时各物质浓度均为, 。
9.(2024山东泰安第一中学阶段测试)二氧
化碳到淀粉的人工合成的第一步为用无机催
化剂将二氧化碳还原为甲醇,反应的化学方
程式为 。
一定温度下,向恒容密闭容器中按照投料比
充入与 ,在不同条件下达
到平衡,设体系中甲醇的物质的量分数为
,在 下的、
在 下的 如图所示。
下列说法不正确的是( )
A.曲线代表下的 ,
曲线代表下的
B.该反应的正反应为放热反应
C.在, 的条件下,向该恒
容密闭容器中继续通入与 ,
达到新的平衡后,
D.在, 的条件下,将投料
比改成,则
√
【解析】 A(√)该反应为气体分子数减小
的反应,恒温条件下加压,平衡正向移动,
增大,则曲线代表 下
的,曲线 代表
下的 。
B(√)曲线代表 下的
,升高温度, 逐渐
减小,平衡逆向移动,逆反应为吸热反应,
则正反应为放热反应。
C(×)在, 的条件下,
向该密闭体系中继续通入 与
,即按照投料比同等倍数增大反
应物浓度,等效于在原平衡的基础上加压,
加压,平衡正向移动,达到新的平衡后,
。
D(√)在, 的条件下,
将投料比改成 ,等效于在原投料
比 时反应达平衡的基础上,减少
反应物 的浓度,平衡逆向移动,
。
10.(2024湖北武汉重点中学期中)甲酸常被用于橡胶、医药等工业。在一定条件下可
分解生成和 。在有、无催化剂条件下的能量与反应历程的关系如图所示。下列说
法错误的是( )
A.,
B.途径二使用催化剂,降低了正反应的活化能,但逆反应的活化能不变
C.途径二 参与反应,通过改变反应途径加快反应速率
D.途径二反应的快慢由生成 的速率决定
√
【解析】
A(√)由上述分析知A项正确。
B(×)途径二使用了催化剂,正逆反应速率都加快,催化剂既降低了正反应的活化能,
也降低了逆反应的活化能。
C(√)途径二反应前后都有氢离子,说明 参与反应,起到催化作用,通过改变反应
途径加快反应速率。
D(√)途径二所示反应历程中生成 的活化能最高,反应速率最慢,途径二反
应的快慢由生成 的速率决定。
11.(2024山东青岛第一中学检测)用活性炭还原 可防止空气污染,其反应原理为
。在密闭容器中 和足量C发生上述反应,
反应相同时间内测得的生成速率与 的生成速率随温度变化的关系如图1所示;维
持温度不变,反应相同时间内测得 的转化率随压强的变化如图2所示。下列说法错
误的是( )
图1
图2
A.图1中的A、B、C三点中只有C点达平衡状态
B.图2中点的小于点的
C.图2中平衡常数,则的平衡浓度
D.在恒温恒容下,向图2中点平衡体系中充入一定量的,与原平衡相比, 的平
衡转化率减小
【解析】
√
A(√)A、B、C三点中只有C点达平衡状态
B(√)点反应正向进行,点反应达到平衡,且压强,则点的小于点的 ,
可画出速率-时间图像直观比较: 。
C(×)题中说“维持温度不变”,说明、两点温度相同,平衡常数 ;浓度
与气体压强有关,压强越大,体积越小,浓度越大,且正反应为气体分子数增大的反应,
增大压强,平衡逆向移动,压强,故的平衡浓度 。
D(√)反应物只有为气体,在恒温恒容下,向点平衡体系中充入一定量的 ,
等效于加压,平衡逆向移动, 的平衡转化率减小。
三、非选择题(本题包括4小题)
12.(“碘钟实验”反应机理探究)(2023四川成都七中期中)研究化学反应的速率和限
度对于日常生活和工农业生产都具有重要的意义。回答下列问题:
(1) 一定温度下,在的恒容容器中充入
与各发生合成氨反应 ,
的物质的量随时间的变化曲线如图所示。
① 内,反应以 表示的平均反应速
率为____________________。
【解析】 内,由 减少为
,则 ,
反应速率之比等于化学计量数之比,合成氨反应
为,故 表示的平均反应速率
。
② 下列能说明该反应达到化学平衡状态的是___
(填标号)。
.混合气体的密度保持不变
.容器内的气体压强保持不变
、、分子数之比为
.气体的平均相对分子质量保持不变
的体积分数保持不变
【解析】 (×)“变量角度”,合成
氨反应气体的总质量不变、容器的体积不变,则
混合气体的密度一直保持不变。
(√)“变量角度”,合成氨反应气体的分子数发
生改变,容器内气体的压强为变量,则容器内的
气体压强保持不变,说明反应达到平衡。
(×)“速率角度”,正、逆反应速率相等时反应
达到平衡,根据反应速率之比等于化学计量数之比可知, 时反应
达到平衡。
(×)“变量角度”,化学反应达平衡时各组分的
浓度、百分含量等保持不变,而不是各组分的量
相等或成比例。
(√)“变量角度”,合成氨反应气体的分子数发
生改变,气体的质量保持不变,则气体的平均相
对分子质量为变量,保持不变时反应达到平衡。
(√)“变量角度”, 的体积分数随反应的进
行发生改变,保持不变说明反应达到平衡。
③ 我国科研人员研究发现合成氨的反应历程有多种,其中有一种反应历程如图所示
(吸附在催化剂表面的物质用*表示)。下列说法错误的是___(填标号)。
通过多步还原反应生成
.过程Ⅰ和Ⅲ中能量的变化相同
.适当提高分压,可以加快的反应速率,提高 转化率
.大量氨分子吸附在催化剂表面,将降低反应速率
【解析】 (√)生成的过程中 元素化合价
是逐渐降低的,即通过多步还原反应生成 。
(×)过程Ⅰ是断裂氮氮三键中的一个键,过程Ⅲ与
过程Ⅰ断键不同,所需能量不同,所以过程Ⅰ和Ⅲ中能
量的变化不相同。
(×)适当提高分压,可以加快 的反
应速率,但 在此步骤的转化率降低。
(√)氨气分子的脱附可留下继续反应的空间,从而增加催化剂的活性位,如果大量氨
分子吸附在催化剂表面,将降低反应速率(【易错】与常见的浓度越大反应速率越快规
律相反,本题需结合催化机理具体问题具体分析)。
(2) 一种“碘钟实验”是将浓度均为的、、、 溶液
及淀粉混合,一定时间后溶液变为蓝色。某小组同学在室温下对该实验原理进行探究。
资料:该实验的总反应为 。反应分两步进行,
第ⅰ步: ,第ⅱ步: ……
① 第ⅱ步的离子方程式是__________________________。对于总反应, 的作用相当于
________。
催化剂
【解析】 该“碘钟实验”的总反应为 ,反应分
两步进行,第ⅰ步反应为,则由 可得到第ⅱ步反
应的离子方程式:, 先消耗后生成,作催化剂。
② 为探究溶液变蓝快慢的影响因素,进行实验Ⅰ、实验Ⅱ(溶液浓度均为
)。
实验序号 溶液 溶液 溶液 溶液(含淀粉) 变蓝时间
实验Ⅰ 0
实验Ⅱ
实验Ⅱ中,、、 所对应的数值分别是_________。对比实验Ⅰ、实验Ⅱ,可得出的实
验结论是________________________________________________。
8、3、2
其他条件相同,增大浓度可以加快该化学反应速率
【解析】 实验Ⅱ与实验Ⅰ相比硫酸体积减少,根据控制变量法,其他条件应完全相同,
故实验Ⅱ中,、、所对应的数值分别是8、3、2(【点拨】 是为了保证溶液总
体积相同),实验Ⅰ比实验Ⅱ变蓝所用的时间短,则可得出的实验结论是其他条件不变,
增大氢离子浓度可以加快反应速率。③实验Ⅲ相比实验Ⅰ,过氧化氢浓度减小,
浓度增大,浓度越大反应速率越快,未出现蓝色现象,说明第ⅰ步反应速率小于第ⅱ步反
应,第ⅰ步反应生成的 很快被第ⅱ步反应消耗。
③ 为探究其他因素对该“碘钟实验”的影响,进行实验Ⅲ(溶液浓度均为
)。
实验序号 溶液 溶液 溶液 溶液(含淀粉)
实验Ⅲ 0
实验过程中,溶液始终无明显颜色变化。试结合该“碘钟实验”总反应方程式及第ⅰ、ⅱ
步反应速率的相对快慢关系,解释实验Ⅲ未产生颜色变化的原因_____________________
______________________________。
第ⅰ步反应速率小于第ⅱ步反应,所以未出现蓝色现象
13.(2024江西贵溪实验中学模拟)聚丙烯塑料是制造口罩的主要材料,丙烯是合成聚
丙烯的原料。科学家研发出自柱式纳米片催化剂,用于高效催化丙烷脱氢。
(1) 在恒温恒容密闭容器中充入和 (不参与反应),发生反应
,下列叙述正确的是___(填标号)。
A
A.气体总压强不变时达到平衡状态
B.平衡时的体积分数为
C.加入催化剂能提高丙烷的平衡转化率
D.平衡后,再充入少量 ,丙烷的平衡转化率增大
【解析】 该反应为反应前后气体分子数增大的反应,恒温恒容下,气体总压强不变时
说明反应达到平衡状态,A项正确。若 完全转化,则平衡时氢气的体积分
数为,但丙烷脱氢是可逆反应, 不可能完全转化,故平衡时氢气的
体积分数小于 ,B项错误。加入催化剂,能提高反应速率,但不能提高平衡转化率,
C项错误。平衡后,再充入少量丙烷,恒温恒容条件下,相当于增大压强,平衡逆向移
动,丙烷的平衡转化率减小,D项错误,应选A。
(2) 已知:丙烷在一定温度下会发生副反应: 。
丙烷的转化率和丙烯的选择性 随温度的变化关系如图1
所示。随着温度升高,丙烯的选择性降低的原因可能为____________________________
_______________________________(写出一条即可)。丙烷转化率增大的原因是_____
____________________________________________________________________________
_____________________________。
催化剂失活(或副产物增加或产物聚合生成聚丙烯等合理答案)
两个反应都是吸热反应,平衡前升温,反应速率增大,丙烷的转化率增大;平衡后升温,平衡正向移动,丙烷的转化率增大
图1
图2
【解析】 升高温度,丙烯的选择性降低,原因可能为催化剂失活、副产物增加、产物聚合
生成聚丙烯等。由题意知,题给两个反应都是吸热反应,平衡之前,升高温度,反应速率
增大,丙烷的转化率增大;平衡之后,升高温度,平衡正向移动,丙烷的转化率增大。
(3) 在,压强恒定为时,向有催化剂的密闭容器中充入和 ,只发
生脱氢反应。丙烷的平衡转化率与投料比 的变化关系如图2所示。反应经过
达到 点。
【解析】 ①根据题图2可知,假设起始时充入和 ,
时丙烷的平衡转化率为,丙烷的转化量为 ,列三段式:
此时气体的总物质的量为 ,
, 。
起始时, 内生成丙烷的平均速率为
(【易错警示】计算平衡、起始时气体的分压时容易忽
略体系中含有的 而计算错误)。②该温度下,平衡常数
。
① 内生成丙烷的平均速率为____ 。
② 该温度下,平衡常数为_______(要求带单位)(已知: 为用分压计算的平衡
常数,分压总压 物质的量分数)。
6.3
14.(2024陕西西安期末)金属钛 在航空航天、医疗器械等工业领域有着重要用途。
目前生产钛的方法之一是将金红石转化为 ,再进一步还原得到钛。回答下列
问题:
(1) 转化为有直接氯化法和碳氯化法。在 时反应的热化学方程式及
其平衡常数如下:
ⅰ.直接氯化: ,
ⅱ.碳氯化: ,
① 对于直接氯化反应:增大压强,平衡____(填“向左”“向右”或“不”)移动;温度升
高, 平衡转化率______(填“变大”“变小”或“不变”)。
不
变大
【解析】 对于直接氯化反应,反应后气体分子数不变,依据勒·夏特列原理,增大压强,
平衡向气体分子数减少的方向移动,即平衡不移动;该反应是吸热反应,温度升高,平
衡向吸热方向移动,即向右移动,则 平衡转化率变大。
② 直接氯化的反应趋势远小于碳氯化,其原因是_________________________________
____________________________________________________________________________
___________________________。
直接氯化的反应为气体分子数不变的吸热反应,,不是自发过程;而碳氯化反应为气体分子数增加的放热反应,,,为自发过程
(2) 在条件下,将、C、
按物质的量之比为 进行反应。体系中气
体平衡组成比例(物质的量分数)随温度变化
的理论计算结果如图所示。
① 反应 的平衡常数
_ _______________(写出计算表
达式即可)。
【解析】 分析题图可知,,体系中气体平衡组成比例是, 是
,是,是0,反应 的平衡常数
。
② 图中显示,在平衡时 几乎完全转
化为 ,但实际生产中反应温度却远高于此
温度,其原因是___________________________
__________________________________。
为了提高反应速率,在相同时间内得到更多的产品,提高效益
【解析】 “四方面”——化学反应速
率,实际生产中需要综合考虑反应的速率、产
率等,以达到最佳效益,实际反应温度远高于 ,是为了提高反应速率,在相同时
间内得到更多的 产品,提高效益。
(3) 直接氯化和碳氯化都属于“气-固”反应,工业生产中有利于“气-固”充分接触
的措施是____________________________________________________________________。
将固体粉碎后加入反应容器中,鼓入吹起固体反应物,使固体粉末“沸腾”
【解析】 固体颗粒越小,比表面积越大,反应接触面积越大。有利于“气-固”充分接触
的措施是将固体粉碎后,鼓入 吹起固体反应物,使固体粉末“沸腾”,增大接触面积。
15.(2023浙江四校联考)高纯硅用途广泛, 是制备高纯硅的主要原料,制备
主要有以下工艺。
Ⅰ.热氢化法:在、条件下,和 在热氢化炉内
反应。
图1
(1) 已知热氢化法制 有两种反应路
径,反应进程如图1所示,该过程更优的路
径是__(填“”或“ ”)。
【解析】 由题图1可知, 转化为三氯硅
烷时,过程的活化能远小于过程 ,活化能
越大,反应速率越慢,则过程 的反应速率
远大于过程 ,是制备三氯硅烷的更优路径。
Ⅱ.氯氢化法:反应原理为 。
(2) 在恒温恒容条件下,该反应达到化学平衡状态,下列说法正确的是_____。
CD
A.、和的物质的量浓度之比为
B.向体系中充入 ,反应速率增大,平衡常数增大
C.向反应体系充入惰性气体,平衡不发生移动
D.移除部分 ,逆反应速率减小,平衡向正反应方向移动
E.该反应在高温下自发正向进行
【解析】 A(×)氯化氢、三氯硅烷、氢气的物质的量浓度之比为 不能说明正、
逆反应速率相等,无法判断反应达到平衡。
B(×)温度不变,平衡常数不变,则向体系中充入氯化氢,平衡常数不变。
C(√)恒温恒容条件下,向反应体系中充入不参与反应的惰性气体,反应体系中各物
质的浓度不变,化学平衡不移动。
D(√)移除部分生成物三氯硅烷,生成物的浓度减小,逆反应速率减小,平衡向正反
应方向移动。
(×)该反应是熵减的放热反应,高温条件下反应的 ,反应不能自
发正向进行。
Ⅲ.冷氢化法,在一定条件下发生如下反应:
ⅰ.
ⅱ.
ⅲ.
ⅳ.
(3) ____________(写出代数式)。
【解析】 根据盖斯定律,由反应ⅰ反应ⅱ 可得到反应ⅳ(【提醒】链接大招5),
则 。
图2
(4) 已知反应ⅰ和反应ⅳ的压强平衡常数的负对数
随着温度的变化如图2所示。
① 反应ⅰ、ⅳ中,属于放热反应的是__(填序号)。
ⅰ
【解析】 分析题图2可知,随着温度升高,反应ⅰ
的压强平衡常数减小(【注意】纵轴表示 ,
从下到上变大,则 变小),说明平衡逆
向移动,则该反应为放热反应;随着温度升高,反
应ⅳ的压强平衡常数增大,说明平衡正向移动,则该反应为吸热反应。
图2
② 某温度下,保持压强为 的某恒压密闭容器中,
起始时加入足量,通入和 ,假设只
发生反应ⅰ和反应ⅳ,反应达到平衡后,测得 转化率
为, ,该温度下反应ⅰ的
压强平衡常数___ (已知压强平衡常数的表达
式为各气体物质的平衡分压替代物质的量浓度,气体的分
压等于其物质的量分数乘以总压强)。
1
图2
【解析】 设平衡时反应生成、 的物质的量
分别为、 ,由反应ⅰ和反应ⅳ可知,反应消耗
的的物质的量为 ,
又的转化率为,则 ,解得
,则平衡时、、、 的物质的量
分别为 、
、、 ,平
衡分压分别为 、、
、 ,反应ⅰ的
压强平衡常数 。
Ⅳ.锌还原法,已知发生如下反应:
ⅴ.
ⅵ.
(5) 一定温度下,向恒容密闭容器中充入和 的混合气体,发生反应ⅴ和ⅵ,反
应ⅵ的净速率,其中、
分别为正、逆反应的速率常数,为气体的分压,降低温度时, ______
(填“增大”“减小”或“不变”)。
减小
【解析】 降低温度,反应速率减小,、均减小,反应 为吸热反应,降低温度,平
衡逆向移动,逆反应速率大于正反应速率,则的减小幅度大于,所以 减小。
(6) 图3为不同温度下达到平衡时各组分的物质的量分数 ,图4为在催化剂作用下同
一时间内,硅的产率与反应温度的关系曲线,点到 点硅的产率缓慢下降的可能原因
是__________________________________________, 点后硅的产率快速下降的主要原
因是____________________________。
反应ⅴ为放热反应,升高温度,反应ⅴ逆向移动
温度过高导致催化剂失去活性
图3
图4
【解析】 反应ⅵ为吸热反应,升高温度,平衡向正反应方向移动,和 的浓度减
小,的浓度增大,由题图3可知,升高温度, 的物质的量分数减小,说明反
应ⅴ为放热反应,温度升高,反应ⅴ逆向移动,导致硅的产率下降。 点后硅产率快速下
降说明温度过高导致催化剂失去活性。
第2章 化学反应的方向、限度与速率
2025年高考化学一轮复习
选择性必修第一册鲁科版
章节测试复习
一、选择题(本题包括7小题,每小题只有1个选项符合题意)
1.(2024山东滕州一中月考)在, 气体通过铁管时,发生腐蚀反应
,下列分析不正确的是( )
D
A.降低反应温度,可减缓反应 的速率
B.在气体中加入一定量 能起到防护铁管的作用
C.反应的可通过如下反应获得: 、
D.时,若气体混合物中 ,铁管易被腐蚀
【解析】 A(√) “两个核心”之能量,降低温度 活化分子百分数减小
单位体积内活化分子数减少,单位时间内有效碰撞次数减少,化学反应速率减慢。
B(√)在气体中加入一定量 ,氢气浓度增大,可以抑制平衡正向移动,能起到防
护铁管的作用。
(√)、 ,根据盖斯定
律得 。
D(×)时,若气体混合物中 ,则
,反应逆向移动,铁管不易腐蚀。
2.(2024辽宁六校期中)已知:氧化制 的主反应热化学方程式为
。
该反应的历程分为如下两步:
反应① (快反应)
反应② (慢反应)
下列说法正确的是( )
C
A.反应①的活化能 反应②的活化能
B.其他条件相同时,同等程度增大、,增大 对主反应速率影响更大
C.将 液化分离,可以提高反应物的转化率
D.若反应①的,则该反应自发进行的最高温度
【解析】 A(×)通常反应的活化能较低时,反应速率较大,反应①为快反应,反应②
为慢反应,说明活化能 。
B(×)反应②为慢反应,则总反应的反应速率取决于反应②,提高 对提高反应
②的反应速率影响较小,故对主反应的速率影响较小,提高 对提高反应②的反应
速率影响较大,进而对提高主反应的反应速率影响较大。
C(√)将 液化分离,根据主反应可知,生成物浓度减小,则主反应化学平衡正
向移动,提高反应物的转化率。
D(×)反应①的 ,反应①的
,根据反应自发进行的条件
,得到 ,因此反应自发进行的最低温度为
。
3.(2023重庆一中考试)时,在体积为 的恒
温恒容密闭容器中充入和 ,发
生反应 ,测得
和 的物质的量随时间的变化如图所示。
该反应的正、逆反应速率分别可表示为
,,
分别为正、逆反应速率常数,只受温度影响。
B
A.从反应开始至达到平衡时,用表示的平均反应速率为
B.该反应在A、B两点的正反应速率之比为
C.当容器中混合气体的密度不随时间变化时,该反应达到平衡状态
D.时,该反应的平衡常数
下列说法正确的是 ( )
【解析】 A(×)
。
B(√)点处和 的物质的量相等,均为
,的物质的量也为 ,此时
,B点达到平
衡, ,此时
,故 。
C(×)该反应中物质全为气体,气体总质量保持不变,容器的体积不变,则混合气体
的密度始终不变。
D(×)达到平衡时, ,
,该温度下的平衡常数
。
4.(2024辽宁实验中学阶段测试)如图所示,向A和B中都充入和 ,起始
时, ,保持温度不变,在有催化剂的条件下,两容器中各自发生下
列反应:,达到平衡时 。下列说法错误
的是( )
B
A.两容器中达到平衡的时间
B.打开 达到新平衡后,升高B容器温度,A容器体积相比原平衡状态时一定减小
C.原平衡A容器中的转化率为
D.打开一段时间达新平衡时,A的体积为 (连通管中的气体体积忽略不计)
【解析】 A(√)起始时、 ,A中物质的浓度
大于B中物质的浓度,随着反应的进行,最终 ,A中物
质的浓度仍大于B中物质的浓度,所以两容器中达到平衡的时间
。
B(×)反应 放热,所以升高温度,平衡逆向移动,气体体
积减小,但升高温度,气体膨胀,体积增大,所以A容器的体积可能增大,也可能减小。
C(√)达到平衡时, ,恒压恒温条件下,气体的体积之比等于气体的物质
的量之比,所以平衡后混合气体的物质的量是 ,设参加反
应的A的物质的量为 ,则:
,解得,所以 的转化率
为 。
D(√) “三段式”法,打开 一段时间达到的新平衡等效为A中达到的平衡
(【提醒】A为恒温恒压状态,打开 之后整个体系也为恒温恒压状态,且投料量成比
例),的转化率为,参加反应的的总的物质的量为 ,则:
平衡后容器内总的物质的量为
,气体的体积之比等于物
质的量之比,则总容器的体积为 ,A的体积
为 。
有“化”好说
等效平衡的判断方法
类型 等效条件 结果
恒温 恒容 反应前后气体分子 数目不相等 投料换算成相同物质表 示时量相同 两次平衡时各组分百分含量、 、
均相同
反应前后气体分子 数目相等 投料换算成相同物质表 示时等比例 两次平衡时各组分百分含量相
同,、 同比例变化
恒温恒压 投料换算成相同物质表 示时等比例 两次平衡时各组分百分含量、 相
同, 同比例变化
5.(新概念)(2023湖南长沙浏阳一中检测)已知反应 ,速
率方程为。在金 表面分解的实验数据如表所示。
0 20 40 60 80 100
0.100 0.080 0.060 0.020 0
已知:为速率常数,只与温度、催化剂有关,与浓度无关; 时,该反应为0
级反应,时,该反应为1级反应,以此类推, 可以为整数,也可以为分数;③浓
度消耗一半所用的时间叫半衰期 。下列说法正确的是( )
C
A.表格中
B.该反应为2级反应
C.保持其他条件不变,若的起始浓度为,则半衰期为
D.该反应的速率常数
【解析】 A(×)由表中数据可知,相同时间内的浓度变化相同,则 。
B(×)由A项分析可知,该反应是匀速反应,由得 ,该反应是0级
反应。
C(√)设的起始浓度为,,则 ,半衰期与起始浓度成正比,根据
表格数据知,的起始浓度为时半衰期为 ,温度不变,速率常数
不变,则起始浓度为时,半衰期为 。
D(×)该反应是0级反应, ,可根据任何一段时间求速率和速率常数,
时,
。
6.(2024河北保定定州中学月考)二甲醚 催化制备乙醇主要涉及以下两个反
应:
反应Ⅰ:
反应Ⅱ:
在固定、、 的原料比及体系压强不变的条件
下,同时发生反应Ⅰ、Ⅱ,平衡时部分物质的物质的量分数
随温度的变化如图所示。下列说法正确的是( )
A.反应 一定可以自发进行
B.温度高于 时,温度对反应Ⅰ的影响大于对反应Ⅱ的影响
C.由图可知随着温度的升高, 的平衡转化率先下降后升高
D.其他条件不变,延长反应时间或选用对反应Ⅱ催化性能
更好的催化剂都能提高平衡混合物中乙醇含量
√
【解析】 A(×)根据盖斯定律,由反应Ⅰ 反应Ⅱ可得
,该反应为气体分
子数减小的反应,,在高温下 ,反应不能自发进行。
B(√)温度高于时, 的物质的量分数急剧下降,说明反应Ⅰ平衡左
移的程度超过反应Ⅱ平衡左移的程度,即温度升高对反应Ⅰ的影响程度大于反应Ⅱ。
C(×) 只存在于反应Ⅱ中,反应Ⅱ为放热反应,因此,随着温度升高,反应Ⅱ逆向进
行, 的平衡转化率始终下降。
D(×)温度不变时,平衡常数不变,延长反应时间不会影响平衡状态,平衡混合物中
乙醇的含量不变,选用对反应Ⅱ催化性能更好的催化剂只会加快反应速率,不影响平衡
混合物中乙醇的含量。
7.(2024安徽安庆期中)在体积均为 的恒容密闭容器甲、乙中,起始投料量如表,
在不同温度下发生反应:, 的平衡浓度随温度的变化如图所
示。下列说法正确的是( )
容器
甲 0.1 0.3 0
乙 0 0 0.4
A.曲线Ⅰ对应的是容器甲
B.、两点所处状态的压强大小关系:
C.点:的体积分数
D.时,若起始时向容器乙中加入、、C各,则(正) (逆)
√
【解析】 A(×)固体物质的量不影响平衡移动,
乙中投入一氧化碳,相当于投入 二氧
化碳,则乙相当于两个容器甲加压,无论平衡如何
移动,乙中一氧化碳浓度一定大于甲,故图中曲线Ⅰ
对应的是容器乙。
B(×) “三段式”法,曲线Ⅱ对应容器甲,
根据 点数据计算:
曲线Ⅰ对应容器乙,根据 点数据计算:
若、 两点所处温度相同,恒温恒容下,气体的压
强之比等于物质的量之比,则
,即
,由于点温度更高,故、 两点所处状态的压强: 。
C(√)点时 的体积分数为
,点相当于 点减压,平衡正
向移动,的体积分数变大,故点处 的体积分
数大于 。
D(×)点温度为,此时 ,
降温减小(【点拨】温度升高, 的平衡浓度增
大,说明升温,平衡正向移动,反应吸热, 增
大),时 ,若起始向容器乙中加入
、、C各,则 ,平衡逆向移动,故(正) (逆)。
二、选择题(本题包括4小题,每小题有1个或2个选项符合题意)
8.(2023山东威海期末)实验室模拟利用工业废气
合成甲醇,反应为
。
在密闭容器中按照不同氢碳比 投料
(曲线①~③),测得 平衡转化率与温度的关系
如图所示。已知该反应速率
,其中、 分别为正、
逆反应速率常数。下列说法正确的是( )
A.氢碳比由大到小的顺序是:
B.、、处
C.、处
D.时,若按曲线③的氢碳比充入 和
达到平衡,则点处
√
√
【解析】 A(×)相同温度下,氢碳比越大,氢气
的平衡转化率越小,则氢碳比由大到小的顺序为
。
B(√)、、 三点都处于平衡状态,
,则有
,
, ,
点温度相同,相同,点温度较低,且该反应正反应为放热反应,故点大于 、
点。
C(×)点相对于点温度升高,温度升高反应速率增大,点小于 点。
D(√) 时,按曲线③氢碳比充入
和,平衡时氢气转化率为 ,
设反应消耗的物质的量为 ,则有
,解得 ,则平衡时各物质浓度均为, 。
9.(2024山东泰安第一中学阶段测试)二氧
化碳到淀粉的人工合成的第一步为用无机催
化剂将二氧化碳还原为甲醇,反应的化学方
程式为 。
一定温度下,向恒容密闭容器中按照投料比
充入与 ,在不同条件下达
到平衡,设体系中甲醇的物质的量分数为
,在 下的、
在 下的 如图所示。
下列说法不正确的是( )
A.曲线代表下的 ,
曲线代表下的
B.该反应的正反应为放热反应
C.在, 的条件下,向该恒
容密闭容器中继续通入与 ,
达到新的平衡后,
D.在, 的条件下,将投料
比改成,则
√
【解析】 A(√)该反应为气体分子数减小
的反应,恒温条件下加压,平衡正向移动,
增大,则曲线代表 下
的,曲线 代表
下的 。
B(√)曲线代表 下的
,升高温度, 逐渐
减小,平衡逆向移动,逆反应为吸热反应,
则正反应为放热反应。
C(×)在, 的条件下,
向该密闭体系中继续通入 与
,即按照投料比同等倍数增大反
应物浓度,等效于在原平衡的基础上加压,
加压,平衡正向移动,达到新的平衡后,
。
D(√)在, 的条件下,
将投料比改成 ,等效于在原投料
比 时反应达平衡的基础上,减少
反应物 的浓度,平衡逆向移动,
。
10.(2024湖北武汉重点中学期中)甲酸常被用于橡胶、医药等工业。在一定条件下可
分解生成和 。在有、无催化剂条件下的能量与反应历程的关系如图所示。下列说
法错误的是( )
A.,
B.途径二使用催化剂,降低了正反应的活化能,但逆反应的活化能不变
C.途径二 参与反应,通过改变反应途径加快反应速率
D.途径二反应的快慢由生成 的速率决定
√
【解析】
A(√)由上述分析知A项正确。
B(×)途径二使用了催化剂,正逆反应速率都加快,催化剂既降低了正反应的活化能,
也降低了逆反应的活化能。
C(√)途径二反应前后都有氢离子,说明 参与反应,起到催化作用,通过改变反应
途径加快反应速率。
D(√)途径二所示反应历程中生成 的活化能最高,反应速率最慢,途径二反
应的快慢由生成 的速率决定。
11.(2024山东青岛第一中学检测)用活性炭还原 可防止空气污染,其反应原理为
。在密闭容器中 和足量C发生上述反应,
反应相同时间内测得的生成速率与 的生成速率随温度变化的关系如图1所示;维
持温度不变,反应相同时间内测得 的转化率随压强的变化如图2所示。下列说法错
误的是( )
图1
图2
A.图1中的A、B、C三点中只有C点达平衡状态
B.图2中点的小于点的
C.图2中平衡常数,则的平衡浓度
D.在恒温恒容下,向图2中点平衡体系中充入一定量的,与原平衡相比, 的平
衡转化率减小
【解析】
√
A(√)A、B、C三点中只有C点达平衡状态
B(√)点反应正向进行,点反应达到平衡,且压强,则点的小于点的 ,
可画出速率-时间图像直观比较: 。
C(×)题中说“维持温度不变”,说明、两点温度相同,平衡常数 ;浓度
与气体压强有关,压强越大,体积越小,浓度越大,且正反应为气体分子数增大的反应,
增大压强,平衡逆向移动,压强,故的平衡浓度 。
D(√)反应物只有为气体,在恒温恒容下,向点平衡体系中充入一定量的 ,
等效于加压,平衡逆向移动, 的平衡转化率减小。
三、非选择题(本题包括4小题)
12.(“碘钟实验”反应机理探究)(2023四川成都七中期中)研究化学反应的速率和限
度对于日常生活和工农业生产都具有重要的意义。回答下列问题:
(1) 一定温度下,在的恒容容器中充入
与各发生合成氨反应 ,
的物质的量随时间的变化曲线如图所示。
① 内,反应以 表示的平均反应速
率为____________________。
【解析】 内,由 减少为
,则 ,
反应速率之比等于化学计量数之比,合成氨反应
为,故 表示的平均反应速率
。
② 下列能说明该反应达到化学平衡状态的是___
(填标号)。
.混合气体的密度保持不变
.容器内的气体压强保持不变
、、分子数之比为
.气体的平均相对分子质量保持不变
的体积分数保持不变
【解析】 (×)“变量角度”,合成
氨反应气体的总质量不变、容器的体积不变,则
混合气体的密度一直保持不变。
(√)“变量角度”,合成氨反应气体的分子数发
生改变,容器内气体的压强为变量,则容器内的
气体压强保持不变,说明反应达到平衡。
(×)“速率角度”,正、逆反应速率相等时反应
达到平衡,根据反应速率之比等于化学计量数之比可知, 时反应
达到平衡。
(×)“变量角度”,化学反应达平衡时各组分的
浓度、百分含量等保持不变,而不是各组分的量
相等或成比例。
(√)“变量角度”,合成氨反应气体的分子数发
生改变,气体的质量保持不变,则气体的平均相
对分子质量为变量,保持不变时反应达到平衡。
(√)“变量角度”, 的体积分数随反应的进
行发生改变,保持不变说明反应达到平衡。
③ 我国科研人员研究发现合成氨的反应历程有多种,其中有一种反应历程如图所示
(吸附在催化剂表面的物质用*表示)。下列说法错误的是___(填标号)。
通过多步还原反应生成
.过程Ⅰ和Ⅲ中能量的变化相同
.适当提高分压,可以加快的反应速率,提高 转化率
.大量氨分子吸附在催化剂表面,将降低反应速率
【解析】 (√)生成的过程中 元素化合价
是逐渐降低的,即通过多步还原反应生成 。
(×)过程Ⅰ是断裂氮氮三键中的一个键,过程Ⅲ与
过程Ⅰ断键不同,所需能量不同,所以过程Ⅰ和Ⅲ中能
量的变化不相同。
(×)适当提高分压,可以加快 的反
应速率,但 在此步骤的转化率降低。
(√)氨气分子的脱附可留下继续反应的空间,从而增加催化剂的活性位,如果大量氨
分子吸附在催化剂表面,将降低反应速率(【易错】与常见的浓度越大反应速率越快规
律相反,本题需结合催化机理具体问题具体分析)。
(2) 一种“碘钟实验”是将浓度均为的、、、 溶液
及淀粉混合,一定时间后溶液变为蓝色。某小组同学在室温下对该实验原理进行探究。
资料:该实验的总反应为 。反应分两步进行,
第ⅰ步: ,第ⅱ步: ……
① 第ⅱ步的离子方程式是__________________________。对于总反应, 的作用相当于
________。
催化剂
【解析】 该“碘钟实验”的总反应为 ,反应分
两步进行,第ⅰ步反应为,则由 可得到第ⅱ步反
应的离子方程式:, 先消耗后生成,作催化剂。
② 为探究溶液变蓝快慢的影响因素,进行实验Ⅰ、实验Ⅱ(溶液浓度均为
)。
实验序号 溶液 溶液 溶液 溶液(含淀粉) 变蓝时间
实验Ⅰ 0
实验Ⅱ
实验Ⅱ中,、、 所对应的数值分别是_________。对比实验Ⅰ、实验Ⅱ,可得出的实
验结论是________________________________________________。
8、3、2
其他条件相同,增大浓度可以加快该化学反应速率
【解析】 实验Ⅱ与实验Ⅰ相比硫酸体积减少,根据控制变量法,其他条件应完全相同,
故实验Ⅱ中,、、所对应的数值分别是8、3、2(【点拨】 是为了保证溶液总
体积相同),实验Ⅰ比实验Ⅱ变蓝所用的时间短,则可得出的实验结论是其他条件不变,
增大氢离子浓度可以加快反应速率。③实验Ⅲ相比实验Ⅰ,过氧化氢浓度减小,
浓度增大,浓度越大反应速率越快,未出现蓝色现象,说明第ⅰ步反应速率小于第ⅱ步反
应,第ⅰ步反应生成的 很快被第ⅱ步反应消耗。
③ 为探究其他因素对该“碘钟实验”的影响,进行实验Ⅲ(溶液浓度均为
)。
实验序号 溶液 溶液 溶液 溶液(含淀粉)
实验Ⅲ 0
实验过程中,溶液始终无明显颜色变化。试结合该“碘钟实验”总反应方程式及第ⅰ、ⅱ
步反应速率的相对快慢关系,解释实验Ⅲ未产生颜色变化的原因_____________________
______________________________。
第ⅰ步反应速率小于第ⅱ步反应,所以未出现蓝色现象
13.(2024江西贵溪实验中学模拟)聚丙烯塑料是制造口罩的主要材料,丙烯是合成聚
丙烯的原料。科学家研发出自柱式纳米片催化剂,用于高效催化丙烷脱氢。
(1) 在恒温恒容密闭容器中充入和 (不参与反应),发生反应
,下列叙述正确的是___(填标号)。
A
A.气体总压强不变时达到平衡状态
B.平衡时的体积分数为
C.加入催化剂能提高丙烷的平衡转化率
D.平衡后,再充入少量 ,丙烷的平衡转化率增大
【解析】 该反应为反应前后气体分子数增大的反应,恒温恒容下,气体总压强不变时
说明反应达到平衡状态,A项正确。若 完全转化,则平衡时氢气的体积分
数为,但丙烷脱氢是可逆反应, 不可能完全转化,故平衡时氢气的
体积分数小于 ,B项错误。加入催化剂,能提高反应速率,但不能提高平衡转化率,
C项错误。平衡后,再充入少量丙烷,恒温恒容条件下,相当于增大压强,平衡逆向移
动,丙烷的平衡转化率减小,D项错误,应选A。
(2) 已知:丙烷在一定温度下会发生副反应: 。
丙烷的转化率和丙烯的选择性 随温度的变化关系如图1
所示。随着温度升高,丙烯的选择性降低的原因可能为____________________________
_______________________________(写出一条即可)。丙烷转化率增大的原因是_____
____________________________________________________________________________
_____________________________。
催化剂失活(或副产物增加或产物聚合生成聚丙烯等合理答案)
两个反应都是吸热反应,平衡前升温,反应速率增大,丙烷的转化率增大;平衡后升温,平衡正向移动,丙烷的转化率增大
图1
图2
【解析】 升高温度,丙烯的选择性降低,原因可能为催化剂失活、副产物增加、产物聚合
生成聚丙烯等。由题意知,题给两个反应都是吸热反应,平衡之前,升高温度,反应速率
增大,丙烷的转化率增大;平衡之后,升高温度,平衡正向移动,丙烷的转化率增大。
(3) 在,压强恒定为时,向有催化剂的密闭容器中充入和 ,只发
生脱氢反应。丙烷的平衡转化率与投料比 的变化关系如图2所示。反应经过
达到 点。
【解析】 ①根据题图2可知,假设起始时充入和 ,
时丙烷的平衡转化率为,丙烷的转化量为 ,列三段式:
此时气体的总物质的量为 ,
, 。
起始时, 内生成丙烷的平均速率为
(【易错警示】计算平衡、起始时气体的分压时容易忽
略体系中含有的 而计算错误)。②该温度下,平衡常数
。
① 内生成丙烷的平均速率为____ 。
② 该温度下,平衡常数为_______(要求带单位)(已知: 为用分压计算的平衡
常数,分压总压 物质的量分数)。
6.3
14.(2024陕西西安期末)金属钛 在航空航天、医疗器械等工业领域有着重要用途。
目前生产钛的方法之一是将金红石转化为 ,再进一步还原得到钛。回答下列
问题:
(1) 转化为有直接氯化法和碳氯化法。在 时反应的热化学方程式及
其平衡常数如下:
ⅰ.直接氯化: ,
ⅱ.碳氯化: ,
① 对于直接氯化反应:增大压强,平衡____(填“向左”“向右”或“不”)移动;温度升
高, 平衡转化率______(填“变大”“变小”或“不变”)。
不
变大
【解析】 对于直接氯化反应,反应后气体分子数不变,依据勒·夏特列原理,增大压强,
平衡向气体分子数减少的方向移动,即平衡不移动;该反应是吸热反应,温度升高,平
衡向吸热方向移动,即向右移动,则 平衡转化率变大。
② 直接氯化的反应趋势远小于碳氯化,其原因是_________________________________
____________________________________________________________________________
___________________________。
直接氯化的反应为气体分子数不变的吸热反应,,不是自发过程;而碳氯化反应为气体分子数增加的放热反应,,,为自发过程
(2) 在条件下,将、C、
按物质的量之比为 进行反应。体系中气
体平衡组成比例(物质的量分数)随温度变化
的理论计算结果如图所示。
① 反应 的平衡常数
_ _______________(写出计算表
达式即可)。
【解析】 分析题图可知,,体系中气体平衡组成比例是, 是
,是,是0,反应 的平衡常数
。
② 图中显示,在平衡时 几乎完全转
化为 ,但实际生产中反应温度却远高于此
温度,其原因是___________________________
__________________________________。
为了提高反应速率,在相同时间内得到更多的产品,提高效益
【解析】 “四方面”——化学反应速
率,实际生产中需要综合考虑反应的速率、产
率等,以达到最佳效益,实际反应温度远高于 ,是为了提高反应速率,在相同时
间内得到更多的 产品,提高效益。
(3) 直接氯化和碳氯化都属于“气-固”反应,工业生产中有利于“气-固”充分接触
的措施是____________________________________________________________________。
将固体粉碎后加入反应容器中,鼓入吹起固体反应物,使固体粉末“沸腾”
【解析】 固体颗粒越小,比表面积越大,反应接触面积越大。有利于“气-固”充分接触
的措施是将固体粉碎后,鼓入 吹起固体反应物,使固体粉末“沸腾”,增大接触面积。
15.(2023浙江四校联考)高纯硅用途广泛, 是制备高纯硅的主要原料,制备
主要有以下工艺。
Ⅰ.热氢化法:在、条件下,和 在热氢化炉内
反应。
图1
(1) 已知热氢化法制 有两种反应路
径,反应进程如图1所示,该过程更优的路
径是__(填“”或“ ”)。
【解析】 由题图1可知, 转化为三氯硅
烷时,过程的活化能远小于过程 ,活化能
越大,反应速率越慢,则过程 的反应速率
远大于过程 ,是制备三氯硅烷的更优路径。
Ⅱ.氯氢化法:反应原理为 。
(2) 在恒温恒容条件下,该反应达到化学平衡状态,下列说法正确的是_____。
CD
A.、和的物质的量浓度之比为
B.向体系中充入 ,反应速率增大,平衡常数增大
C.向反应体系充入惰性气体,平衡不发生移动
D.移除部分 ,逆反应速率减小,平衡向正反应方向移动
E.该反应在高温下自发正向进行
【解析】 A(×)氯化氢、三氯硅烷、氢气的物质的量浓度之比为 不能说明正、
逆反应速率相等,无法判断反应达到平衡。
B(×)温度不变,平衡常数不变,则向体系中充入氯化氢,平衡常数不变。
C(√)恒温恒容条件下,向反应体系中充入不参与反应的惰性气体,反应体系中各物
质的浓度不变,化学平衡不移动。
D(√)移除部分生成物三氯硅烷,生成物的浓度减小,逆反应速率减小,平衡向正反
应方向移动。
(×)该反应是熵减的放热反应,高温条件下反应的 ,反应不能自
发正向进行。
Ⅲ.冷氢化法,在一定条件下发生如下反应:
ⅰ.
ⅱ.
ⅲ.
ⅳ.
(3) ____________(写出代数式)。
【解析】 根据盖斯定律,由反应ⅰ反应ⅱ 可得到反应ⅳ(【提醒】链接大招5),
则 。
图2
(4) 已知反应ⅰ和反应ⅳ的压强平衡常数的负对数
随着温度的变化如图2所示。
① 反应ⅰ、ⅳ中,属于放热反应的是__(填序号)。
ⅰ
【解析】 分析题图2可知,随着温度升高,反应ⅰ
的压强平衡常数减小(【注意】纵轴表示 ,
从下到上变大,则 变小),说明平衡逆
向移动,则该反应为放热反应;随着温度升高,反
应ⅳ的压强平衡常数增大,说明平衡正向移动,则该反应为吸热反应。
图2
② 某温度下,保持压强为 的某恒压密闭容器中,
起始时加入足量,通入和 ,假设只
发生反应ⅰ和反应ⅳ,反应达到平衡后,测得 转化率
为, ,该温度下反应ⅰ的
压强平衡常数___ (已知压强平衡常数的表达
式为各气体物质的平衡分压替代物质的量浓度,气体的分
压等于其物质的量分数乘以总压强)。
1
图2
【解析】 设平衡时反应生成、 的物质的量
分别为、 ,由反应ⅰ和反应ⅳ可知,反应消耗
的的物质的量为 ,
又的转化率为,则 ,解得
,则平衡时、、、 的物质的量
分别为 、
、、 ,平
衡分压分别为 、、
、 ,反应ⅰ的
压强平衡常数 。
Ⅳ.锌还原法,已知发生如下反应:
ⅴ.
ⅵ.
(5) 一定温度下,向恒容密闭容器中充入和 的混合气体,发生反应ⅴ和ⅵ,反
应ⅵ的净速率,其中、
分别为正、逆反应的速率常数,为气体的分压,降低温度时, ______
(填“增大”“减小”或“不变”)。
减小
【解析】 降低温度,反应速率减小,、均减小,反应 为吸热反应,降低温度,平
衡逆向移动,逆反应速率大于正反应速率,则的减小幅度大于,所以 减小。
(6) 图3为不同温度下达到平衡时各组分的物质的量分数 ,图4为在催化剂作用下同
一时间内,硅的产率与反应温度的关系曲线,点到 点硅的产率缓慢下降的可能原因
是__________________________________________, 点后硅的产率快速下降的主要原
因是____________________________。
反应ⅴ为放热反应,升高温度,反应ⅴ逆向移动
温度过高导致催化剂失去活性
图3
图4
【解析】 反应ⅵ为吸热反应,升高温度,平衡向正反应方向移动,和 的浓度减
小,的浓度增大,由题图3可知,升高温度, 的物质的量分数减小,说明反
应ⅴ为放热反应,温度升高,反应ⅴ逆向移动,导致硅的产率下降。 点后硅产率快速下
降说明温度过高导致催化剂失去活性。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
