第3节 化学反应的速率--2025年高考化学选择性必修第一册(鲁科版)(共61张PPT)
文档属性
| 名称 | 第3节 化学反应的速率--2025年高考化学选择性必修第一册(鲁科版)(共61张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 4.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-06 00:00:00 | ||
图片预览









文档简介
(共61张PPT)
第2章 化学反应的方向、限度与速率
2025年高考化学一轮复习
选择性必修第一册鲁科版
第3节 化学反应的速率
课时1 化学反应速率
题型觉醒
题型一 化学反应的历程
1.(原创,双选)下列有关反应历程和基元反应的理解不正确的是( )
CD
A.同一个化学反应的反应历程可能不同
B.反应历程是由基元反应构成的反应序列
C.所有的化学反应都由多个基元反应构成
D.简单反应的反应速率一定比复杂反应的速率快
【解析】 A(√)不同条件时,同一个反应的反应历程不同。
B(√)基元反应构成的反应序列称为反应历程。
C(×)某些化学反应是由多个基元反应构成的,而还有一些反应其本身就是基元反应。
D(×)反应历程的差别造成了反应速率的不同,但简单反应的反应速率不一定比复杂
反应的速率快。
题型二 化学反应速率的计算
2.(2024四川遂宁期中)反应,经过 后,B的浓度
减少了 。下列反应速率的表示正确的是( )
B
A.内,用A表示的反应速率是
B.内,用C表示的反应速率是
C.末时,用B表示的反应速率是
D.在 内用B表示的反应速率的值是减小的,用C表示的反应速率的值逐渐增大
【解析】 A(×)A为固体,不能用固体的浓度表示化学反应速率
(【点拨】对于固体和纯液体,其浓度可视为常数,一般不用来表示化学反应速率)。
(√)内, ,根据各物
质的化学反应速率之比等于反应方程式中化学计量数之比,可知 ,
。
C(×)表示的是内的平均反应速率,不是
末的瞬时反应速率。
D(×)用不同物质表示的反应速率,反应速率之比等于化学方程式中的化学计量数之
比,不管反应速率是用反应物表示还是用生成物表示,随着反应的进行,反应速率都是
逐渐减小的,故 内用B和C表示的反应速率都是逐渐减小的。
题型三 化学反应速率大小的比较
3.(2024江西南昌一中月考)已知密闭容器中发生反应
,在四种不同条件下测得的反应速率分别如
下:
则四种条件下反应速率快慢的比较正确的是( )
C
① ②
③ ④ 。
A. B.
C. D.
【解析】
方法一(归一法) 将用不同物质表示的化学反应速率都转化为用 表示的化学反应
速率,同时注意单位的统一。
① 、
② 、
③ 、
④ ,
故四种不同条件下反应速率 。
方法二(比值法) 不同物质表示的速率与其化学计量数的比值越大,其表示的反应速
率越快,同时注意单位的统一。
① 、
② 、
③ 、
④ ,
故四种不同条件下反应速率 。
题型四 化学方程式的确定
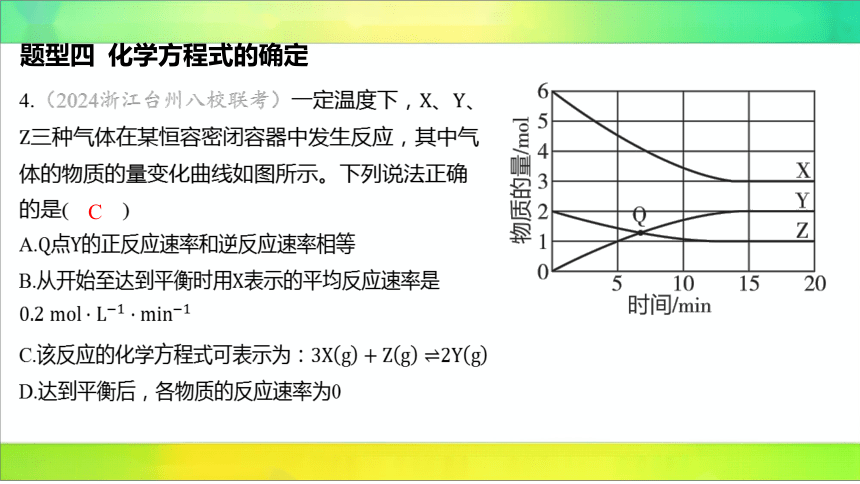
4.(2024浙江台州八校联考)一定温度下,、 、
三种气体在某恒容密闭容器中发生反应,其中气
体的物质的量变化曲线如图所示。下列说法正确
的是( )
C
A.点 的正反应速率和逆反应速率相等
B.从开始至达到平衡时用 表示的平均反应速率是
C.该反应的化学方程式可表示为:
D.达到平衡后,各物质的反应速率为0
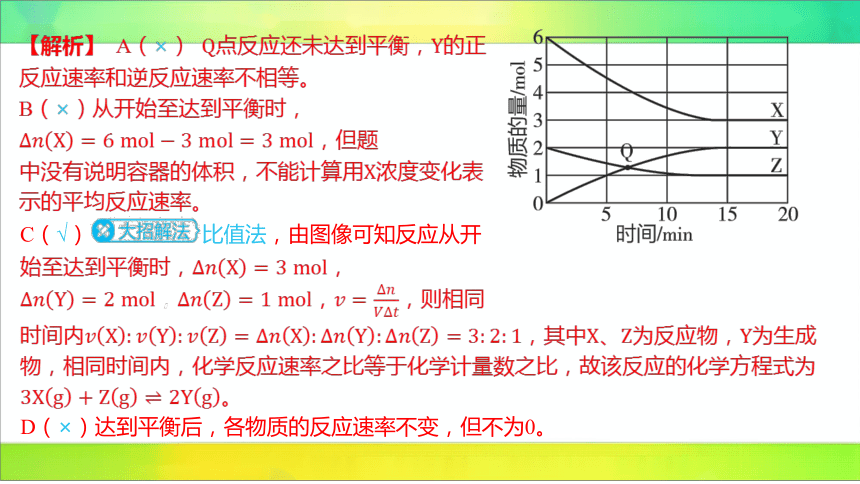
【解析】 A(×)点反应还未达到平衡, 的正
反应速率和逆反应速率不相等。
B(×)从开始至达到平衡时,
,但题
中没有说明容器的体积,不能计算用 浓度变化表
示的平均反应速率。
C(√) 比值法,由图像可知反应从开
D(×)达到平衡后,各物质的反应速率不变,但不为0。
始至达到平衡时, ,
,, ,则相同
时间内,其中、为反应物, 为生成
物,相同时间内,化学反应速率之比等于化学计量数之比,故该反应的化学方程式为
。
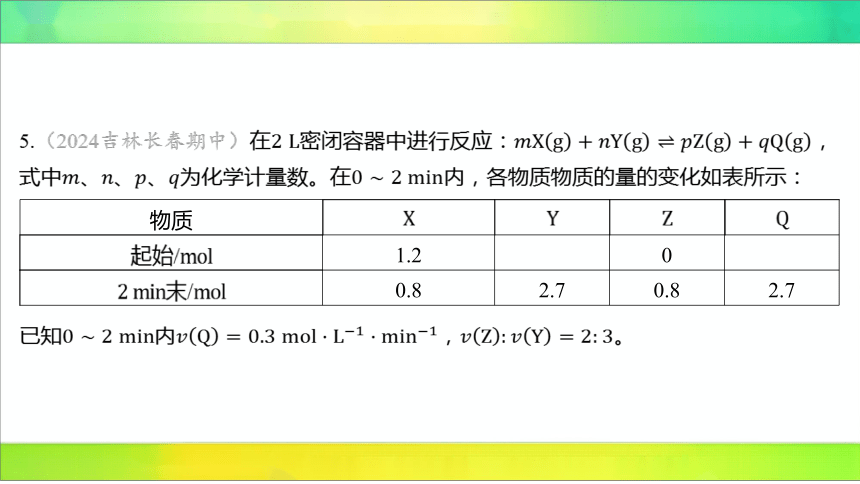
5.(2024吉林长春期中)在密闭容器中进行反应: ,
式中、、、为化学计量数。在 内,各物质物质的量的变化如表所示:
物质
起始/ 1.2 0
末/ 0.8 2.7 0.8 2.7
已知内, 。
(1) 试确定以下物质的物质的量:起始时________, ________。
【解析】 设起始时、的物质的量分别为、 ,则
,则,再根据可知, ,解得
。
(2) 化学方程式中___,___,___, ___。
1
3
2
3
【解析】 根据(1)分析知,、、、分别为、 、
、 ,反应中各物质的物质的量的变化量之比等于化学计量数之比,则
,由于化学计量数取最小整数,
故、、、 。
(3) 用表示 内的反应速率___________________。
【解析】 根据(2)分析知化学方程式为 ,则
, 。
能力觉醒
6.(2023四川成都期末)实验室用如图装置测定化学反应速率,下
列说法错误的是( )
D
A.实验前关闭分液漏斗活塞,向右拉注射器活塞,检查装置气密性
B.用 的体积变化表示化学反应速率可能会因为反应放热而不准确
C.改用恒压滴液漏斗可以消除加入稀硫酸所占体积带来的误差
D.根据单位时间内锌粒质量的变化不能表示反应速率
【解析】 A(√)该实验有气体生成,为防止实验中气体逸出造成
实验误差,实验前应关闭分液漏斗活塞,向右拉注射器活塞,检查
装置气密性,若停止用力后,活塞恢复原位说明装置气密性良好。
B(√)锌与稀硫酸的反应为放热反应,若没有冷却至反应前温度,
反应放出的热量会使测得的氢气体积偏大,导致用氢气的体积变化
表示化学反应速率出现误差。
C(√)恒压滴液漏斗可以减小增加的液体对气体压强的影响,从而在测量气体体积时
更加准确,所以改用恒压滴液漏斗可以消除加入稀硫酸所占体积带来的误差。
D(×)可以根据单位时间内锌粒质量的变化表示反应速率,若时间单位为 ,反应速率
的单位为 。
7.已知,的催化氧化反应为① ,反应
过程中存在副反应②和③ ,向 的反
应器中加入和足量氧气,后检测到反应器中有、
和,则用 表示反应①的化学反应速率为( )
D
A. B.
C. D.
【解析】 后检测到反应器中有、和 ,则反应
①共生成,即共消耗 ,
。
8.(大招22)(2024山西长治期末)恒温条件下,向体积为 的恒容密闭容器中充入
与发生反应,反应 后达到平衡,
此时的物质的量减少,的物质的量浓度为, 内,
用表示反应的平均速率为 ,下列说法错误的是( )
D
A.该反应的化学方程式为
B.时,减少了
C.内,用表示的平均反应速率为
D.反应前后容器内气体的压强之比为
【解析】 (【易错】易因忽视容器体积
而计算错误)
(√)B(√)反应中各物质的物质的量的变化量之比等于化学计量数之比,则
,则反应的化学方程式为 。
C(√),则 。
D(×)恒温恒容条件下压强之比等于气体的物质的量之比,故反应前后容器内压强之
比为 。
9.(2024陕西师范大学附中检测)一定温度下,在的四氯化碳溶液 中发
生分解反应:。在不同时刻测量放出的体积,换算成 的浓
度如下表:
0 600 1 200 1 710 2 220 2 820
1.40 0.96 0.66 0.48 0.35 0.24
下列说法正确的是( )
D
A.,生成的平均速率为
B.反应至时,放出的体积为
C.反应过程中
D.随着反应进行,反应速率逐渐减小
【解析】 A(×)在,的浓度减少了 ,根据物质反应
转化关系可知,在此时间段内生成的浓度为,因此,生成 的平均
速率 。
B(×) 题中未指明是标准状况,因此无法确定氧气的具体体积。
由表中数据可知,反应从起始至时,的浓度减少了 ,即
减少了,则生成的物质的量为 ,
因此,放出的在标准状况下的体积为 。
C(×)用不同物质表示的反应速率之比等于其化学计量数之比, 。
D(√)根据题表数据知,每 的变化量逐渐减小,故反应速率逐渐减小。
10.(2024江苏无锡太湖高级中学期中)已知:反应
,某温度下,在 的密闭容器
中投入一定量的A、B,两种气体的物质的量浓度随时
间变化的曲线如图所示:
(1) 从反应开始到 时,用A的浓度变化表示的反
应速率为__________________。
【解析】 从反应开始到 时,A的浓度的变化量为
, 。
(2) 经测定前内 ,则该
反应的化学方程式为____________________。
【解析】 前内 ,则
。由图像可知 内,
, ,
。内,A的浓度的变化量为 ,即
,所以 ,所以该反应的化学方程式为
。
(3) 请在图中将生成物C的物质的量浓度随时间的变化曲线绘制出来。
【答案】
【解析】 生成物C的浓度从0开始增加,到时达到最大, ,所以
,图中两条曲线的交点处A和B的物质的量浓度均
为,此时C的物质的量浓度为 ,以此绘出C的曲线。
(4) (大招22)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段
时间后,测得三个容器中的反应速率分别为甲中 ;乙中
;丙中 ,则甲、乙、丙三个容器
中反应速率最快的是____。
乙
【解析】 方法一(归一法) 将用不同物质表示的
化学反应速率都转化为用A表示的化学反应速率,同时注意单位
的统一。甲容器中 ,乙容器中
,
方法二(比值法)甲容器中
,乙容器中
丙容器中
,所以三个容器中反应速率大小为乙 甲 丙。
,丙容器中 ,
所以三个容器中反应速率大小为乙 甲 丙。
第2章 化学反应的方向、限度与速率
2025年高考化学一轮复习
选择性必修第一册鲁科版
第3节 化学反应的速率
课时2 影响化学反应速率的因素
题型觉醒
题型一 有效碰撞理论和活化能
1.(2024浙江嘉兴八校联考)下列有关碰撞理论的说法正确的是( )
B
A.活化分子的每一次碰撞都能发生化学反应
B.能发生有效碰撞的分子一定是活化分子
C.活化能的大小不仅意味着一般分子成为活化分子的难易,也会对化学反应前后的能量
变化产生影响
D.催化剂能增大反应的活化能,从而加快反应速率
【解析】 A(×)活化分子的碰撞不一定都能发生化学反应,只有活化分
子的碰撞取向合适时才能发生化学反应。
B(√)有效碰撞是能发生化学反应的碰撞,所以能发生有效碰撞的分子一定是活化分子。
C(×)活化能的大小对化学反应前后的能量变化不产生影响。
D(×)使用催化剂 降低反应的活化能 活化分子百分数增加 总分子数不变,单位
体积内活化分子数增加 单位时间、单位体积内有效碰撞次数增加 化学反应速率增大。
2.(2024山东部分学校联考)下列说法正确的是( )
A
A.活化能接近零的反应,当反应物相互接触时,反应瞬间完成,而且温度对其反应速率
几乎没有影响
B.升高温度和增大压强(减小容器体积)都是通过增大活化分子百分数来加快化学反应
速率的
C.人们把能够发生有效碰撞的分子叫做活化分子,把活化分子具有的能量叫做活化能
D.只要条件合适,普通分子之间的碰撞也可能是有效碰撞
【解析】 A(√)活化能接近零的反应,几乎所有分子都是活化分子,只
要接触就可迅速反应,反应瞬间完成,故温度对其反应速率的影响不大。
B(×)升高温度,活化分子百分数增加 单位体积内分子数不变,单位体积内活化分
子总数增加 单位时间、单位体积内有效碰撞次数增加 化学反应速率增大;增大压
强(减小容器体积),单位体积内分子数增加 活化分子百分数不变,单位体积内活
化分子总数增加 单位时间、单位体积内有效碰撞次数增加 化学反应速率增大。
C(×)活化能是指活化分子具有的平均能量与反应物分子具有的平均能量之差。
D(×)发生有效碰撞的分子一定是活化分子。
题型二 影响化学反应速率的因素
3.(2023广东广州十七中期中)关于反应 ,下
列说法正确的是( )
C
A.其他条件不变时,增加碳的量,化学反应速率增大
B.其他条件不变时,升高温度,正反应速率增大,逆反应速率减小
C.其他条件不变时,缩小容器的体积,增大压强,化学反应速率增大
D.其他条件不变时,向体积不变的密闭容器中充入 ,正反应速率增大,逆反应
速率减小
【解析】 A(×)“两个核心”之浓度,碳是固体,浓度可视为常数,只增大碳
的量时化学反应速率不变。(【点拨】改变固体或纯液体的量,对化学反应速率无影响)
B(×)“两个核心”之能量,温度升高 活化分子百分数增大 分子总数不变,单位体
积内活化分子数增多 单位时间、单位体积内有效碰撞次数增多 正、逆反应速率均
增大。(【易错】温度对化学反应速率的影响规律对吸热反应、放热反应都适用)
C(√)“两个核心”之浓度,其他条件不变时,缩小容器的体积,增大压强,气体的浓度
增大 单位体积内气体分子数增多 活化分子百分数不变,单位体积内活化分子数增
多 单位时间、单位体积内有效碰撞次数增多 化学反应速率增大。
D(×)“两个核心”之浓度,其他条件不变时,向体积不变的密闭容器中充入 ,
的浓度增大 单位体积内气体分子数增多 活化分子百分数不变,单位体积内
活化分子数增多 单位时间、单位体积内有效碰撞次数增多 正反应速率增大,单位
时间内产生的、 浓度增大,逆反应速率也增大。
4.(2024江苏丰城中学月考)一定温度下,向一恒容密闭容器中充入 和
,发生反应: ,下列有关该反应的说法正确
的是( )
B
A.其他条件不变,升高温度,(正) 增大, (逆)减小
B.其他条件不变,移走一定量的,(正) 、 (逆)都下降
C.温度不变,向该容器中充入气体 ,反应速率增大
D.温度不变,将容器体积增大,反应速率也增大
【解析】 A(×)“两个核心”之能量,升高温度 活化分子百分数增大
分子总数不变,单位体积内活化分子数增多 单位时间、单位体积内有效碰撞次数增
多 正、逆反应速率均增大。
B(√)“两个核心”之浓度,移走一定量的 ,平衡右移,反应物、生成物的浓度均减
小 单位体积内气体分子数减少 活化分子百分数不变,单位体积内活化分子数减少
单位时间、单位体积内有效碰撞次数减少 正、逆反应速率均减慢。
C(×)“两个核心”之浓度,恒容下充入无关气体,反应物浓度不变 (【点拨】对于有
气体参加的反应,改变压强,化学反应速率是否改变取决于气体物质的分压或浓度是否
改变) 单位体积内与反应有关的分子数不变 活化分子百分数不变,单位体积内
活化分子数不变 化学反应速率不变。
D(×)“两个核心”之浓度,对有气体参加的化学反应,扩大容器的体积使压强减小
气体的浓度减小 单位体积内气体分子数减少 活化分子百分数不变,单位体积内活
化分子数减少 单位时间、单位体积内有效碰撞次数减少 化学反应速率减慢。
题型三 化学反应速率图像分析
5.(2023北京第三中学期中)某学生用纯净的 与
过量浓反应制取 气体,实验结果如
图所示(气体体积已换算为标准状况下的体积,且
忽略溶液体积变化)。下列说法正确的是( )
C
A. 段表示的反应速率最快
B. 段反应速率加快,仅因为产物有催化作用
C. 内用浓硝酸表示的反应速率为
D.向反应体系中加入固体 对反应速率无影响
【解析】 A(×)方法一,看斜率,由图像可知
段曲线斜率最大,反应速率最快。
方法二,看变量,相同时间内 段产生的气体最多,
所以 段表示的反应速率最快。
B(×) 段反应速率加快,还可能是因为反应放
热,体系温度升高。
C(√) 与浓硝酸反应的化学方程式为
, 内共产生
, ,所以用浓硝酸表
示的反应速率为 。
D(×)“两个核心”之浓度,向反应体系中加入固体
,溶液中硝酸根离子浓度增大(【点拨】对于
离子反应,只有参加反应的离子的浓度发生变化,
才会引起化学反应速率的改变) 单位体积内
与反应有关的微粒数增加 单位体积内活化分子数
增加 单位时间、单位体积内有效碰撞次数增加
反应速率增大。
能力觉醒
6.(大招24)(2023湖南长沙雅礼中学期中)过量锌粒与 的稀盐
酸反应,反应速率太慢。为了加快此反应速率而不改变 的产量,可以使用如下方法
中的( )
A
①改用锌粉 ②滴入几滴浓
③滴入几滴浓盐酸 ④加固体 ⑤加 固体 ⑥升高温度(不考虑盐酸挥发)
⑦改用盐酸 ⑧加少量 固体
A.①⑥⑦⑧ B.①④⑥⑧ C.①③⑥⑦ D.①②⑥⑦
【解析】 ①(√)“两个核心”之浓度,改用锌粉可以增大接触面积,提高
反应速率,且不会改变 产量。
②(×)滴入几滴浓硝酸后会生成,改变 的产量。
③(×)滴入几滴浓盐酸后会改变 的产量。
④(×)“两个核心”之浓度,加固体后,与结合,瞬时 浓度
减小,反应速率降低。
⑤(×)加入 固体对反应速率无影响。
⑥(√)“两个核心”之能量,升高温度 单位体积内分子数不变,活化分子百分数增大
单位体积内活化分子数增大 单位时间内有效碰撞次数增大 反应速率增大,且不
会改变 的产量。
⑦(√)“两个核心”之浓度,改用盐酸,反应物浓度增大 单位体
积内与反应有关的微粒数增多 活化分子百分数增大,单位体积内活化分子数增多
化学反应速率增大,且不会改变 的产量。
⑧(√)加少量固体可以生成,、 可以构成原电池,提高反应速率,且不
会改变 的产量。
7.(2024河北邢台联考)由下列实验事实得出的相应结论不正确的是( )
选项 实验事实 结论
A 其他条件相同,溶液和 溶液反应, 升高溶液的温度,析出硫沉淀所需时间缩短 当其他条件不变时,升高反
应温度,化学反应速率加快
B 铁在空气中和在纯氧中反应的剧烈程度明显不同 空气中的某种成分可以加快
铁与氧气的化学反应速率
C 晶体和 晶体混合后,无明显现象,若一起 投入水中,很快生成红色 当其他条件不变时,增大反
应物接触面积可加快反应速
率
D 向A、B两支试管中分别加入等体积的 溶 液,在B试管中加入滴 溶液,B试管中产 生气泡快 当其他条件不变时,催化剂
可以改变化学反应速率
B
【解析】 A(√)其他条件相同,溶液和 溶液反应,升高溶液的温度,
析出硫沉淀所需时间缩短,说明其他条件不变时,升高反应温度,化学反应速率加快。
B(×)铁在空气中和在纯氧中反应的剧烈程度明显不同,说明反应物浓度会影响化学
反应速率。
C (√) 晶体和 晶体混合后,无明显现象,一起投入水中,接触面积增大,很
快生成红色 ,说明增大接触面积能加快反应速率。
D(√)向A、B两支试管中分别加入等体积的过氧化氢溶液,在B试管中加入 滴
氯化铁溶液(【拓展】过渡金属元素的部分化合物可作催化剂),B试管中产生气泡快,
说明催化剂可以改变化学反应速率。
8.(2024广东广州执信中学期中)实验室中在相
同温度下对溶液中影响 分解速率的因素进
行研究,有关实验数据如图所示。下列说法正
确的是( )
D
A.内,Ⅰ中的 分解速率为
B.水样酸性越强, 的分解速率越慢
C.内,Ⅲ中 的分解百分率比Ⅱ小
D.由于存在,Ⅳ中 的分解速率比Ⅲ快
【解析】 A (×) 内,Ⅰ中 的浓度变化为 ,分解速率为
。
B(×)对比曲线Ⅰ、曲线Ⅱ可知,酸性越强,
分解速率越快。
C(×)根据图可知,曲线Ⅱ对应的的初始浓度为, 内,
的浓度变化约为, 分解率约为,曲线Ⅲ对应的
的初始浓度为,相同时间内的浓度变化超过,
则 分解率大于 。
D(√)对比曲线Ⅲ和Ⅳ可知, 相同的情况下,
曲线Ⅳ对应的分解速率更快,说明 可催
化 分解。
9.(大招24)(2024江西新余一中检测)反应速率 和反应物浓度的关系是用实验方法
测定的。化学反应的反应速率 可表示为
,式中为反应速率常数,、 的值可由下表中数据确定。
实验序号
① 1.0 1.0
② 2.0 1.0
③ 2.0 4.0
下列说法正确的是( )
A.在上述反应中,、、的反应速率之比为
B.加入催化剂,正反应速率增大,逆反应速率减小
C.上述化学反应速率表达式中、
D.相同条件下,的浓度对反应速率的影响小于 的浓度对反应速率的影响
√
【解析】 A(×)化学反应速率之比等于对应物质的化学计量数之比,故、、
的反应速率之比应为 。
B(×) “两个核心”之能量,加入催化剂 单位体积内分子数不变,活化分
子百分数增大 单位体积内活化分子数增大 单位时间内有效碰撞次数增大 正、逆
反应速率均增大。
C(√),由题表②、③数据可知, 、
,解得、 。
D(×) (【提醒】对于很多反应,反应速率方程中浓度的指数与
化学方程式中各物质化学式前的系数并无确定关系),氢气的浓度对反应速率的影响程
度大于氯气。
10.(2024福建厦门湖滨中学期中)某温度下,降冰片烯在钛杂环丁烷催化下聚合,反
应物浓度与催化剂浓度及时间关系如图所示。已知反应物消耗一半所需的时间称为半衰
期,下列说法错误的是( )
B
A.其他条件相同时,催化剂浓度越大,反应速率越大
B.其他条件相同时,降冰片烯浓度越大,反应速率越大
C.条件①,反应速率为
D.条件②,降冰片烯起始浓度为 时,半衰期
为
【解析】 A(√)根据曲线①、②可知,其他条件相同时,催化
剂浓度越大,反应速率越大。
B(×)(【易错】易因思维定式,认为浓度越大反应速率越大,
而认为B项正确) C(√)根据曲线①、③对应的反应物浓度和
反应时间,可计算出其对应的反应速率分别为
,所以
反应速率与降冰片烯浓度无关。(【点拨】也可根据斜率直接判断,曲线①、③斜率
相同,故其他条件相同时,反应速率与降冰片烯浓度无关)
D(√)结合题图可知,条件②下降冰片烯完全反应耗时 ,则对应的半衰期为
。
11.(2024河南郑州外国语学校调研)Ⅰ. 用于照相业定影剂、鞣革时重铬酸盐的
还原剂等。
(1) 溶液与稀硫酸的反应可探究外界条件对化学反应速率的影响,
溶液与稀硫酸反应的化学方程式为____________________________________________。
【解析】 溶液与稀硫酸反应的化学方程式为
。
(2) 某同学探究影响硫代硫酸钠溶液与稀硫酸反应速率的因素时,设计如表所示系列
实验:
实验序 号 反应温度/ 溶液 稀
① 20 10.0 0.10 10.0 0.50 0
② 40 0.10 0.50
③ 20 0.10 4.0 0.50
该实验①、②可探究______对反应速率的影响,因此_____,_____, ___;
实验①、③可探究_______________对反应速率的影响,因此_____, ____。
温度
10.0
10.0
0
稀的浓度
10.0
6.0
【解析】 实验①、②的温度不同,则该实验①、②可探究温度对反应速率的影响,因
此其他条件应完全相同(【点拨】注意变量控制方法的应用),则 ,
,;实验①、③稀的体积不同,则实验①、③可探究稀 的
浓度对反应速率的影响,,为保证混合后溶液的总体积相同, 。
Ⅱ.某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入
酸性高锰酸钾溶液时
,
猜想Ⅰ:此反应过程放热,温度升高,反应速率加快;
猜想Ⅱ:……
(3) 猜想Ⅱ可能是________________________________。
生成的对该反应具有催化作用
【解析】 该反应的速率先增大,除了该反应为放热反应外,还有可能是反应新生成的
物质对反应具有催化作用,使反应速率加快,则猜想Ⅱ可能是生成的 对该反应具有
催化作用。
反应速率随时间的变化如图所示,小组成员探究 内反应速率变快的主要原因,
为此“异常”现象展开讨论,猜想造成这种现象最可能的原因有两种。
(4) 基于猜想Ⅱ成立,设计方案进行实验,请完成以下实验记录表内容。
加入 试剂 溶 液、 酸性 溶液 溶液、
酸性 溶液,少量
_______固体
实验 现象 褪色时间 褪色时间___ (填“ ”“ ”或“ ”)
结论 猜想Ⅱ正确
【解析】 为证明对该反应具有催化作用,在对比实验中加入少量 固体,若
褪色时间小于,则说明 对该反应具有催化作用。
素养觉醒
12.(2023山东模拟)已知。 时,向一恒容密闭
容器中充入一定量 ,发生上述反应,测得的数据如表所示。上述反应的正、逆反
应速率分别为和,、 为速率常数,只受
温度的影响。下列说法不正确的是( )
时间/ 0 500 1 000 1 500 2 000 2 500 3 000
5.00 3.52 2.40 1.75 1.23 1.00 1.00
A. 后,该反应体系内气体的平均相对分子质量不再发生变化
B.内,用表示的平均反应速率为
C.
D.若该反应在下的平衡常数为,则
√
【解析】 A(√)题给反应是气体分子数增大的吸热反应,由题给表格信息可知,
后,反应已达到平衡状态,故反应体系内气体的平均相对分子质量不再发生变
化。
B(√)由题给热化学方程式可知,,内,用 表示
的平均反应速率为 。
C(×)当反应达到平衡后,, 、
,,则 。
D(√)该反应在下的,又 ,降低温度,平
衡逆向移动,平衡常数减小,若在时平衡常数为,则 。
第2章 化学反应的方向、限度与速率
2025年高考化学一轮复习
选择性必修第一册鲁科版
第3节 化学反应的速率
课时1 化学反应速率
题型觉醒
题型一 化学反应的历程
1.(原创,双选)下列有关反应历程和基元反应的理解不正确的是( )
CD
A.同一个化学反应的反应历程可能不同
B.反应历程是由基元反应构成的反应序列
C.所有的化学反应都由多个基元反应构成
D.简单反应的反应速率一定比复杂反应的速率快
【解析】 A(√)不同条件时,同一个反应的反应历程不同。
B(√)基元反应构成的反应序列称为反应历程。
C(×)某些化学反应是由多个基元反应构成的,而还有一些反应其本身就是基元反应。
D(×)反应历程的差别造成了反应速率的不同,但简单反应的反应速率不一定比复杂
反应的速率快。
题型二 化学反应速率的计算
2.(2024四川遂宁期中)反应,经过 后,B的浓度
减少了 。下列反应速率的表示正确的是( )
B
A.内,用A表示的反应速率是
B.内,用C表示的反应速率是
C.末时,用B表示的反应速率是
D.在 内用B表示的反应速率的值是减小的,用C表示的反应速率的值逐渐增大
【解析】 A(×)A为固体,不能用固体的浓度表示化学反应速率
(【点拨】对于固体和纯液体,其浓度可视为常数,一般不用来表示化学反应速率)。
(√)内, ,根据各物
质的化学反应速率之比等于反应方程式中化学计量数之比,可知 ,
。
C(×)表示的是内的平均反应速率,不是
末的瞬时反应速率。
D(×)用不同物质表示的反应速率,反应速率之比等于化学方程式中的化学计量数之
比,不管反应速率是用反应物表示还是用生成物表示,随着反应的进行,反应速率都是
逐渐减小的,故 内用B和C表示的反应速率都是逐渐减小的。
题型三 化学反应速率大小的比较
3.(2024江西南昌一中月考)已知密闭容器中发生反应
,在四种不同条件下测得的反应速率分别如
下:
则四种条件下反应速率快慢的比较正确的是( )
C
① ②
③ ④ 。
A. B.
C. D.
【解析】
方法一(归一法) 将用不同物质表示的化学反应速率都转化为用 表示的化学反应
速率,同时注意单位的统一。
① 、
② 、
③ 、
④ ,
故四种不同条件下反应速率 。
方法二(比值法) 不同物质表示的速率与其化学计量数的比值越大,其表示的反应速
率越快,同时注意单位的统一。
① 、
② 、
③ 、
④ ,
故四种不同条件下反应速率 。
题型四 化学方程式的确定
4.(2024浙江台州八校联考)一定温度下,、 、
三种气体在某恒容密闭容器中发生反应,其中气
体的物质的量变化曲线如图所示。下列说法正确
的是( )
C
A.点 的正反应速率和逆反应速率相等
B.从开始至达到平衡时用 表示的平均反应速率是
C.该反应的化学方程式可表示为:
D.达到平衡后,各物质的反应速率为0
【解析】 A(×)点反应还未达到平衡, 的正
反应速率和逆反应速率不相等。
B(×)从开始至达到平衡时,
,但题
中没有说明容器的体积,不能计算用 浓度变化表
示的平均反应速率。
C(√) 比值法,由图像可知反应从开
D(×)达到平衡后,各物质的反应速率不变,但不为0。
始至达到平衡时, ,
,, ,则相同
时间内,其中、为反应物, 为生成
物,相同时间内,化学反应速率之比等于化学计量数之比,故该反应的化学方程式为
。
5.(2024吉林长春期中)在密闭容器中进行反应: ,
式中、、、为化学计量数。在 内,各物质物质的量的变化如表所示:
物质
起始/ 1.2 0
末/ 0.8 2.7 0.8 2.7
已知内, 。
(1) 试确定以下物质的物质的量:起始时________, ________。
【解析】 设起始时、的物质的量分别为、 ,则
,则,再根据可知, ,解得
。
(2) 化学方程式中___,___,___, ___。
1
3
2
3
【解析】 根据(1)分析知,、、、分别为、 、
、 ,反应中各物质的物质的量的变化量之比等于化学计量数之比,则
,由于化学计量数取最小整数,
故、、、 。
(3) 用表示 内的反应速率___________________。
【解析】 根据(2)分析知化学方程式为 ,则
, 。
能力觉醒
6.(2023四川成都期末)实验室用如图装置测定化学反应速率,下
列说法错误的是( )
D
A.实验前关闭分液漏斗活塞,向右拉注射器活塞,检查装置气密性
B.用 的体积变化表示化学反应速率可能会因为反应放热而不准确
C.改用恒压滴液漏斗可以消除加入稀硫酸所占体积带来的误差
D.根据单位时间内锌粒质量的变化不能表示反应速率
【解析】 A(√)该实验有气体生成,为防止实验中气体逸出造成
实验误差,实验前应关闭分液漏斗活塞,向右拉注射器活塞,检查
装置气密性,若停止用力后,活塞恢复原位说明装置气密性良好。
B(√)锌与稀硫酸的反应为放热反应,若没有冷却至反应前温度,
反应放出的热量会使测得的氢气体积偏大,导致用氢气的体积变化
表示化学反应速率出现误差。
C(√)恒压滴液漏斗可以减小增加的液体对气体压强的影响,从而在测量气体体积时
更加准确,所以改用恒压滴液漏斗可以消除加入稀硫酸所占体积带来的误差。
D(×)可以根据单位时间内锌粒质量的变化表示反应速率,若时间单位为 ,反应速率
的单位为 。
7.已知,的催化氧化反应为① ,反应
过程中存在副反应②和③ ,向 的反
应器中加入和足量氧气,后检测到反应器中有、
和,则用 表示反应①的化学反应速率为( )
D
A. B.
C. D.
【解析】 后检测到反应器中有、和 ,则反应
①共生成,即共消耗 ,
。
8.(大招22)(2024山西长治期末)恒温条件下,向体积为 的恒容密闭容器中充入
与发生反应,反应 后达到平衡,
此时的物质的量减少,的物质的量浓度为, 内,
用表示反应的平均速率为 ,下列说法错误的是( )
D
A.该反应的化学方程式为
B.时,减少了
C.内,用表示的平均反应速率为
D.反应前后容器内气体的压强之比为
【解析】 (【易错】易因忽视容器体积
而计算错误)
(√)B(√)反应中各物质的物质的量的变化量之比等于化学计量数之比,则
,则反应的化学方程式为 。
C(√),则 。
D(×)恒温恒容条件下压强之比等于气体的物质的量之比,故反应前后容器内压强之
比为 。
9.(2024陕西师范大学附中检测)一定温度下,在的四氯化碳溶液 中发
生分解反应:。在不同时刻测量放出的体积,换算成 的浓
度如下表:
0 600 1 200 1 710 2 220 2 820
1.40 0.96 0.66 0.48 0.35 0.24
下列说法正确的是( )
D
A.,生成的平均速率为
B.反应至时,放出的体积为
C.反应过程中
D.随着反应进行,反应速率逐渐减小
【解析】 A(×)在,的浓度减少了 ,根据物质反应
转化关系可知,在此时间段内生成的浓度为,因此,生成 的平均
速率 。
B(×) 题中未指明是标准状况,因此无法确定氧气的具体体积。
由表中数据可知,反应从起始至时,的浓度减少了 ,即
减少了,则生成的物质的量为 ,
因此,放出的在标准状况下的体积为 。
C(×)用不同物质表示的反应速率之比等于其化学计量数之比, 。
D(√)根据题表数据知,每 的变化量逐渐减小,故反应速率逐渐减小。
10.(2024江苏无锡太湖高级中学期中)已知:反应
,某温度下,在 的密闭容器
中投入一定量的A、B,两种气体的物质的量浓度随时
间变化的曲线如图所示:
(1) 从反应开始到 时,用A的浓度变化表示的反
应速率为__________________。
【解析】 从反应开始到 时,A的浓度的变化量为
, 。
(2) 经测定前内 ,则该
反应的化学方程式为____________________。
【解析】 前内 ,则
。由图像可知 内,
, ,
。内,A的浓度的变化量为 ,即
,所以 ,所以该反应的化学方程式为
。
(3) 请在图中将生成物C的物质的量浓度随时间的变化曲线绘制出来。
【答案】
【解析】 生成物C的浓度从0开始增加,到时达到最大, ,所以
,图中两条曲线的交点处A和B的物质的量浓度均
为,此时C的物质的量浓度为 ,以此绘出C的曲线。
(4) (大招22)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段
时间后,测得三个容器中的反应速率分别为甲中 ;乙中
;丙中 ,则甲、乙、丙三个容器
中反应速率最快的是____。
乙
【解析】 方法一(归一法) 将用不同物质表示的
化学反应速率都转化为用A表示的化学反应速率,同时注意单位
的统一。甲容器中 ,乙容器中
,
方法二(比值法)甲容器中
,乙容器中
丙容器中
,所以三个容器中反应速率大小为乙 甲 丙。
,丙容器中 ,
所以三个容器中反应速率大小为乙 甲 丙。
第2章 化学反应的方向、限度与速率
2025年高考化学一轮复习
选择性必修第一册鲁科版
第3节 化学反应的速率
课时2 影响化学反应速率的因素
题型觉醒
题型一 有效碰撞理论和活化能
1.(2024浙江嘉兴八校联考)下列有关碰撞理论的说法正确的是( )
B
A.活化分子的每一次碰撞都能发生化学反应
B.能发生有效碰撞的分子一定是活化分子
C.活化能的大小不仅意味着一般分子成为活化分子的难易,也会对化学反应前后的能量
变化产生影响
D.催化剂能增大反应的活化能,从而加快反应速率
【解析】 A(×)活化分子的碰撞不一定都能发生化学反应,只有活化分
子的碰撞取向合适时才能发生化学反应。
B(√)有效碰撞是能发生化学反应的碰撞,所以能发生有效碰撞的分子一定是活化分子。
C(×)活化能的大小对化学反应前后的能量变化不产生影响。
D(×)使用催化剂 降低反应的活化能 活化分子百分数增加 总分子数不变,单位
体积内活化分子数增加 单位时间、单位体积内有效碰撞次数增加 化学反应速率增大。
2.(2024山东部分学校联考)下列说法正确的是( )
A
A.活化能接近零的反应,当反应物相互接触时,反应瞬间完成,而且温度对其反应速率
几乎没有影响
B.升高温度和增大压强(减小容器体积)都是通过增大活化分子百分数来加快化学反应
速率的
C.人们把能够发生有效碰撞的分子叫做活化分子,把活化分子具有的能量叫做活化能
D.只要条件合适,普通分子之间的碰撞也可能是有效碰撞
【解析】 A(√)活化能接近零的反应,几乎所有分子都是活化分子,只
要接触就可迅速反应,反应瞬间完成,故温度对其反应速率的影响不大。
B(×)升高温度,活化分子百分数增加 单位体积内分子数不变,单位体积内活化分
子总数增加 单位时间、单位体积内有效碰撞次数增加 化学反应速率增大;增大压
强(减小容器体积),单位体积内分子数增加 活化分子百分数不变,单位体积内活
化分子总数增加 单位时间、单位体积内有效碰撞次数增加 化学反应速率增大。
C(×)活化能是指活化分子具有的平均能量与反应物分子具有的平均能量之差。
D(×)发生有效碰撞的分子一定是活化分子。
题型二 影响化学反应速率的因素
3.(2023广东广州十七中期中)关于反应 ,下
列说法正确的是( )
C
A.其他条件不变时,增加碳的量,化学反应速率增大
B.其他条件不变时,升高温度,正反应速率增大,逆反应速率减小
C.其他条件不变时,缩小容器的体积,增大压强,化学反应速率增大
D.其他条件不变时,向体积不变的密闭容器中充入 ,正反应速率增大,逆反应
速率减小
【解析】 A(×)“两个核心”之浓度,碳是固体,浓度可视为常数,只增大碳
的量时化学反应速率不变。(【点拨】改变固体或纯液体的量,对化学反应速率无影响)
B(×)“两个核心”之能量,温度升高 活化分子百分数增大 分子总数不变,单位体
积内活化分子数增多 单位时间、单位体积内有效碰撞次数增多 正、逆反应速率均
增大。(【易错】温度对化学反应速率的影响规律对吸热反应、放热反应都适用)
C(√)“两个核心”之浓度,其他条件不变时,缩小容器的体积,增大压强,气体的浓度
增大 单位体积内气体分子数增多 活化分子百分数不变,单位体积内活化分子数增
多 单位时间、单位体积内有效碰撞次数增多 化学反应速率增大。
D(×)“两个核心”之浓度,其他条件不变时,向体积不变的密闭容器中充入 ,
的浓度增大 单位体积内气体分子数增多 活化分子百分数不变,单位体积内
活化分子数增多 单位时间、单位体积内有效碰撞次数增多 正反应速率增大,单位
时间内产生的、 浓度增大,逆反应速率也增大。
4.(2024江苏丰城中学月考)一定温度下,向一恒容密闭容器中充入 和
,发生反应: ,下列有关该反应的说法正确
的是( )
B
A.其他条件不变,升高温度,(正) 增大, (逆)减小
B.其他条件不变,移走一定量的,(正) 、 (逆)都下降
C.温度不变,向该容器中充入气体 ,反应速率增大
D.温度不变,将容器体积增大,反应速率也增大
【解析】 A(×)“两个核心”之能量,升高温度 活化分子百分数增大
分子总数不变,单位体积内活化分子数增多 单位时间、单位体积内有效碰撞次数增
多 正、逆反应速率均增大。
B(√)“两个核心”之浓度,移走一定量的 ,平衡右移,反应物、生成物的浓度均减
小 单位体积内气体分子数减少 活化分子百分数不变,单位体积内活化分子数减少
单位时间、单位体积内有效碰撞次数减少 正、逆反应速率均减慢。
C(×)“两个核心”之浓度,恒容下充入无关气体,反应物浓度不变 (【点拨】对于有
气体参加的反应,改变压强,化学反应速率是否改变取决于气体物质的分压或浓度是否
改变) 单位体积内与反应有关的分子数不变 活化分子百分数不变,单位体积内
活化分子数不变 化学反应速率不变。
D(×)“两个核心”之浓度,对有气体参加的化学反应,扩大容器的体积使压强减小
气体的浓度减小 单位体积内气体分子数减少 活化分子百分数不变,单位体积内活
化分子数减少 单位时间、单位体积内有效碰撞次数减少 化学反应速率减慢。
题型三 化学反应速率图像分析
5.(2023北京第三中学期中)某学生用纯净的 与
过量浓反应制取 气体,实验结果如
图所示(气体体积已换算为标准状况下的体积,且
忽略溶液体积变化)。下列说法正确的是( )
C
A. 段表示的反应速率最快
B. 段反应速率加快,仅因为产物有催化作用
C. 内用浓硝酸表示的反应速率为
D.向反应体系中加入固体 对反应速率无影响
【解析】 A(×)方法一,看斜率,由图像可知
段曲线斜率最大,反应速率最快。
方法二,看变量,相同时间内 段产生的气体最多,
所以 段表示的反应速率最快。
B(×) 段反应速率加快,还可能是因为反应放
热,体系温度升高。
C(√) 与浓硝酸反应的化学方程式为
, 内共产生
, ,所以用浓硝酸表
示的反应速率为 。
D(×)“两个核心”之浓度,向反应体系中加入固体
,溶液中硝酸根离子浓度增大(【点拨】对于
离子反应,只有参加反应的离子的浓度发生变化,
才会引起化学反应速率的改变) 单位体积内
与反应有关的微粒数增加 单位体积内活化分子数
增加 单位时间、单位体积内有效碰撞次数增加
反应速率增大。
能力觉醒
6.(大招24)(2023湖南长沙雅礼中学期中)过量锌粒与 的稀盐
酸反应,反应速率太慢。为了加快此反应速率而不改变 的产量,可以使用如下方法
中的( )
A
①改用锌粉 ②滴入几滴浓
③滴入几滴浓盐酸 ④加固体 ⑤加 固体 ⑥升高温度(不考虑盐酸挥发)
⑦改用盐酸 ⑧加少量 固体
A.①⑥⑦⑧ B.①④⑥⑧ C.①③⑥⑦ D.①②⑥⑦
【解析】 ①(√)“两个核心”之浓度,改用锌粉可以增大接触面积,提高
反应速率,且不会改变 产量。
②(×)滴入几滴浓硝酸后会生成,改变 的产量。
③(×)滴入几滴浓盐酸后会改变 的产量。
④(×)“两个核心”之浓度,加固体后,与结合,瞬时 浓度
减小,反应速率降低。
⑤(×)加入 固体对反应速率无影响。
⑥(√)“两个核心”之能量,升高温度 单位体积内分子数不变,活化分子百分数增大
单位体积内活化分子数增大 单位时间内有效碰撞次数增大 反应速率增大,且不
会改变 的产量。
⑦(√)“两个核心”之浓度,改用盐酸,反应物浓度增大 单位体
积内与反应有关的微粒数增多 活化分子百分数增大,单位体积内活化分子数增多
化学反应速率增大,且不会改变 的产量。
⑧(√)加少量固体可以生成,、 可以构成原电池,提高反应速率,且不
会改变 的产量。
7.(2024河北邢台联考)由下列实验事实得出的相应结论不正确的是( )
选项 实验事实 结论
A 其他条件相同,溶液和 溶液反应, 升高溶液的温度,析出硫沉淀所需时间缩短 当其他条件不变时,升高反
应温度,化学反应速率加快
B 铁在空气中和在纯氧中反应的剧烈程度明显不同 空气中的某种成分可以加快
铁与氧气的化学反应速率
C 晶体和 晶体混合后,无明显现象,若一起 投入水中,很快生成红色 当其他条件不变时,增大反
应物接触面积可加快反应速
率
D 向A、B两支试管中分别加入等体积的 溶 液,在B试管中加入滴 溶液,B试管中产 生气泡快 当其他条件不变时,催化剂
可以改变化学反应速率
B
【解析】 A(√)其他条件相同,溶液和 溶液反应,升高溶液的温度,
析出硫沉淀所需时间缩短,说明其他条件不变时,升高反应温度,化学反应速率加快。
B(×)铁在空气中和在纯氧中反应的剧烈程度明显不同,说明反应物浓度会影响化学
反应速率。
C (√) 晶体和 晶体混合后,无明显现象,一起投入水中,接触面积增大,很
快生成红色 ,说明增大接触面积能加快反应速率。
D(√)向A、B两支试管中分别加入等体积的过氧化氢溶液,在B试管中加入 滴
氯化铁溶液(【拓展】过渡金属元素的部分化合物可作催化剂),B试管中产生气泡快,
说明催化剂可以改变化学反应速率。
8.(2024广东广州执信中学期中)实验室中在相
同温度下对溶液中影响 分解速率的因素进
行研究,有关实验数据如图所示。下列说法正
确的是( )
D
A.内,Ⅰ中的 分解速率为
B.水样酸性越强, 的分解速率越慢
C.内,Ⅲ中 的分解百分率比Ⅱ小
D.由于存在,Ⅳ中 的分解速率比Ⅲ快
【解析】 A (×) 内,Ⅰ中 的浓度变化为 ,分解速率为
。
B(×)对比曲线Ⅰ、曲线Ⅱ可知,酸性越强,
分解速率越快。
C(×)根据图可知,曲线Ⅱ对应的的初始浓度为, 内,
的浓度变化约为, 分解率约为,曲线Ⅲ对应的
的初始浓度为,相同时间内的浓度变化超过,
则 分解率大于 。
D(√)对比曲线Ⅲ和Ⅳ可知, 相同的情况下,
曲线Ⅳ对应的分解速率更快,说明 可催
化 分解。
9.(大招24)(2024江西新余一中检测)反应速率 和反应物浓度的关系是用实验方法
测定的。化学反应的反应速率 可表示为
,式中为反应速率常数,、 的值可由下表中数据确定。
实验序号
① 1.0 1.0
② 2.0 1.0
③ 2.0 4.0
下列说法正确的是( )
A.在上述反应中,、、的反应速率之比为
B.加入催化剂,正反应速率增大,逆反应速率减小
C.上述化学反应速率表达式中、
D.相同条件下,的浓度对反应速率的影响小于 的浓度对反应速率的影响
√
【解析】 A(×)化学反应速率之比等于对应物质的化学计量数之比,故、、
的反应速率之比应为 。
B(×) “两个核心”之能量,加入催化剂 单位体积内分子数不变,活化分
子百分数增大 单位体积内活化分子数增大 单位时间内有效碰撞次数增大 正、逆
反应速率均增大。
C(√),由题表②、③数据可知, 、
,解得、 。
D(×) (【提醒】对于很多反应,反应速率方程中浓度的指数与
化学方程式中各物质化学式前的系数并无确定关系),氢气的浓度对反应速率的影响程
度大于氯气。
10.(2024福建厦门湖滨中学期中)某温度下,降冰片烯在钛杂环丁烷催化下聚合,反
应物浓度与催化剂浓度及时间关系如图所示。已知反应物消耗一半所需的时间称为半衰
期,下列说法错误的是( )
B
A.其他条件相同时,催化剂浓度越大,反应速率越大
B.其他条件相同时,降冰片烯浓度越大,反应速率越大
C.条件①,反应速率为
D.条件②,降冰片烯起始浓度为 时,半衰期
为
【解析】 A(√)根据曲线①、②可知,其他条件相同时,催化
剂浓度越大,反应速率越大。
B(×)(【易错】易因思维定式,认为浓度越大反应速率越大,
而认为B项正确) C(√)根据曲线①、③对应的反应物浓度和
反应时间,可计算出其对应的反应速率分别为
,所以
反应速率与降冰片烯浓度无关。(【点拨】也可根据斜率直接判断,曲线①、③斜率
相同,故其他条件相同时,反应速率与降冰片烯浓度无关)
D(√)结合题图可知,条件②下降冰片烯完全反应耗时 ,则对应的半衰期为
。
11.(2024河南郑州外国语学校调研)Ⅰ. 用于照相业定影剂、鞣革时重铬酸盐的
还原剂等。
(1) 溶液与稀硫酸的反应可探究外界条件对化学反应速率的影响,
溶液与稀硫酸反应的化学方程式为____________________________________________。
【解析】 溶液与稀硫酸反应的化学方程式为
。
(2) 某同学探究影响硫代硫酸钠溶液与稀硫酸反应速率的因素时,设计如表所示系列
实验:
实验序 号 反应温度/ 溶液 稀
① 20 10.0 0.10 10.0 0.50 0
② 40 0.10 0.50
③ 20 0.10 4.0 0.50
该实验①、②可探究______对反应速率的影响,因此_____,_____, ___;
实验①、③可探究_______________对反应速率的影响,因此_____, ____。
温度
10.0
10.0
0
稀的浓度
10.0
6.0
【解析】 实验①、②的温度不同,则该实验①、②可探究温度对反应速率的影响,因
此其他条件应完全相同(【点拨】注意变量控制方法的应用),则 ,
,;实验①、③稀的体积不同,则实验①、③可探究稀 的
浓度对反应速率的影响,,为保证混合后溶液的总体积相同, 。
Ⅱ.某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入
酸性高锰酸钾溶液时
,
猜想Ⅰ:此反应过程放热,温度升高,反应速率加快;
猜想Ⅱ:……
(3) 猜想Ⅱ可能是________________________________。
生成的对该反应具有催化作用
【解析】 该反应的速率先增大,除了该反应为放热反应外,还有可能是反应新生成的
物质对反应具有催化作用,使反应速率加快,则猜想Ⅱ可能是生成的 对该反应具有
催化作用。
反应速率随时间的变化如图所示,小组成员探究 内反应速率变快的主要原因,
为此“异常”现象展开讨论,猜想造成这种现象最可能的原因有两种。
(4) 基于猜想Ⅱ成立,设计方案进行实验,请完成以下实验记录表内容。
加入 试剂 溶 液、 酸性 溶液 溶液、
酸性 溶液,少量
_______固体
实验 现象 褪色时间 褪色时间___ (填“ ”“ ”或“ ”)
结论 猜想Ⅱ正确
【解析】 为证明对该反应具有催化作用,在对比实验中加入少量 固体,若
褪色时间小于,则说明 对该反应具有催化作用。
素养觉醒
12.(2023山东模拟)已知。 时,向一恒容密闭
容器中充入一定量 ,发生上述反应,测得的数据如表所示。上述反应的正、逆反
应速率分别为和,、 为速率常数,只受
温度的影响。下列说法不正确的是( )
时间/ 0 500 1 000 1 500 2 000 2 500 3 000
5.00 3.52 2.40 1.75 1.23 1.00 1.00
A. 后,该反应体系内气体的平均相对分子质量不再发生变化
B.内,用表示的平均反应速率为
C.
D.若该反应在下的平衡常数为,则
√
【解析】 A(√)题给反应是气体分子数增大的吸热反应,由题给表格信息可知,
后,反应已达到平衡状态,故反应体系内气体的平均相对分子质量不再发生变
化。
B(√)由题给热化学方程式可知,,内,用 表示
的平均反应速率为 。
C(×)当反应达到平衡后,, 、
,,则 。
D(√)该反应在下的,又 ,降低温度,平
衡逆向移动,平衡常数减小,若在时平衡常数为,则 。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
