第4节 化学反应条件的优化——工业合成氨--2025年高考化学选择性必修第一册(鲁科版)(共37张PPT)
文档属性
| 名称 | 第4节 化学反应条件的优化——工业合成氨--2025年高考化学选择性必修第一册(鲁科版)(共37张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-06 20:54:14 | ||
图片预览








文档简介
(共37张PPT)
第2章 化学反应的方向、限度与速率
2025年高考化学一轮复习
选择性必修第一册鲁科版
第4节 化学反应条件的优化——工业合成氨
题型觉醒
题型一 合成氨反应的限度和速率
1.(2024浙江嘉兴八校联考)在合成氨工业中,要使氨的产率增大,同时又能提高化学
反应速率,可采取的措施有( )
C
①增大容器体积使压强减小 ②减小容器体积使压强增大 ③升高温度 ④降低温度 ⑤恒
温恒容,再充入等量的和 ⑥及时分离产生的 ⑦使用催化剂
A.②④⑤⑥ B.②③④⑤⑦ C.②⑤ D.①②③⑤⑦
【解析】 从反应速率的角度分析:增大反应物浓度、增大压强(减小容器体积)、使
用催化剂、升高温度均能加快反应速率,故②③⑤⑦均使化学反应速率加快,①④⑥均
使化学反应速率减慢。从平衡移动的角度分析:合成氨的反应为气体分子数减小的放热
反应,故②④⑤⑥均使合成氨的反应正向移动,氨的产率增大;①③均使合成氨的反应
逆向移动,氨的产率减小;⑦不影响化学平衡,氨的产率不变。故C项正确。
题型二 合成氨的适宜生产条件
2.(2024广东深圳外国语学校联考)下列有关合成氨工业的说法正确的是( )
D
A.、的投料比采用(物质的量比)而不是,是为了提高 的转化率
B.反应温度控制在 左右,目的是使化学平衡向正反应方向移动
C.压强采用 ,是因为该条件下催化剂的活性最好
D.不断将氨液化并移去液氨,目的是使平衡正向移动
【解析】 A(×)“四方面”——原料利用率,适当提高、 的投料比能
提高 的转化率。
B(×)“四方面”——化学反应限度、化学反应速率,氮气和氢气反应生成氨气的过程
是放热的,反应温度控制在 左右(【拓展】此温度下铁催化剂活性最大)的目的
是加快反应速率,并不是使化学平衡向正反应方向移动。
C(×)“四方面”——设备,氮气和氢气的反应是气体分子数减小的反应,增大压强,
平衡正向移动,合成氨工业采用 ,是因为继续增大压强对设备的要求
更高,不能达到更好的经济效益。
D(√)“四方面”——原料利用率、化学反应限度,不断将氨液化并移去液氨,目的是
降低氨气的浓度,使平衡正向移动。
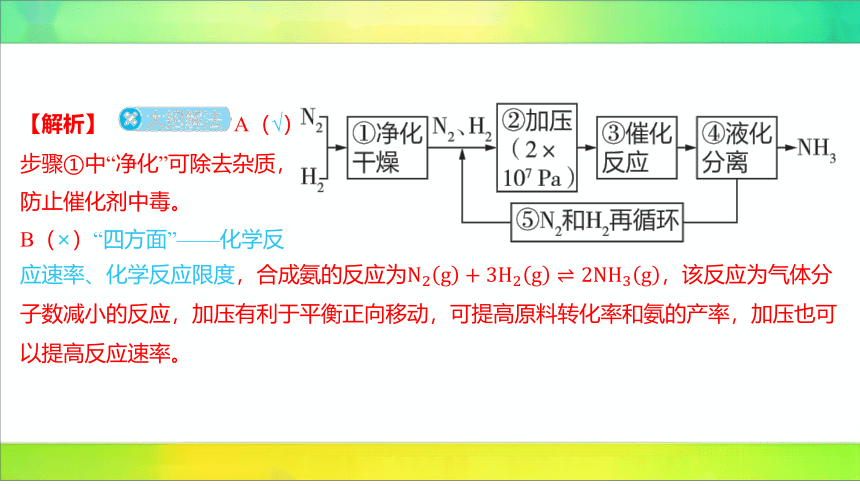
3.(2024福建厦门同安第一中学期中)
工业合成氨的流程如图所示。下列
有关生产条件的调控作用分析错误
的是 ( )
B
A.步骤①中“净化”可以防止催化剂中毒
B.步骤②“加压”可以加快反应速率,但压强过高,氨的产率会降低
C.步骤③一般选择控制反应温度为 ,因为在该温度下催化剂的活性最大
D.步骤④⑤有利于提高原料的利用率,能节约生产成本
【解析】 A(√)
步骤①中“净化”可除去杂质,
防止催化剂中毒。
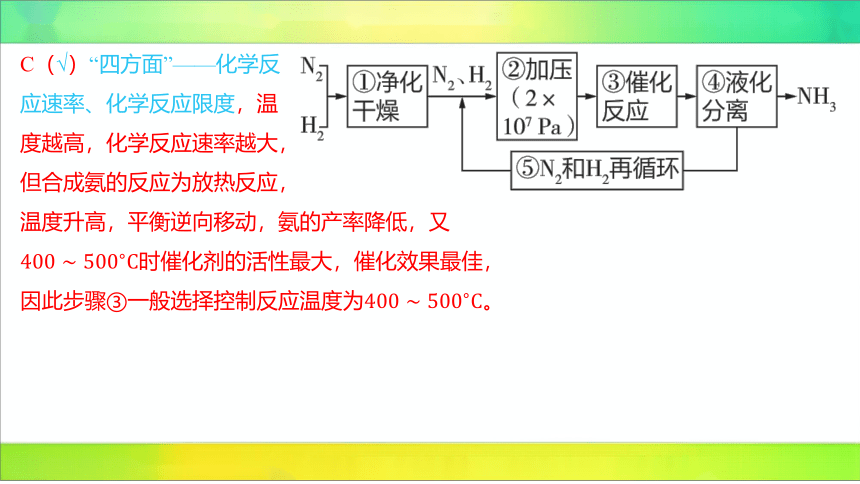
B(×)“四方面”——化学反
应速率、化学反应限度,合成氨的反应为 ,该反应为气体分
子数减小的反应,加压有利于平衡正向移动,可提高原料转化率和氨的产率,加压也可
以提高反应速率。
C(√)“四方面”——化学反
应速率、化学反应限度,温
度越高,化学反应速率越大,
但合成氨的反应为放热反应,
温度升高,平衡逆向移动,氨的产率降低,又
时催化剂的活性最大,催化效果最佳,
因此步骤③一般选择控制反应温度为 。
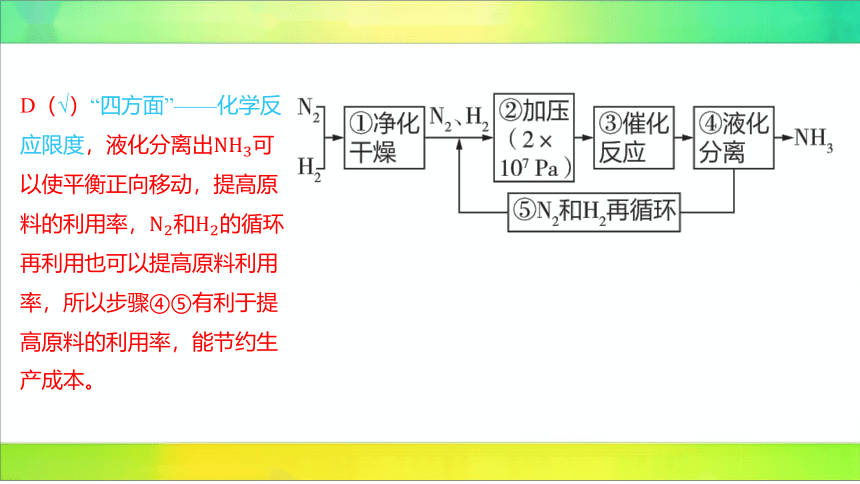
D(√)“四方面”——化学反
应限度,液化分离出 可
以使平衡正向移动,提高原
料的利用率,和 的循环
再利用也可以提高原料利用
率,所以步骤④⑤有利于提
高原料的利用率,能节约生
产成本。
4.(2024天津第一中学期中)工业合成氨是人类科学技术的一项重大突破,目前已有三
位科学家因其获得诺贝尔奖,其反应为
。回答下
列问题:
(1) 合成氨反应在常温下____(填“能”或“不能”)自发。
能
【解析】 常温下,合成氨反应的
,故合成氨反应在常温下能自发。
(2) ____温(填“高”或“低”,下同)有利于提高反应速率,____温有利于提高平衡转
化率,综合考虑催化剂(铁触媒)活性等因素,工业常采用 。
高
低
【解析】 “四方面”——化学反应限度、化学反应速率,高温有利于提高反
应速率,而合成氨反应是放热反应,低温可使平衡正向移动,有利于提高平衡转化率。
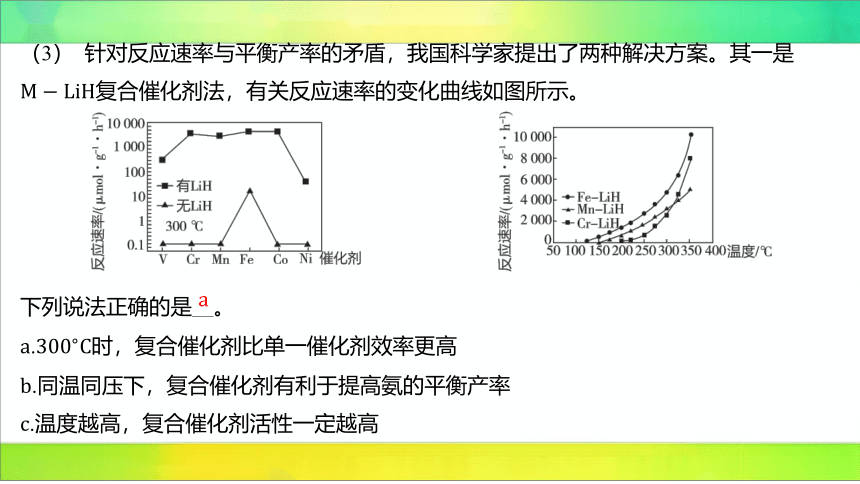
(3) 针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。其一是
复合催化剂法,有关反应速率的变化曲线如图所示。
下列说法正确的是__。
. 时,复合催化剂比单一催化剂效率更高
.同温同压下,复合催化剂有利于提高氨的平衡产率
.温度越高,复合催化剂活性一定越高
【解析】 由题图可知,时复合催化剂比单一催化剂反应速率快,催化效率高, 正确;
催化剂不能改变平衡状态,故不能提高氨的平衡产率, 错误;催化剂在一定的温度范围内
具有活性,而不是温度越高,催化剂活性越高, 错误。
(4) 在合成氨过程中,需要不断分离出氨的原因为__。
.有利于平衡正向移动
.防止催化剂中毒
.提高正反应速率
【解析】 分离出氨,使产物浓度降低,平衡正向移动,正确;不会造成催化剂中毒,
错误;分离出氨不会提高正反应速率, 错误。
题型三 化学反应的调控
5.(2024福建福州第一中学期末)常压下羰基化法精炼镍的原理为
。 时,该反应的平衡常数
。已知:的沸点为 ,固体杂质不参与反应。
第一阶段:将粗镍与反应转化成气态 ;
第二阶段:将第一阶段反应后的气体分离出来,加热至 制得高纯镍。
下列判断正确的是( )
B
A.增加 ,平衡正向移动,反应的平衡常数增大
B.第一阶段,若在和两者之间选择反应温度,应选
C.第二阶段, 分解率较低
D.该反应达到平衡时,
【解析】 A(×) “四方面”——化学反应限度,平衡常数只与温度有关,
与浓度无关。
B(√)的沸点为,第一阶段要制得气态的 ,应选择反应温度为
。
C(×)分解反应 的平衡常数
,可知 的分解率较高。
D(×)平衡时,正、逆反应速率相等,反应速率之比等于化学计量数之比,则
。
6.(2024黑龙江哈尔滨九中月考)催化重整可得到合成气(和 ),其主
要反应为 。同时存在以下反
应:
积碳反应 ;
消碳反应 。
在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变
化关系如图所示。下列说法正确的是( )
C
A.高压有利于提高 的平衡转化率并减少积碳
B.增大与 的物质的量之比有助于减少积碳
C.温度高于,升高温度 (消碳反应速率)增加
的倍数比 (积碳反应速率)增加的倍数大
D.升高温度(积碳反应平衡常数)减小、
(消碳反应平衡常数)增加
【解析】 A(×)“四方面”——化学反应限度,题中反应均为气体分子数
增大的反应,增大压强,平衡均逆向移动,故高压不利于提高 的平衡转化率。
B(×)“四方面”——化学反应限度,增大与的物质的量之比即增大 的用量,
积碳反应平衡正向移动,不利于减少积碳。
C(√)“四方面”——化学反应速率,温度高于 时,
积碳量随温度的升高而减小,说明此时升高温度,
(消碳反应速率)增加的倍数比 (积碳反应速率)
增加的倍数大。
D(×)积碳反应和消碳反应均为吸热反应,升高温度
平衡常数均增大。
7.(2023江苏苏州调研)氮及其化合物的转化具有重要应用。 是人工固氮的产物,
广泛用于生产铵盐、硝酸、纯碱等;在一定条件下与 反应可制备尿素,尿素加
热至将脱氨成缩二脲。以和 为原料可以合成尿素[],涉及
的化学反应如下:
反应Ⅰ: (快)
反应Ⅱ: (慢)
下列有关说法正确的是( )
C
A.反应
B.和 合成尿素的总反应速率由反应Ⅰ决定
C.增大压强,既能加快反应Ⅰ的速率又能提高原料的平衡转化率
D.生产过程中温度越高,尿素的产率越高
【解析】 A(×)反应 可由反
应Ⅰ和反应Ⅱ相加得到,根据盖斯定律, 。
B(×)反应Ⅱ是慢反应,活化能大,故总反应的速率由反应Ⅱ决定。
C(√)“四方面”——化学反应速率、化学反应限度,反应Ⅰ是气体分子数减小的反应,
故增大压强既能加快反应Ⅰ的速率又能提高原料的平衡转化率。
D(×)“四方面”——化学反应限度,由A项分析知合成尿素的反应是放热反应,故升高
温度,平衡逆向移动,尿素的产率降低。
能力觉醒
8.(大招31)(2024辽宁大连滨城高中检测)如图所示为接
触法制硫酸的设备和工艺流程,其中关键步骤是 的催化
氧化: ,下列说法正确
的是( )
C
A.增大反应容器内压强一定有利于提高生产效益
B.为提高 转化率,工业生产中应尽可能在较低温度下反应
C.工业生产要求高效,应使用催化剂并在催化剂活性最佳的温度下反应
D.该反应为放热反应,在任何条件下都能自发进行,因为吸热反应是非自发的
【解析】 A(×)“四方面”——化学反应速率、
设备,该反应为反应前后气体分子数减小的反应,增大反应
容器内压强,有利于平衡正向移动,但由于增大压强对设备
的要求和动力要求很高,成本高,效益可能不佳。
B(×)“四方面”——化学反应速率、化学反应限度,该反
应为放热反应,为提高 转化率,应尽可能在较低温度下
反应,但温度过低会使反应速率太慢,经济效益低。
C(√)“四方面”——化学反应速率,为加快反应速率,应使用催化剂,还需要考虑催化
剂的活性最佳温度,应在催化剂活性最佳温度下进行。
D(×)化学反应能否自发进行的判断依据是 ,反应能否自发进行要综合
考虑焓变和熵变以及温度。
9.(大招31)(2023北京西城区二模)中国科学家首次用 改性铜基催化剂,将草酸
二甲酯加氢制乙二醇的反应条件从高压降至常压。草酸二甲酯加氢的主要反应有:
其他条件相同时,相同时间内温度对产物选择性的影响结
果如图。
已知:ⅰ.物质B的选择性
ⅱ. ,反应③的平衡常数远大于反应①和反应②的
平衡常数
下列说法不正确的是( )
C
A.制乙二醇适宜的温度范围是
B.实验条件下反应③的活化能最高,升温更有利于反应③
C.减压可提高乙二醇的平衡产率
D.铜基催化剂用 改性后反应速率增大
【解析】 A(√)图中温度为 时,乙二醇的选择性较高。
B(√)温度升高至约 时乙醇的选择性才开始由0逐渐增大,说明此时刚开始生成
乙醇,则该实验条件下生成乙醇的反应③的活化能最高,所以升温有利于反应③。
C(×)“四方面”——化学反应限度,反应①、②均为气体分子数减小的反应,反应③
为气体分子数不变的反应,则增大压强可以提高乙二醇的平衡产率。
D(√)“四方面”——化学反应速率,铜基催化剂用 改性后,将草酸二甲酯加氢制乙
二醇的反应条件从高压降至常压(【点拨】压强减小使反应速率减慢),则催化剂可
以使反应速率增大。
10.(2024北京师范大学附属中学月考)燃煤电厂锅炉尾气中含有的 ,以氨还原法除
去,发生的反应如下:
反应Ⅰ:
反应Ⅱ:
在恒压、反应物起始物质的量之比一定的条件下,反应相同时间, 的转化率在不同
催化剂作用下随温度变化的曲线如图所示。下列说法不正确的是( )
C
A.其他条件不变,升高温度, 的平衡转化率可能降低
B.催化剂B条件下,提高点 的转化率的方法可以是增大压强
或延长反应时间
C.在 点所示条件下,使用催化剂A或催化剂B,反应均达平衡
D.高效节能除去尾气中的 ,应选择催化剂A
【解析】 A(√)反应Ⅰ、反应Ⅱ都是放热反应,升高温度,平
衡均逆向移动,且反应Ⅰ放热多,平衡逆向移动的程度大
(【点拨】反应Ⅰ平衡逆向移动使NO 的平衡转化率减小,反应
Ⅱ平衡逆向移动使 的平衡转化率增大,因此此处要比较两反
应平衡逆向移动的程度),所以 的平衡转化率可能降低。
B(√)催化剂不影响平衡移动,点对应 转化率低于同温度下催化剂A条件下的
转化率,说明 点反应未达平衡,可以通过增大压强(【点拨】增大单位时间内
的产率, 点反应未达平衡,不考虑平衡移动)或延长反应时间提高点 的转化率。
C(×)若 点所示条件下,使用催化剂A或催化剂B反应达平衡,平衡转化率与催化剂
无关,则点之后两曲线应重合,故 点反应未达平衡。
D(√)温度较低时,催化剂A条件下的 转化率较高,催化剂A的催化效果更好。
11.(2023山东师大附中模拟)催化加氢合成二甲醚是 资源化利用的有效途径之
一,合成二甲醚的总反应可表示为, 。
该反应可通过如下步骤来实现。
反应Ⅰ:,
反应Ⅱ:,
(1) ____________(用,表示),________(用, 表示)。
【解析】 根据盖斯定律,反应Ⅰ 反应Ⅱ得热化学方程式
,则平衡常数
。
图1
(2) 、的条件下,平衡时 平
衡转化率和 平衡选择性随温度变化如图1所
示。其中 的平衡选择性
。
图1
① 下列说法正确的是____(填序号)。
A.、、 均小于0
B.若反应在恒容密闭容器中进行,当体系压强不再变化,则反应
Ⅰ、Ⅱ均达到平衡状态
C.工业上应选择在下具有较高催化活性及 选
择性的催化剂
BC
图1
【解析】 A(×)随着温度升高,二甲醚的平衡选择性降
低,可知升温不利于二甲醚的生成,则总反应及反应Ⅱ均
为放热反应,即, ;二氧化碳的平衡转化
率先降低后升高,说明升温有利于反应Ⅰ正向移动,则反应
Ⅰ为吸热反应,即 。
B(√)若反应在恒容密闭容器中进行,因为反应Ⅱ为反应
前后气体总物质的量不同的反应,当体系压强不再变化,反应Ⅱ达到平衡,反应Ⅰ与
反应Ⅱ有相同物质,进而推知反应Ⅰ也达到平衡状态。
C(√)时,的选择性较高,此时 的平衡转化率也较大,选择
在此温度下具有较高催化活性的催化剂,有利于 的生成。
② 时,不考虑其他副反应,反应Ⅰ的平衡常数 为______。
0.052
图1
图1
【解析】 从图中 点分析,二氧化碳的平衡转化率为
,此时没有生成二甲醚,设起始时 ,
,故有
则平衡常数。③从表中数据分析,在 二甲醚的实际选择性最
大,且此时的实际转化率也不是很小,故最佳反应温度为。 ,在
催化剂作用下,随着温度升高,反应Ⅰ的反应速率加快的程度比反应Ⅱ大,故二甲醚的
实际选择性逐渐减小。
③ 、的条件下,催化加氢反应一段时间,不同温度下 实际转
化率和 实际选择性数据如表:
温度/ 220 240 260 280 300
实际转化率 7.6 12.4 14.8 18.6 22.9
二甲醚实际选择性 68.7 77.2 61.0 41.5 27.5
该体系合成二甲醚的最佳反应温度为_______。
图1
④ 由上表数据可知, 二甲醚的实际选择性逐渐减小,从化学反应速率角度
分析原因____________________________________________________________________
________________________________________。
,在催化剂作用下,随着温度升高,反应Ⅰ反应速率加快的程度比反应Ⅱ大,故二甲醚的实际选择性逐渐减小
图1
图2
(3) 、、,平衡时 转化率
和的收率与进料气中体积分数 有关,
其变化如图2所示,其中:
的平衡收率
, 的平
衡收率 。请在图2中选出
【解析】 由题图分析,随 体积分数增大,二氧化碳的平衡转化率降低,而二甲醚的平
衡收率增大,故一氧化碳的平衡收率应逐渐降低且降低程度比二氧化碳大,故选择 曲线。
在之间平衡收率的变化趋势__(填“”“”或“” )。
第2章 化学反应的方向、限度与速率
2025年高考化学一轮复习
选择性必修第一册鲁科版
第4节 化学反应条件的优化——工业合成氨
题型觉醒
题型一 合成氨反应的限度和速率
1.(2024浙江嘉兴八校联考)在合成氨工业中,要使氨的产率增大,同时又能提高化学
反应速率,可采取的措施有( )
C
①增大容器体积使压强减小 ②减小容器体积使压强增大 ③升高温度 ④降低温度 ⑤恒
温恒容,再充入等量的和 ⑥及时分离产生的 ⑦使用催化剂
A.②④⑤⑥ B.②③④⑤⑦ C.②⑤ D.①②③⑤⑦
【解析】 从反应速率的角度分析:增大反应物浓度、增大压强(减小容器体积)、使
用催化剂、升高温度均能加快反应速率,故②③⑤⑦均使化学反应速率加快,①④⑥均
使化学反应速率减慢。从平衡移动的角度分析:合成氨的反应为气体分子数减小的放热
反应,故②④⑤⑥均使合成氨的反应正向移动,氨的产率增大;①③均使合成氨的反应
逆向移动,氨的产率减小;⑦不影响化学平衡,氨的产率不变。故C项正确。
题型二 合成氨的适宜生产条件
2.(2024广东深圳外国语学校联考)下列有关合成氨工业的说法正确的是( )
D
A.、的投料比采用(物质的量比)而不是,是为了提高 的转化率
B.反应温度控制在 左右,目的是使化学平衡向正反应方向移动
C.压强采用 ,是因为该条件下催化剂的活性最好
D.不断将氨液化并移去液氨,目的是使平衡正向移动
【解析】 A(×)“四方面”——原料利用率,适当提高、 的投料比能
提高 的转化率。
B(×)“四方面”——化学反应限度、化学反应速率,氮气和氢气反应生成氨气的过程
是放热的,反应温度控制在 左右(【拓展】此温度下铁催化剂活性最大)的目的
是加快反应速率,并不是使化学平衡向正反应方向移动。
C(×)“四方面”——设备,氮气和氢气的反应是气体分子数减小的反应,增大压强,
平衡正向移动,合成氨工业采用 ,是因为继续增大压强对设备的要求
更高,不能达到更好的经济效益。
D(√)“四方面”——原料利用率、化学反应限度,不断将氨液化并移去液氨,目的是
降低氨气的浓度,使平衡正向移动。
3.(2024福建厦门同安第一中学期中)
工业合成氨的流程如图所示。下列
有关生产条件的调控作用分析错误
的是 ( )
B
A.步骤①中“净化”可以防止催化剂中毒
B.步骤②“加压”可以加快反应速率,但压强过高,氨的产率会降低
C.步骤③一般选择控制反应温度为 ,因为在该温度下催化剂的活性最大
D.步骤④⑤有利于提高原料的利用率,能节约生产成本
【解析】 A(√)
步骤①中“净化”可除去杂质,
防止催化剂中毒。
B(×)“四方面”——化学反
应速率、化学反应限度,合成氨的反应为 ,该反应为气体分
子数减小的反应,加压有利于平衡正向移动,可提高原料转化率和氨的产率,加压也可
以提高反应速率。
C(√)“四方面”——化学反
应速率、化学反应限度,温
度越高,化学反应速率越大,
但合成氨的反应为放热反应,
温度升高,平衡逆向移动,氨的产率降低,又
时催化剂的活性最大,催化效果最佳,
因此步骤③一般选择控制反应温度为 。
D(√)“四方面”——化学反
应限度,液化分离出 可
以使平衡正向移动,提高原
料的利用率,和 的循环
再利用也可以提高原料利用
率,所以步骤④⑤有利于提
高原料的利用率,能节约生
产成本。
4.(2024天津第一中学期中)工业合成氨是人类科学技术的一项重大突破,目前已有三
位科学家因其获得诺贝尔奖,其反应为
。回答下
列问题:
(1) 合成氨反应在常温下____(填“能”或“不能”)自发。
能
【解析】 常温下,合成氨反应的
,故合成氨反应在常温下能自发。
(2) ____温(填“高”或“低”,下同)有利于提高反应速率,____温有利于提高平衡转
化率,综合考虑催化剂(铁触媒)活性等因素,工业常采用 。
高
低
【解析】 “四方面”——化学反应限度、化学反应速率,高温有利于提高反
应速率,而合成氨反应是放热反应,低温可使平衡正向移动,有利于提高平衡转化率。
(3) 针对反应速率与平衡产率的矛盾,我国科学家提出了两种解决方案。其一是
复合催化剂法,有关反应速率的变化曲线如图所示。
下列说法正确的是__。
. 时,复合催化剂比单一催化剂效率更高
.同温同压下,复合催化剂有利于提高氨的平衡产率
.温度越高,复合催化剂活性一定越高
【解析】 由题图可知,时复合催化剂比单一催化剂反应速率快,催化效率高, 正确;
催化剂不能改变平衡状态,故不能提高氨的平衡产率, 错误;催化剂在一定的温度范围内
具有活性,而不是温度越高,催化剂活性越高, 错误。
(4) 在合成氨过程中,需要不断分离出氨的原因为__。
.有利于平衡正向移动
.防止催化剂中毒
.提高正反应速率
【解析】 分离出氨,使产物浓度降低,平衡正向移动,正确;不会造成催化剂中毒,
错误;分离出氨不会提高正反应速率, 错误。
题型三 化学反应的调控
5.(2024福建福州第一中学期末)常压下羰基化法精炼镍的原理为
。 时,该反应的平衡常数
。已知:的沸点为 ,固体杂质不参与反应。
第一阶段:将粗镍与反应转化成气态 ;
第二阶段:将第一阶段反应后的气体分离出来,加热至 制得高纯镍。
下列判断正确的是( )
B
A.增加 ,平衡正向移动,反应的平衡常数增大
B.第一阶段,若在和两者之间选择反应温度,应选
C.第二阶段, 分解率较低
D.该反应达到平衡时,
【解析】 A(×) “四方面”——化学反应限度,平衡常数只与温度有关,
与浓度无关。
B(√)的沸点为,第一阶段要制得气态的 ,应选择反应温度为
。
C(×)分解反应 的平衡常数
,可知 的分解率较高。
D(×)平衡时,正、逆反应速率相等,反应速率之比等于化学计量数之比,则
。
6.(2024黑龙江哈尔滨九中月考)催化重整可得到合成气(和 ),其主
要反应为 。同时存在以下反
应:
积碳反应 ;
消碳反应 。
在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变
化关系如图所示。下列说法正确的是( )
C
A.高压有利于提高 的平衡转化率并减少积碳
B.增大与 的物质的量之比有助于减少积碳
C.温度高于,升高温度 (消碳反应速率)增加
的倍数比 (积碳反应速率)增加的倍数大
D.升高温度(积碳反应平衡常数)减小、
(消碳反应平衡常数)增加
【解析】 A(×)“四方面”——化学反应限度,题中反应均为气体分子数
增大的反应,增大压强,平衡均逆向移动,故高压不利于提高 的平衡转化率。
B(×)“四方面”——化学反应限度,增大与的物质的量之比即增大 的用量,
积碳反应平衡正向移动,不利于减少积碳。
C(√)“四方面”——化学反应速率,温度高于 时,
积碳量随温度的升高而减小,说明此时升高温度,
(消碳反应速率)增加的倍数比 (积碳反应速率)
增加的倍数大。
D(×)积碳反应和消碳反应均为吸热反应,升高温度
平衡常数均增大。
7.(2023江苏苏州调研)氮及其化合物的转化具有重要应用。 是人工固氮的产物,
广泛用于生产铵盐、硝酸、纯碱等;在一定条件下与 反应可制备尿素,尿素加
热至将脱氨成缩二脲。以和 为原料可以合成尿素[],涉及
的化学反应如下:
反应Ⅰ: (快)
反应Ⅱ: (慢)
下列有关说法正确的是( )
C
A.反应
B.和 合成尿素的总反应速率由反应Ⅰ决定
C.增大压强,既能加快反应Ⅰ的速率又能提高原料的平衡转化率
D.生产过程中温度越高,尿素的产率越高
【解析】 A(×)反应 可由反
应Ⅰ和反应Ⅱ相加得到,根据盖斯定律, 。
B(×)反应Ⅱ是慢反应,活化能大,故总反应的速率由反应Ⅱ决定。
C(√)“四方面”——化学反应速率、化学反应限度,反应Ⅰ是气体分子数减小的反应,
故增大压强既能加快反应Ⅰ的速率又能提高原料的平衡转化率。
D(×)“四方面”——化学反应限度,由A项分析知合成尿素的反应是放热反应,故升高
温度,平衡逆向移动,尿素的产率降低。
能力觉醒
8.(大招31)(2024辽宁大连滨城高中检测)如图所示为接
触法制硫酸的设备和工艺流程,其中关键步骤是 的催化
氧化: ,下列说法正确
的是( )
C
A.增大反应容器内压强一定有利于提高生产效益
B.为提高 转化率,工业生产中应尽可能在较低温度下反应
C.工业生产要求高效,应使用催化剂并在催化剂活性最佳的温度下反应
D.该反应为放热反应,在任何条件下都能自发进行,因为吸热反应是非自发的
【解析】 A(×)“四方面”——化学反应速率、
设备,该反应为反应前后气体分子数减小的反应,增大反应
容器内压强,有利于平衡正向移动,但由于增大压强对设备
的要求和动力要求很高,成本高,效益可能不佳。
B(×)“四方面”——化学反应速率、化学反应限度,该反
应为放热反应,为提高 转化率,应尽可能在较低温度下
反应,但温度过低会使反应速率太慢,经济效益低。
C(√)“四方面”——化学反应速率,为加快反应速率,应使用催化剂,还需要考虑催化
剂的活性最佳温度,应在催化剂活性最佳温度下进行。
D(×)化学反应能否自发进行的判断依据是 ,反应能否自发进行要综合
考虑焓变和熵变以及温度。
9.(大招31)(2023北京西城区二模)中国科学家首次用 改性铜基催化剂,将草酸
二甲酯加氢制乙二醇的反应条件从高压降至常压。草酸二甲酯加氢的主要反应有:
其他条件相同时,相同时间内温度对产物选择性的影响结
果如图。
已知:ⅰ.物质B的选择性
ⅱ. ,反应③的平衡常数远大于反应①和反应②的
平衡常数
下列说法不正确的是( )
C
A.制乙二醇适宜的温度范围是
B.实验条件下反应③的活化能最高,升温更有利于反应③
C.减压可提高乙二醇的平衡产率
D.铜基催化剂用 改性后反应速率增大
【解析】 A(√)图中温度为 时,乙二醇的选择性较高。
B(√)温度升高至约 时乙醇的选择性才开始由0逐渐增大,说明此时刚开始生成
乙醇,则该实验条件下生成乙醇的反应③的活化能最高,所以升温有利于反应③。
C(×)“四方面”——化学反应限度,反应①、②均为气体分子数减小的反应,反应③
为气体分子数不变的反应,则增大压强可以提高乙二醇的平衡产率。
D(√)“四方面”——化学反应速率,铜基催化剂用 改性后,将草酸二甲酯加氢制乙
二醇的反应条件从高压降至常压(【点拨】压强减小使反应速率减慢),则催化剂可
以使反应速率增大。
10.(2024北京师范大学附属中学月考)燃煤电厂锅炉尾气中含有的 ,以氨还原法除
去,发生的反应如下:
反应Ⅰ:
反应Ⅱ:
在恒压、反应物起始物质的量之比一定的条件下,反应相同时间, 的转化率在不同
催化剂作用下随温度变化的曲线如图所示。下列说法不正确的是( )
C
A.其他条件不变,升高温度, 的平衡转化率可能降低
B.催化剂B条件下,提高点 的转化率的方法可以是增大压强
或延长反应时间
C.在 点所示条件下,使用催化剂A或催化剂B,反应均达平衡
D.高效节能除去尾气中的 ,应选择催化剂A
【解析】 A(√)反应Ⅰ、反应Ⅱ都是放热反应,升高温度,平
衡均逆向移动,且反应Ⅰ放热多,平衡逆向移动的程度大
(【点拨】反应Ⅰ平衡逆向移动使NO 的平衡转化率减小,反应
Ⅱ平衡逆向移动使 的平衡转化率增大,因此此处要比较两反
应平衡逆向移动的程度),所以 的平衡转化率可能降低。
B(√)催化剂不影响平衡移动,点对应 转化率低于同温度下催化剂A条件下的
转化率,说明 点反应未达平衡,可以通过增大压强(【点拨】增大单位时间内
的产率, 点反应未达平衡,不考虑平衡移动)或延长反应时间提高点 的转化率。
C(×)若 点所示条件下,使用催化剂A或催化剂B反应达平衡,平衡转化率与催化剂
无关,则点之后两曲线应重合,故 点反应未达平衡。
D(√)温度较低时,催化剂A条件下的 转化率较高,催化剂A的催化效果更好。
11.(2023山东师大附中模拟)催化加氢合成二甲醚是 资源化利用的有效途径之
一,合成二甲醚的总反应可表示为, 。
该反应可通过如下步骤来实现。
反应Ⅰ:,
反应Ⅱ:,
(1) ____________(用,表示),________(用, 表示)。
【解析】 根据盖斯定律,反应Ⅰ 反应Ⅱ得热化学方程式
,则平衡常数
。
图1
(2) 、的条件下,平衡时 平
衡转化率和 平衡选择性随温度变化如图1所
示。其中 的平衡选择性
。
图1
① 下列说法正确的是____(填序号)。
A.、、 均小于0
B.若反应在恒容密闭容器中进行,当体系压强不再变化,则反应
Ⅰ、Ⅱ均达到平衡状态
C.工业上应选择在下具有较高催化活性及 选
择性的催化剂
BC
图1
【解析】 A(×)随着温度升高,二甲醚的平衡选择性降
低,可知升温不利于二甲醚的生成,则总反应及反应Ⅱ均
为放热反应,即, ;二氧化碳的平衡转化
率先降低后升高,说明升温有利于反应Ⅰ正向移动,则反应
Ⅰ为吸热反应,即 。
B(√)若反应在恒容密闭容器中进行,因为反应Ⅱ为反应
前后气体总物质的量不同的反应,当体系压强不再变化,反应Ⅱ达到平衡,反应Ⅰ与
反应Ⅱ有相同物质,进而推知反应Ⅰ也达到平衡状态。
C(√)时,的选择性较高,此时 的平衡转化率也较大,选择
在此温度下具有较高催化活性的催化剂,有利于 的生成。
② 时,不考虑其他副反应,反应Ⅰ的平衡常数 为______。
0.052
图1
图1
【解析】 从图中 点分析,二氧化碳的平衡转化率为
,此时没有生成二甲醚,设起始时 ,
,故有
则平衡常数。③从表中数据分析,在 二甲醚的实际选择性最
大,且此时的实际转化率也不是很小,故最佳反应温度为。 ,在
催化剂作用下,随着温度升高,反应Ⅰ的反应速率加快的程度比反应Ⅱ大,故二甲醚的
实际选择性逐渐减小。
③ 、的条件下,催化加氢反应一段时间,不同温度下 实际转
化率和 实际选择性数据如表:
温度/ 220 240 260 280 300
实际转化率 7.6 12.4 14.8 18.6 22.9
二甲醚实际选择性 68.7 77.2 61.0 41.5 27.5
该体系合成二甲醚的最佳反应温度为_______。
图1
④ 由上表数据可知, 二甲醚的实际选择性逐渐减小,从化学反应速率角度
分析原因____________________________________________________________________
________________________________________。
,在催化剂作用下,随着温度升高,反应Ⅰ反应速率加快的程度比反应Ⅱ大,故二甲醚的实际选择性逐渐减小
图1
图2
(3) 、、,平衡时 转化率
和的收率与进料气中体积分数 有关,
其变化如图2所示,其中:
的平衡收率
, 的平
衡收率 。请在图2中选出
【解析】 由题图分析,随 体积分数增大,二氧化碳的平衡转化率降低,而二甲醚的平
衡收率增大,故一氧化碳的平衡收率应逐渐降低且降低程度比二氧化碳大,故选择 曲线。
在之间平衡收率的变化趋势__(填“”“”或“” )。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
