微项目 探讨如何利用工业废气中的二氧化碳合成甲醇(共23张PPT)--2025年高考化学选择性必修第一册(鲁科版)
文档属性
| 名称 | 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇(共23张PPT)--2025年高考化学选择性必修第一册(鲁科版) |

|
|
| 格式 | pptx | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-06 20:54:40 | ||
图片预览








文档简介
(共23张PPT)
第2章 化学反应的方向、限度与速率
2025年高考化学一轮复习
选择性必修第一册鲁科版
微项目 探讨如何利用工业废气中的二氧化碳合成甲醇
1.(2024河南商丘检测)为了实现“碳中和”,利用合成 的反应如下:
Ⅰ.
Ⅱ. (副反应)
已知温度对、 的平衡产率影响如图所示,下列说法中正
确的是( )
B
A.
B.可以通过使用合适的催化剂提高 的选择性
C.增大压强可以加快反应Ⅰ的反应速率,对反应Ⅱ的反应速率无影响
D.实际生产过程中,一定要在较低温度下才能提高 的产率
【解析】 A(×)由图可知,升高温度,一氧化碳的产率增大、甲醇的产率减小,说明
反应Ⅰ是放热反应, 。
B(√)催化剂具有选择性,选用合适的催化剂可以减少副反应的发生,提高甲醇的选
择性。
C(×)“四方面”——化学反应速率,反应Ⅰ和反应Ⅱ都是有气体参加和生成的反应,增
大压强,反应Ⅰ的反应速率和反应Ⅱ的反应速率均增大。
D(×)“四方面”——化学反应限度,反应Ⅰ是气体分子数减小的放热反应,适当降低温
度和增大压强都能提高甲醇的产率。
2.(2024广东深圳外国语学校段考,双选)在 恒容密闭容器中
充入、,在一定条件下发生反应: ,
的平衡转化率 与温度、压强之间的关系如图所示。
下列推断正确的是( )
BC
A.工业上,利用上述反应合成甲醇,温度越高越好
B.图像中代表压强,与代表不同温度,且
C.图像中点时反应的平衡常数
D.若维持温度和容器体积不变,再充入、,达到平衡时 的转化率
不变
【解析】 第一步:明确横、纵轴的含义 纵轴代
表 的平衡转化率,横轴代表温度或压强。
A(×)“四方面”——化学反应限度,该反应的正反应为放热反
应,升高温度,虽然化学反应速率加快,但平衡逆向移动,甲醇
的产率减小,故利用该反应合成甲醇时温度不是越高越好。
B(√)代表压强,与代表不同温度,且 。
C(√)图像中点时的平衡转化率为 ,列三段式:
平衡常数 。
D(×)该反应的正反应为气体分子数减小的反应,若维持温度
和容器体积不变,再充入、 ,相当于增大压
强,平衡正向移动,达到平衡时 的转化率增大。
3.(2024四川绵阳南山中学实验学校月考)探究 合成反应化学平衡的影响因素,
有利于提高的产率。以、为原料合成 涉及的主要反应如下:
Ⅰ.
Ⅱ.
Ⅲ.
回答下列问题:
(1) _______ 。
【解析】 分析三个热化学方程式,可应用盖斯定律计算,
。
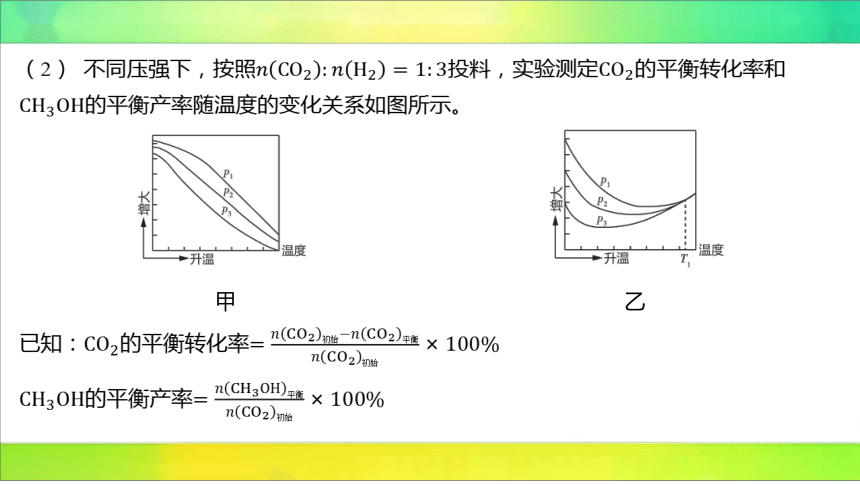
(2) 不同压强下,按照投料,实验测定 的平衡转化率和
的平衡产率随温度的变化关系如图所示。
甲
乙
已知:的平衡转化率
的平衡产率
其中纵轴表示平衡转化率的是图____(填“甲”或“乙”);压强、、 由大到小
的顺序为___________;图乙中 时,三条曲线几乎交于一点的原因是________________
_________________________________________________________。
乙
、、
时以反应Ⅲ为主,反应Ⅲ为气体分子数不变的反应,压强改变对平衡没有影响
【解析】 反应Ⅰ为放热反应,故低温阶段,温度越高, 的平衡转化率越低,而反应
Ⅲ为吸热反应,温度较高时,主要发生反应Ⅲ,则温度越高, 的平衡转化率越高,
即图乙的纵轴表示的是 的平衡转化率。反应Ⅰ为气体分子数减小的反应,反应Ⅲ为气
体分子数不变的反应,因此压强越大, 的平衡转化率越高,故压强由大到小的顺序
是、、 。反应Ⅲ为吸热反应,温度较高时,主要发生反应Ⅲ,且反应Ⅲ反应前后
气体分子数相等,故 的平衡转化率几乎不再受压强影响。
(3) 为同时提高的平衡转化率和 的平衡产率,应选择的反应条件为___
(填标号)。
A
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
【解析】 由上述分析知,图甲、图乙的纵轴分别表示的平衡产率、 的平衡
转化率,且 ,分析图像可知,应选择的反应条件为低温、高压,A项正确。
4.(2024湖南师范大学附属中学月考)二氧化碳加氢制甲醇是碳中和的一个重要研究方
向。在恒压条件下,将和 充入密闭容器中进行如下反应:
Ⅰ:
Ⅱ:
Ⅲ:
回答下列问题:
图 1
(1) 平衡转化率、 选择
性(产物中 的物质的量与参加反应
的物质的量之比,用表示)、 选
择性(产物中的物质的量与参加反应
的物质的量之比,用 表示)随温度变化
如图1所示。
① 反应Ⅰ正反应活化能为 ,逆
反应活化能为,则___
(填“ ”“ ”或“ ”)。
【解析】 根据盖斯定律知反应Ⅱ反应Ⅲ反应Ⅰ,即 ,又
,故正 逆。
图 1
② 图1中表示的曲线是__,曲线 随
温度升高而升高的原因是________________
______________________________________
___________。
温度升高,反应Ⅱ、Ⅲ均逆向移动,但反应Ⅲ平衡移动受温度影响更大
【解析】 三个反应均为放热反应,随着温
度升高减小,又与 的和是
,故曲线表示 随温度的变化;
三个反应同时进行且均为放热反应,随着温度升高减小、可能增大,故曲线 表
示随温度的变化,曲线表示随温度的变化,曲线 随温度升高而升高的原因是温
度升高,反应Ⅱ、Ⅲ均逆向移动,但反应Ⅲ平衡移动受温度影响更大。
③ 已知时,, ,反应Ⅱ的分压平衡常数
______(保留2位有效数字)。
0.012
图 1
【解析】 时,,所以参与反应的 的物质的量为
,由可得平衡时, 的物质的量分
别为, 。
平衡状态物质的量为 ,根据氧元素守恒可得平衡状
态 ,根据氢元素守恒可得平衡
状态 ,
。
根据题目信息列出方程 、
、,故 的平衡量
为
(【点拨】根据题干信息无法求出、、
的具体值,对代数式进行变形,整体代入求解)
,
的平衡量为 ,故反应Ⅱ的分压平衡常数
。
(2) 为探究原料气中混杂对反应的影响,测得平衡转化率 、平衡时
与初始物质的量之比 随原料气中 的变化如图2所示。
图 2
① 图2中随的增大降低而 升高的原因是 ___________________________
____________________________________________________________________________
_______________________ ;当时,,则
_____。
0.25
图 2
增大,与反应的 变
多,与反应的变少,所以降低; 增大,反应Ⅲ进行程度更大,产生
变多,所以 升高
【解析】 初始投料为和,时, ,平衡
状态时,所以, ,
根据碳元素守恒, ,所以
。
图 2
图 2
② 下列措施能提高 值的是_____(填标号)。
AD
A.恒容条件通入
B.恒容条件通入氩气
C.选用更高效的催化剂
D.将尾气进行循环使用
【解析】 A(√)恒容条件通入 ,平衡正向移
动生成更多的, 增大。
B(×)恒容条件通入氩气平衡不发生移动, 不变。
C(×)催化剂不改变平衡状态, 不变。
D(√)将尾气进行循环使用会使与反应生成更多的, 增大。
5.(2023四川成都外国语学校期中)甲醇是重要的化工原料。
利用和 在催化剂的作用下合成甲醇,发生的反应为
。一定比例
的和 在装有催化剂的反应器中反应12小时,体系中甲
醇产率和催化剂的催化活性与温度的关系如图所示。
当温度为时,图中点________(填“处于”或“不处于”)平衡状态。 之后,
甲醇产率下降的原因是________________________________________________________
_____。
不处于
正反应为放热反应,升高温度,平衡逆向移动,且催化剂活性降低
【解析】 该反应放热,温度升高,甲醇的平衡产率下降,而 点后,温度升高甲醇的产
率升高,说明 点甲醇产率没有达到最大,不处于平衡状态。正反应为放热反应,
之后,升高温度,平衡逆向移动,且催化剂活性降低,甲醇产率下降。
第2章 化学反应的方向、限度与速率
2025年高考化学一轮复习
选择性必修第一册鲁科版
微项目 探讨如何利用工业废气中的二氧化碳合成甲醇
1.(2024河南商丘检测)为了实现“碳中和”,利用合成 的反应如下:
Ⅰ.
Ⅱ. (副反应)
已知温度对、 的平衡产率影响如图所示,下列说法中正
确的是( )
B
A.
B.可以通过使用合适的催化剂提高 的选择性
C.增大压强可以加快反应Ⅰ的反应速率,对反应Ⅱ的反应速率无影响
D.实际生产过程中,一定要在较低温度下才能提高 的产率
【解析】 A(×)由图可知,升高温度,一氧化碳的产率增大、甲醇的产率减小,说明
反应Ⅰ是放热反应, 。
B(√)催化剂具有选择性,选用合适的催化剂可以减少副反应的发生,提高甲醇的选
择性。
C(×)“四方面”——化学反应速率,反应Ⅰ和反应Ⅱ都是有气体参加和生成的反应,增
大压强,反应Ⅰ的反应速率和反应Ⅱ的反应速率均增大。
D(×)“四方面”——化学反应限度,反应Ⅰ是气体分子数减小的放热反应,适当降低温
度和增大压强都能提高甲醇的产率。
2.(2024广东深圳外国语学校段考,双选)在 恒容密闭容器中
充入、,在一定条件下发生反应: ,
的平衡转化率 与温度、压强之间的关系如图所示。
下列推断正确的是( )
BC
A.工业上,利用上述反应合成甲醇,温度越高越好
B.图像中代表压强,与代表不同温度,且
C.图像中点时反应的平衡常数
D.若维持温度和容器体积不变,再充入、,达到平衡时 的转化率
不变
【解析】 第一步:明确横、纵轴的含义 纵轴代
表 的平衡转化率,横轴代表温度或压强。
A(×)“四方面”——化学反应限度,该反应的正反应为放热反
应,升高温度,虽然化学反应速率加快,但平衡逆向移动,甲醇
的产率减小,故利用该反应合成甲醇时温度不是越高越好。
B(√)代表压强,与代表不同温度,且 。
C(√)图像中点时的平衡转化率为 ,列三段式:
平衡常数 。
D(×)该反应的正反应为气体分子数减小的反应,若维持温度
和容器体积不变,再充入、 ,相当于增大压
强,平衡正向移动,达到平衡时 的转化率增大。
3.(2024四川绵阳南山中学实验学校月考)探究 合成反应化学平衡的影响因素,
有利于提高的产率。以、为原料合成 涉及的主要反应如下:
Ⅰ.
Ⅱ.
Ⅲ.
回答下列问题:
(1) _______ 。
【解析】 分析三个热化学方程式,可应用盖斯定律计算,
。
(2) 不同压强下,按照投料,实验测定 的平衡转化率和
的平衡产率随温度的变化关系如图所示。
甲
乙
已知:的平衡转化率
的平衡产率
其中纵轴表示平衡转化率的是图____(填“甲”或“乙”);压强、、 由大到小
的顺序为___________;图乙中 时,三条曲线几乎交于一点的原因是________________
_________________________________________________________。
乙
、、
时以反应Ⅲ为主,反应Ⅲ为气体分子数不变的反应,压强改变对平衡没有影响
【解析】 反应Ⅰ为放热反应,故低温阶段,温度越高, 的平衡转化率越低,而反应
Ⅲ为吸热反应,温度较高时,主要发生反应Ⅲ,则温度越高, 的平衡转化率越高,
即图乙的纵轴表示的是 的平衡转化率。反应Ⅰ为气体分子数减小的反应,反应Ⅲ为气
体分子数不变的反应,因此压强越大, 的平衡转化率越高,故压强由大到小的顺序
是、、 。反应Ⅲ为吸热反应,温度较高时,主要发生反应Ⅲ,且反应Ⅲ反应前后
气体分子数相等,故 的平衡转化率几乎不再受压强影响。
(3) 为同时提高的平衡转化率和 的平衡产率,应选择的反应条件为___
(填标号)。
A
A.低温、高压 B.高温、低压 C.低温、低压 D.高温、高压
【解析】 由上述分析知,图甲、图乙的纵轴分别表示的平衡产率、 的平衡
转化率,且 ,分析图像可知,应选择的反应条件为低温、高压,A项正确。
4.(2024湖南师范大学附属中学月考)二氧化碳加氢制甲醇是碳中和的一个重要研究方
向。在恒压条件下,将和 充入密闭容器中进行如下反应:
Ⅰ:
Ⅱ:
Ⅲ:
回答下列问题:
图 1
(1) 平衡转化率、 选择
性(产物中 的物质的量与参加反应
的物质的量之比,用表示)、 选
择性(产物中的物质的量与参加反应
的物质的量之比,用 表示)随温度变化
如图1所示。
① 反应Ⅰ正反应活化能为 ,逆
反应活化能为,则___
(填“ ”“ ”或“ ”)。
【解析】 根据盖斯定律知反应Ⅱ反应Ⅲ反应Ⅰ,即 ,又
,故正 逆。
图 1
② 图1中表示的曲线是__,曲线 随
温度升高而升高的原因是________________
______________________________________
___________。
温度升高,反应Ⅱ、Ⅲ均逆向移动,但反应Ⅲ平衡移动受温度影响更大
【解析】 三个反应均为放热反应,随着温
度升高减小,又与 的和是
,故曲线表示 随温度的变化;
三个反应同时进行且均为放热反应,随着温度升高减小、可能增大,故曲线 表
示随温度的变化,曲线表示随温度的变化,曲线 随温度升高而升高的原因是温
度升高,反应Ⅱ、Ⅲ均逆向移动,但反应Ⅲ平衡移动受温度影响更大。
③ 已知时,, ,反应Ⅱ的分压平衡常数
______(保留2位有效数字)。
0.012
图 1
【解析】 时,,所以参与反应的 的物质的量为
,由可得平衡时, 的物质的量分
别为, 。
平衡状态物质的量为 ,根据氧元素守恒可得平衡状
态 ,根据氢元素守恒可得平衡
状态 ,
。
根据题目信息列出方程 、
、,故 的平衡量
为
(【点拨】根据题干信息无法求出、、
的具体值,对代数式进行变形,整体代入求解)
,
的平衡量为 ,故反应Ⅱ的分压平衡常数
。
(2) 为探究原料气中混杂对反应的影响,测得平衡转化率 、平衡时
与初始物质的量之比 随原料气中 的变化如图2所示。
图 2
① 图2中随的增大降低而 升高的原因是 ___________________________
____________________________________________________________________________
_______________________ ;当时,,则
_____。
0.25
图 2
增大,与反应的 变
多,与反应的变少,所以降低; 增大,反应Ⅲ进行程度更大,产生
变多,所以 升高
【解析】 初始投料为和,时, ,平衡
状态时,所以, ,
根据碳元素守恒, ,所以
。
图 2
图 2
② 下列措施能提高 值的是_____(填标号)。
AD
A.恒容条件通入
B.恒容条件通入氩气
C.选用更高效的催化剂
D.将尾气进行循环使用
【解析】 A(√)恒容条件通入 ,平衡正向移
动生成更多的, 增大。
B(×)恒容条件通入氩气平衡不发生移动, 不变。
C(×)催化剂不改变平衡状态, 不变。
D(√)将尾气进行循环使用会使与反应生成更多的, 增大。
5.(2023四川成都外国语学校期中)甲醇是重要的化工原料。
利用和 在催化剂的作用下合成甲醇,发生的反应为
。一定比例
的和 在装有催化剂的反应器中反应12小时,体系中甲
醇产率和催化剂的催化活性与温度的关系如图所示。
当温度为时,图中点________(填“处于”或“不处于”)平衡状态。 之后,
甲醇产率下降的原因是________________________________________________________
_____。
不处于
正反应为放热反应,升高温度,平衡逆向移动,且催化剂活性降低
【解析】 该反应放热,温度升高,甲醇的平衡产率下降,而 点后,温度升高甲醇的产
率升高,说明 点甲醇产率没有达到最大,不处于平衡状态。正反应为放热反应,
之后,升高温度,平衡逆向移动,且催化剂活性降低,甲醇产率下降。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
