专项复习 化学反应的微观历程--2025年高考化学选择性必修第一册(鲁科版)(共21张PPT)
文档属性
| 名称 | 专项复习 化学反应的微观历程--2025年高考化学选择性必修第一册(鲁科版)(共21张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-06 20:55:12 | ||
图片预览





文档简介
(共21张PPT)
第2章 化学反应的方向、限度与速率
2025年高考化学一轮复习
选择性必修第一册鲁科版
专项复习 化学反应的微观历程
角度1 “波形”反应机理图
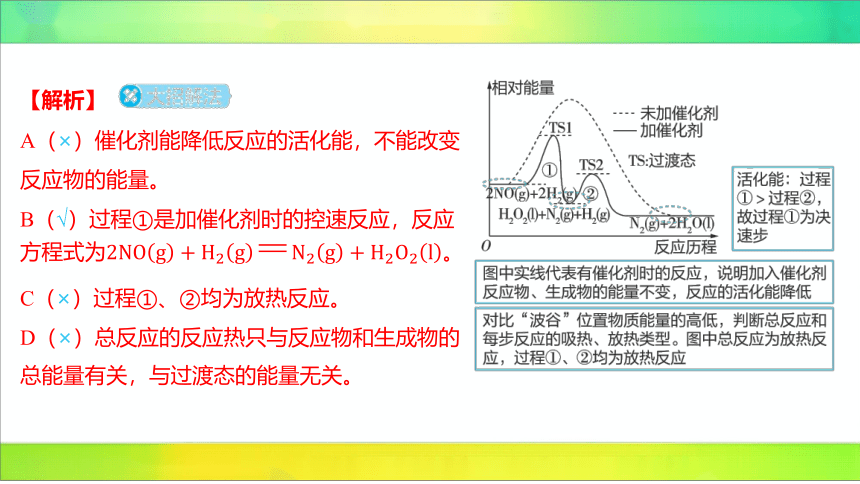
1.(2024江苏南京航空航天大学苏州附属中学月考) 是
大气污染物之一,常用还原。与 反应的反应历程
如图所示。下列说法正确的是( )
B
A.催化剂能提高反应物的能量
B.加催化剂时的控速反应为
C.过程①是放热反应,过程②是吸热反应
D.过渡态的能量决定总反应的反应热
【解析】
A(×)催化剂能降低反应的活化能,不能改变
反应物的能量。
B(√)过程①是加催化剂时的控速反应,反应
方程式为 。
C(×)过程①、②均为放热反应。
D(×)总反应的反应热只与反应物和生成物的
总能量有关,与过渡态的能量无关。
角度2 “环形”反应机理图
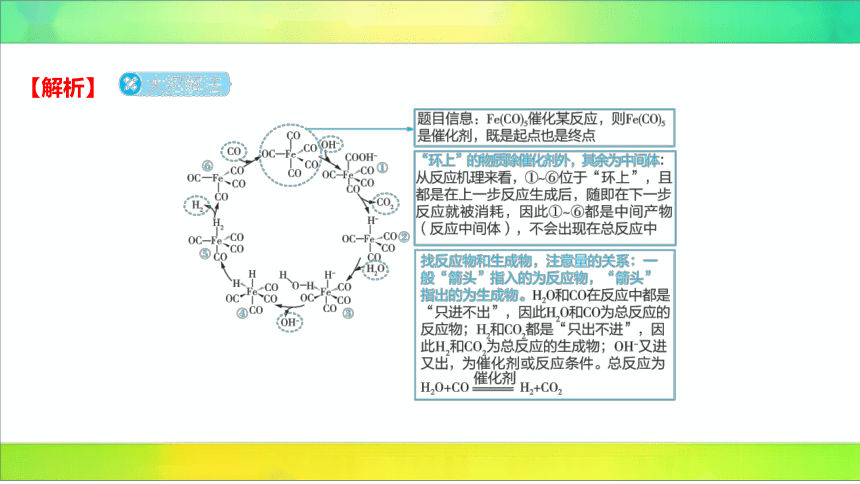
2.(2024河北石家庄十七中期末)据文献报道: 催
化某反应的一种反应机理如图所示。下列叙述错误的是
( )
C
A. 参与了该催化循环
B.该反应可产生清洁燃料
C.该反应可消耗温室气体
D.该催化循环中 的成键数目发生变化
【解析】
A(√)分析反应机理图可知,有进入的箭头也有出去的箭头,说明 参与了该
催化循环。
B(√)根据上述分析可知,总反应为,可产生清洁燃料 。
C(×)从总反应可知,该反应不消耗温室气体,而是生成了温室气体 。
D(√)从结构简式可知,催化剂和①、②、⑤中 的成键数目均为5,③、④
中的成键数目均为6,⑥中的成键数目为4,该催化循环中 的成键数目发生变化。
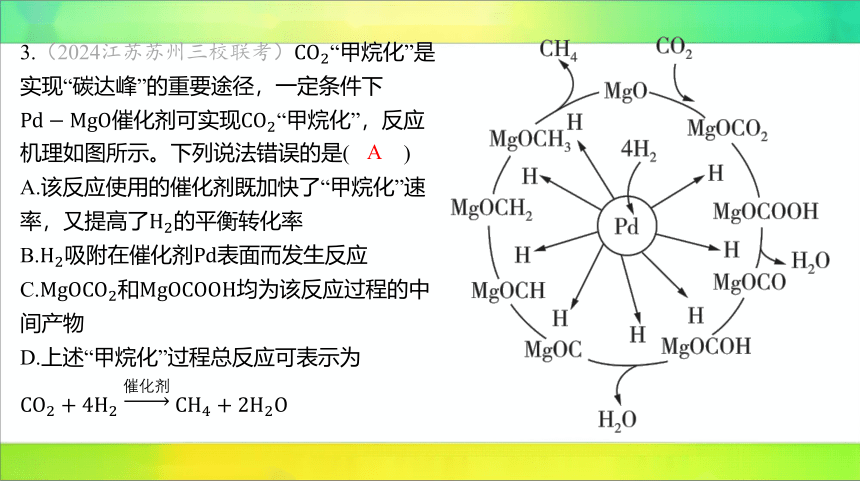
3.(2024江苏苏州三校联考) “甲烷化”是
实现“碳达峰”的重要途径,一定条件下
催化剂可实现 “甲烷化”,反应
机理如图所示。下列说法错误的是( )
A
A.该反应使用的催化剂既加快了“甲烷化”速
率,又提高了 的平衡转化率
B.吸附在催化剂 表面而发生反应
C.和 均为该反应过程的中
间产物
D.上述“甲烷化”过程总反应可表示为
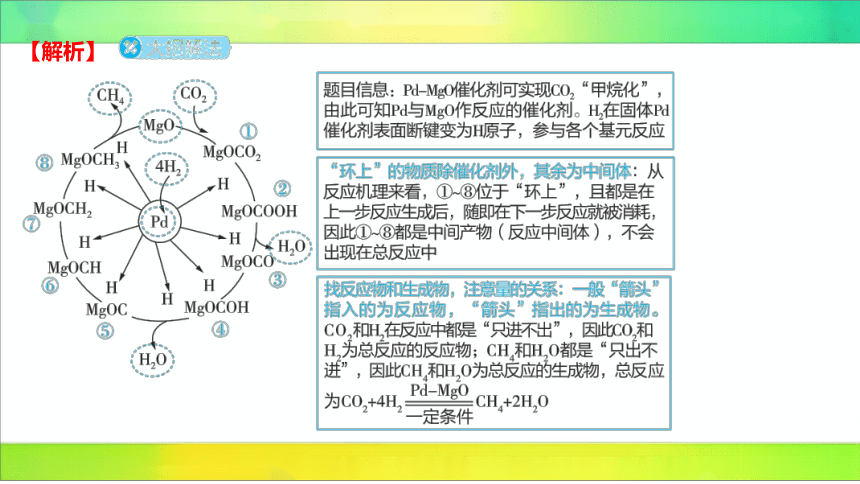
【解析】
A(×)使用催化剂可加快甲烷化速率,但对平衡移动无影响,不能改变 的平衡转化
率。
B(√)由反应历程图可知,吸附在催化剂 表面发生反应。
C(√)根据上述分析可知,和 均为该反应过程的中间产物。
D(√)根据上述分析可知,总反应为和在催化剂作用下生成和 ,
总反应为 。
角度3 “梯形”能量图
4.(2024浙江台州期中)活泼自由基与氧气的反应一直是备受关注的热点。 自由
基与 反应过程的能量变化如图所示,下列说法不正确的是( )
B
A.参与反应的反应物的总键能小于生成物的总键能
B.产物的稳定性:
C.相同条件下,中间产物转化为生成物、 的速
率
D.该反应过程中最大能垒(活化能)
【解析】
A(√)由分析可知,图中两个反应均为放热反应,
,则 ,即参与
反应的反应物的总键能小于生成物的总键能。
B(×)物质所具有的能量越高,物质越不稳定,由图像可知
生成物的能量高于,故产物的稳定性: 。
C(√)由分析可知,中间产物转化为生成物的活化能: ,活化能越大反应速率
越慢,则速率: 。
D(√)由分析可知,该历程中最大能垒活化能(为中间产物 生成物 的反应)
。
5.(2024福建三明第一中学月考)计算机模拟在电极材料表面发生反应制备
的历程如下(*表示微粒与催化剂 的接触位点):
下列说法错误的是( )
D
A.整个过程中既有极性键的断裂又有非极性键的断裂
B.逆向转化为的能垒为
C.转化为的过程中原子利用率为
D.相同条件下,在产物中的比例比 高
【解析】
A(√)反应过程中有极性键(键)、非极性键( 键)的断裂。
B (√) 逆向转化为的能垒为 。
C (√) 转化为的过程中,只生成 一种产物,所以原子利用率为
。
D (×) 转化为的反应慢,则在产物中的比例比 低。
角度4 其他反应机理图
6.(2024四川绵阳南山中学实验学校月考)为减少环境污染,发电厂试图采用以下方法
将废气中的进行合理利用,以获得重要工业产品。和研究发现与
合成 的反应机理如下:
快;
快;
慢。
其中反应②的速率方程,,、 是速率常
数。下列说法错误的是( )
C
A.反应②的平衡常数
B.反应①的活化能小于反应③的活化能
C.增大压强或使用催化剂可以增大该平衡时反应体系中 的体积分数
D.要提高合成 的速率,关键是提高反应③的速率
【解析】 A(√)反应②平衡常数,反应达到平衡状态时 ,即
,故 。
B(√)活化能越大,反应速率越慢,反应①是快反应、反应③是慢反应,故反应①的
活化能小于反应③的活化能。
C(×)催化剂不能使平衡移动,使用合适的催化剂不能改变平衡时该反应体系中
的体积分数。
D(√)反应③是慢反应,慢反应决定总反应速率 (【点拨】由多个基元反应构成的反
应中,其快慢取决于反应历程中的慢反应 ),要提高合成 的速率,关键是提高反
应③的速率。
7.(2024广东广州培英中学期中)“接触法制硫酸”的主要反应 在
催化剂表面的反应历程如下:
下列说法正确的是( )
D
A.使用催化剂只能加快正反应速率
B.反应②的活化能比反应①大
C.该反应的催化剂是
D.该过程中既有键的断裂,又有 键的形成
【解析】 A(×)“两个核心”之能量,加入适宜的催化剂 活化分子百分
数增加 单位体积内活化分子数增多 化学反应速率加快,催化剂能同等幅度地改变
正、逆反应速率,加快正反应速率的同时也加快逆反应速率。
B(×)反应的活化能越小,反应速率越快,反应②为快反应,故反应②的活化能比反
应①的小。
C(×)催化剂在反应中“先消耗后生成”,从反应历程图中可知,该反应的催化剂为
。
D(√)反应①中有键的断裂,反应②中有 键的形成。
8.(2023重庆育才中学考试)乙烯在酸催化下水合制乙醇的反应机理、能量与反应进程
的关系如图所示。下列说法正确的是( )
B
A.由图可知,总反应为放热反应,所以不需加热就能进行
B.第①步反应为决速步骤
C.使用催化剂只降低正反应的活化能,反应的焓变不变
D.中间体比中间体 更稳定
【解析】
A(×)总反应为放热反应,但反应是否需要加热与反应是否为放热反应无关。
B(√)第①步反应的能垒最大,为决速步骤。
C(×)使用催化剂,正、逆反应的活化能都降低,反应的焓变不变。
D(×)第①步反应的中间体比第②步反应的中间体 能量高,能量越高越不稳定,则
中间体的稳定性比中间体 弱。
第2章 化学反应的方向、限度与速率
2025年高考化学一轮复习
选择性必修第一册鲁科版
专项复习 化学反应的微观历程
角度1 “波形”反应机理图
1.(2024江苏南京航空航天大学苏州附属中学月考) 是
大气污染物之一,常用还原。与 反应的反应历程
如图所示。下列说法正确的是( )
B
A.催化剂能提高反应物的能量
B.加催化剂时的控速反应为
C.过程①是放热反应,过程②是吸热反应
D.过渡态的能量决定总反应的反应热
【解析】
A(×)催化剂能降低反应的活化能,不能改变
反应物的能量。
B(√)过程①是加催化剂时的控速反应,反应
方程式为 。
C(×)过程①、②均为放热反应。
D(×)总反应的反应热只与反应物和生成物的
总能量有关,与过渡态的能量无关。
角度2 “环形”反应机理图
2.(2024河北石家庄十七中期末)据文献报道: 催
化某反应的一种反应机理如图所示。下列叙述错误的是
( )
C
A. 参与了该催化循环
B.该反应可产生清洁燃料
C.该反应可消耗温室气体
D.该催化循环中 的成键数目发生变化
【解析】
A(√)分析反应机理图可知,有进入的箭头也有出去的箭头,说明 参与了该
催化循环。
B(√)根据上述分析可知,总反应为,可产生清洁燃料 。
C(×)从总反应可知,该反应不消耗温室气体,而是生成了温室气体 。
D(√)从结构简式可知,催化剂和①、②、⑤中 的成键数目均为5,③、④
中的成键数目均为6,⑥中的成键数目为4,该催化循环中 的成键数目发生变化。
3.(2024江苏苏州三校联考) “甲烷化”是
实现“碳达峰”的重要途径,一定条件下
催化剂可实现 “甲烷化”,反应
机理如图所示。下列说法错误的是( )
A
A.该反应使用的催化剂既加快了“甲烷化”速
率,又提高了 的平衡转化率
B.吸附在催化剂 表面而发生反应
C.和 均为该反应过程的中
间产物
D.上述“甲烷化”过程总反应可表示为
【解析】
A(×)使用催化剂可加快甲烷化速率,但对平衡移动无影响,不能改变 的平衡转化
率。
B(√)由反应历程图可知,吸附在催化剂 表面发生反应。
C(√)根据上述分析可知,和 均为该反应过程的中间产物。
D(√)根据上述分析可知,总反应为和在催化剂作用下生成和 ,
总反应为 。
角度3 “梯形”能量图
4.(2024浙江台州期中)活泼自由基与氧气的反应一直是备受关注的热点。 自由
基与 反应过程的能量变化如图所示,下列说法不正确的是( )
B
A.参与反应的反应物的总键能小于生成物的总键能
B.产物的稳定性:
C.相同条件下,中间产物转化为生成物、 的速
率
D.该反应过程中最大能垒(活化能)
【解析】
A(√)由分析可知,图中两个反应均为放热反应,
,则 ,即参与
反应的反应物的总键能小于生成物的总键能。
B(×)物质所具有的能量越高,物质越不稳定,由图像可知
生成物的能量高于,故产物的稳定性: 。
C(√)由分析可知,中间产物转化为生成物的活化能: ,活化能越大反应速率
越慢,则速率: 。
D(√)由分析可知,该历程中最大能垒活化能(为中间产物 生成物 的反应)
。
5.(2024福建三明第一中学月考)计算机模拟在电极材料表面发生反应制备
的历程如下(*表示微粒与催化剂 的接触位点):
下列说法错误的是( )
D
A.整个过程中既有极性键的断裂又有非极性键的断裂
B.逆向转化为的能垒为
C.转化为的过程中原子利用率为
D.相同条件下,在产物中的比例比 高
【解析】
A(√)反应过程中有极性键(键)、非极性键( 键)的断裂。
B (√) 逆向转化为的能垒为 。
C (√) 转化为的过程中,只生成 一种产物,所以原子利用率为
。
D (×) 转化为的反应慢,则在产物中的比例比 低。
角度4 其他反应机理图
6.(2024四川绵阳南山中学实验学校月考)为减少环境污染,发电厂试图采用以下方法
将废气中的进行合理利用,以获得重要工业产品。和研究发现与
合成 的反应机理如下:
快;
快;
慢。
其中反应②的速率方程,,、 是速率常
数。下列说法错误的是( )
C
A.反应②的平衡常数
B.反应①的活化能小于反应③的活化能
C.增大压强或使用催化剂可以增大该平衡时反应体系中 的体积分数
D.要提高合成 的速率,关键是提高反应③的速率
【解析】 A(√)反应②平衡常数,反应达到平衡状态时 ,即
,故 。
B(√)活化能越大,反应速率越慢,反应①是快反应、反应③是慢反应,故反应①的
活化能小于反应③的活化能。
C(×)催化剂不能使平衡移动,使用合适的催化剂不能改变平衡时该反应体系中
的体积分数。
D(√)反应③是慢反应,慢反应决定总反应速率 (【点拨】由多个基元反应构成的反
应中,其快慢取决于反应历程中的慢反应 ),要提高合成 的速率,关键是提高反
应③的速率。
7.(2024广东广州培英中学期中)“接触法制硫酸”的主要反应 在
催化剂表面的反应历程如下:
下列说法正确的是( )
D
A.使用催化剂只能加快正反应速率
B.反应②的活化能比反应①大
C.该反应的催化剂是
D.该过程中既有键的断裂,又有 键的形成
【解析】 A(×)“两个核心”之能量,加入适宜的催化剂 活化分子百分
数增加 单位体积内活化分子数增多 化学反应速率加快,催化剂能同等幅度地改变
正、逆反应速率,加快正反应速率的同时也加快逆反应速率。
B(×)反应的活化能越小,反应速率越快,反应②为快反应,故反应②的活化能比反
应①的小。
C(×)催化剂在反应中“先消耗后生成”,从反应历程图中可知,该反应的催化剂为
。
D(√)反应①中有键的断裂,反应②中有 键的形成。
8.(2023重庆育才中学考试)乙烯在酸催化下水合制乙醇的反应机理、能量与反应进程
的关系如图所示。下列说法正确的是( )
B
A.由图可知,总反应为放热反应,所以不需加热就能进行
B.第①步反应为决速步骤
C.使用催化剂只降低正反应的活化能,反应的焓变不变
D.中间体比中间体 更稳定
【解析】
A(×)总反应为放热反应,但反应是否需要加热与反应是否为放热反应无关。
B(√)第①步反应的能垒最大,为决速步骤。
C(×)使用催化剂,正、逆反应的活化能都降低,反应的焓变不变。
D(×)第①步反应的中间体比第②步反应的中间体 能量高,能量越高越不稳定,则
中间体的稳定性比中间体 弱。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
