专项复习 化学反应速率与化学平衡图像分析--2025年高考化学选择性必修第一册(鲁科版)(共24张PPT)
文档属性
| 名称 | 专项复习 化学反应速率与化学平衡图像分析--2025年高考化学选择性必修第一册(鲁科版)(共24张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-06 20:55:56 | ||
图片预览





文档简介
(共24张PPT)
第2章 化学反应的方向、限度与速率
2025年高考化学一轮复习
选择性必修第一册鲁科版
专项复习 化学反应速率与化学平衡图像分析
角度1 速率-时间图像
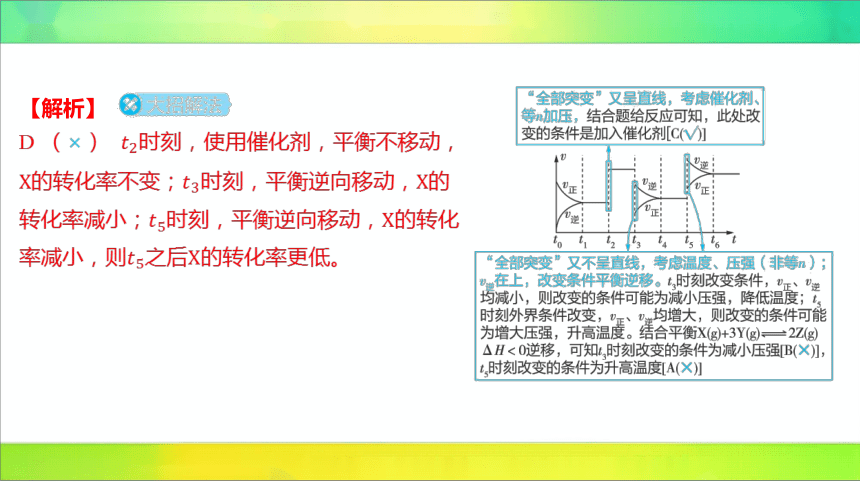
1.(2024吉林长春二中期中)某密闭容器中发生反应: 。如
图表示该反应的速率随时间变化的关系,、、 时刻外界条件有所改变,但都没
有改变各物质的初始加入量。下列说法正确的是( )
C
A.时刻增大了压强 B. 时刻降低了温度
C.时刻加入了催化剂 D.时间内 的转化率一定最低
【解析】
D (×) 时刻,使用催化剂,平衡不移动,
的转化率不变;时刻,平衡逆向移动, 的
转化率减小;时刻,平衡逆向移动, 的转化
率减小,则之后 的转化率更低。
角度2 浓度(物质的量)-时间图像
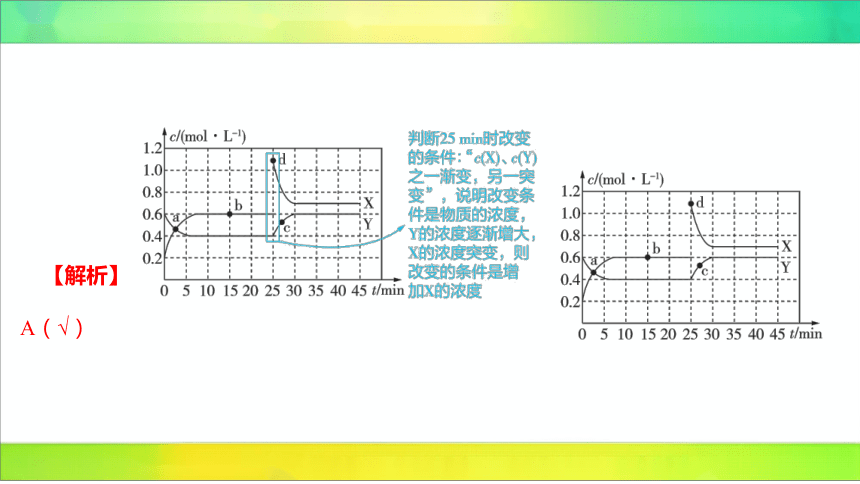
2.(2024广东广州东涌中学期中)已知和 可以相
互转化:。现将一定量和 的
混合气体通入体积为 的恒温密闭容器中,反应物及生成
物的浓度随时间变化的关系如图所示。下列说法不正确的
是( )
D
A.若混合气体的压强不变,则说明反应已达化学平衡状态
B.、、、四个点表示的反应体系中,表示化学反应处于平衡状态的只有 点
C.内用表示的平均化学反应速率是
D.反应进行至时,曲线发生变化的原因是增加 的浓度
【解析】 .
A(√)
分析反应 条件 分析反应特点 假设反应 正向进行 对应公式 及分析 作出判断
“变 量” 角度 恒温恒容 (、 不 变) 没有固体或纯液体参加 反应,反应前后气体分 子数减小 气体分子 数减小 ( ) ,, 则 体系的压强不再改
变,反应达到平衡
状态
速率之比等于化学计量数之比, ,则
。
D(×)由图示分析可知,时改变的条件是增大 的浓度。
B(√)物质的物质的量浓度不变时,表明反应达到平衡状
态,分析题图可知,、、、 四个点表示的反应体系中,
只有 点体系中各物质的物质的量浓度不变。
C (√) 内
,反应
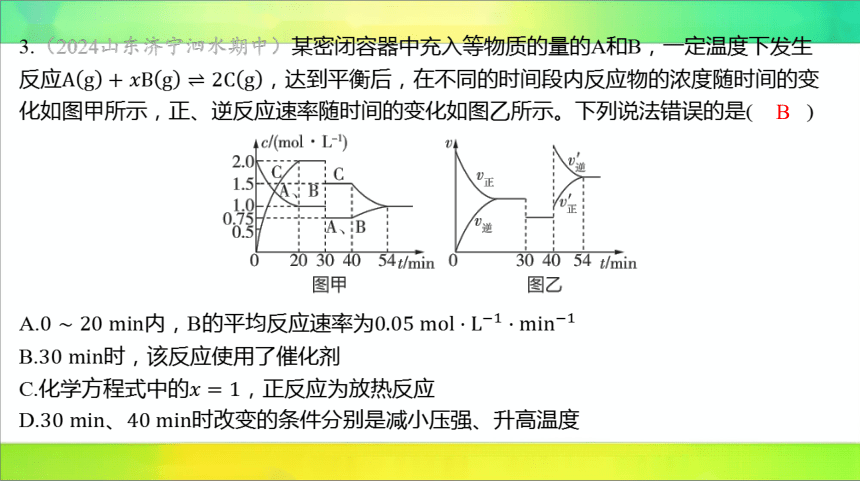
3.(2024山东济宁泗水期中)某密闭容器中充入等物质的量的A和B,一定温度下发生
反应 ,达到平衡后,在不同的时间段内反应物的浓度随时间的变
化如图甲所示,正、逆反应速率随时间的变化如图乙所示。下列说法错误的是( )
B
A.内,B的平均反应速率为
B. 时,该反应使用了催化剂
C.化学方程式中的 ,正反应为放热反应
D.、 时改变的条件分别是减小压强、升高温度
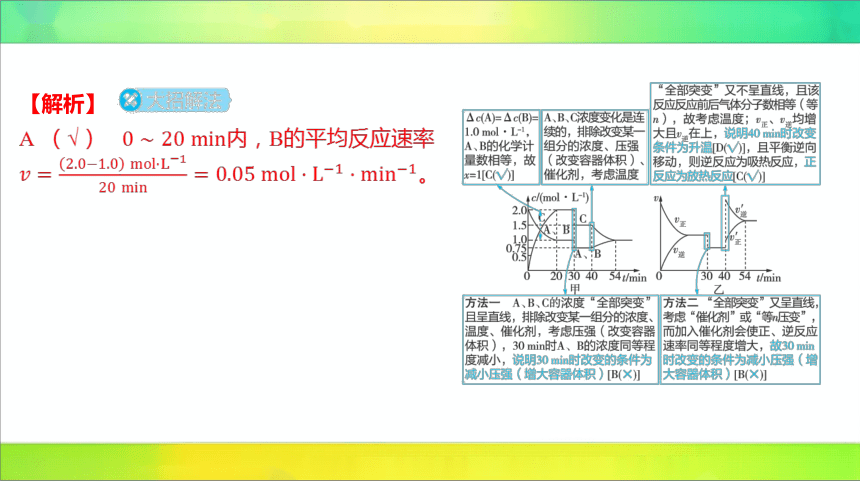
【解析】
A (√) 内,B的平均反应速率
。
角度3 含量(转化率)-时间-温度(压强)图像
4.(2023湖北十堰期末)工业上利用还原 可
制备金属铁,其反应原理为
。在不同温
度、下,向装有足量固体的 恒容密
闭容器中通入,测得反应体系中 的体积
分数随时间 的变化曲线如图所示。下列说
法正确的是( )
C
A.由图像分析可知
B.点时,的转化率为
C.点和点的化学平衡常数:
D.反应达到平衡后,保持温度不变,将从反应体系中移走可提高 的转化率
【解析】
A(×)由上述分析知 。
B(×)“三段式”法,设点时的转化量为 ,则
点时的体积分数为,则,解得,此时 的转化率为
。
C (√) ,温度越高,达到平衡时 的体积分数越低,说明升高温度,平衡
逆向移动,则减小,故化学平衡常数: 。
D(×)由于为固体,将从反应体系中移走,平衡不发生移动,不能提高 的转化
率。
5.(2024北京工业大学附中期中)已知某反应
在密闭容器中进行,在不同温度
和及压强和下,混合气体中B的质量分数 与
反应时间 的关系如图所示,下列判断正确的是( )
B
A.,,,
B.,,,
C.,,,
D.,,,
【解析】
角度4 转化率(质量分数)-温度(压强)图像
6.(2024广东佛山联考)乙烯气相直接水合反应制备乙醇:
。乙烯的平衡转化率随温度、压强的变化关系如图[起
始时,,容器体积为 。下列分析正确的是( )
C
A.乙烯气相直接水合反应的 B.图中压强的大小关系为
C.图中点对应的平衡常数 D.达到平衡状态所需要的时间:
【解析】 第一步:明确横、纵轴的含义 乙
烯的平衡转化率-温度图像。
C(√)“三段式”法,点对应的乙烯的平衡转化率为 ,
则点乙烯的转化量为 ,则:
点时、、的浓度分别为、、 ,则
点对应的平衡常数 。
D(×) 点对应的压强、温度均高于点,反应速率比 点大,先达到平衡。
7.(2024湖北武汉部分重点中学期中)已知反应
。在体积可变的密闭容器中,
按 充入反应物进行反应,A的平衡转化
率与温度、压强的关系如图所示。下列说法正确的是
( )
C
A.温度:
B.平均摩尔质量:,
C.点时平衡常数
D.点:(A) (B)
【解析】 第一步:明
确横、纵轴的含义 的平衡转化
率-压强图像。
B(×)反应中反应物和生成物均
为气体,则 不变;反应放热,
温度升高,平衡逆向移动,
增大,气体的平均摩尔质量减小,
即 。反应前后气体分
子数减小,同一温度下, 的
过程中,压强减小,平衡逆向移
动, 增大,气体的平均摩尔质量
减小,即 。
C(√)“三段式”法,初始时
,设, 点时A的平衡转化率为 ,故A的转化量为 ,则:
。
点为平衡点, ,反应速率之比等于化学计量数之比, ,故 。
角度5 其他特殊图像
8.(2024重庆杨家坪中学检测)现有下列两
个图像:
下列反应中符合上述图像的是( )
B
A.
B.
C.
D.
【解析】
9.(2024湖南长沙长郡中学期中)温度为 ,向体
积不等的恒容密闭容器中均充入气体 ,发生
反应,反应均进行 ,测
得各容器中 的转化率与容器体积的关系如图所示。
下列说法正确的是( )
B
A.点再充入一定量的,平衡正向移动, 的转化率
增大
B.点有
C.正反应速率
D.若点为平衡点,则浓度平衡常数
【解析】 A (×) 点再充入一定量的 ,容器体
积不变,相当于增大压强,平衡逆向移动, 的转化
率减小。
B(√)该反应为气体分子数增加的反应,容器体积
增大,相当于减小压强,平衡正向移动,因为 点容
器体积小于点,且点的转化率大于点,则 点反
应未达到平衡,反应正向进行, 。
C (×) 、点的转化率相同,但点容器体积更小, 点容器中反应物、生成物浓
度均大于点容器中的,浓度越大反应速率越大,所以正反应速率 。
D (×) 点不知容器体积,无法确定物质浓度,无法计算平衡常数。
第2章 化学反应的方向、限度与速率
2025年高考化学一轮复习
选择性必修第一册鲁科版
专项复习 化学反应速率与化学平衡图像分析
角度1 速率-时间图像
1.(2024吉林长春二中期中)某密闭容器中发生反应: 。如
图表示该反应的速率随时间变化的关系,、、 时刻外界条件有所改变,但都没
有改变各物质的初始加入量。下列说法正确的是( )
C
A.时刻增大了压强 B. 时刻降低了温度
C.时刻加入了催化剂 D.时间内 的转化率一定最低
【解析】
D (×) 时刻,使用催化剂,平衡不移动,
的转化率不变;时刻,平衡逆向移动, 的
转化率减小;时刻,平衡逆向移动, 的转化
率减小,则之后 的转化率更低。
角度2 浓度(物质的量)-时间图像
2.(2024广东广州东涌中学期中)已知和 可以相
互转化:。现将一定量和 的
混合气体通入体积为 的恒温密闭容器中,反应物及生成
物的浓度随时间变化的关系如图所示。下列说法不正确的
是( )
D
A.若混合气体的压强不变,则说明反应已达化学平衡状态
B.、、、四个点表示的反应体系中,表示化学反应处于平衡状态的只有 点
C.内用表示的平均化学反应速率是
D.反应进行至时,曲线发生变化的原因是增加 的浓度
【解析】 .
A(√)
分析反应 条件 分析反应特点 假设反应 正向进行 对应公式 及分析 作出判断
“变 量” 角度 恒温恒容 (、 不 变) 没有固体或纯液体参加 反应,反应前后气体分 子数减小 气体分子 数减小 ( ) ,, 则 体系的压强不再改
变,反应达到平衡
状态
速率之比等于化学计量数之比, ,则
。
D(×)由图示分析可知,时改变的条件是增大 的浓度。
B(√)物质的物质的量浓度不变时,表明反应达到平衡状
态,分析题图可知,、、、 四个点表示的反应体系中,
只有 点体系中各物质的物质的量浓度不变。
C (√) 内
,反应
3.(2024山东济宁泗水期中)某密闭容器中充入等物质的量的A和B,一定温度下发生
反应 ,达到平衡后,在不同的时间段内反应物的浓度随时间的变
化如图甲所示,正、逆反应速率随时间的变化如图乙所示。下列说法错误的是( )
B
A.内,B的平均反应速率为
B. 时,该反应使用了催化剂
C.化学方程式中的 ,正反应为放热反应
D.、 时改变的条件分别是减小压强、升高温度
【解析】
A (√) 内,B的平均反应速率
。
角度3 含量(转化率)-时间-温度(压强)图像
4.(2023湖北十堰期末)工业上利用还原 可
制备金属铁,其反应原理为
。在不同温
度、下,向装有足量固体的 恒容密
闭容器中通入,测得反应体系中 的体积
分数随时间 的变化曲线如图所示。下列说
法正确的是( )
C
A.由图像分析可知
B.点时,的转化率为
C.点和点的化学平衡常数:
D.反应达到平衡后,保持温度不变,将从反应体系中移走可提高 的转化率
【解析】
A(×)由上述分析知 。
B(×)“三段式”法,设点时的转化量为 ,则
点时的体积分数为,则,解得,此时 的转化率为
。
C (√) ,温度越高,达到平衡时 的体积分数越低,说明升高温度,平衡
逆向移动,则减小,故化学平衡常数: 。
D(×)由于为固体,将从反应体系中移走,平衡不发生移动,不能提高 的转化
率。
5.(2024北京工业大学附中期中)已知某反应
在密闭容器中进行,在不同温度
和及压强和下,混合气体中B的质量分数 与
反应时间 的关系如图所示,下列判断正确的是( )
B
A.,,,
B.,,,
C.,,,
D.,,,
【解析】
角度4 转化率(质量分数)-温度(压强)图像
6.(2024广东佛山联考)乙烯气相直接水合反应制备乙醇:
。乙烯的平衡转化率随温度、压强的变化关系如图[起
始时,,容器体积为 。下列分析正确的是( )
C
A.乙烯气相直接水合反应的 B.图中压强的大小关系为
C.图中点对应的平衡常数 D.达到平衡状态所需要的时间:
【解析】 第一步:明确横、纵轴的含义 乙
烯的平衡转化率-温度图像。
C(√)“三段式”法,点对应的乙烯的平衡转化率为 ,
则点乙烯的转化量为 ,则:
点时、、的浓度分别为、、 ,则
点对应的平衡常数 。
D(×) 点对应的压强、温度均高于点,反应速率比 点大,先达到平衡。
7.(2024湖北武汉部分重点中学期中)已知反应
。在体积可变的密闭容器中,
按 充入反应物进行反应,A的平衡转化
率与温度、压强的关系如图所示。下列说法正确的是
( )
C
A.温度:
B.平均摩尔质量:,
C.点时平衡常数
D.点:(A) (B)
【解析】 第一步:明
确横、纵轴的含义 的平衡转化
率-压强图像。
B(×)反应中反应物和生成物均
为气体,则 不变;反应放热,
温度升高,平衡逆向移动,
增大,气体的平均摩尔质量减小,
即 。反应前后气体分
子数减小,同一温度下, 的
过程中,压强减小,平衡逆向移
动, 增大,气体的平均摩尔质量
减小,即 。
C(√)“三段式”法,初始时
,设, 点时A的平衡转化率为 ,故A的转化量为 ,则:
。
点为平衡点, ,反应速率之比等于化学计量数之比, ,故 。
角度5 其他特殊图像
8.(2024重庆杨家坪中学检测)现有下列两
个图像:
下列反应中符合上述图像的是( )
B
A.
B.
C.
D.
【解析】
9.(2024湖南长沙长郡中学期中)温度为 ,向体
积不等的恒容密闭容器中均充入气体 ,发生
反应,反应均进行 ,测
得各容器中 的转化率与容器体积的关系如图所示。
下列说法正确的是( )
B
A.点再充入一定量的,平衡正向移动, 的转化率
增大
B.点有
C.正反应速率
D.若点为平衡点,则浓度平衡常数
【解析】 A (×) 点再充入一定量的 ,容器体
积不变,相当于增大压强,平衡逆向移动, 的转化
率减小。
B(√)该反应为气体分子数增加的反应,容器体积
增大,相当于减小压强,平衡正向移动,因为 点容
器体积小于点,且点的转化率大于点,则 点反
应未达到平衡,反应正向进行, 。
C (×) 、点的转化率相同,但点容器体积更小, 点容器中反应物、生成物浓
度均大于点容器中的,浓度越大反应速率越大,所以正反应速率 。
D (×) 点不知容器体积,无法确定物质浓度,无法计算平衡常数。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
