第3章 物质在水溶液中的行为-章末复习测试(共83张PPT)--2025年高考化学选择性必修第一册(鲁科版).pptx
文档属性
| 名称 | 第3章 物质在水溶液中的行为-章末复习测试(共83张PPT)--2025年高考化学选择性必修第一册(鲁科版).pptx |  | |
| 格式 | pptx | ||
| 文件大小 | 7.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-06 20:57:42 | ||
图片预览










文档简介
(共83张PPT)
第3章 物质在水溶液中的行为
2025年高考化学一轮复习
选择性必修第一册鲁科版
章节复习测试
一、选择题(本题包括10小题,每小题只有1个选项符合题意)
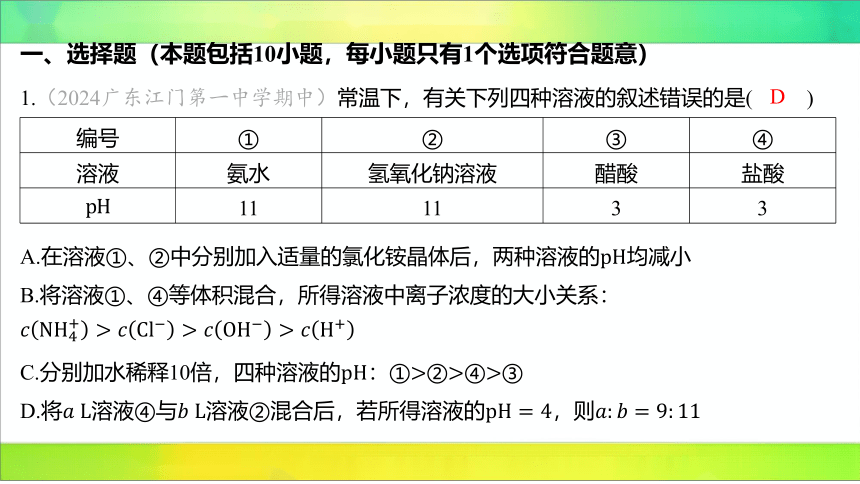
1.(2024广东江门第一中学期中)常温下,有关下列四种溶液的叙述错误的是( )
编号 ① ② ③ ④
溶液 氨水 氢氧化钠溶液 醋酸 盐酸
11 11 3 3
D
A.在溶液①、②中分别加入适量的氯化铵晶体后,两种溶液的 均减小
B.将溶液①、④等体积混合,所得溶液中离子浓度的大小关系:
C.分别加水稀释10倍,四种溶液的:①②④ ③
D.将溶液④与溶液②混合后,若所得溶液的,则
【解析】 A(√)氨水中存在电离平衡 ,在溶液①中加入
,增大,的电离平衡逆向移动, 减小,在溶液②中加入
,与反应生成,部分电离, 减小,又温度
不变不变,则两种溶液中均增大, 均减小。
B(√)的盐酸(强酸)溶液与的氨水( 是弱碱)等体积混合,
完全中和后氨水有大量剩余,溶液呈碱性, ,结合电荷守恒
,知
C(√)强电解质完全电离、弱电解质部分电离,常温下 相同的溶液①、②浓度大小
顺序为①②,相同的溶液③、④浓度大小顺序为③ ④,加水促进弱电解质的电离,
弱电解质溶液变化较缓慢,则这四种溶液稀释相同倍数时 。
D(×)若所得溶液的 ,则酸过量,
, 。
2.(2024山东泰安一中月考)常温下,下列各组离子在指定溶液中一定能大量共存的是
( )
A
A.的溶液中:、、、
B.的溶液中:、、、
C.滴加溶液显红色的溶液中:、、、
D.水电离的的溶液中:、、、
【解析】 A(√) 的溶液显碱性,碱性条件下,该组离子均能共存。
B(×),即,溶液呈酸性, 不能大量存在。
C(×)滴加溶液显红色的溶液中含有,能与 发生氧化还原反应,
不能大量共存。
D(×)水电离的 的溶液,可能为酸性,也可能为碱性,
若为酸性,不能大量存在,若为碱性, 不能大量存在。
3.(生活情境)(2023江苏徐州王杰中学月考)水溶液中的离子反应与平衡在生活中应
用广泛。下列说法不正确的是( )
C
A.已知人体体液中存在如下平衡: ,当静脉滴注大量
生理盐水时,平衡向右移动,体液的 增大
B.牙齿表面覆盖的牙釉质存在如下平衡:
,小孩长牙时少吃糖多补钙
C.用硫酸洗涤沉淀,与用等体积的蒸馏水洗涤相比,
损失更多
D.人们洗发时所用的洗发液的约为,洗净后再使用具有保护头发、调节 功能的
护发素
【解析】 A(√)输入生理盐水相当于稀释体液,和 浓度减小,平衡右移
(【提醒】平衡移动是有限的,不能抵消条件的改变,最终结果减小), 增大。
B(√)残留在牙齿上的糖会发酵产生,能与反应,可使 沉淀
溶解平衡右移,破坏牙釉质;增大,可使 沉淀溶解平衡左移,
保护牙齿,故小孩长牙时少吃糖多补钙。
C(×)沉淀存在沉淀溶解平衡: ,稀硫酸洗涤
可使沉淀溶解平衡逆向移动,减少 沉淀的损失。
D(√)头皮本身是弱酸性环境,使用弱碱性洗发水后再使用弱酸性成分的护发素,护
发素具有保护头发、调节 的功能。
4.(2023陕西咸阳期末)下列实验操作、现象与结论相匹配的是( )
选项 实验操作 现象 结论
A 向溶液中通入 产生白色沉 淀 白色沉淀是
B 常温下,分别测定浓度均为 的 溶液和 溶液的 均等于7 常温下,浓度均为
的溶液和 溶
液中水的电离程度相等
C 向沸水中滴入几滴 饱和溶 液,继续煮沸,并用激光笔照射 溶液变红褐 色,出现丁 达尔效应 产生了 胶体
√
选项 实验操作 现象 结论
D 向 溶液中滴 加等浓度的 溶液,再加 入等浓度的 溶液 先产生白色 沉淀后产生 黑色沉淀
续表
【解析】 A(×)溶于水后溶液显酸性,酸性条件下 有强氧化性,故最终得到
的白色沉淀为 。
B(×) (弱酸弱碱盐)水解促进水的电离,且两种离子的水解程度相当,
最终使溶液呈中性; (强酸强碱盐)不水解,对水的电离无影响,
溶液呈中性,故水的电离程度:溶液 溶液。
C(√)丁达尔效应是胶体的特征性质。
D(×)向溶液中滴加等浓度的溶液, 过量
(【易错】忽视过量,误认为发生了沉淀转化),再滴加 溶液发生反应
,未发生沉淀的转化,不能得到 。
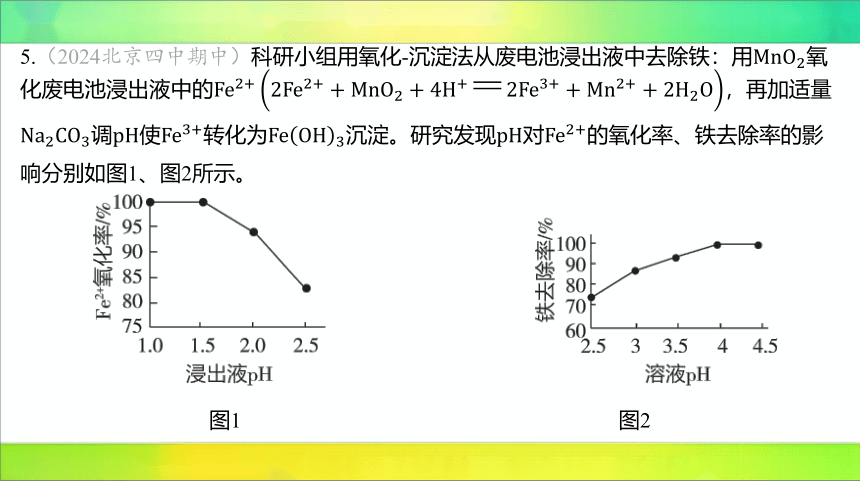
5.(2024北京四中期中)科研小组用氧化-沉淀法从废电池浸出液中去除铁:用 氧
化废电池浸出液中的,再加适量
调使转化为沉淀。研究发现对 的氧化率、铁去除率的影
响分别如图1、图2所示。
图1
图2
下列说法不合理的是( )
B
A.由图1可知,时氧化率随浸出液 增大而减小
B.若起始浸出液,与反应一段时间后,浸出液 会减小
C.转变为沉淀的离子方程式为
D.推测若用调溶液也可以使转化为 沉淀
【解析】 A(√)由题图1可知,时氧化率随着 增大而减小。
B(×)由题图1可知,时,完全被氧化,与反应时消耗 ,即随
着反应进行减小, 增大。
C(√)与发生相互促进的水解反应生成沉淀和 气体,离子方程式
为 。
D(√)和也能发生相互促进的水解反应生成沉淀和 气体。
6.(2024广东江门培英中学期中)某小组的同学向一定体积的
溶液中逐渐加入稀硫酸,并测得混合溶液的导电能力随
时间变化的曲线如图所示。下列说法正确的是( )
D
A.段溶液的导电能力不断减弱,说明产物 是弱电解质
B. 段碱过量,反应的离子方程式为:
C.段溶液的导电能力不断增强,说明过量的 发生电离
D.时刻 溶液与稀硫酸恰好完全中和
【解析】 A(×)溶液的导电能力与电解质的强弱没有必然联系
(【点拨】溶液的导电能力与溶液中的离子浓度和离子所带电荷
数有关), 溶解度很小,但溶于水的部分能完全电离,属
于强电解质。
B(×) 段反应的离子方程式为
。
C(×)D(√)加入稀硫酸的过程中发生反应
,反应完全( 时刻)时溶液的
导电性最小,继续加入稀硫酸,过量的 发生电离,溶液的导电性逐渐增强。
7.(2024江苏扬州中学月考)工业上可利用氨水吸收和 ,原理如图所示。已
知:时,的, 的
, ,下列说法正确的是( )
C
A.向氨水中通入恰好生成:
B.向氨水中通入至:
C.反应的平衡常数
D.被吸收的离子方程式:
【解析】 A(×) 等式中一边微粒能电离出,另一边微粒能结合 ,先
找质子守恒。
第一步:将弱电解质粒子写在中 间,并标明得失质子数 _________________________________________________________________________________
第二步:列等式,得失几个质 子,微粒前面的计量数就是几
,以电离为主,且 水解也使溶液显
酸性,则溶液显酸性, ,故
。
B(×) 向氨水中通入至(【点拨】一般给出 ,必考电荷守
恒), ,找电荷守恒。
第一步:列出溶液中所有离子 、、、、
第二步:阳离子、阴离子列在两侧
第三步:乘电荷、写等号
故 。
C(√) 。
D(×)不能拆开写,正确的离子方程式为 。
8.(2024北京师范大学附中月考)测定 溶液先升温再降温过程中的
,数据如表所示。
时刻 ① ② ③ ④
温度 25 30 40 25
9.66 9.52 9.37 9.25
实验过程中,取①④时刻的溶液,加入盐酸酸化的 溶液做对比试验,④产生白色
沉淀多。下列说法错误的是( )
C
A.溶液中存在水解平衡:
B.④的与①不同,是由于 浓度减小造成的
C.① ③的过程中,温度和浓度对水解平衡移动方向的影响一致
D.①与④的 相等
【解析】 A(√)为强碱弱酸盐, 存在水解平衡:
(【点拨】多元弱酸根离子的水解分步进行,且以第一步为
主)。
B(√)(√)取①④时刻的溶液,加入盐酸酸化的 溶液做对比实验,④产生白色
沉淀多,说明实验过程中部分被氧化成,④与①相比 减小,
的水解平衡逆向移动,减小,而只与温度有关,④与①温度相同,
相同,故, 。
C(×)盐类水解为吸热过程,的过程中,升高温度 水解平衡正向移动,部
分被氧化成,减小, 水解平衡逆向移动。
9.(2024江苏南京师范大学附中期中)室温下,用含少量的 溶液制备
的过程如图所示。已知 ,
。下列说法正确的是( )
C
A.溶液中:
B.“除镁”得到的上层清液中:
C.溶液中:
D.“沉锰”后的滤液中:
【解析】 A(×) 溶液中
存在电荷守恒 。
B(×)“除镁”得到的上层清液中存在 的沉淀溶解平衡,
,则 。
C(√)将等式 进行变形得到
,
溶液中存在质子守恒:
(链接大招35)。
D(×)“沉锰”后的滤液中还存在、
等离子,故电荷守恒中应增加其他离子使等
式成立(【警示】电荷守恒中要包含溶液中
所有存在的离子)。
10.(2024重庆部分学校联考)某同学在两个相同的特制容器中分
别加入 溶液和
溶液,再分别用 盐酸滴定,
用 计和压力传感器检测,得到如图曲线,下列说法不正确的是
( )
D
A.甲、丁表示向溶液中滴加盐酸,乙、丙表示向 溶液中滴加盐酸
B.和 溶液中均满足:
C.根据图,滴定分析时 点可用甲基橙作指示剂指示滴定终点
D.若换成醋酸, 点向下移动
【解析】 A(√)越弱越水解,水解程度:
,则溶液 :
;直接与反应生成 气体,
与反应先生成,再与反应生成
气体,体系压强较 体系先增大,故甲、丁表示向
溶液中滴加盐酸,乙、丙表示向 溶液中滴加盐酸。
B(√)将等式 进行变形得到
,等式中一边全为阳离子,另一边全
为阴离子,找电荷守恒。
第一步:列出溶液中所有离子 、、、、
第二步:阳离子、阴离子列在两侧
第三步:乘电荷(乘以自身所带电荷 数)、写等号 2
C(√)点的 在4左右,在甲基橙的变色范围内,可选择甲基橙作指示剂。
D(×)若换成醋酸,反应生成,其水解使溶液显碱性, 点向
上移动。
二、选择题(本题包括5小题,每小题有1个或2个选项符合题意)
11.(2024陕西榆林五校联考)常温下,将 缓慢通入水中
至饱和,然后向所得饱和氯水中滴加 溶液,
整个实验进程中溶液的 变化曲线如图所示,下列叙述正确
的是( )
AB
已知:常温常压下,
A.点所示溶液中:
B.点所示的溶液中:
C.水的电离程度:
D.点所示溶液中:
【解析】
A(√)点所示溶液中氯水没有饱和, 正向进行,
。
B(√)点所示溶液中达到饱和,存在平衡, 为
弱电解质,部分电离,则 。
C(×)、点所示溶液均为和的混合溶液,水的电离被抑制, 点所示溶液
,水解对水电离的促进程度与电离对水电离的抑制程度相当,故 点
所示溶液中水的电离程度最大。
D(×)点所示溶液呈中性,则 ,结合电荷守恒
,知 ,又存在
元素质量守恒,故 。
12.(2024黑龙江哈尔滨师范大学附中期中)某温度下,
改变溶液的 时,各种含铬元素
微粒及浓度变化如图所示(已知 是二元
酸),下列有关说法正确的是( )
D
A.该温度下的
B.溶液中存在平衡 ,该
温度下此反应的
C.向 溶液(橙色)中加入一定量
固体,溶液橙色加深
D.点溶液中存在:
【解析】 A(√)点时, ,此时
,则
。
B(×)点时, ,则
。
C(×)加入固体,平衡正向移动, 增大,
溶液橙色变浅。
D(√)点时, ,溶液中存在电荷守恒:
,即
,此时溶液显酸性,
,则。
13.(2024吉林长春吉大附中实验学校期末)溶洞水体中的
与空气中的保持平衡,其水体中
(为、、或)与 的关系如图所示。
已知 ,下列说法错误的
是( )
BC
A.
B.曲线Ⅱ代表
C.
D.点溶液中,
【解析】
识图过程 第一步:定曲线。 存在电离平衡:
(主)、 ,随着
溶液碱性增强(增大),、 逐渐增大,
且偏酸性条件下,较大,故曲线Ⅰ代表 ,曲线
Ⅱ代表;溶洞水体中 存在沉淀溶解平衡:
,随着增大, 增
大,的沉淀溶解平衡逆向移动, 减小,故曲
线Ⅲ代表 。
第二步:找交点,利用交点处的离子浓度相等关系可计算
酸的电离常数。 点处, ,则
,
同理,由点可得 。
识图结果
A(√) 。
B(×)曲线Ⅱ代表 。
C(×), 点
时,则, 。
D(√)点溶液中,, ,又
,且 ,则
, 。
14.(2024湖南永州模拟)用溶液滴定
溶液,溶液中(为、、、)随 变化曲线及滴定曲线如图所
示,其中表示加入的溶液体积与 溶液体积之比。下列说法错误的是
( )
C
A.曲线①代表,曲线②代表
B.的
C.溶液中:
D.D、 两点之间的某一点有:
【解析】
识图过程 第一步:定曲线。用 溶液滴定
溶液,先后发生反应 、
、 ,在滴定过程中,
逐渐增大,减小,先增大后减小, 先增大后减小,
增大,且开始时,故曲线①代表,曲线②代表 ,
曲线③代表,曲线④代表 。
第二步:找交点,利用交点处的离子浓度相等关系可计算
酸的电离常数。B点处, ,则
,同理,由
D点可得、由点可得 。
识图结果
A(√)曲线①代表,曲线②代表 。
B(√)的 。
C(×)点对应溶液溶质为,,显碱性, ,故
。
D(√)等式中一边全含一种元素,另一边全含另一种元素,找元素守恒。D点对应溶液
中:
第一步:列出关键元素 (非、非 元素)的比例关系 ,即
第二步:找出关键元素在溶液 中的所有存在形式 A元素在溶液中以、、、 的形式存
在
第三步:列等式
同理可得点时, ,故
D、两点之间的某一点有 。
15.(新图像)(2024湖南长沙长郡中学期末)电位滴定是利用溶液电位突变指示终点
的滴定法。在化学计量点附近,被测离子浓度发生突跃,指示电极电位 也产生了
突跃,进而确定滴定终点的位置。常温下,用盐酸标准溶液测定 某纯碱
样品溶液中 的含量(其他杂质不参与反应),电位滴定曲线如图所示。下列说
法错误的是( )
B
A.点表示第一滴定终点, 点表示第二滴定终点
B.该滴定过程需要酚酞和甲基橙两种指示剂
C.该纯碱样品溶液中含有的质量为
D.到过程中存在
【解析】 A(√)由已知信息“电位滴定是利用溶液电位
突变指示终点的滴定法”可知,点、 点对应的电极电位
均产生了突跃,即达到了滴定终点,故 点表示第一滴定
终点, 点表示第二滴定终点。
B(×)电位滴定根据指示电极电位的突跃位置就可以确
定滴定终点,无需任何指示剂。
C(√)滴定过程中依次发生的反应为
、 ,
若没有 杂质,滴定到达两个滴定终点消耗的盐酸
的量应相等,则第二个滴定终点相比第一个滴定终点多
消耗的盐酸为杂质消耗的盐酸,则 的质
量为 。
D(√)在整个滴定过程中,参加反应的离子是 、
、,溶液中的不参加反应, 点是第二滴定终
点,此时完全反应生成, ,
在点之前盐酸不足, 。
三、非选择题(本题包括4小题)
16.(2023辽宁六校联考)常温下,有浓度均为的下列六种溶液:① 溶
液,②溶液,③溶液,④溶液,⑤溶液,⑥ 溶液。
物质
电离常数/ 、
(1) 溶液③ 的原因是_________________________________(用离子方程式
表示)。
【解析】 为强碱弱酸盐,溶液因 水解而显碱性,其水解的离子方
程式为 。
(2) 溶液①中各离子浓度由大到小的顺序是__________________________________。
【解析】 为强碱弱酸盐,溶液因 水解而显碱性,但水解程度较小,故溶液中
各离子浓度由大到小的顺序是 。
(3) 溶液①和③相比较,___(填“ ”“ ”或“”) 。
【解析】 ,酸性:,“越弱越水解”, 的
水解能力比强,则溶液的 大。
(4) 溶液②和溶液④稀释100倍,则稀释后___(填“ ”“ ”或“ ”)
。
【解析】 溶液②和溶液④浓度相同(【警示】溶液②和溶液④起始 不同,切勿根据
等的强碱、弱碱溶液稀释相同倍数,强碱溶液 减小得多来判断),均稀释100倍后
浓度仍相同,为强电解质,完全电离, 为弱电解质,部分电离,故二者
均稀释100倍后 。
(5) 溶液中混有 杂质时,通常加入氧化铜固体以达到除杂目的,原因是__
____________________________________________________________________________
_________________________________________(用相应的离子方程式和必要的文字加
以解释)。
,加入粉末时,与反应,降低,使的水解正向进行,逐渐减小至消除
(6) 时,向溶液①中通入少量 ,发生反应的离子方程式为________________
___________________。
【解析】
故溶液中通入少量 ,发生的反应是
。
(7) 常温下,若溶液④和溶液⑤的混合溶液中 ,则该混合溶液呈___
(填“酸”“碱”或“中”)性。
中
【解析】 溶液、 溶液的混合溶液中存在电荷守恒:
,因,则 ,溶液
呈中性。
17.(2024辽宁大连滨城高中期中)雌黄和雄黄 都是自然界中常见的砷化
合物,早期曾用作绘画颜料,因都有抗病毒疗效而入药。 可转化为用于治疗白血
病的亚砷酸 。
图1
(1) 向溶液中滴加 溶液,
溶液中、、、 的分布分数
(平衡时某含微粒的浓度占所有含 微粒浓度之和的
分数)与 的关系如图1所示。
【解析】
识图过程 第一步:定曲线,随着 增大,溶液中酸分子浓度逐渐减少、酸根离子浓度
逐渐增加、各级酸式酸根离子浓度先增加后减少。为三元弱酸,则 浓度
逐渐减少、浓度先增加后减少、浓度先增加后减少且变化比
晚、 浓度逐渐增加。
第二步:找交点,利用交点处的离子浓度相等可计算酸
的电离常数。 点处, ,则
。
第三步:看峰值,曲线峰值对应的 ,说明对应离
子以电离为主;曲线峰值对应的 ,说明对应离子
以水解为主。表示、 的曲线峰值对应的
,说明、 均以水解为主。
识图结果
图1
① 溶液呈______(填“酸性”“碱性”或“中
性”)。
碱性
【解析】 溶液 ,呈碱性。
图1
② 时,的第一电离平衡常数
______________。
【解析】 。
图1
③ 人体血液的在 之间,用药后人体中含
砷元素的主要微粒是________。
【解析】 在 之间含砷元素的主要微粒是
。
图1
④ 下列说法正确的是___(填字母)。
.点对应的溶液中:
. 点对应的溶液中:
.在 溶液中:
.常温下,时,溶液中:
【解析】 (×)等式中一边全含 ,找元素质量守
恒。 ,
但点时加入了 溶液,溶液总体积发生了变化
(【警示】切勿忽视 点时溶液体积的变化),故
。
(√)等式中一边全为阳离子,另一边全为阴离子,找电荷守恒。
第一步:列出溶液 中所有离子 、、、、、
第二步:阳离子、 阴离子列在两侧
第三步:乘电荷、 写等号
又点对应的溶液中 ,故
。
(×)
“ 层次”
、
“ 层次”
、
极其微弱的层 次
、、
离子浓度关系: (×) 时,溶液中有电荷守恒:
,而当
时,几乎为0, ,故
。
⑤当时含砷元素的主要微粒是,当 时含砷元素的主要微粒
是,故反应的离子方程式是 。
图1
图1
⑤ 将溶液滴入亚砷酸溶液中,在溶液 由10.8
变至12.8过程中,发生反应的离子方程式是__________
_____________________。
图2
(2) 工业含砷(Ⅲ)废水常用铁盐处理后排放,其原理
是铁盐混凝剂在溶液中产生 胶粒,其表面带有正
电荷,可吸附含砷化合物。经测定不同 条件下铁盐对
含砷(Ⅲ)化合物的去除率如图2所示。在 之间时,
随溶液 增大,铁盐混凝剂对含砷(Ⅲ)化合物的吸附
效果增强。结合图1和图2解释可能的原因:
__________________________________________________
__________________________________________________
____________________________________________________________________________
___________________________________________________________________________ 。
之间溶液中主要存在的微粒为 和
, 胶粒表面带正电荷,可以吸附负电荷,
含量随着溶液的增大而增多,含量多,吸附效果好,此外, 升高
有利于铁盐水解,促进胶粒的生成, 胶粒的含量高,吸收效果增强
(3) 和属于同主族元素,存在亚磷酸,常温下,的 溶
液的,亚磷酸与足量的溶液反应生成,则 的
溶液中含磷粒子浓度由大到小的顺序是________________________________。
【解析】 常温下,溶液的 ,说明亚磷酸为弱酸,亚磷酸与
足量的溶液反应生成,说明亚磷酸为二元弱酸,在 溶液中存在
两步水解:(主)、 ,故
溶液中含磷粒子浓度由大到小的顺序为 。
18.(2024江苏省木渎高级中学期中)废旧铅蓄电池的铅膏中主要含有、 、
和,还有少量、、 的盐或氧化物等。为了保护环境、充分利用铅资源,通
过如图所示流程实现铅的回收。
已知:ⅰ.一些难溶电解质的溶度积常数如表所示:
难溶电解质
ⅱ.浓度为的一些金属离子生成氢氧化物沉淀时的 如表所示:
金属离子
开始沉淀的 1.5 6.3 3.3 7.1
完全沉淀的 2.8 8.3 4.6 9.1
回答下列问题:
(1) 在“脱硫”中, 发生转化反应的离子方程式为__________________________
___________________。
【解析】 、为同种类型的难溶电解质, ,故“脱
硫”中,碳酸钠溶液与硫酸铅反应生成碳酸铅和硫酸钠,反应的离子方程式为
。
(2) 在“脱硫”中,加入不易使铅膏中的 发生转化,原因是
____________________________________________________________________________
______________________ 。
若要有生成,溶液中的 至少大于____。
的平衡常数 ,
反应正向进行的程度有限
【解析】 反应 的平衡常数
,说明该反应
正向进行的程度有限,因此加入碳酸钠溶液不易使铅膏中的 发生转化。若要有
生成,则溶液中,反应正向进行,故 。
(3) 在“酸浸”中,除加入,还要加入 。
① 除了能将(Ⅱ)转化为(Ⅲ),还能促进金属 在醋酸中转化为
。写出使转化为 的化学方程式___________________
___________________________。
【解析】 促进金属在醋酸溶液中转化为,过氧化氢与 、
发生氧化还原反应生成和 ,依据得失电子守恒和原子守恒可
知,反应的化学方程式为 。
② 也能使转化为。其中 的作用是________。
还原剂
【解析】 也能使转化为,铅元素化合价由降低到,
是氧化剂,则过氧化氢是还原剂。
③ “酸浸”时,为了加快反应速率,可适当加热,但温度不宜过高,原因可能是_______
_______________________________________________________________(写出2条)。
温度过高导致分解、温度过高醋酸挥发,反应物浓度减小,反应速率降低
(4) “酸浸”后调节溶液的约为 ,则滤渣的主要成分是_______________________
______。
、、
【解析】 酸浸后溶液的约为,依据金属离子沉淀时的 可知,滤渣主要成分为
、,还有不溶于酸的(【点拨】 在“脱硫”工序不能完全除
去)。
(5) “沉铅”时,开始沉淀时溶液,原因是开始沉淀时___(填“ ”“ ”
或“ ”) 。
【解析】 铅离子浓度为时,刚开始沉淀时溶液 ,
,若开始沉淀
时溶液,即,则 。
19.(2024河南开封高中质检)分析化学中的滴定法除了酸碱中和滴定,还有沉淀滴定、
络合滴定、氧化还原滴定等。沉淀滴定法可用于溶液中 的测定。实验过程包
括准备标准溶液和滴定待测溶液。已知:
① 是一种难溶于水的砖红色沉淀;
②溶液中同时存在和时,滴入溶液,先生成 沉淀;
③ 。
Ⅰ.准备标准溶液
准确称取基准物(约)后,配制成 标准溶液,
放在棕色试剂瓶中避光保存,备用。
Ⅱ.滴定待测溶液
.取待测溶液 于锥形瓶中。
.加入 溶液。
.边不断晃动锥形瓶边用 标准溶液滴定,当接近滴定终点时,半滴半滴地滴入
标准溶液,并用力摇晃。记下达到滴定终点时消耗 标准溶液的体积。
.重复上述操作两次。三次测定数据如表所示。
实验序号 1 2 3
消耗标准溶液体积 20.45 20.02 19.98
.数据处理。
回答下列问题:
(1) 将称得的基准物配制成 标准溶液。所使用的玻璃仪器除烧杯和玻璃
棒外,还有________________________________。
(棕色)容量瓶、胶头滴管
【解析】 见光易分解,配制 标准溶液时,所使用的玻璃仪器除烧杯和玻
璃棒外,还有 (棕色)容量瓶(【易错警示】不要忽略实验中常用的硝酸银具
有在光照下易分解的特点,需保存在棕色试剂瓶中)
(【拓展】常见的见光易分解的试剂有、、氯水、、、 等)、
胶头滴管。
(2) 达到滴定终点的现象是__________________________________________________
_________________________________。
滴入最后半滴标准溶液时,锥形瓶中出现砖红色沉淀,且半分钟内砖红色沉淀不溶解
【解析】 根据已知信息②可知,沉淀完全后,才会生成砖红色 沉淀,故达
到滴定终点的现象为滴入最后半滴 标准溶液时,锥形瓶中出现砖红色沉淀,且半
分钟内砖红色沉淀不溶解。
(3) 计算所消耗的标准溶液平均体积为______,测得 ________
。
20.00
【解析】 对比3组数据可知,实验1数据误差较大,为无效数据,应舍去,故消耗
标准溶液的平均体积为, 标准溶液的物质的量浓度为
, 。
(4) 若用该方法测定溶液中的,待测溶液的 不宜超过7.2,理由是____
____________________________________________________________________________
____________________________________。
若溶液过大,与结合会生成,增大的溶解能力,使标准溶液所用体积增大,测定结果偏高
【解析】 由已知信息③可知,若溶液过大,与结合生成的 与
反应生成可溶性的,增大标准溶液所用体积,使 测定结
果偏高。
(5) 下列关于实验的说法合理的是______(填标号)。
BCD
A.为使滴定终点现象更加明显,可改为加入 溶液
B.滴定过程中可用蒸馏水将锥形瓶壁上附着的溶液冲下
C.若在配制标准溶液时,烧杯中的溶液有少量溅出,则 测定结果偏高
D.滴定后,若未等滴定管液面稳定就读数,会导致 测定结果偏高
【解析】 A项,由于也能与反应,所以加入的 不宜过多,不合理。
B项,滴定过程中可用蒸馏水将锥形瓶壁上附着的溶液冲下,有利于提高实验准确度,
合理。C项,若在配制标准溶液时,烧杯中的溶液有少量溅出,所配制 标
准溶液的物质的量浓度偏小,则滴定时消耗标准溶液的体积偏大,使 测
定结果偏高,合理。D项,滴定后,若未等滴定管液面稳定就读数,会导致读数偏大,
因为稍等片刻后,悬挂于滴定管内壁上的溶液流下,还会使液面略上升,故未等滴定管
液面稳定就读数会导致读取的标准溶液的体积偏大,则 测定结果偏高,合
理。
第3章 物质在水溶液中的行为
2025年高考化学一轮复习
选择性必修第一册鲁科版
章节复习测试
一、选择题(本题包括10小题,每小题只有1个选项符合题意)
1.(2024广东江门第一中学期中)常温下,有关下列四种溶液的叙述错误的是( )
编号 ① ② ③ ④
溶液 氨水 氢氧化钠溶液 醋酸 盐酸
11 11 3 3
D
A.在溶液①、②中分别加入适量的氯化铵晶体后,两种溶液的 均减小
B.将溶液①、④等体积混合,所得溶液中离子浓度的大小关系:
C.分别加水稀释10倍,四种溶液的:①②④ ③
D.将溶液④与溶液②混合后,若所得溶液的,则
【解析】 A(√)氨水中存在电离平衡 ,在溶液①中加入
,增大,的电离平衡逆向移动, 减小,在溶液②中加入
,与反应生成,部分电离, 减小,又温度
不变不变,则两种溶液中均增大, 均减小。
B(√)的盐酸(强酸)溶液与的氨水( 是弱碱)等体积混合,
完全中和后氨水有大量剩余,溶液呈碱性, ,结合电荷守恒
,知
C(√)强电解质完全电离、弱电解质部分电离,常温下 相同的溶液①、②浓度大小
顺序为①②,相同的溶液③、④浓度大小顺序为③ ④,加水促进弱电解质的电离,
弱电解质溶液变化较缓慢,则这四种溶液稀释相同倍数时 。
D(×)若所得溶液的 ,则酸过量,
, 。
2.(2024山东泰安一中月考)常温下,下列各组离子在指定溶液中一定能大量共存的是
( )
A
A.的溶液中:、、、
B.的溶液中:、、、
C.滴加溶液显红色的溶液中:、、、
D.水电离的的溶液中:、、、
【解析】 A(√) 的溶液显碱性,碱性条件下,该组离子均能共存。
B(×),即,溶液呈酸性, 不能大量存在。
C(×)滴加溶液显红色的溶液中含有,能与 发生氧化还原反应,
不能大量共存。
D(×)水电离的 的溶液,可能为酸性,也可能为碱性,
若为酸性,不能大量存在,若为碱性, 不能大量存在。
3.(生活情境)(2023江苏徐州王杰中学月考)水溶液中的离子反应与平衡在生活中应
用广泛。下列说法不正确的是( )
C
A.已知人体体液中存在如下平衡: ,当静脉滴注大量
生理盐水时,平衡向右移动,体液的 增大
B.牙齿表面覆盖的牙釉质存在如下平衡:
,小孩长牙时少吃糖多补钙
C.用硫酸洗涤沉淀,与用等体积的蒸馏水洗涤相比,
损失更多
D.人们洗发时所用的洗发液的约为,洗净后再使用具有保护头发、调节 功能的
护发素
【解析】 A(√)输入生理盐水相当于稀释体液,和 浓度减小,平衡右移
(【提醒】平衡移动是有限的,不能抵消条件的改变,最终结果减小), 增大。
B(√)残留在牙齿上的糖会发酵产生,能与反应,可使 沉淀
溶解平衡右移,破坏牙釉质;增大,可使 沉淀溶解平衡左移,
保护牙齿,故小孩长牙时少吃糖多补钙。
C(×)沉淀存在沉淀溶解平衡: ,稀硫酸洗涤
可使沉淀溶解平衡逆向移动,减少 沉淀的损失。
D(√)头皮本身是弱酸性环境,使用弱碱性洗发水后再使用弱酸性成分的护发素,护
发素具有保护头发、调节 的功能。
4.(2023陕西咸阳期末)下列实验操作、现象与结论相匹配的是( )
选项 实验操作 现象 结论
A 向溶液中通入 产生白色沉 淀 白色沉淀是
B 常温下,分别测定浓度均为 的 溶液和 溶液的 均等于7 常温下,浓度均为
的溶液和 溶
液中水的电离程度相等
C 向沸水中滴入几滴 饱和溶 液,继续煮沸,并用激光笔照射 溶液变红褐 色,出现丁 达尔效应 产生了 胶体
√
选项 实验操作 现象 结论
D 向 溶液中滴 加等浓度的 溶液,再加 入等浓度的 溶液 先产生白色 沉淀后产生 黑色沉淀
续表
【解析】 A(×)溶于水后溶液显酸性,酸性条件下 有强氧化性,故最终得到
的白色沉淀为 。
B(×) (弱酸弱碱盐)水解促进水的电离,且两种离子的水解程度相当,
最终使溶液呈中性; (强酸强碱盐)不水解,对水的电离无影响,
溶液呈中性,故水的电离程度:溶液 溶液。
C(√)丁达尔效应是胶体的特征性质。
D(×)向溶液中滴加等浓度的溶液, 过量
(【易错】忽视过量,误认为发生了沉淀转化),再滴加 溶液发生反应
,未发生沉淀的转化,不能得到 。
5.(2024北京四中期中)科研小组用氧化-沉淀法从废电池浸出液中去除铁:用 氧
化废电池浸出液中的,再加适量
调使转化为沉淀。研究发现对 的氧化率、铁去除率的影
响分别如图1、图2所示。
图1
图2
下列说法不合理的是( )
B
A.由图1可知,时氧化率随浸出液 增大而减小
B.若起始浸出液,与反应一段时间后,浸出液 会减小
C.转变为沉淀的离子方程式为
D.推测若用调溶液也可以使转化为 沉淀
【解析】 A(√)由题图1可知,时氧化率随着 增大而减小。
B(×)由题图1可知,时,完全被氧化,与反应时消耗 ,即随
着反应进行减小, 增大。
C(√)与发生相互促进的水解反应生成沉淀和 气体,离子方程式
为 。
D(√)和也能发生相互促进的水解反应生成沉淀和 气体。
6.(2024广东江门培英中学期中)某小组的同学向一定体积的
溶液中逐渐加入稀硫酸,并测得混合溶液的导电能力随
时间变化的曲线如图所示。下列说法正确的是( )
D
A.段溶液的导电能力不断减弱,说明产物 是弱电解质
B. 段碱过量,反应的离子方程式为:
C.段溶液的导电能力不断增强,说明过量的 发生电离
D.时刻 溶液与稀硫酸恰好完全中和
【解析】 A(×)溶液的导电能力与电解质的强弱没有必然联系
(【点拨】溶液的导电能力与溶液中的离子浓度和离子所带电荷
数有关), 溶解度很小,但溶于水的部分能完全电离,属
于强电解质。
B(×) 段反应的离子方程式为
。
C(×)D(√)加入稀硫酸的过程中发生反应
,反应完全( 时刻)时溶液的
导电性最小,继续加入稀硫酸,过量的 发生电离,溶液的导电性逐渐增强。
7.(2024江苏扬州中学月考)工业上可利用氨水吸收和 ,原理如图所示。已
知:时,的, 的
, ,下列说法正确的是( )
C
A.向氨水中通入恰好生成:
B.向氨水中通入至:
C.反应的平衡常数
D.被吸收的离子方程式:
【解析】 A(×) 等式中一边微粒能电离出,另一边微粒能结合 ,先
找质子守恒。
第一步:将弱电解质粒子写在中 间,并标明得失质子数 _________________________________________________________________________________
第二步:列等式,得失几个质 子,微粒前面的计量数就是几
,以电离为主,且 水解也使溶液显
酸性,则溶液显酸性, ,故
。
B(×) 向氨水中通入至(【点拨】一般给出 ,必考电荷守
恒), ,找电荷守恒。
第一步:列出溶液中所有离子 、、、、
第二步:阳离子、阴离子列在两侧
第三步:乘电荷、写等号
故 。
C(√) 。
D(×)不能拆开写,正确的离子方程式为 。
8.(2024北京师范大学附中月考)测定 溶液先升温再降温过程中的
,数据如表所示。
时刻 ① ② ③ ④
温度 25 30 40 25
9.66 9.52 9.37 9.25
实验过程中,取①④时刻的溶液,加入盐酸酸化的 溶液做对比试验,④产生白色
沉淀多。下列说法错误的是( )
C
A.溶液中存在水解平衡:
B.④的与①不同,是由于 浓度减小造成的
C.① ③的过程中,温度和浓度对水解平衡移动方向的影响一致
D.①与④的 相等
【解析】 A(√)为强碱弱酸盐, 存在水解平衡:
(【点拨】多元弱酸根离子的水解分步进行,且以第一步为
主)。
B(√)(√)取①④时刻的溶液,加入盐酸酸化的 溶液做对比实验,④产生白色
沉淀多,说明实验过程中部分被氧化成,④与①相比 减小,
的水解平衡逆向移动,减小,而只与温度有关,④与①温度相同,
相同,故, 。
C(×)盐类水解为吸热过程,的过程中,升高温度 水解平衡正向移动,部
分被氧化成,减小, 水解平衡逆向移动。
9.(2024江苏南京师范大学附中期中)室温下,用含少量的 溶液制备
的过程如图所示。已知 ,
。下列说法正确的是( )
C
A.溶液中:
B.“除镁”得到的上层清液中:
C.溶液中:
D.“沉锰”后的滤液中:
【解析】 A(×) 溶液中
存在电荷守恒 。
B(×)“除镁”得到的上层清液中存在 的沉淀溶解平衡,
,则 。
C(√)将等式 进行变形得到
,
溶液中存在质子守恒:
(链接大招35)。
D(×)“沉锰”后的滤液中还存在、
等离子,故电荷守恒中应增加其他离子使等
式成立(【警示】电荷守恒中要包含溶液中
所有存在的离子)。
10.(2024重庆部分学校联考)某同学在两个相同的特制容器中分
别加入 溶液和
溶液,再分别用 盐酸滴定,
用 计和压力传感器检测,得到如图曲线,下列说法不正确的是
( )
D
A.甲、丁表示向溶液中滴加盐酸,乙、丙表示向 溶液中滴加盐酸
B.和 溶液中均满足:
C.根据图,滴定分析时 点可用甲基橙作指示剂指示滴定终点
D.若换成醋酸, 点向下移动
【解析】 A(√)越弱越水解,水解程度:
,则溶液 :
;直接与反应生成 气体,
与反应先生成,再与反应生成
气体,体系压强较 体系先增大,故甲、丁表示向
溶液中滴加盐酸,乙、丙表示向 溶液中滴加盐酸。
B(√)将等式 进行变形得到
,等式中一边全为阳离子,另一边全
为阴离子,找电荷守恒。
第一步:列出溶液中所有离子 、、、、
第二步:阳离子、阴离子列在两侧
第三步:乘电荷(乘以自身所带电荷 数)、写等号 2
C(√)点的 在4左右,在甲基橙的变色范围内,可选择甲基橙作指示剂。
D(×)若换成醋酸,反应生成,其水解使溶液显碱性, 点向
上移动。
二、选择题(本题包括5小题,每小题有1个或2个选项符合题意)
11.(2024陕西榆林五校联考)常温下,将 缓慢通入水中
至饱和,然后向所得饱和氯水中滴加 溶液,
整个实验进程中溶液的 变化曲线如图所示,下列叙述正确
的是( )
AB
已知:常温常压下,
A.点所示溶液中:
B.点所示的溶液中:
C.水的电离程度:
D.点所示溶液中:
【解析】
A(√)点所示溶液中氯水没有饱和, 正向进行,
。
B(√)点所示溶液中达到饱和,存在平衡, 为
弱电解质,部分电离,则 。
C(×)、点所示溶液均为和的混合溶液,水的电离被抑制, 点所示溶液
,水解对水电离的促进程度与电离对水电离的抑制程度相当,故 点
所示溶液中水的电离程度最大。
D(×)点所示溶液呈中性,则 ,结合电荷守恒
,知 ,又存在
元素质量守恒,故 。
12.(2024黑龙江哈尔滨师范大学附中期中)某温度下,
改变溶液的 时,各种含铬元素
微粒及浓度变化如图所示(已知 是二元
酸),下列有关说法正确的是( )
D
A.该温度下的
B.溶液中存在平衡 ,该
温度下此反应的
C.向 溶液(橙色)中加入一定量
固体,溶液橙色加深
D.点溶液中存在:
【解析】 A(√)点时, ,此时
,则
。
B(×)点时, ,则
。
C(×)加入固体,平衡正向移动, 增大,
溶液橙色变浅。
D(√)点时, ,溶液中存在电荷守恒:
,即
,此时溶液显酸性,
,则。
13.(2024吉林长春吉大附中实验学校期末)溶洞水体中的
与空气中的保持平衡,其水体中
(为、、或)与 的关系如图所示。
已知 ,下列说法错误的
是( )
BC
A.
B.曲线Ⅱ代表
C.
D.点溶液中,
【解析】
识图过程 第一步:定曲线。 存在电离平衡:
(主)、 ,随着
溶液碱性增强(增大),、 逐渐增大,
且偏酸性条件下,较大,故曲线Ⅰ代表 ,曲线
Ⅱ代表;溶洞水体中 存在沉淀溶解平衡:
,随着增大, 增
大,的沉淀溶解平衡逆向移动, 减小,故曲
线Ⅲ代表 。
第二步:找交点,利用交点处的离子浓度相等关系可计算
酸的电离常数。 点处, ,则
,
同理,由点可得 。
识图结果
A(√) 。
B(×)曲线Ⅱ代表 。
C(×), 点
时,则, 。
D(√)点溶液中,, ,又
,且 ,则
, 。
14.(2024湖南永州模拟)用溶液滴定
溶液,溶液中(为、、、)随 变化曲线及滴定曲线如图所
示,其中表示加入的溶液体积与 溶液体积之比。下列说法错误的是
( )
C
A.曲线①代表,曲线②代表
B.的
C.溶液中:
D.D、 两点之间的某一点有:
【解析】
识图过程 第一步:定曲线。用 溶液滴定
溶液,先后发生反应 、
、 ,在滴定过程中,
逐渐增大,减小,先增大后减小, 先增大后减小,
增大,且开始时,故曲线①代表,曲线②代表 ,
曲线③代表,曲线④代表 。
第二步:找交点,利用交点处的离子浓度相等关系可计算
酸的电离常数。B点处, ,则
,同理,由
D点可得、由点可得 。
识图结果
A(√)曲线①代表,曲线②代表 。
B(√)的 。
C(×)点对应溶液溶质为,,显碱性, ,故
。
D(√)等式中一边全含一种元素,另一边全含另一种元素,找元素守恒。D点对应溶液
中:
第一步:列出关键元素 (非、非 元素)的比例关系 ,即
第二步:找出关键元素在溶液 中的所有存在形式 A元素在溶液中以、、、 的形式存
在
第三步:列等式
同理可得点时, ,故
D、两点之间的某一点有 。
15.(新图像)(2024湖南长沙长郡中学期末)电位滴定是利用溶液电位突变指示终点
的滴定法。在化学计量点附近,被测离子浓度发生突跃,指示电极电位 也产生了
突跃,进而确定滴定终点的位置。常温下,用盐酸标准溶液测定 某纯碱
样品溶液中 的含量(其他杂质不参与反应),电位滴定曲线如图所示。下列说
法错误的是( )
B
A.点表示第一滴定终点, 点表示第二滴定终点
B.该滴定过程需要酚酞和甲基橙两种指示剂
C.该纯碱样品溶液中含有的质量为
D.到过程中存在
【解析】 A(√)由已知信息“电位滴定是利用溶液电位
突变指示终点的滴定法”可知,点、 点对应的电极电位
均产生了突跃,即达到了滴定终点,故 点表示第一滴定
终点, 点表示第二滴定终点。
B(×)电位滴定根据指示电极电位的突跃位置就可以确
定滴定终点,无需任何指示剂。
C(√)滴定过程中依次发生的反应为
、 ,
若没有 杂质,滴定到达两个滴定终点消耗的盐酸
的量应相等,则第二个滴定终点相比第一个滴定终点多
消耗的盐酸为杂质消耗的盐酸,则 的质
量为 。
D(√)在整个滴定过程中,参加反应的离子是 、
、,溶液中的不参加反应, 点是第二滴定终
点,此时完全反应生成, ,
在点之前盐酸不足, 。
三、非选择题(本题包括4小题)
16.(2023辽宁六校联考)常温下,有浓度均为的下列六种溶液:① 溶
液,②溶液,③溶液,④溶液,⑤溶液,⑥ 溶液。
物质
电离常数/ 、
(1) 溶液③ 的原因是_________________________________(用离子方程式
表示)。
【解析】 为强碱弱酸盐,溶液因 水解而显碱性,其水解的离子方
程式为 。
(2) 溶液①中各离子浓度由大到小的顺序是__________________________________。
【解析】 为强碱弱酸盐,溶液因 水解而显碱性,但水解程度较小,故溶液中
各离子浓度由大到小的顺序是 。
(3) 溶液①和③相比较,___(填“ ”“ ”或“”) 。
【解析】 ,酸性:,“越弱越水解”, 的
水解能力比强,则溶液的 大。
(4) 溶液②和溶液④稀释100倍,则稀释后___(填“ ”“ ”或“ ”)
。
【解析】 溶液②和溶液④浓度相同(【警示】溶液②和溶液④起始 不同,切勿根据
等的强碱、弱碱溶液稀释相同倍数,强碱溶液 减小得多来判断),均稀释100倍后
浓度仍相同,为强电解质,完全电离, 为弱电解质,部分电离,故二者
均稀释100倍后 。
(5) 溶液中混有 杂质时,通常加入氧化铜固体以达到除杂目的,原因是__
____________________________________________________________________________
_________________________________________(用相应的离子方程式和必要的文字加
以解释)。
,加入粉末时,与反应,降低,使的水解正向进行,逐渐减小至消除
(6) 时,向溶液①中通入少量 ,发生反应的离子方程式为________________
___________________。
【解析】
故溶液中通入少量 ,发生的反应是
。
(7) 常温下,若溶液④和溶液⑤的混合溶液中 ,则该混合溶液呈___
(填“酸”“碱”或“中”)性。
中
【解析】 溶液、 溶液的混合溶液中存在电荷守恒:
,因,则 ,溶液
呈中性。
17.(2024辽宁大连滨城高中期中)雌黄和雄黄 都是自然界中常见的砷化
合物,早期曾用作绘画颜料,因都有抗病毒疗效而入药。 可转化为用于治疗白血
病的亚砷酸 。
图1
(1) 向溶液中滴加 溶液,
溶液中、、、 的分布分数
(平衡时某含微粒的浓度占所有含 微粒浓度之和的
分数)与 的关系如图1所示。
【解析】
识图过程 第一步:定曲线,随着 增大,溶液中酸分子浓度逐渐减少、酸根离子浓度
逐渐增加、各级酸式酸根离子浓度先增加后减少。为三元弱酸,则 浓度
逐渐减少、浓度先增加后减少、浓度先增加后减少且变化比
晚、 浓度逐渐增加。
第二步:找交点,利用交点处的离子浓度相等可计算酸
的电离常数。 点处, ,则
。
第三步:看峰值,曲线峰值对应的 ,说明对应离
子以电离为主;曲线峰值对应的 ,说明对应离子
以水解为主。表示、 的曲线峰值对应的
,说明、 均以水解为主。
识图结果
图1
① 溶液呈______(填“酸性”“碱性”或“中
性”)。
碱性
【解析】 溶液 ,呈碱性。
图1
② 时,的第一电离平衡常数
______________。
【解析】 。
图1
③ 人体血液的在 之间,用药后人体中含
砷元素的主要微粒是________。
【解析】 在 之间含砷元素的主要微粒是
。
图1
④ 下列说法正确的是___(填字母)。
.点对应的溶液中:
. 点对应的溶液中:
.在 溶液中:
.常温下,时,溶液中:
【解析】 (×)等式中一边全含 ,找元素质量守
恒。 ,
但点时加入了 溶液,溶液总体积发生了变化
(【警示】切勿忽视 点时溶液体积的变化),故
。
(√)等式中一边全为阳离子,另一边全为阴离子,找电荷守恒。
第一步:列出溶液 中所有离子 、、、、、
第二步:阳离子、 阴离子列在两侧
第三步:乘电荷、 写等号
又点对应的溶液中 ,故
。
(×)
“ 层次”
、
“ 层次”
、
极其微弱的层 次
、、
离子浓度关系: (×) 时,溶液中有电荷守恒:
,而当
时,几乎为0, ,故
。
⑤当时含砷元素的主要微粒是,当 时含砷元素的主要微粒
是,故反应的离子方程式是 。
图1
图1
⑤ 将溶液滴入亚砷酸溶液中,在溶液 由10.8
变至12.8过程中,发生反应的离子方程式是__________
_____________________。
图2
(2) 工业含砷(Ⅲ)废水常用铁盐处理后排放,其原理
是铁盐混凝剂在溶液中产生 胶粒,其表面带有正
电荷,可吸附含砷化合物。经测定不同 条件下铁盐对
含砷(Ⅲ)化合物的去除率如图2所示。在 之间时,
随溶液 增大,铁盐混凝剂对含砷(Ⅲ)化合物的吸附
效果增强。结合图1和图2解释可能的原因:
__________________________________________________
__________________________________________________
____________________________________________________________________________
___________________________________________________________________________ 。
之间溶液中主要存在的微粒为 和
, 胶粒表面带正电荷,可以吸附负电荷,
含量随着溶液的增大而增多,含量多,吸附效果好,此外, 升高
有利于铁盐水解,促进胶粒的生成, 胶粒的含量高,吸收效果增强
(3) 和属于同主族元素,存在亚磷酸,常温下,的 溶
液的,亚磷酸与足量的溶液反应生成,则 的
溶液中含磷粒子浓度由大到小的顺序是________________________________。
【解析】 常温下,溶液的 ,说明亚磷酸为弱酸,亚磷酸与
足量的溶液反应生成,说明亚磷酸为二元弱酸,在 溶液中存在
两步水解:(主)、 ,故
溶液中含磷粒子浓度由大到小的顺序为 。
18.(2024江苏省木渎高级中学期中)废旧铅蓄电池的铅膏中主要含有、 、
和,还有少量、、 的盐或氧化物等。为了保护环境、充分利用铅资源,通
过如图所示流程实现铅的回收。
已知:ⅰ.一些难溶电解质的溶度积常数如表所示:
难溶电解质
ⅱ.浓度为的一些金属离子生成氢氧化物沉淀时的 如表所示:
金属离子
开始沉淀的 1.5 6.3 3.3 7.1
完全沉淀的 2.8 8.3 4.6 9.1
回答下列问题:
(1) 在“脱硫”中, 发生转化反应的离子方程式为__________________________
___________________。
【解析】 、为同种类型的难溶电解质, ,故“脱
硫”中,碳酸钠溶液与硫酸铅反应生成碳酸铅和硫酸钠,反应的离子方程式为
。
(2) 在“脱硫”中,加入不易使铅膏中的 发生转化,原因是
____________________________________________________________________________
______________________ 。
若要有生成,溶液中的 至少大于____。
的平衡常数 ,
反应正向进行的程度有限
【解析】 反应 的平衡常数
,说明该反应
正向进行的程度有限,因此加入碳酸钠溶液不易使铅膏中的 发生转化。若要有
生成,则溶液中,反应正向进行,故 。
(3) 在“酸浸”中,除加入,还要加入 。
① 除了能将(Ⅱ)转化为(Ⅲ),还能促进金属 在醋酸中转化为
。写出使转化为 的化学方程式___________________
___________________________。
【解析】 促进金属在醋酸溶液中转化为,过氧化氢与 、
发生氧化还原反应生成和 ,依据得失电子守恒和原子守恒可
知,反应的化学方程式为 。
② 也能使转化为。其中 的作用是________。
还原剂
【解析】 也能使转化为,铅元素化合价由降低到,
是氧化剂,则过氧化氢是还原剂。
③ “酸浸”时,为了加快反应速率,可适当加热,但温度不宜过高,原因可能是_______
_______________________________________________________________(写出2条)。
温度过高导致分解、温度过高醋酸挥发,反应物浓度减小,反应速率降低
(4) “酸浸”后调节溶液的约为 ,则滤渣的主要成分是_______________________
______。
、、
【解析】 酸浸后溶液的约为,依据金属离子沉淀时的 可知,滤渣主要成分为
、,还有不溶于酸的(【点拨】 在“脱硫”工序不能完全除
去)。
(5) “沉铅”时,开始沉淀时溶液,原因是开始沉淀时___(填“ ”“ ”
或“ ”) 。
【解析】 铅离子浓度为时,刚开始沉淀时溶液 ,
,若开始沉淀
时溶液,即,则 。
19.(2024河南开封高中质检)分析化学中的滴定法除了酸碱中和滴定,还有沉淀滴定、
络合滴定、氧化还原滴定等。沉淀滴定法可用于溶液中 的测定。实验过程包
括准备标准溶液和滴定待测溶液。已知:
① 是一种难溶于水的砖红色沉淀;
②溶液中同时存在和时,滴入溶液,先生成 沉淀;
③ 。
Ⅰ.准备标准溶液
准确称取基准物(约)后,配制成 标准溶液,
放在棕色试剂瓶中避光保存,备用。
Ⅱ.滴定待测溶液
.取待测溶液 于锥形瓶中。
.加入 溶液。
.边不断晃动锥形瓶边用 标准溶液滴定,当接近滴定终点时,半滴半滴地滴入
标准溶液,并用力摇晃。记下达到滴定终点时消耗 标准溶液的体积。
.重复上述操作两次。三次测定数据如表所示。
实验序号 1 2 3
消耗标准溶液体积 20.45 20.02 19.98
.数据处理。
回答下列问题:
(1) 将称得的基准物配制成 标准溶液。所使用的玻璃仪器除烧杯和玻璃
棒外,还有________________________________。
(棕色)容量瓶、胶头滴管
【解析】 见光易分解,配制 标准溶液时,所使用的玻璃仪器除烧杯和玻
璃棒外,还有 (棕色)容量瓶(【易错警示】不要忽略实验中常用的硝酸银具
有在光照下易分解的特点,需保存在棕色试剂瓶中)
(【拓展】常见的见光易分解的试剂有、、氯水、、、 等)、
胶头滴管。
(2) 达到滴定终点的现象是__________________________________________________
_________________________________。
滴入最后半滴标准溶液时,锥形瓶中出现砖红色沉淀,且半分钟内砖红色沉淀不溶解
【解析】 根据已知信息②可知,沉淀完全后,才会生成砖红色 沉淀,故达
到滴定终点的现象为滴入最后半滴 标准溶液时,锥形瓶中出现砖红色沉淀,且半
分钟内砖红色沉淀不溶解。
(3) 计算所消耗的标准溶液平均体积为______,测得 ________
。
20.00
【解析】 对比3组数据可知,实验1数据误差较大,为无效数据,应舍去,故消耗
标准溶液的平均体积为, 标准溶液的物质的量浓度为
, 。
(4) 若用该方法测定溶液中的,待测溶液的 不宜超过7.2,理由是____
____________________________________________________________________________
____________________________________。
若溶液过大,与结合会生成,增大的溶解能力,使标准溶液所用体积增大,测定结果偏高
【解析】 由已知信息③可知,若溶液过大,与结合生成的 与
反应生成可溶性的,增大标准溶液所用体积,使 测定结
果偏高。
(5) 下列关于实验的说法合理的是______(填标号)。
BCD
A.为使滴定终点现象更加明显,可改为加入 溶液
B.滴定过程中可用蒸馏水将锥形瓶壁上附着的溶液冲下
C.若在配制标准溶液时,烧杯中的溶液有少量溅出,则 测定结果偏高
D.滴定后,若未等滴定管液面稳定就读数,会导致 测定结果偏高
【解析】 A项,由于也能与反应,所以加入的 不宜过多,不合理。
B项,滴定过程中可用蒸馏水将锥形瓶壁上附着的溶液冲下,有利于提高实验准确度,
合理。C项,若在配制标准溶液时,烧杯中的溶液有少量溅出,所配制 标
准溶液的物质的量浓度偏小,则滴定时消耗标准溶液的体积偏大,使 测
定结果偏高,合理。D项,滴定后,若未等滴定管液面稳定就读数,会导致读数偏大,
因为稍等片刻后,悬挂于滴定管内壁上的溶液流下,还会使液面略上升,故未等滴定管
液面稳定就读数会导致读取的标准溶液的体积偏大,则 测定结果偏高,合
理。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
