第4节 离子反应--2025年高考化学选择性必修第一册(鲁科版)(共90张PPT)
文档属性
| 名称 | 第4节 离子反应--2025年高考化学选择性必修第一册(鲁科版)(共90张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 7.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-06 20:59:46 | ||
图片预览











文档简介
(共90张PPT)
第3章 物质在水溶液中的行为
2025年高考化学一轮复习
选择性必修第一册鲁科版
第4节 离子反应
课时1 离子反应发生的条件
题型觉醒
题型一 离子共存
1.(2023江西安福中学期中)下列透明溶液中,一定能大量共存的离子组是( )
C
A.、、、 B.、、、
C.、、、 D.、、、
【解析】 AA(×)与可发生相互促进的水解反应生成、, 与
不能大量共存。
(×)与反应可生成气体,、 不能大量共存。
D(×)与反应生成沉淀,、 不能大量共存。
2.(2024重庆铁路中学月考)室温下,下列各组离子在指定溶液中一定能大量共存的是
( )
A
A.的溶液:、、、
B.的澄清透明溶液:、、、
C.能使甲基橙变红的溶液:、、、
D.水电离出的溶液:、、、
【解析】 A(√)的溶液中, ,则
该溶液显碱性,碱性条件下,该项中的四种离子能大量共存。
B(×)说明溶液显酸性,可以和反应生成弱电解质, 不能大量
存在,、、 可大量共存(【提醒】透明溶液中有色离子可以大量存在,不
能认为“有色”就不透明)。
C(×)使甲基橙变红的溶液显酸性,、 因发生氧化还原反应而不能大量共存。
D(×)水电离出 的溶液中水的电离被抑制,溶液可能显
酸性或碱性,酸性条件下,不能大量存在,碱性条件下, 不能大量存在。
有“化”好说
溶液酸碱性的判断
表示酸性溶液 表示碱性溶液 可能酸性或碱性
(1) ; 时,或; (3)能使紫色石蕊溶液显红色; (4)能使甲基橙显红色或橙色; (5)能使 试纸显红色 (1) ; (2)时, 或 ; (3)能使紫色石蕊溶液显蓝色; (4)能使酚酞溶液显红色; (5)能使 试纸显蓝色 (1)与反应放出 ;
(2)由水电离出的
或由
水电离出的
(常温下 );
(3)与 、
、 、
等溶液反应放出气体
题型二 离子方程式的正误判断
3.(2023江苏扬州期中)下列离子反应方程式正确的是( )
C
A.向硫酸铜溶液中通入少量氨气:
B.用硫酸酸化的溶液与溶液反应,证明 具有还原性:
C.向稀硝酸中加入过量铁粉:
D.向溶液中滴加溶液,使 完全沉淀:
【解析】 A(×)“拆不拆”,氨气溶于水生成, 是弱电
解质,不能拆成离子,正确的离子方程式为 。
B(×)“平不平”,电子得失不守恒,按照题目的配平发现(价 )
共得,但(2个价)只失去 ,因此配平错误,正确的
离子方程式为 。
C(√)铁粉过量时,与稀硝酸反应得到、 ,题给离子方程式正确。
D(×)“对不对”,完全沉淀时, ,正确的离子方程式为
。
4.(2024四川绵阳南山中学月考)下列离子方程式正确,且与所给事实相符的是( )
C
A.与足量反应:
B.用过量溶液脱除烟气中的
C.向溶液中通入少量
D.湿润的淀粉碘化钾试纸遇氯气变蓝:
【解析】 A(×)“对不对”,过量,与 也能发生反应,离
子方程式为 。
B(×)“对不对”,过量,生成,离子方程式为 。
C(√)还原性:,少量,只会发生氧化 的反应,离子方程式为
。
D(×)“对不对”,湿润的淀粉碘化钾试纸遇氯气变蓝,则生成物为 ,离子方程式为
。
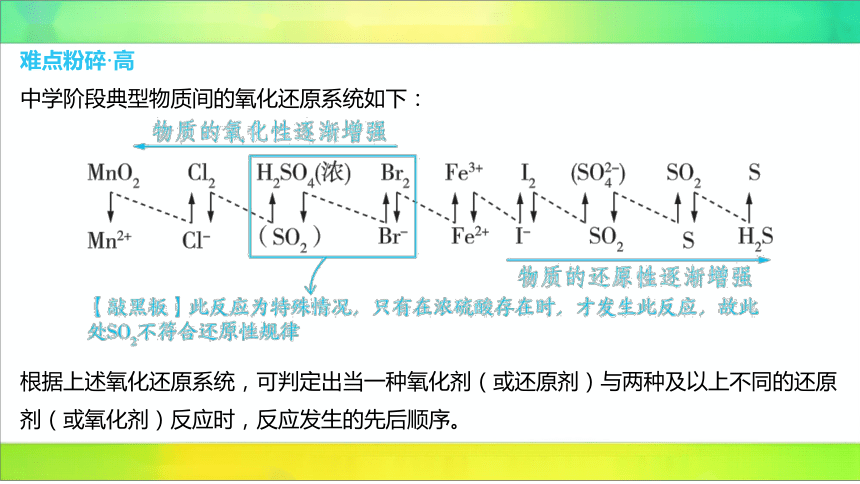
难点粉碎·高
中学阶段典型物质间的氧化还原系统如下:
根据上述氧化还原系统,可判定出当一种氧化剂(或还原剂)与两种及以上不同的还原
剂(或氧化剂)反应时,反应发生的先后顺序。
题型三 离子检验与推断
5.(2023山东枣庄三中月考,双选)某无色透明溶液中,可能含有以下离子中的若干
种:、、、、、、、、和 ,取该溶液进行如
下实验:
①将溶液滴在 试纸上,呈红色。
②将少许溶液浓缩后加入铜片和硫酸,有无色气体逸出,通入空气则立即变成红棕色。
③取少许溶液滴入 溶液,则产生白色沉淀。
④取实验③中的澄清溶液,滴入溶液,产生不溶于稀 的白色沉淀。
⑤另取少许溶液,滴入溶液,有白色沉淀生成,当 过量时,又有部分白色沉
淀溶解。根据以上现象判断原溶液中( )
A.肯定不存在的离子是、、、
B.肯定存在的离子是、、、、
C.不能作出判断的离子是、
D.以上判断都不正确
√
√
【解析】 有什么,没有什么?(肯定性原则)溶液无色说明一定不存在
;①说明溶液呈酸性,则原溶液中一定不存在 ;②中有无色气体逸出,通入
空气则立即变成红棕色表明无色气体为,则原溶液中一定存在 ,酸性溶液中
有强氧化性,可判断原溶液中一定不存在;③中产生的白色沉淀为 ,则原
溶液中一定存在;⑤中生成的沉淀部分溶解,则原溶液中一定存在、 。
还没有什么?(互斥性原则)原溶液中一定存在,则一定不存在 。加入了什
么?(进出性原则)③中滴入溶液,引入了,故④中检验出的 不一定是原
溶液中的,即不能确定原溶液中是否含有 。
(√)C(√)原溶液中肯定存在、、、,肯定不存在、 、
、,可能存在、 。
能力觉醒
6.(2023吉林长春三校期中)下列实验过程中,始终无明显现象的是( )
B
A.通入溶液中 B.通入 溶液中
C.通入溶液中 D.通入已酸化的 溶液中
【解析】 A(×)二氧化氮和水反应生成硝酸,硝酸把氧化成 ,溶液由浅绿色
变为棕黄色。
B(√)酸性,与溶液不反应,故通入 溶液中无明显现象。
C(×)氨气溶于水得到,与反应可生成 白色沉淀。
D(×)在酸性条件下具有强氧化性,可将价氧化为价,故 通入已酸化
的溶液可生成 白色沉淀。
7.(2023广东深圳光明区期末)室温下,下列离子组在给定条件下能大量共存的是
( )
B
A.的溶液:、、、
B.的溶液:、、、
C.的溶液:、、、
D.加铝粉有氢气产生的溶液:、、、
【解析】 A(×)与能发生相互促进的水解反应生成 和
沉淀,不能大量共存。
B(√)的溶液呈酸性,、、、 能大量共存。
C(×)即,溶液呈碱性,会转化为 沉淀,
不能大量存在。
D(×)加铝粉有氢气产生的溶液既可呈酸性,又可呈碱性,而 在酸性和碱性溶液
中均不能大量存在。
8.(2024辽宁沈阳第一二〇中学检测)下列各组澄清溶液中离子能大量共存,且加入
试剂后发生的离子方程式书写正确的是( )
选项 离子组 试剂 离子方程式
A 、、、 过量
B 、、、 少量
C 、、、 过量铜粉
D 、、、 少量
A
【解析】 A(√)四种离子相互不反应,能够共存;三价铁离子能氧化 生成硫单
质,为弱电解质,不能拆成离子,离子方程式为 。
B(×)四种离子相互不反应,能够共存;还原性:,加入少量, 先被氧
化,离子方程式为 。
C(×)与能发生相互促进的水解反应生成和 沉淀,四
种离子不能共存;加入过量铜粉,与反应生成 ,离子方程式为
。
D(×)与能发生相互促进的水解反应生成沉淀和 ,四种离子不能共存;
加入少量,与反应生成,离子方程式为 。
9.(2023山东淄博临淄中学月考)常温下,取用硫酸浸出铝土矿(含有、 、
、 等物质)后的溶液,分别向其中加入指定物质,反应后的溶液中主要存在
的离子正确的是( )
A
A.加入过量溶液:、、、
B.加入过量氨水:、、、
C.通入过量、、、
D.加入过量溶液:、、、
【解析】 硫酸浸出后的溶液中主要含有的离子为、、、、 。
A(√)加入过量溶液,转化为,和转化为沉淀, 转化
为水,溶液中主要存在的离子为、、、 。
B(×)加入过量氨水,转化为沉淀,溶液中 不能大量存在。
C(×)通入过量,被氧化为,溶液中 不能大量存在。
D(×)酸性条件下,具有强氧化性,会将氧化为,自身被还原为 ,
、可与发生相互促进的水解反应生成、 沉淀,故溶液中
存在的主要离子为、、、 。
10.(2024山东青岛第六十八中期中)已知:①相同温度下:
;②电离出 的能力:
,则下列离子方程式错误的是( )
C
A.将加入稀盐酸中:
B.向溶液中通入气体:
C.将溶液和溶液混合:
D.向少量溶液中加入足量 溶液:
【解析】 A(√)电离出的能力:,更易结合 ,则离子反应方程式
为 。
B(√)电离出的能力:,更易结合 ,则离子反应方程式为
。
C(×)相同温度下:,比更难溶,和 结
合生成沉淀,则离子反应方程式为 。
D(√)相同温度下:,比 更难溶,则向少
量溶液中加入足量溶液时得到沉淀。 少量,定为
“1”,写出,过量,要多少有多少。和形成,
和形成 ,则离子方程式为
。
难点粉碎·高
“少定多”巧写配比型离子方程式
以与 反应的离子方程式的书写为例,如表所示:
少量溶液与过量 溶液反应 少量溶液与过量
溶液反应
(1)少定多 变,少量定为 “1”,过量者“要 多少有多少”, 过量配合少量 少量,定为“1”,写出 , 过量,要多 少有多少,取与 反 应,生成的再和 反应 生成 ,最后得离子方程式: 少量,电离出的 的计
量数定为“1”,与 过
量,要多少有多少,取 与
反应,生成的 再和
反应生成 ,最后
得离子方程式:
(2)先中和, 后沉淀 少量溶液与过量 溶液反应 少量溶液与过量
溶液反应
(3)少量者的 计量数符合化学 式比例,过量者 不一定 少量,最后离子方程式 中与 的化学计量数符合 化学式中比例1 过量,最后离子方程式
中与 的化学计量数并没
有符合化学式中比例 而是
,因此过量物的配比取决于少
量物质反应需求(过量配合少
量)
续表
11.(大招41)(2023山东济宁月考)某无色溶
液中可能含有、、、、 、
、、 中的几种离子,溶液中阳
离子的浓度相同。为了确定其组成,某同学进行
了如下实验(假设气体均全部逸出,忽略 的分解)。
下列说法不正确的是( )
B
A.溶液中一定不存在、
B.溶液中一定含有,且
C.溶液中肯定存在、、 、、
D.溶液中可能存在 ,为确定其是否存在,可取溶液1通过焰色试验验证
【解析】 有什么,没有什么?
(肯定性原则)无色溶液中一定不含;向溶液
中加入足量 溶液(盐酸酸化),产生气体1、溶
液1和沉淀,沉淀一定是,被氧化,还原产物为,则气体1为 ,
溶液 中一定含有
、、 ;向溶液
1中加入过量溶液,产生气体2且不产生沉淀,则气体2为, 在上一步
与 完全反应,溶
液中 、
。还没有什么?
(互斥性原则)溶液中含有,则一定不含 。溶
液呈电中性!(电中性原则)溶液中阳离子的浓度相同,
则,则溶液 中一定还含有
,可能含有 。
A(√)溶液中一定不存在、 。
B(×)C(√)溶液中一定含有、、、、,可能含有 ,且
、、、的物质的量都为 ,根据溶液中阳离子的浓度相同,
结合溶液呈电中性可知,若溶液中含有,, ,
若溶液中不含, 。
D(√)溶液中可能存在 ,可取溶液1通过焰色试验验证,若溶液1的焰色呈黄色,
则说明溶液中含有 。
第3章 物质在水溶液中的行为
2025年高考化学一轮复习
选择性必修第一册鲁科版
第4节 离子反应
课时2 离子反应的应用
题型觉醒
题型一 酸碱中和滴定实验操作
1.(2024北京第八十中学期中)下列是一段关于酸碱中和滴定的实验叙述,其中错误的
是( )
D
①取一锥形瓶,用待测 溶液润洗两次;
②在锥形瓶中放入待测 溶液;
③加入几滴石蕊溶液作指示剂;
④取一支酸式滴定管,洗涤干净;
⑤直接向酸式滴定管中注入标准酸溶液,进行滴定;
⑥左手旋转滴定管的玻璃活塞,右手不停地摇动锥形瓶;
⑦两眼注视着滴定管内盐酸液面,直至滴定终点。
A.④⑥⑦ B.①⑤⑥⑦ C.③⑤⑦ D.①③⑤⑦
【解析】 ①(×)锥形瓶不能用待测液润洗。
③(×)石蕊的颜色变化不明显,且变色范围较宽,不用作酸碱中和滴定的指示剂。
⑤(×)滴定管必须用标准液润洗后才能注入标准液。
⑦(×)两眼应注视锥形瓶中溶液颜色的变化。
考点挖掘·高
碱式滴定管排气泡的方法:将胶管向上弯曲,用力捏挤玻璃珠使溶液从尖嘴喷出。
酸式滴定管排气泡的方法:开启活塞的速度需快一点,使溶液流出时带有一定的冲力,
将气泡带出。
2.(2023河南商丘名校期中)下列实验操作正确的是( )
A
图1
图2
图3
A.选用图1滴定管量取 溶液
B.如图2所示,记录滴定终点读数为
C.中和滴定时,选用图1滴定管盛装 标准溶液
D.可用图3装置进行酸性溶液滴定未知浓度的 溶液实验
【解析】 A(√)图1为酸式滴定管,可以盛装 溶液(中性),滴定管能精确到
。
B(×)滴定管“0”刻度在上,故终点读数为 。
C(×)图1为酸式滴定管,不能盛装碱性物质。
D(×)图3为碱式滴定管,不能盛装强氧化性的试剂,故不能盛装酸性 溶液。
难点粉碎·高
(1)酸式滴定管下端的玻璃活塞能耐酸和强氧化剂的腐蚀,故其可用于盛装酸性或强
氧化性溶液,但不能盛装碱性溶液。
(2)碱式滴定管下端的橡胶管易被酸性或强氧化性溶液腐蚀,所以碱式滴定管一般盛
装碱性溶液。
题型二 酸碱中和滴定曲线分析
3.(2024四川遂宁射洪中学期中,双选)常温下,向
盐酸中滴加 溶
液,溶液的随 溶液体积的变化如图所示。已知:
,下列说法不正确的是( )
AC
A.选酚酞作指示剂时,滴入半滴 溶液使溶液由无色变为粉
红色,即达到滴定终点
B.与盐酸恰好完全反应时,
C.滴定过程中水的电离程度不断增大
D.时,所得溶液的
【解析】 A(×)滴定管选酚酞作指示剂时,滴入半滴 溶液
使溶液由无色变为粉红色,且半分钟内不褪色,即达到滴定终点。
B(√)与完全反应生成 ,即恰好完全反应时溶液显
中性, 。
C(×)(溶液)从 过程中,盐酸逐渐被中
和至恰好完全反应,酸抑制水的电离,盐酸浓度逐渐减小,水
的电离程度逐渐增大,当(溶液) 时,水的
电离程度最大,(溶液)从 过程中,
盐酸已完全反应,过量,溶液中 浓度逐渐增大,碱
抑制水的电离,溶液中水的电离程度减小。
D(√) 抓“指定比例混合点”, 时,碱过量,
,
,
。
考点挖掘·高
选择指示剂的原则:变色明显、变色的 范围小、滴定终点的
与指示剂变色范围的 接近。
4.(2023安徽池州期中)常温下,用的 溶
液分别滴定的溶液和 的醋酸
溶液,滴定分数[或]与 的关
系如下图。下列有关说法正确的是( )
B
A.实线表示滴定盐酸的曲线
B.滴定分数为时,溶液与醋酸混合液的
C.段的离子方程式为
D.两个体系滴定时都可用甲基橙作指示剂
【解析】 A(×)抓“起始点”,为强酸,
为弱酸,相同浓度溶液的溶液 醋酸溶液,故虚线表示滴定
盐酸的曲线,实线表示滴定醋酸溶液的曲线。
B(√)抓“恰好完全中和点”,滴定分数为时, 与
恰好完全反应,溶质为, 水解使溶液
呈碱性, 。
C(×)实线表示滴定醋酸溶液的曲线,为弱酸,不能拆成离子, 段的离子
方程式为 。
D(×)甲基橙变色的范围是 ,符合图中虚线的突变范围,不符合图中实线
的突变范围,则滴定盐酸时可以用甲基橙作指示剂,滴定醋酸溶液时不可以用甲基橙作
指示剂。
题型三 酸碱中和滴定误差分析
5.(2024福建三明一中检测)某学生用的标准 溶液滴定未知浓度
的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入的标准 溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记录读数;
④量取待测液注入洁净的锥形瓶中,并加入 滴酚酞溶液;
⑤用标准 溶液滴定至终点,记下滴定管液面读数;
⑥重复以上滴定操作 次。
请回答下列问题:
(1) 以上步骤有错误的是____(填编号),该步骤错误操作会导致测定结果______
(填“偏高”“偏低”或“无影响”)。
①
偏高
【解析】 碱式滴定管在洗涤后需要润洗,步骤①错误;碱式滴定管在洗涤后未润洗,
则消耗标准溶液的体积增大,即 增大,使测定结果偏高。
(2) 下列操作会导致上述所测盐酸溶液的浓度偏高的是_____(填标号)。
BD
A.滴定达到终点时,俯视滴定管内液面读数
B.碱式滴定管尖嘴部分开始有气泡,滴定后消失
C.锥形瓶用蒸馏水洗净后未干燥就装入盐酸待测液
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
【解析】 A(×)滴定达到终点时,俯视滴定管内液面读数,即 ,
偏小,使测定结果偏低。
B(√)碱式滴定管尖嘴部分开始有气泡,滴定后消失, 偏大,使测定结果偏高。
C(×)锥形瓶用蒸馏水洗净后未干燥就装入盐酸待测液,对 无影响,测定结果不变。
D(√)滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液, 偏大,使测定结果偏高。
题型四 物质的制备与纯化
6.(2024浙江省吴兴高级中学检测)通过海水晒盐可以得到粗盐。某粗盐中除含有
外,还含有、、 以及泥沙等杂质。以下是某兴趣小组制备精盐的实
验方案,其操作流程如图所示(所加试剂均过量):
下列说法错误的是( )
A
A.试剂A、试剂B、试剂C分别为溶液、溶液、 溶液
B.操作②、③、④、⑥均为离子反应
C.操作①、⑤、⑦均需用到玻璃棒
D.除去可以用溶液,也可以用 溶液
【解析】 A(×)B(√)操作②加入溶液,与生成 沉淀;操作
③加入溶液,与生成沉淀;操作④加入溶液, 与
、生成沉淀(【提醒】过量的需用除去,溶液需在
溶液之后加入);操作⑥加入盐酸(【提醒】除去过量的、),与
生成水,与 生成气体。
C(√)操作①溶解过程中,用玻璃棒加快溶解速率;操作⑤过滤中,玻璃棒起到引流
作用;操作⑦结晶中,用玻璃棒进行搅拌,使溶液受热均匀。
D(√)将换成,引入,盐酸可以去除 。
7.(2023山东联考)某锂离子电池的正极材料为 、碳粉及铝箔,某化学兴趣小
组设计下列室温下的流程处理废旧锂离子电池的正极材料,下列离子反应方程式书写不
正确的是( )
B
A.加入过量溶液: 。
B.被氧化:
C.滤液Ⅱ中加入饱和碳酸钠溶液:
D.滤液Ⅰ中通入过量;
【解析】
.
A(√)加入过量溶液, ,离子方程式为
。
B(×)在酸性环境下,生成物不能有 ,离子方程式为
。
C(√)滤液Ⅱ中加入饱和碳酸钠溶液得到 晶体,离子方程式为
。
D(√)滤液Ⅰ含有、 ,通入过量二氧化碳,分别发生反应
、 。
题型五 生活中的离子反应
8.(2024陕西西安第一中学月考)下列解释事实的方程式正确的是( )
D
A.用溶液刻蚀覆铜板:
B.常温下,新切开的钠表面很快变暗:
C.用小苏打治疗胃酸(盐酸)过多:
D.不能将炽热的铁水注入未经干燥的模具是为防止发生反应:
【解析】 A(×)“平不平”,得失电子不守恒、电荷不守恒,正确的离子方程式为
。
B(×)“对不对”,常温下,钠与氧气反应生成氧化钠,化学方程式为
。
C(×)“对不对”,小苏打是,正确的离子方程式为 。
D(√)高温下,铁与水蒸气反应生成和 ,离子方程式为
。
能力觉醒
9.(大招43)配制一定浓度的氢氧化钠溶液,并用其滴定未知浓度的盐酸,下列实验操
作会引起测量结果偏高的是( )
A
①用天平称量 固体,将小烧杯放在右盘,砝码放在左盘,并移动游码,使之平衡;
②在配制氢氧化钠溶液时,将称量后的 固体溶于水,立即移入容量瓶,将洗涤烧
杯的液体注入容量瓶后,加蒸馏水至刻度线;③中和滴定时,锥形瓶用盐酸润洗;④用
酸式滴定管量取未知浓度的盐酸时,读取滴定管终点数据时,仰视刻度线;⑤滴定前仰
视读数,滴定后平视读数。
A.①③ B.③④⑤ C.②④⑤ D.①②③④⑤
【解析】 ①(√)使用天平时遵循“左物右码”原则,且 ,
实际测量时若“左码右物”并移动游码,则, 为定值,故测量值比实
际值偏小,即配制的氢氧化钠溶液浓度偏低, 增大,使测定结果偏高。
②(×) 固体溶于水放热,溶液体积膨胀,立即移入容量瓶,将洗涤烧杯的液体
注入容量瓶后,加蒸馏水至刻度线,配制的氢氧化钠溶液浓度偏高,则 减小,使测
定结果偏低。
③(√)中和滴定时,锥形瓶用盐酸润洗,实际加入的盐酸偏多,则 增大,使测定结
果偏高。
④(×)用酸式滴定管量取未知浓度的盐酸时,读取滴定管终点数据时,仰视刻度线,
即 ,则实际量取的盐酸体积偏小, 减小,使测定结果偏低。
⑤(×)滴定前仰视读数,滴定后平视读数,即 ,则 减小,使测定结果偏
低。
10.(2024北京四中期中)下列有关水处理的离子方程式书写不正确的是( )
B
A.沉淀法:用处理含废水,
B.中和法:用生石灰中和酸性废水,
C.氧化法:用处理氨氮废水,
D.混凝法:用明矾凝聚沉降细颗粒物,
【解析】 A(√)是易溶于水的强电解质(可拆),难溶于水,故用 处理
含废水的离子方程式为 。
B(×)属于氧化物,离子方程式中写化学式,故用生石灰 中和酸性废水的离
子方程式为 。
C(√) 具有强氧化性,将氨氮废水中的氮氧化为氮气,其离子方程式为
。
D(√)明矾溶于水电离出来的铝离子能发生水解,生成的氢氧化铝胶体具有吸附性,
可以凝聚沉降细颗粒物,其反应的离子方程式为 。
11.(大招42)(2024天津耀华中学月考)室温下,用相同浓
度的溶液分别滴定浓度均为 的三种酸
(和)溶液,中和百分数与 的
关系如图所示,下列判断正确的是( )
D
A.三种酸的酸性强弱关系:
B.滴定至 点时,溶液中:
C.时,三种溶液中:
D.当中和百分数达 时,将三种溶液混合后:
【解析】 A(×)抓“起始点”,浓度均为
的、、溶液, ,说明相同浓度下电离程
度,故酸性 。
B(×)抓“恰好中和一半点”,点中和百分数为 ,溶液中溶质
为等物质的量浓度的和,溶液显酸性,说明 的电离程度大
于的水解程度,故 。
C(×)抓“中性点”, 时,三种混合液中分别存在电荷守恒
、 、
,则三种溶液中、、 分别和钠离子
浓度相等,但三种溶液中阴离子的水解程度不同, 时加入的氢氧化钠溶液的体积
不同,钠离子浓度不等,则三种阴离子浓度不相等。
D(√)将题给式子进行变形可得
,式子一边微粒能电离
出,另一边微粒能结合,找质子守恒。当中和百分数达
时,将三种溶液混合后,溶液溶质为等物质的量的、 、
。元素守恒关系式为
,电荷
守恒关系式为 ,
联立两式消去得 。
12.(大招42)(2023山东淄博四中期末)已
知:, 时,向
氨水中滴入
的盐酸,溶液的和 与加入
盐酸体积的关系如图所示。下列说法正确的是
( )
D
A.曲线表示溶液中 的变化
B.点水的电离程度比 点大
C.、两点的数值之和 不一定等于14
D.与交叉点对应的 (盐酸)小于
【解析】
A(×)曲线表示溶液中的变化,曲线表示溶液中 的变化。
B(×)点与点的相等,即水电离出的离子溶度相等,故、 两点水的电离
程度相同。
C(×)、 两点时加入盐酸的体积相同,实际为酸碱中和同一点,
、, 时,
,则 。
D(√)抓中性点,为中性点,是弱碱, 水解使溶液显酸性,要使混合
溶液呈中性,则盐酸需要少加,故盐酸体积小于 。
13.(大招42)(2023江西八校联考,双选)常温下,
向 溶液中滴加同浓
度的溶液,水电离的与 溶液体积的关
系如图所示。下列说法错误的是( )
AC
A. 点溶液显酸性
B.点溶液中
C.点溶液中
D.常温下, 的水解常数约为
【解析】
A(×) 点溶液呈中性。
B(√)点溶液溶质为 。
“ 层次” 、
“ 层次”
、
极其微弱的层 次
、
离子浓度关系: C(×)点溶液呈碱性, 。
D(√)抓“起始点”, ,则
,常温下,故
, 。
14.(大招42)(2024浙江嘉兴高级中学期
中)常温下,将 溶液滴加
到二元弱酸 溶液中,
混合溶液的随 溶液滴入量的关系如
图所示。下列叙述不正确的是( )
C
A.
B.点时溶液中存在
C.点时溶液中存在
D.溶液中水的电离程度:
【解析】 A(√)计算找点, 点对应溶液中溶质为等物质的量的和 ,
。
B(√)点时得到溶液,且此时,说明 的电离程度大于其水解程度,
以电离为主,则 。
“ 层次” 、
“ 层次” (主)
、
极其微弱的层次
、、
微粒浓度关系: C(×)点对应溶液溶质为等物质的量的和 。等式中一边全为阳离子,另一
边全为阴离子,找电荷守恒。
第一步:列出溶液中所有离子 、、、、
第二步:阳离子、阴离子列在两侧
第三步:乘电荷、写等号
D(√)点对应溶液为等物质的量的与的混合溶液,点对应溶液为 溶
液,点对应溶液为等物质的量的与的混合溶液,又因为 抑制水的电离、
以电离为主抑制水的电离、 促进水的电离,所以对水的电离抑制程度为
,故水的电离程度为 。
15.(2024陕西西安长安区一中月考)食醋是日常饮食中的一种调味剂,国家标准规定
酿造食醋中醋酸含量不得低于,实验室用标准 溶液测定食醋中醋酸
的浓度,以检测食醋是否符合国家标准,某品牌白醋的醋酸浓度测定过程如图所示,请
回答:
(1) 选用____(填“甲”或“乙”)滴定管量取白醋后,将白醋稀释至 时,
需要使用的玻璃仪器有烧杯、玻璃棒和_________________________。
甲
胶头滴管、容量瓶
甲
乙
【解析】 白醋要用酸式滴定管(甲)量取,选用甲滴定管量取 白醋后,将白
醋稀释至时,需要使用的玻璃仪器有烧杯、玻璃棒、胶头滴管、 容量瓶。
(2) 某同学用酸碱中和滴定法测定该品牌白醋的醋酸浓度,当醋酸与氢氧化钠恰好完
全反应时,测得溶液中,则此时溶液的 ___。(已知:室温下
醋酸的 )
8
【解析】 凑法,上下同乘, ,故
, 。
(3) 根据该同学的计算结果,应选______(填“酚酞”“甲基橙”或“石蕊”)作指示剂。
酚酞
【解析】 用氢氧化钠溶液滴定醋酸溶液,恰好中和生成醋酸钠时,溶液显碱性,应选
酚酞作指示剂。
(4) 该滴定达到终点时的现象是______________________________________________
_____________________________。
当滴入最后半滴氢氧化钠溶液时,溶液由无色变为浅红色,且半分钟内溶液不褪色
【解析】 该滴定达到终点时的现象是当滴入最后半滴氢氧化钠溶液时,溶液由无色变
为浅红色,且半分钟内溶液不褪色。
(5) 某次实验滴定开始和结束时,碱式滴定管中的液面如图所示,则所用 溶液
的体积为______ 。
26.10
【解析】 所用溶液的体积为 。
(6) 用标准的 溶液滴定上述稀释后的白醋溶液,滴定结果如
下表所示:
滴定次数 待测溶液的体积/ 标准溶液的体积 滴定前刻度/ 滴定后刻度/
1 25.00 0.02 25.01
2 25.00 0.70 25.71
3 25.00 0.50 24.20
则该品牌白醋中醋酸含量为______ 。
0.036
【解析】 三次所用标准溶液的体积分别为 、
、(【提醒】误差较大,舍去),则消耗标准 溶液的体积为
,测得稀释后白醋中醋酸的浓度为
,转化为国家标准,质量浓度为 。
(7) 下列操作中,可能使所测白醋中醋酸的浓度数值偏高的是_____(填编号)。
CD
A.取待测液的滴定管,取液后尖嘴处出现气泡
B.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥
C.碱式滴定管未用标准溶液润洗就直接注入标准 溶液
D.读取 溶液体积时,开始时俯视读数,滴定结束时仰视读数
【解析】 A(×)取待测液的滴定管,取液后尖嘴处出现气泡,则实际量取的待测液体
积偏小,即 减小,使测定结果偏低。
B(×)滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥,无影响。
C(√)碱式滴定管未用标准溶液润洗就直接注入标准溶液, 溶液被蒸
馏水稀释,即 增大,使测定结果偏高。
D(√)读取溶液体积时,开始时俯视读数,滴定结束时仰视读数,即 ,
增大,使测定结果偏高。
(8) 有一支的酸式滴定管,其中盛有溶液,液面恰好在 刻度处,现
把管内液体全部放出,用量筒接收,得到溶液的体积是___。
C
A.等于 B.等于 C.大于 D.不能确定
【解析】 的酸式滴定管, 刻度以下有一段没有刻度,当其中盛有溶
液,液面恰好在 刻度处,把管内液体全部放出,用量筒接收,得到溶液的体
积大于 。
素养觉醒
16.(大招42)(2023天津中学期中)在某温度时,将
氨水滴入盐酸中,溶液 和
温度随加入氨水体积变化曲线如图所示,下列有关说法正
确的是( )
C
A.点
B.点:
C.时,的水解常数为
D. 点水的电离程度最大
【解析】
A(×)点时溶液温度小于,则水的离子积 。
B(×)点时溶液的,则 ,根据电荷守恒
,可知 ,故溶液中离子浓度大小为
。
C(√)向盐酸中滴入氨水时,溶液温度为 、
,则, ,
由物料守恒 可知,
,则 时
的水解常数
。
D(×)点恰好完全反应生成, 水解促进水的电离,水的电离程度最大,继
续滴入氨水,过量的 抑制水的电离,水的电离程度逐渐减小。
17.(2023山东济南、枣庄期中,双选)硝基苯是一种重要有机合成中间体,其制备、
纯化流程如图。已知:制备反应在温度稍高时会生成间二硝基苯。
下列说法错误的是( )
AD
A.制备硝基苯所需玻璃仪器只有酒精灯、烧杯、试管、导管
B.配制混酸时,应将浓硫酸缓慢注入浓硝酸中,边加边搅拌
C. 溶液可以用 溶液代替
D.由②、③分别获取相应物质时可采用相同的操作方法
【解析】 A(×)制备硝基苯时的温度为 ,需要用水浴加热,则所需玻璃仪
器还有温度计等。
B(√)配制混酸时,应将密度大的浓硫酸缓慢加入密度小的浓硝酸中,边加边搅拌,
使产生的热量迅速散失。
C(√)碳酸钠溶液的作用是除去粗产品1中残留的酸,可以用氢氧化钠溶液代替。
D(×)②中由反应后的混合物得到粗产品采用分液;③中粗产品2经过干燥后,采用蒸
馏得到硝基苯。
第3章 物质在水溶液中的行为
2025年高考化学一轮复习
选择性必修第一册鲁科版
第4节 离子反应
课时1 离子反应发生的条件
题型觉醒
题型一 离子共存
1.(2023江西安福中学期中)下列透明溶液中,一定能大量共存的离子组是( )
C
A.、、、 B.、、、
C.、、、 D.、、、
【解析】 AA(×)与可发生相互促进的水解反应生成、, 与
不能大量共存。
(×)与反应可生成气体,、 不能大量共存。
D(×)与反应生成沉淀,、 不能大量共存。
2.(2024重庆铁路中学月考)室温下,下列各组离子在指定溶液中一定能大量共存的是
( )
A
A.的溶液:、、、
B.的澄清透明溶液:、、、
C.能使甲基橙变红的溶液:、、、
D.水电离出的溶液:、、、
【解析】 A(√)的溶液中, ,则
该溶液显碱性,碱性条件下,该项中的四种离子能大量共存。
B(×)说明溶液显酸性,可以和反应生成弱电解质, 不能大量
存在,、、 可大量共存(【提醒】透明溶液中有色离子可以大量存在,不
能认为“有色”就不透明)。
C(×)使甲基橙变红的溶液显酸性,、 因发生氧化还原反应而不能大量共存。
D(×)水电离出 的溶液中水的电离被抑制,溶液可能显
酸性或碱性,酸性条件下,不能大量存在,碱性条件下, 不能大量存在。
有“化”好说
溶液酸碱性的判断
表示酸性溶液 表示碱性溶液 可能酸性或碱性
(1) ; 时,或; (3)能使紫色石蕊溶液显红色; (4)能使甲基橙显红色或橙色; (5)能使 试纸显红色 (1) ; (2)时, 或 ; (3)能使紫色石蕊溶液显蓝色; (4)能使酚酞溶液显红色; (5)能使 试纸显蓝色 (1)与反应放出 ;
(2)由水电离出的
或由
水电离出的
(常温下 );
(3)与 、
、 、
等溶液反应放出气体
题型二 离子方程式的正误判断
3.(2023江苏扬州期中)下列离子反应方程式正确的是( )
C
A.向硫酸铜溶液中通入少量氨气:
B.用硫酸酸化的溶液与溶液反应,证明 具有还原性:
C.向稀硝酸中加入过量铁粉:
D.向溶液中滴加溶液,使 完全沉淀:
【解析】 A(×)“拆不拆”,氨气溶于水生成, 是弱电
解质,不能拆成离子,正确的离子方程式为 。
B(×)“平不平”,电子得失不守恒,按照题目的配平发现(价 )
共得,但(2个价)只失去 ,因此配平错误,正确的
离子方程式为 。
C(√)铁粉过量时,与稀硝酸反应得到、 ,题给离子方程式正确。
D(×)“对不对”,完全沉淀时, ,正确的离子方程式为
。
4.(2024四川绵阳南山中学月考)下列离子方程式正确,且与所给事实相符的是( )
C
A.与足量反应:
B.用过量溶液脱除烟气中的
C.向溶液中通入少量
D.湿润的淀粉碘化钾试纸遇氯气变蓝:
【解析】 A(×)“对不对”,过量,与 也能发生反应,离
子方程式为 。
B(×)“对不对”,过量,生成,离子方程式为 。
C(√)还原性:,少量,只会发生氧化 的反应,离子方程式为
。
D(×)“对不对”,湿润的淀粉碘化钾试纸遇氯气变蓝,则生成物为 ,离子方程式为
。
难点粉碎·高
中学阶段典型物质间的氧化还原系统如下:
根据上述氧化还原系统,可判定出当一种氧化剂(或还原剂)与两种及以上不同的还原
剂(或氧化剂)反应时,反应发生的先后顺序。
题型三 离子检验与推断
5.(2023山东枣庄三中月考,双选)某无色透明溶液中,可能含有以下离子中的若干
种:、、、、、、、、和 ,取该溶液进行如
下实验:
①将溶液滴在 试纸上,呈红色。
②将少许溶液浓缩后加入铜片和硫酸,有无色气体逸出,通入空气则立即变成红棕色。
③取少许溶液滴入 溶液,则产生白色沉淀。
④取实验③中的澄清溶液,滴入溶液,产生不溶于稀 的白色沉淀。
⑤另取少许溶液,滴入溶液,有白色沉淀生成,当 过量时,又有部分白色沉
淀溶解。根据以上现象判断原溶液中( )
A.肯定不存在的离子是、、、
B.肯定存在的离子是、、、、
C.不能作出判断的离子是、
D.以上判断都不正确
√
√
【解析】 有什么,没有什么?(肯定性原则)溶液无色说明一定不存在
;①说明溶液呈酸性,则原溶液中一定不存在 ;②中有无色气体逸出,通入
空气则立即变成红棕色表明无色气体为,则原溶液中一定存在 ,酸性溶液中
有强氧化性,可判断原溶液中一定不存在;③中产生的白色沉淀为 ,则原
溶液中一定存在;⑤中生成的沉淀部分溶解,则原溶液中一定存在、 。
还没有什么?(互斥性原则)原溶液中一定存在,则一定不存在 。加入了什
么?(进出性原则)③中滴入溶液,引入了,故④中检验出的 不一定是原
溶液中的,即不能确定原溶液中是否含有 。
(√)C(√)原溶液中肯定存在、、、,肯定不存在、 、
、,可能存在、 。
能力觉醒
6.(2023吉林长春三校期中)下列实验过程中,始终无明显现象的是( )
B
A.通入溶液中 B.通入 溶液中
C.通入溶液中 D.通入已酸化的 溶液中
【解析】 A(×)二氧化氮和水反应生成硝酸,硝酸把氧化成 ,溶液由浅绿色
变为棕黄色。
B(√)酸性,与溶液不反应,故通入 溶液中无明显现象。
C(×)氨气溶于水得到,与反应可生成 白色沉淀。
D(×)在酸性条件下具有强氧化性,可将价氧化为价,故 通入已酸化
的溶液可生成 白色沉淀。
7.(2023广东深圳光明区期末)室温下,下列离子组在给定条件下能大量共存的是
( )
B
A.的溶液:、、、
B.的溶液:、、、
C.的溶液:、、、
D.加铝粉有氢气产生的溶液:、、、
【解析】 A(×)与能发生相互促进的水解反应生成 和
沉淀,不能大量共存。
B(√)的溶液呈酸性,、、、 能大量共存。
C(×)即,溶液呈碱性,会转化为 沉淀,
不能大量存在。
D(×)加铝粉有氢气产生的溶液既可呈酸性,又可呈碱性,而 在酸性和碱性溶液
中均不能大量存在。
8.(2024辽宁沈阳第一二〇中学检测)下列各组澄清溶液中离子能大量共存,且加入
试剂后发生的离子方程式书写正确的是( )
选项 离子组 试剂 离子方程式
A 、、、 过量
B 、、、 少量
C 、、、 过量铜粉
D 、、、 少量
A
【解析】 A(√)四种离子相互不反应,能够共存;三价铁离子能氧化 生成硫单
质,为弱电解质,不能拆成离子,离子方程式为 。
B(×)四种离子相互不反应,能够共存;还原性:,加入少量, 先被氧
化,离子方程式为 。
C(×)与能发生相互促进的水解反应生成和 沉淀,四
种离子不能共存;加入过量铜粉,与反应生成 ,离子方程式为
。
D(×)与能发生相互促进的水解反应生成沉淀和 ,四种离子不能共存;
加入少量,与反应生成,离子方程式为 。
9.(2023山东淄博临淄中学月考)常温下,取用硫酸浸出铝土矿(含有、 、
、 等物质)后的溶液,分别向其中加入指定物质,反应后的溶液中主要存在
的离子正确的是( )
A
A.加入过量溶液:、、、
B.加入过量氨水:、、、
C.通入过量、、、
D.加入过量溶液:、、、
【解析】 硫酸浸出后的溶液中主要含有的离子为、、、、 。
A(√)加入过量溶液,转化为,和转化为沉淀, 转化
为水,溶液中主要存在的离子为、、、 。
B(×)加入过量氨水,转化为沉淀,溶液中 不能大量存在。
C(×)通入过量,被氧化为,溶液中 不能大量存在。
D(×)酸性条件下,具有强氧化性,会将氧化为,自身被还原为 ,
、可与发生相互促进的水解反应生成、 沉淀,故溶液中
存在的主要离子为、、、 。
10.(2024山东青岛第六十八中期中)已知:①相同温度下:
;②电离出 的能力:
,则下列离子方程式错误的是( )
C
A.将加入稀盐酸中:
B.向溶液中通入气体:
C.将溶液和溶液混合:
D.向少量溶液中加入足量 溶液:
【解析】 A(√)电离出的能力:,更易结合 ,则离子反应方程式
为 。
B(√)电离出的能力:,更易结合 ,则离子反应方程式为
。
C(×)相同温度下:,比更难溶,和 结
合生成沉淀,则离子反应方程式为 。
D(√)相同温度下:,比 更难溶,则向少
量溶液中加入足量溶液时得到沉淀。 少量,定为
“1”,写出,过量,要多少有多少。和形成,
和形成 ,则离子方程式为
。
难点粉碎·高
“少定多”巧写配比型离子方程式
以与 反应的离子方程式的书写为例,如表所示:
少量溶液与过量 溶液反应 少量溶液与过量
溶液反应
(1)少定多 变,少量定为 “1”,过量者“要 多少有多少”, 过量配合少量 少量,定为“1”,写出 , 过量,要多 少有多少,取与 反 应,生成的再和 反应 生成 ,最后得离子方程式: 少量,电离出的 的计
量数定为“1”,与 过
量,要多少有多少,取 与
反应,生成的 再和
反应生成 ,最后
得离子方程式:
(2)先中和, 后沉淀 少量溶液与过量 溶液反应 少量溶液与过量
溶液反应
(3)少量者的 计量数符合化学 式比例,过量者 不一定 少量,最后离子方程式 中与 的化学计量数符合 化学式中比例1 过量,最后离子方程式
中与 的化学计量数并没
有符合化学式中比例 而是
,因此过量物的配比取决于少
量物质反应需求(过量配合少
量)
续表
11.(大招41)(2023山东济宁月考)某无色溶
液中可能含有、、、、 、
、、 中的几种离子,溶液中阳
离子的浓度相同。为了确定其组成,某同学进行
了如下实验(假设气体均全部逸出,忽略 的分解)。
下列说法不正确的是( )
B
A.溶液中一定不存在、
B.溶液中一定含有,且
C.溶液中肯定存在、、 、、
D.溶液中可能存在 ,为确定其是否存在,可取溶液1通过焰色试验验证
【解析】 有什么,没有什么?
(肯定性原则)无色溶液中一定不含;向溶液
中加入足量 溶液(盐酸酸化),产生气体1、溶
液1和沉淀,沉淀一定是,被氧化,还原产物为,则气体1为 ,
溶液 中一定含有
、、 ;向溶液
1中加入过量溶液,产生气体2且不产生沉淀,则气体2为, 在上一步
与 完全反应,溶
液中 、
。还没有什么?
(互斥性原则)溶液中含有,则一定不含 。溶
液呈电中性!(电中性原则)溶液中阳离子的浓度相同,
则,则溶液 中一定还含有
,可能含有 。
A(√)溶液中一定不存在、 。
B(×)C(√)溶液中一定含有、、、、,可能含有 ,且
、、、的物质的量都为 ,根据溶液中阳离子的浓度相同,
结合溶液呈电中性可知,若溶液中含有,, ,
若溶液中不含, 。
D(√)溶液中可能存在 ,可取溶液1通过焰色试验验证,若溶液1的焰色呈黄色,
则说明溶液中含有 。
第3章 物质在水溶液中的行为
2025年高考化学一轮复习
选择性必修第一册鲁科版
第4节 离子反应
课时2 离子反应的应用
题型觉醒
题型一 酸碱中和滴定实验操作
1.(2024北京第八十中学期中)下列是一段关于酸碱中和滴定的实验叙述,其中错误的
是( )
D
①取一锥形瓶,用待测 溶液润洗两次;
②在锥形瓶中放入待测 溶液;
③加入几滴石蕊溶液作指示剂;
④取一支酸式滴定管,洗涤干净;
⑤直接向酸式滴定管中注入标准酸溶液,进行滴定;
⑥左手旋转滴定管的玻璃活塞,右手不停地摇动锥形瓶;
⑦两眼注视着滴定管内盐酸液面,直至滴定终点。
A.④⑥⑦ B.①⑤⑥⑦ C.③⑤⑦ D.①③⑤⑦
【解析】 ①(×)锥形瓶不能用待测液润洗。
③(×)石蕊的颜色变化不明显,且变色范围较宽,不用作酸碱中和滴定的指示剂。
⑤(×)滴定管必须用标准液润洗后才能注入标准液。
⑦(×)两眼应注视锥形瓶中溶液颜色的变化。
考点挖掘·高
碱式滴定管排气泡的方法:将胶管向上弯曲,用力捏挤玻璃珠使溶液从尖嘴喷出。
酸式滴定管排气泡的方法:开启活塞的速度需快一点,使溶液流出时带有一定的冲力,
将气泡带出。
2.(2023河南商丘名校期中)下列实验操作正确的是( )
A
图1
图2
图3
A.选用图1滴定管量取 溶液
B.如图2所示,记录滴定终点读数为
C.中和滴定时,选用图1滴定管盛装 标准溶液
D.可用图3装置进行酸性溶液滴定未知浓度的 溶液实验
【解析】 A(√)图1为酸式滴定管,可以盛装 溶液(中性),滴定管能精确到
。
B(×)滴定管“0”刻度在上,故终点读数为 。
C(×)图1为酸式滴定管,不能盛装碱性物质。
D(×)图3为碱式滴定管,不能盛装强氧化性的试剂,故不能盛装酸性 溶液。
难点粉碎·高
(1)酸式滴定管下端的玻璃活塞能耐酸和强氧化剂的腐蚀,故其可用于盛装酸性或强
氧化性溶液,但不能盛装碱性溶液。
(2)碱式滴定管下端的橡胶管易被酸性或强氧化性溶液腐蚀,所以碱式滴定管一般盛
装碱性溶液。
题型二 酸碱中和滴定曲线分析
3.(2024四川遂宁射洪中学期中,双选)常温下,向
盐酸中滴加 溶
液,溶液的随 溶液体积的变化如图所示。已知:
,下列说法不正确的是( )
AC
A.选酚酞作指示剂时,滴入半滴 溶液使溶液由无色变为粉
红色,即达到滴定终点
B.与盐酸恰好完全反应时,
C.滴定过程中水的电离程度不断增大
D.时,所得溶液的
【解析】 A(×)滴定管选酚酞作指示剂时,滴入半滴 溶液
使溶液由无色变为粉红色,且半分钟内不褪色,即达到滴定终点。
B(√)与完全反应生成 ,即恰好完全反应时溶液显
中性, 。
C(×)(溶液)从 过程中,盐酸逐渐被中
和至恰好完全反应,酸抑制水的电离,盐酸浓度逐渐减小,水
的电离程度逐渐增大,当(溶液) 时,水的
电离程度最大,(溶液)从 过程中,
盐酸已完全反应,过量,溶液中 浓度逐渐增大,碱
抑制水的电离,溶液中水的电离程度减小。
D(√) 抓“指定比例混合点”, 时,碱过量,
,
,
。
考点挖掘·高
选择指示剂的原则:变色明显、变色的 范围小、滴定终点的
与指示剂变色范围的 接近。
4.(2023安徽池州期中)常温下,用的 溶
液分别滴定的溶液和 的醋酸
溶液,滴定分数[或]与 的关
系如下图。下列有关说法正确的是( )
B
A.实线表示滴定盐酸的曲线
B.滴定分数为时,溶液与醋酸混合液的
C.段的离子方程式为
D.两个体系滴定时都可用甲基橙作指示剂
【解析】 A(×)抓“起始点”,为强酸,
为弱酸,相同浓度溶液的溶液 醋酸溶液,故虚线表示滴定
盐酸的曲线,实线表示滴定醋酸溶液的曲线。
B(√)抓“恰好完全中和点”,滴定分数为时, 与
恰好完全反应,溶质为, 水解使溶液
呈碱性, 。
C(×)实线表示滴定醋酸溶液的曲线,为弱酸,不能拆成离子, 段的离子
方程式为 。
D(×)甲基橙变色的范围是 ,符合图中虚线的突变范围,不符合图中实线
的突变范围,则滴定盐酸时可以用甲基橙作指示剂,滴定醋酸溶液时不可以用甲基橙作
指示剂。
题型三 酸碱中和滴定误差分析
5.(2024福建三明一中检测)某学生用的标准 溶液滴定未知浓度
的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入的标准 溶液至“0”刻度线以上;
②固定好滴定管并使滴定管尖嘴充满液体;
③调节液面至“0”或“0”刻度线稍下,并记录读数;
④量取待测液注入洁净的锥形瓶中,并加入 滴酚酞溶液;
⑤用标准 溶液滴定至终点,记下滴定管液面读数;
⑥重复以上滴定操作 次。
请回答下列问题:
(1) 以上步骤有错误的是____(填编号),该步骤错误操作会导致测定结果______
(填“偏高”“偏低”或“无影响”)。
①
偏高
【解析】 碱式滴定管在洗涤后需要润洗,步骤①错误;碱式滴定管在洗涤后未润洗,
则消耗标准溶液的体积增大,即 增大,使测定结果偏高。
(2) 下列操作会导致上述所测盐酸溶液的浓度偏高的是_____(填标号)。
BD
A.滴定达到终点时,俯视滴定管内液面读数
B.碱式滴定管尖嘴部分开始有气泡,滴定后消失
C.锥形瓶用蒸馏水洗净后未干燥就装入盐酸待测液
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
【解析】 A(×)滴定达到终点时,俯视滴定管内液面读数,即 ,
偏小,使测定结果偏低。
B(√)碱式滴定管尖嘴部分开始有气泡,滴定后消失, 偏大,使测定结果偏高。
C(×)锥形瓶用蒸馏水洗净后未干燥就装入盐酸待测液,对 无影响,测定结果不变。
D(√)滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液, 偏大,使测定结果偏高。
题型四 物质的制备与纯化
6.(2024浙江省吴兴高级中学检测)通过海水晒盐可以得到粗盐。某粗盐中除含有
外,还含有、、 以及泥沙等杂质。以下是某兴趣小组制备精盐的实
验方案,其操作流程如图所示(所加试剂均过量):
下列说法错误的是( )
A
A.试剂A、试剂B、试剂C分别为溶液、溶液、 溶液
B.操作②、③、④、⑥均为离子反应
C.操作①、⑤、⑦均需用到玻璃棒
D.除去可以用溶液,也可以用 溶液
【解析】 A(×)B(√)操作②加入溶液,与生成 沉淀;操作
③加入溶液,与生成沉淀;操作④加入溶液, 与
、生成沉淀(【提醒】过量的需用除去,溶液需在
溶液之后加入);操作⑥加入盐酸(【提醒】除去过量的、),与
生成水,与 生成气体。
C(√)操作①溶解过程中,用玻璃棒加快溶解速率;操作⑤过滤中,玻璃棒起到引流
作用;操作⑦结晶中,用玻璃棒进行搅拌,使溶液受热均匀。
D(√)将换成,引入,盐酸可以去除 。
7.(2023山东联考)某锂离子电池的正极材料为 、碳粉及铝箔,某化学兴趣小
组设计下列室温下的流程处理废旧锂离子电池的正极材料,下列离子反应方程式书写不
正确的是( )
B
A.加入过量溶液: 。
B.被氧化:
C.滤液Ⅱ中加入饱和碳酸钠溶液:
D.滤液Ⅰ中通入过量;
【解析】
.
A(√)加入过量溶液, ,离子方程式为
。
B(×)在酸性环境下,生成物不能有 ,离子方程式为
。
C(√)滤液Ⅱ中加入饱和碳酸钠溶液得到 晶体,离子方程式为
。
D(√)滤液Ⅰ含有、 ,通入过量二氧化碳,分别发生反应
、 。
题型五 生活中的离子反应
8.(2024陕西西安第一中学月考)下列解释事实的方程式正确的是( )
D
A.用溶液刻蚀覆铜板:
B.常温下,新切开的钠表面很快变暗:
C.用小苏打治疗胃酸(盐酸)过多:
D.不能将炽热的铁水注入未经干燥的模具是为防止发生反应:
【解析】 A(×)“平不平”,得失电子不守恒、电荷不守恒,正确的离子方程式为
。
B(×)“对不对”,常温下,钠与氧气反应生成氧化钠,化学方程式为
。
C(×)“对不对”,小苏打是,正确的离子方程式为 。
D(√)高温下,铁与水蒸气反应生成和 ,离子方程式为
。
能力觉醒
9.(大招43)配制一定浓度的氢氧化钠溶液,并用其滴定未知浓度的盐酸,下列实验操
作会引起测量结果偏高的是( )
A
①用天平称量 固体,将小烧杯放在右盘,砝码放在左盘,并移动游码,使之平衡;
②在配制氢氧化钠溶液时,将称量后的 固体溶于水,立即移入容量瓶,将洗涤烧
杯的液体注入容量瓶后,加蒸馏水至刻度线;③中和滴定时,锥形瓶用盐酸润洗;④用
酸式滴定管量取未知浓度的盐酸时,读取滴定管终点数据时,仰视刻度线;⑤滴定前仰
视读数,滴定后平视读数。
A.①③ B.③④⑤ C.②④⑤ D.①②③④⑤
【解析】 ①(√)使用天平时遵循“左物右码”原则,且 ,
实际测量时若“左码右物”并移动游码,则, 为定值,故测量值比实
际值偏小,即配制的氢氧化钠溶液浓度偏低, 增大,使测定结果偏高。
②(×) 固体溶于水放热,溶液体积膨胀,立即移入容量瓶,将洗涤烧杯的液体
注入容量瓶后,加蒸馏水至刻度线,配制的氢氧化钠溶液浓度偏高,则 减小,使测
定结果偏低。
③(√)中和滴定时,锥形瓶用盐酸润洗,实际加入的盐酸偏多,则 增大,使测定结
果偏高。
④(×)用酸式滴定管量取未知浓度的盐酸时,读取滴定管终点数据时,仰视刻度线,
即 ,则实际量取的盐酸体积偏小, 减小,使测定结果偏低。
⑤(×)滴定前仰视读数,滴定后平视读数,即 ,则 减小,使测定结果偏
低。
10.(2024北京四中期中)下列有关水处理的离子方程式书写不正确的是( )
B
A.沉淀法:用处理含废水,
B.中和法:用生石灰中和酸性废水,
C.氧化法:用处理氨氮废水,
D.混凝法:用明矾凝聚沉降细颗粒物,
【解析】 A(√)是易溶于水的强电解质(可拆),难溶于水,故用 处理
含废水的离子方程式为 。
B(×)属于氧化物,离子方程式中写化学式,故用生石灰 中和酸性废水的离
子方程式为 。
C(√) 具有强氧化性,将氨氮废水中的氮氧化为氮气,其离子方程式为
。
D(√)明矾溶于水电离出来的铝离子能发生水解,生成的氢氧化铝胶体具有吸附性,
可以凝聚沉降细颗粒物,其反应的离子方程式为 。
11.(大招42)(2024天津耀华中学月考)室温下,用相同浓
度的溶液分别滴定浓度均为 的三种酸
(和)溶液,中和百分数与 的
关系如图所示,下列判断正确的是( )
D
A.三种酸的酸性强弱关系:
B.滴定至 点时,溶液中:
C.时,三种溶液中:
D.当中和百分数达 时,将三种溶液混合后:
【解析】 A(×)抓“起始点”,浓度均为
的、、溶液, ,说明相同浓度下电离程
度,故酸性 。
B(×)抓“恰好中和一半点”,点中和百分数为 ,溶液中溶质
为等物质的量浓度的和,溶液显酸性,说明 的电离程度大
于的水解程度,故 。
C(×)抓“中性点”, 时,三种混合液中分别存在电荷守恒
、 、
,则三种溶液中、、 分别和钠离子
浓度相等,但三种溶液中阴离子的水解程度不同, 时加入的氢氧化钠溶液的体积
不同,钠离子浓度不等,则三种阴离子浓度不相等。
D(√)将题给式子进行变形可得
,式子一边微粒能电离
出,另一边微粒能结合,找质子守恒。当中和百分数达
时,将三种溶液混合后,溶液溶质为等物质的量的、 、
。元素守恒关系式为
,电荷
守恒关系式为 ,
联立两式消去得 。
12.(大招42)(2023山东淄博四中期末)已
知:, 时,向
氨水中滴入
的盐酸,溶液的和 与加入
盐酸体积的关系如图所示。下列说法正确的是
( )
D
A.曲线表示溶液中 的变化
B.点水的电离程度比 点大
C.、两点的数值之和 不一定等于14
D.与交叉点对应的 (盐酸)小于
【解析】
A(×)曲线表示溶液中的变化,曲线表示溶液中 的变化。
B(×)点与点的相等,即水电离出的离子溶度相等,故、 两点水的电离
程度相同。
C(×)、 两点时加入盐酸的体积相同,实际为酸碱中和同一点,
、, 时,
,则 。
D(√)抓中性点,为中性点,是弱碱, 水解使溶液显酸性,要使混合
溶液呈中性,则盐酸需要少加,故盐酸体积小于 。
13.(大招42)(2023江西八校联考,双选)常温下,
向 溶液中滴加同浓
度的溶液,水电离的与 溶液体积的关
系如图所示。下列说法错误的是( )
AC
A. 点溶液显酸性
B.点溶液中
C.点溶液中
D.常温下, 的水解常数约为
【解析】
A(×) 点溶液呈中性。
B(√)点溶液溶质为 。
“ 层次” 、
“ 层次”
、
极其微弱的层 次
、
离子浓度关系: C(×)点溶液呈碱性, 。
D(√)抓“起始点”, ,则
,常温下,故
, 。
14.(大招42)(2024浙江嘉兴高级中学期
中)常温下,将 溶液滴加
到二元弱酸 溶液中,
混合溶液的随 溶液滴入量的关系如
图所示。下列叙述不正确的是( )
C
A.
B.点时溶液中存在
C.点时溶液中存在
D.溶液中水的电离程度:
【解析】 A(√)计算找点, 点对应溶液中溶质为等物质的量的和 ,
。
B(√)点时得到溶液,且此时,说明 的电离程度大于其水解程度,
以电离为主,则 。
“ 层次” 、
“ 层次” (主)
、
极其微弱的层次
、、
微粒浓度关系: C(×)点对应溶液溶质为等物质的量的和 。等式中一边全为阳离子,另一
边全为阴离子,找电荷守恒。
第一步:列出溶液中所有离子 、、、、
第二步:阳离子、阴离子列在两侧
第三步:乘电荷、写等号
D(√)点对应溶液为等物质的量的与的混合溶液,点对应溶液为 溶
液,点对应溶液为等物质的量的与的混合溶液,又因为 抑制水的电离、
以电离为主抑制水的电离、 促进水的电离,所以对水的电离抑制程度为
,故水的电离程度为 。
15.(2024陕西西安长安区一中月考)食醋是日常饮食中的一种调味剂,国家标准规定
酿造食醋中醋酸含量不得低于,实验室用标准 溶液测定食醋中醋酸
的浓度,以检测食醋是否符合国家标准,某品牌白醋的醋酸浓度测定过程如图所示,请
回答:
(1) 选用____(填“甲”或“乙”)滴定管量取白醋后,将白醋稀释至 时,
需要使用的玻璃仪器有烧杯、玻璃棒和_________________________。
甲
胶头滴管、容量瓶
甲
乙
【解析】 白醋要用酸式滴定管(甲)量取,选用甲滴定管量取 白醋后,将白
醋稀释至时,需要使用的玻璃仪器有烧杯、玻璃棒、胶头滴管、 容量瓶。
(2) 某同学用酸碱中和滴定法测定该品牌白醋的醋酸浓度,当醋酸与氢氧化钠恰好完
全反应时,测得溶液中,则此时溶液的 ___。(已知:室温下
醋酸的 )
8
【解析】 凑法,上下同乘, ,故
, 。
(3) 根据该同学的计算结果,应选______(填“酚酞”“甲基橙”或“石蕊”)作指示剂。
酚酞
【解析】 用氢氧化钠溶液滴定醋酸溶液,恰好中和生成醋酸钠时,溶液显碱性,应选
酚酞作指示剂。
(4) 该滴定达到终点时的现象是______________________________________________
_____________________________。
当滴入最后半滴氢氧化钠溶液时,溶液由无色变为浅红色,且半分钟内溶液不褪色
【解析】 该滴定达到终点时的现象是当滴入最后半滴氢氧化钠溶液时,溶液由无色变
为浅红色,且半分钟内溶液不褪色。
(5) 某次实验滴定开始和结束时,碱式滴定管中的液面如图所示,则所用 溶液
的体积为______ 。
26.10
【解析】 所用溶液的体积为 。
(6) 用标准的 溶液滴定上述稀释后的白醋溶液,滴定结果如
下表所示:
滴定次数 待测溶液的体积/ 标准溶液的体积 滴定前刻度/ 滴定后刻度/
1 25.00 0.02 25.01
2 25.00 0.70 25.71
3 25.00 0.50 24.20
则该品牌白醋中醋酸含量为______ 。
0.036
【解析】 三次所用标准溶液的体积分别为 、
、(【提醒】误差较大,舍去),则消耗标准 溶液的体积为
,测得稀释后白醋中醋酸的浓度为
,转化为国家标准,质量浓度为 。
(7) 下列操作中,可能使所测白醋中醋酸的浓度数值偏高的是_____(填编号)。
CD
A.取待测液的滴定管,取液后尖嘴处出现气泡
B.滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥
C.碱式滴定管未用标准溶液润洗就直接注入标准 溶液
D.读取 溶液体积时,开始时俯视读数,滴定结束时仰视读数
【解析】 A(×)取待测液的滴定管,取液后尖嘴处出现气泡,则实际量取的待测液体
积偏小,即 减小,使测定结果偏低。
B(×)滴定前盛放白醋稀溶液的锥形瓶用蒸馏水洗净后没有干燥,无影响。
C(√)碱式滴定管未用标准溶液润洗就直接注入标准溶液, 溶液被蒸
馏水稀释,即 增大,使测定结果偏高。
D(√)读取溶液体积时,开始时俯视读数,滴定结束时仰视读数,即 ,
增大,使测定结果偏高。
(8) 有一支的酸式滴定管,其中盛有溶液,液面恰好在 刻度处,现
把管内液体全部放出,用量筒接收,得到溶液的体积是___。
C
A.等于 B.等于 C.大于 D.不能确定
【解析】 的酸式滴定管, 刻度以下有一段没有刻度,当其中盛有溶
液,液面恰好在 刻度处,把管内液体全部放出,用量筒接收,得到溶液的体
积大于 。
素养觉醒
16.(大招42)(2023天津中学期中)在某温度时,将
氨水滴入盐酸中,溶液 和
温度随加入氨水体积变化曲线如图所示,下列有关说法正
确的是( )
C
A.点
B.点:
C.时,的水解常数为
D. 点水的电离程度最大
【解析】
A(×)点时溶液温度小于,则水的离子积 。
B(×)点时溶液的,则 ,根据电荷守恒
,可知 ,故溶液中离子浓度大小为
。
C(√)向盐酸中滴入氨水时,溶液温度为 、
,则, ,
由物料守恒 可知,
,则 时
的水解常数
。
D(×)点恰好完全反应生成, 水解促进水的电离,水的电离程度最大,继
续滴入氨水,过量的 抑制水的电离,水的电离程度逐渐减小。
17.(2023山东济南、枣庄期中,双选)硝基苯是一种重要有机合成中间体,其制备、
纯化流程如图。已知:制备反应在温度稍高时会生成间二硝基苯。
下列说法错误的是( )
AD
A.制备硝基苯所需玻璃仪器只有酒精灯、烧杯、试管、导管
B.配制混酸时,应将浓硫酸缓慢注入浓硝酸中,边加边搅拌
C. 溶液可以用 溶液代替
D.由②、③分别获取相应物质时可采用相同的操作方法
【解析】 A(×)制备硝基苯时的温度为 ,需要用水浴加热,则所需玻璃仪
器还有温度计等。
B(√)配制混酸时,应将密度大的浓硫酸缓慢加入密度小的浓硝酸中,边加边搅拌,
使产生的热量迅速散失。
C(√)碳酸钠溶液的作用是除去粗产品1中残留的酸,可以用氢氧化钠溶液代替。
D(×)②中由反应后的混合物得到粗产品采用分液;③中粗产品2经过干燥后,采用蒸
馏得到硝基苯。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
