单元小结复习--2025年高考化学选择性必修第二册(鲁科版)(共67张PPT)
文档属性
| 名称 | 单元小结复习--2025年高考化学选择性必修第二册(鲁科版)(共67张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 7.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-06 00:00:00 | ||
图片预览











文档简介
(共67张PPT)
第1章 原子结构与元素性质
2025年高考化学一轮复习
选择性必修第二册鲁科版
第一章小结复习
一、选择题(本题包括10小题,每小题只有1个选项符合题意)
1.(2024河南郑州月考)下列轨道中,原子轨道数最多的是 ( )
D
A. B. C. D.
【解析】 原子轨道数与能级有关,与电子层数无关,能级只有1个原子轨道, 能级有
3个原子轨道,能级有5个原子轨道, 能级有7个原子轨道。
2.(2024山东烟台期末)电子跃迁伴随着能量的释放或吸收,下列与电子跃迁无关的是
( )
B
A.成都大运会燃放的焰火 B.铜丝可以导电
C.装饰建筑夜景的 灯光 D.从太阳光谱中发现氦
【解析】 燃放的焰火是金属的焰色试验的体现,焰色试验是因为金属离子吸收能
量,电子发生跃迁,形成激发态离子,激发态离子上的电子又跃迁回低能级,从而形成
不同颜色的光,与电子跃迁有关,不符合题意。
铜丝可以导电是因为自由电子的定向移动,与电子跃迁无关,符合题意。
灯发光是因为电子吸收能量,发生跃迁,从而发出光,与电子跃迁有关,不符
合题意。
从太阳光谱中发现氦是因为氦原子中的电子吸收能量,电子发生跃迁形成激发态,
激发态氦原子上的电子又跃迁回低能级释放能量,形成特殊颜色的光,与电子跃迁有关,
不符合题意。
3.(2024上海杨浦高级中学摸底考)下列有关原子轨道和核外电子排布的说法正确的是
( )
C
A.原子核外的电子像云雾一样笼罩在原子核周围,故称电子云
B.“ ”没有给出的信息是电子云在空间的伸展方向
C.原子轨道是一种描述核外电子运动状态的复杂函数
D.基态的核外电子排布式 违背的是泡利不相容原理
【解析】 电子云是电子在核外空间出现的概率密度分布图。
是指层轨道的 轴伸展方向。
原子轨道在量子力学中是用波函数表示的。
违背了能量最低原理,正确的电子排布式是 。
4.(2024河北石家庄一中月考)下列电子排布式中,表示激发态原子的是( )
C
A. B.
C. D.
【解析】 为9号元素 的基态原子电子排布式。
为20号元素 的基态原子电子排布式。
题给电子排布式表示的元素为,的基态原子电子排布式为 ,
为的轨道上的1个电子跃迁到轨道,表示 的激发态原子的电子排布
式。
为24号元素 的基态原子电子排布式。
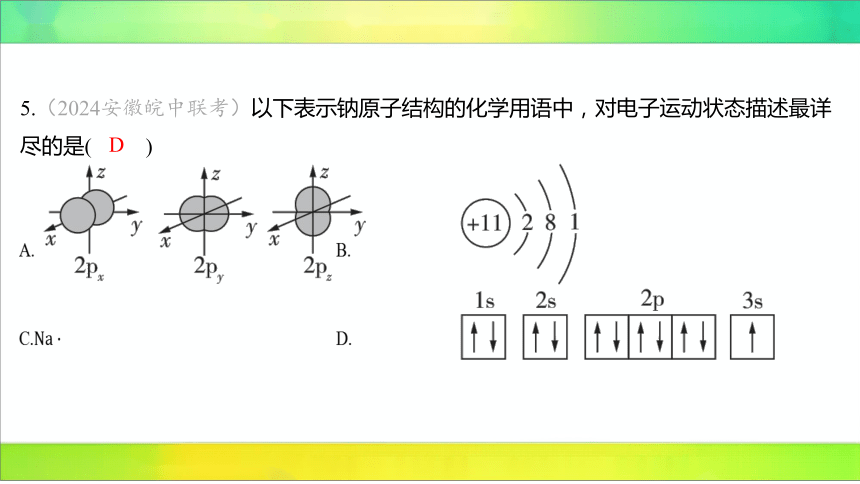
5.(2024安徽皖中联考)以下表示钠原子结构的化学用语中,对电子运动状态描述最详
尽的是( )
D
A. B.
C. D.
【解析】 题图只能表示原子核外 轨道的电子云轮廓图,不能表示其他轨道的电
子云轮廓图,不符合题意。
原子结构示意图只表示核外电子的分层排布情况,不能表示电子的运动状态,不
符合题意。
电子式只能表示最外层电子数,不符合题意。
原子的轨道表示式包含了电子层、轨道及轨道内电子的自旋状态,对电子运动状
态描述最详尽,符合题意。
6.(2024湖北黄冈检测)下列元素性质的递变规律正确的是( )
C
A.原子半径:
B.第一电离能:
C.元素的电负性:
D.上述三个选项所涉及的元素全部位于 区
【解析】 、B、C、位于同一周期,且、B、C、 的原子序数
逐渐增大,根据核电荷数越小,原子半径越大,故原子半径 。
同周期,第一电离能按13246570依次增大,故第一电离能, ,同主
族,从上到下,第一电离能依次减小,则第一电离能 。
根据同周期(只针对主族元素) 一般从左到右,元素的电负性递增可知,电负性
,;同主族:一般自上而下,元素电负性递减可知,电负性 。则元素
的电负性 。
基态原子的价电子排布式为,基态原子的价电子排布式为,基态 原
子的价电子排布式为,电子最后填入的轨道均为轨道,故、、均位于 区;
同理,可判断B、C、、、、最后填入的轨道均为轨道,故这六种元素均位于 区。
7.(2024江苏苏州期末)下列各基态离子的电子排布式书写错误的是 ( )
C
A. B. C. D.
【解析】
A (√) 的原子序数为11 按核外电子排布式的书写规则写出基态 原子的核
外电子排布式:
是失去 轨道的1 个电子所得到的 的核外电子排布式为
B (√) 的原子序数为9 按核外电子排布式的书写规则写出基态 原子的核外
电子排布式:
是的 轨道得到1个 电子形成的 的核外电子排布式为
C ( ) 的原子序数为7 按核外电子排布式的书写规则写出基态 原子的核外
电子排布式:
C ( ) 是基态 原子失去3个 电子形成的 的核外电子排布式为
D (√) 的原子序数为8 按核外电子排布式的书写规则写出基态 原子的核外
电子排布式:
是的 轨道得到2 个电子形成的 的核外电子排布式为
8.(2024四川成都期末)下列关于元素周期表和周期律的叙述正确的是( )
A
A.卤族元素从上到下电负性依次减小
B.最外层1个电子的元素只能位于 区
C.0族元素的价电子排布均为
D.“对角线规则”指某些主族元素与左下方元素性质相似
【解析】 一般同主族,从上到下,元素电负性递减,则卤族元素从上
到下电负性依次减小。
第ⅠA族元素基态原子的最外层均只有1个电子,位于区;副族元素如基态 原子
核外电子排布为,最外层也只有1个电子,位于区;基态 原子核外电子排
布为,最外层也只有1个电子,位于 区。
族元素基态原子的价电子排布式除价电子排布为外,其余均为 。
“对角线规则”指某些主族元素与右下方元素性质相似,多位于金属元素与非金属元
素交界处。
9.(2024福建厦门阶段练习)用于检测室内空气中甲醛含量的一种常见试剂 的结
构如图所示。下列关于该材料组成元素的说法正确的是( )
D
A.电负性:
B.四种元素均位于 区
C.基态C原子的轨道表示式为
D.基态 原子核外电子有16种运动状态
【解析】 根据元素在周期表中的位置判断,越靠近 的电
负性越大,则电负性 。
元素位于区,C、、位于 区。
基态C原子的电子排布式为 ,其轨道表示式
基态原子核外有16个电子,根据等式2电子运动状态数 原子核外电
子数目,则基态 原子核外电子有16种运动状态。
为 。(【速解】题给轨道表示式中 轨道的三个轨道中两个电子
自旋状态相反,不符合洪特规则,直接排除)
10.(2024吉林白山期末)下列说法中,正确的个数是( )
①从空间的角度看,轨道比轨道大,其空间包含了
、、 轨道的轨道数依次增多
区全部是金属元素
④电负性的大小可以用作判断元素非金属性强弱的依据
⑤第一电离能的大小可以作为判断金属性强弱的依据
⑥共价化合物中,电负性大的成键元素表现为负价
⑦电负性越大,元素的非金属性越强,第一电离能也越大
⑧第4周期元素中,未成对电子数最多的元素位于钾元素后面第五位
⑨电负性大于1.8的一定为非金属元素,小于1.8的一定为金属元素
A
A.3 B.4 C.5 D.6
【解析】 ①轨道和 轨道属于不同的亚层,没有包含关系。
②、、均属于 能级,轨道数相同,都为3。
③区包含第ⅠA族和第ⅡA族元素,由于第ⅠA族有,所以 区不全是金属元素。
④ 元素电负性越大,原子对键合电子吸引力越大,则元素非金属性越强,电负性的
大小可以用作判断元素非金属性强弱的依据。
⑤ 第一电离能是气态基态电中性原子失去一个电子形成气态基态正离子时所吸收的
最低能量,金属性是金属原子失去电子的能力,二者是不同的概念,所以第一电离能的
大小不能作为判断元素金属性强弱的依据。
⑥ 电负性表示元素原子在分子中对成键电子的吸引能力,在共价化合物中,元素电
负性大的表现为负价。
元素电负性越大,原子对键合电子吸引力越大,则元素非金属性越强,一般同一
周期电负性从左到右依次增大;同一周期第一电离能从左到右呈增大趋势,但有两特例:
第ⅡA族、第ⅤA族,这两主族元素的第一电离能大于其相邻元素,故第一电离能与电负
性的变化并不完全相同。
⑧第4周期元素中,未成对电子数最多的元素的基态原子中价电子排布式为 ,
为元素,位于第4周期第族,、 元素之间有第ⅡA族、第ⅢB族、第ⅣB族、第
ⅤB族,所以位于 后面的第五位。
⑨ 电负性大于1.8的不一定是非金属,如铅元素为金属,电负性是1.9。
二、选择题(本题包括5小题,每小题有1个或2个选项符合题意)
11.(2024江西赣州期末)王翰《凉州词》中写道“葡萄美酒夜光杯,欲饮琵琶马上催。”
夜光杯的主要成分为 ,下列说法正确的是( )
C
A.基态 原子价电子的轨道表示式:
B.属于第3周期 区元素,其基态原子核外电子的空间运动状态有12种
C.由于硅处于金属与非金属的过渡位置,故硅可用作半导体材料
D.基态氧原子的电子由轨道跃迁至 轨道时,可通过光谱仪摄取其发射光谱
【解析】 题给轨道表示式违反洪特规则,基态原子的价电子排布式为 ,
正确的轨道表示式为 。
的原子序数为12,其基态原子的核外电子排布式为 ,
最后一个电子填充在轨道上,故属于第3周期 区元素。根据等式1空间运动状态数
电子占据的原子轨道数目可知,镁原子有12个电子,占据6个轨道,故 原子核外电
子的空间运动状态有6种。
因为硅在元素周期表中位于金属与非金属交界处,故可用作半导体材料。
通过光谱仪可摄取各种元素的吸收光谱或发射光谱,电子由能量低的 轨道跃迁
至能量高的 轨道,电子需要吸收能量,形成吸收光谱。
12. (2024福建宁德阶段练习)金属 溶解于液氨中形成氨合钠离子和氨合电子,
向该溶液中加入穴醚类配体,得到首个含碱金属阴离子的金黄色化合物 。
下列说法错误的是( )
BC
A.的半径比的大 B.的还原性比 的强
C.第一电离能: D.该事实说明 也可表现出非金属性
【解析】 核外有3个电子层, 核外有2个电子层,根据一看层:一般情况下,
层多径大可知,离子半径 。
比更容易失去电子,即还原性 。
同周期,第一电离能按13246570依次增大,故第一电离能
。
能得到电子形成 ,体现了非金属性。
13.(2024山东枣庄期末)2022年诺贝尔化学奖授予美国学者卡罗琳·贝尔托齐,丹麦学
者莫滕·梅尔达尔,美国学者卡尔·巴里·沙普利斯,以表彰他们对“点击化学和生物正交
化学的发展”的贡献。点击化学的代表反应为铜催化的叠氮-炔基环加成反应, 、
、 等均是点击化学中常用无机试剂。下列说法错误的是( )
AD
A.基态原子的最高电子层符号为
B.若将基态C原子的电子排布式写成 ,则违反了能量最低原理
C. 中含有离子键和非极性共价键
D.电负性:
【解析】 基态原子核外电子排布式为 ,
最高电子层为4,符号为 。
题给电子排布式违反能量最低原理:看到前面轨道未填满,就填入后面的轨道,
可直接判断该基态原子电子排布式书写错误,正确的电子排布式为 。
是离子化合物,和之间形成离子键,中与 之间形成非极性共价
键。
根据“富阳单绿秀,留电谭林清”可直接判断电负性: 。
14.(2024河北定州二中开学考)扑热息痛又叫对乙酰氨基酚
(结构如图所示),是重要的解热镇痛药,下列说法正确的
是( )
A
A.第一电离能:
B.基态碳原子的简化电子排布式为
C.对乙酰氨基酚结构中所有原子均满足8电子稳定结构
D.某同学将基态氧原子的轨道表示式表示为 ,其违背了泡利
不相容原理
【解析】 同周期,第一电离能按13246570依次增大,故第一电离能:
。
基态碳原子的简化电子排布式为 。
对乙酰氨基酚结构中 是2电子稳定结构,不满足8电子稳定结构。
对于 能级的3个简并轨道,电子优先单独分占1个轨道,故轨道表示式
违背了洪特规则。
15.(2024广东二模) 是一种分析试剂,所含的5种元素在前四周期均有分布,
基态的轨道半充满,基态原子价电子排布式为,和位于同一主族,
原子比 原子少1个电子。下列说法错误的是( )
A
A.第一电离能: B.简单离子半径:
C.的单质能与发生置换反应 D.简单氢化物的热稳定性:
【解析】 基态的轨道半充满,则基态 原子的核外电子排布为
(【点拨】区元素原子失去电子时先失去最外层 轨道上的电
子,再失去次外层轨道上的电子,原子失去3个电子后,轨道半充满,则先失去
轨道上的2个电子后再失去轨道上的1个电子,据此可写出 原子的核外电子排布),
为,基态原子价电子排布式为,当时,价电子排布式为,
为;当时,价电子排布式为,为。根据元素可与元素形成 结构
且和位于同一主族,推出为,则为;原子比原子少一个电子,则为 ;根
据五种元素在前四周期均有分布,则为第1周期的 。
“两特例” 同周期,第一电离能:第ⅡA族 第ⅢA族、第ⅤA族 第 族,则第
一电离能;同主族,第一电离能随原子序数递增而减小,则第一电离能 ,故
第一电离能 。
同主族,原子序数越大,离子半径越大,则 ;核外电子排布相同
时,核小径大,则。核外有3个电子层, 核外有2个电子层,不
同电子层时,根据一看层:一般情况下,层多径大,则离子半径 ,故
半径由大到小的顺序为 。
铁在高温条件下可与水蒸气反应生成四氧化三铁和氢气,属于置换反应。
非金属性,简单氢化物的热稳定性 。
三、非选择题(本题包括5小题)
16.(2024安徽合肥期末)原子是肉眼和一般仪器都看不到的微粒,科学家们根据可观
察、可测量的宏观实验事实,经过分析和推理,揭示了原子结构的奥秘。
(1) 下列说法中,正确的个数是___(填标号)。
①同一原子中,电子的能量总是低于 电子的能量
②任何 轨道形状均是球形,只是电子层不同、球的半径大小不同
、、 轨道的轨道数依次增多
④原子核外电子排布,先排满层再排层,排满层再排 层
⑤基态碳原子的轨道表示式:
⑥第ⅢB族到第ⅡB族的10个纵列的元素都是金属元素
⑦用电子式表示 的形成过程:
⑧基态钒原子的结构示意图为
A.2 B.3 C.4 D.5
√
【解析】 ①同一原子中,同一电子层的电子的能量低于 电子的能量,
但不同电子层的电子能量可能高于电子的能量,如轨道上电子的能量高于 轨道上
电子的能量。②电子云轮廓图都是球形,电子层数越大,球的半径越大。③ 每
个电子层的能级都有3个轨道。④根据能量级别电子层数轨道种类数可知,
的能量级别为,的能量级别为, 轨道的能量较低,对于第4周期的
部分元素来说,没有排满层就排了层。⑤ 基态碳原子的核外电子排布式为
,根据洪特规则, 轨道上的两个电子应排布在不同的轨道且自旋方向相同。
⑥ ⅢB族到ⅡB族的10个纵列的元素为过渡元素,过渡元素都是金属元素。⑦
形成过程中镁原子失去电子,氯原子得到电子。⑧ 基态钒原子的核外电子
排布式为 ,其原子结构示意图为 。
(2) 研究发现,正离子的颜色与未成对电子数有关,例如:、、 等。
呈无色,其原因是______________________________________________(从微粒结
构的角度进行描述)。
的核外电子排布式为,没有未成对电子
【解析】 的核外电子排布式为,没有未成对电子,故 无色。
(3) 钠在火焰上灼烧产生的黄光是一种原子______(填“发射”或“吸收”)光谱。
发射
【解析】 钠在火焰上灼烧时,原子中的电子吸收了能量,但处于能量较高轨道上的电
子是不稳定的,此时就将多余的能量以黄色光的形式放出。
17.(2024山东新泰中学月考)有、、、、 五种常见短
周期元素,其原子半径随着原子序数递增的变化如图所示。
已知:①基态原子 轨道的成对电子数与未成对电子数相等;
的简单离子带一个单位正电荷,其电子排布与 的简单离子
相同;
的最高价氧化物十分坚硬,能溶于烧碱溶液,但不溶于盐
酸;
的单质常温下是一种黄绿色气体,且、的最高价氧化物对应的水化物与 的氢化
物水溶液能两两发生反应。
回答下列问题:
(1) 基态 原子的核外电子排布式为_________________;
、、、 的简单离子半径由小到大的顺序为_____________
____________(用离子符号表示)。
【解析】 是,原子序数为13,根据构造原理可知,基态
原子核外电子排布式是。是,是, 是
,是,它们形成的简单离子、、 的核外电子
层结构相同,电子层数为2,离子的核电荷数越大,离子半径就越小; 核外电子层数
为3,离子核外电子层数越多,离子半径就越大,所以离子半径大小关系为
。
(2) 、按原子个数比 形成的化合物的电子式为
_ _______________,含有的化学键类型为________________。
离子键、共价键
【解析】 是,是,二者按原子个数比 形成的化合物
是离子化合物,2个与1个 通过离子键结合,在阴
离子中2个原子之间以共价键结合,故 的电子式为
。
(3) 某元素的电负性与第一电离能都大于 元素,则该元素
为___,其单质在加热条件下与等物质的量的烧碱完全反应,
生成钠盐、 和一种气体。反应的化学方程式为__________
___________________________。
【解析】 一般情况下元素的非金属性越强,其电负性就越大,
第一电离能也越大(第ⅡA、ⅤA族除外)。是 ,某元素的电
负性与第一电离能都大于,则该元素是,在加热条件下与 按等物质的量反应
产生、及一种气体物质,根据原子守恒,可知该气体是 ,该反应的化学方
程式为 。
(4) B的第一电离能,判断 ___
(填“ ”或“ ”) ,从电子排布的角度说明判
断理由:______________________________________________
______________________________________________________
_________________________________________。
B和的基态原子电子排布式分别为和,因为的轨道的能量高于轨道的能量,处于轨道的电子更容易失去,故
【解析】 B和的基态原子电子排布式分别为和,因为 的
轨道的能量高于轨道的能量,处于轨道的电子更容易失去,故 。
【解析】 结合题图关系,基态原子 轨道的成
对电子数与未成对电子数相等,可知基态 原子核外电子排布
式为,是。 的简单离子带一个单位正电荷,其
电子排布与的简单离子相同,则是。 的最高价氧化物
十分坚硬,能溶于烧碱溶液,但不溶于盐酸,是。 的单
质常温下是一种黄绿色气体,则是,且、 的最高价氧化
物对应的水化物与的氢化物水溶液能两两发生反应, 的最高价氧化物对应的水
化物为,可知的最高价氧化物对应的水化物具有两性,则是 。
18.(2024北京九中开学考)如表为元素周期表的一部分,请参照元素①~⑩在表中的位
置,回答下列问题:
(1) ①、②、③、④的电负性由大到小的顺序是_______________(用元素符号表示)。
【解析】 C、、属于同周期元素,从左到右,元素的电负性依次增大,而 中C显
负价,即C吸引电子的能力比强,C的电负性比 大,则电负性由大到小的顺序是
。
(2) 量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道,基态③原子
的电子有___种空间运动状态。
5
【解析】 基态原子的核外电子排布式为,、、 能级的原子轨道数分
别为1、1、3,根据等式1空间运动状态数电子占据的原子轨道数目,则基态 原子的
电子有 种空间运动状态。
(3) ④、⑤、⑥的原子半径由大到小的顺序为____________(用元素符号表示)。
【解析】 位于第2周期,、位于第3周期,根据层多径大可知, 的原子半径最小,
同周期主族元素从左到右,原子半径依次减小,则 的原子半径最大,故原子半径由
大到小的顺序为 。
(4) ②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_______________________
(用化学式表示)。
【解析】 非金属性: ,则最高价含氧酸的酸性由强到弱的顺序是
。
(5) ①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出
其中一种化合物的电子式:_ __________________________。
(或 )
【解析】 ①是、④是、⑤是、⑧是 ,形成的既含离子键又含极性共价键的化合
物有和, 的电子式为
, 的电子式为 。
(6) 第一电离能 ,原因是__________________________
____________________________________________________________________________
___________________。
、、位于同一主族,价电子数相同,自上而下,原子半径逐渐增大,原子核对外层电子的吸引作用逐渐减弱,第一电离能逐渐减小
【解析】 、、 位于同一主族,价电子数相同,自上而下,原子半径逐渐增大,
原子核对外层电子的吸引作用逐渐减弱,第一电离能逐渐减小,则第一电离能:
。
(7) 基态⑧原子占据的最高轨道的电子云轮廓图的形状是______形;基态⑨原子的价
电子轨道表示式为_ _______________________;元素⑩属于___区(填“”“”“ ”或“
”)。
哑铃
【解析】 基态原子的电子排布式为 ,则其电子占据的最高轨道为
,轨道电子云轮廓图的形状是哑铃形。⑨是,基态 原子的价电子排布式为
,其轨道表示式为 。⑩是,基态 原子的价电子排
布式为,位于 区。
【解析】
根据各元素在元素周期表中位置可知,①是、②是C、③是、④是、⑤是 、⑥是
、⑦是、⑧是、⑨是、⑩是 。
19.Ⅰ.(2024山东省实验中学月考)磷酸亚铁锂和锰酸锂 均可用作锂
离子电池正极材料。回答下列问题:
(1) 在元素周期表中,与 化学性质最相似的邻族元素是____(填元素符号),写出
基态原子的价电子轨道表示式:_ ________________。基态 原子电子占据的最高轨道
的电子云轮廓图形状为________。
哑铃形
【解析】 根据对角线规则,相邻主族元素之间,左上与右下相邻周期的两种元素化学
性质相似,所以与元素化学性质最相似的邻族元素应是第3周期第ⅡA族的元素。
的原子序数为8,核外电子排布式为,价电子排布式为 ,价电子的轨道
表示式为 。的原子序数为15,核外电子排布式为 ,
电子占据的最高轨道是 轨道,其电子云轮廓图形状为哑铃形。
(2) 原子核外电子有两种相反的自旋状态,分别用和 表示,称为电子的自旋磁
量子数。基态 原子的价电子自旋磁量子数的代数和为___________。
或
【解析】 的原子序数为25,位于第4周期族,其价电子排布式为 ,只有
轨道的五个轨道中分别含有1个单电子,电子自旋方向相同,所以价电子自旋磁量子
数代数和应为或 。
(3) 的第一电离能与同周期相邻元素相比由大到小的关系为__________(用元素符
号和“ ”表示),原因是_____________________________________________________
_______________________________________________________________________。
同周期从左到右,元素的第一电离能整体呈增大趋势;的轨道处于半充满状态,比较稳定,较难失去电子,第一电离能比相邻元素的高
【解析】 同周期元素,从左到右,第一电离能整体呈增大趋势,而基态 原子的电子排
布式是,轨道处于半充满状态,比较稳定,较难失去电子,所以 的第一
电离能比其同周期相邻元素的大,第一电离能大小顺序是 。
(4) 在元素周期表中的位置是_______________,位于周期表的___区,基态
的价电子排布式为_____。
已知:, 。第三电离能
,其主要原因是________________________________________________
____________________________________________________________________________
_______________________。
第4周期第族
的价电子排布是,为半充满稳定状态,较难再失电子,而失去上的一个电子,变为,轨道半充满时稳定性增强,故第三电离能
②与 元素同周期,基态原子有2个未成对电子的金属元素有___种,下列状态的铁中,
电离最外层一个电子所需能量最大的是__(填标号)。
3
【解析】 是26号元素,在元素周期表中的位置为第4周期第族,第 族元素均处
于元素周期表的区;基态原子的价电子排布式为,则基态 的价电子排布
式为。的价电子排布式为, 轨道处于半充满状态,较难失去电子,而
的价电子排布式为, 轨道再失去1个电子后处于半充满稳定状态,故相比于
,再失去1个电子相对来说较容易。②与 元素同周期,基态原子有2个未成
对电子的元素有、、、种,但金属元素只有、、种。 表示的是基态
原子,表示的是基态,表示的是基态,表示的是激发态原子, 的
电子排布式为, 轨道处于半充满稳定状态,不易失去电子,电离能较大,失
去最外层一个电子所需电离能最大的是 。
Ⅱ.(2024山东青岛期末)
(1) 随着科技的不断发展,人类对质量的要求也越来越高,各种新型材料、新型电池
等层出不穷。
①镍铬钢抗腐蚀性能强,基态铬原子的价电子排布式为________,镍元素在周期表中位
于___区。
②“玉兔二号”月球车通过砷化镓 太阳能电池提供能量进行工作。基态砷原子的电
子占据最高能级的电子云轮廓图为______形。砷的电负性比镓____(填“大”或“小”)。
哑铃
大
【解析】 ①铬的原子序数为24,基态铬原子价层电子排布式为 ;基
态原子的价层电子排布式为,轨道未排满,属于区。②基态 原子核外电
子排布式为,最高能级为,电子云轮廓图为哑铃形。和 属于同一
周期,同周期元素从左到右,元素的电负性依次增大,则电负性: 。
(2) 下表列出了第三周期几种元素的部分性质。
元素编号
电负性 3.0 2.5 1.4 0.9
主要化合价 , , ,
①预测 值的区间:________。
②第三周期中含3个未成对电子的元素,其基态原子最外层电子的轨道表示式为
_ ___________________________________________。
③表中五种元素的第一电离能由大到小的顺序是____________________(写元素符号)。
【解析】 ①根据题表中主要化合价可知,为,为,为,为,为 。根据同
周期元素,从左到右元素电负性逐渐增大,则的电负性大于,小于, 的取值范围
为。②第3周期中含3个未成对电子的元素,为元素,基态 原子核外电子的轨
道表示式为
。③同周期元素的第一电离能按13246570
依次增大,则第一电离能由大到小的顺序为 。
20.(2024山东临沂二中月考)、、、、 是原子序数依次增大的前四周期元素,
其元素性质或结构如下:
元素 元素性质或原子结构
电子只有一种自旋取向
核外只有一个未成对电子,且电子有三种空间运动状态
轨道电子数比 轨道多一个,且第一电离能大于同周期相邻元素
电负性是短周期中最小的
价基态离子能量最高的轨道处于半充满状态
回答下列问题:
(1) 写出元素的名称:____; 元素的元素符号:___。
硼
【解析】 由以上分析可知为B,名称为硼;元素为氮,元素符号为 。
(2) 写出元素基态 价离子的价电子排布式:_____。
【解析】 元素为铁元素,其基态原子的价电子排布式为,故其 价离子的价
电子排布式为 。
(3) 基态 元素原子核外电子占据的最高电子层包含的原子轨道数为___。
9
【解析】 钠的最高电子层为3,该电子层含有、、 三种轨道,分别含有1、3、5
个原子轨道,共9个原子轨道。
(4) 、、可形成强还原性物质,、、 三种元素电负性由大到小的顺序
是____________(用元素符号表示)。
【解析】 钠为活泼金属,其电负性最小,在该化合物中为价,电负性 ,则三
种元素的电负性: 。
(5) 中国的稀土储量世界第一。稀土元素是周期表ⅢB族中原子序数为、
的元素和镧系元素共17种化学元素的统称。其中钪 元素有____种运动状态不同的电
子,最高电子层符号是___;稀土元素分组方法之一是两分法(轻稀土和重稀土)。两
分法分组以(钆)划界的原因是从之后在 亚层上新增加电子的自旋方向改变
了。的价电子排布式为,则其 轨道电子轨道表示式为
_ ___________________________。
21
【解析】 钪有21个电子,根据等式2电子运动状态数 原子核外电子数
目,故有21种运动状态不同的电子,最高电子层是第四层,其符号是。基态 原子
的核外电子排布式为, 轨道电子轨道表示式
为 。
【解析】 、、、、是原子序数依次增大的前四周期元素。 元素
原子中的电子只有一种自旋取向,可知只有1个电子,为; 核外电子有3种空间运
动状态,且只有1个未成对电子,则其核外电子排布式为,为B; 的电负性
是短周期中最小的,为;的轨道电子数比 轨道多一个,第一电离能大于同周期
相邻元素,且的原子序数大于B,小于,则为;的 价基态离子能量最高的轨
道处于半充满状态,则为 。
第1章 原子结构与元素性质
2025年高考化学一轮复习
选择性必修第二册鲁科版
第一章小结复习
一、选择题(本题包括10小题,每小题只有1个选项符合题意)
1.(2024河南郑州月考)下列轨道中,原子轨道数最多的是 ( )
D
A. B. C. D.
【解析】 原子轨道数与能级有关,与电子层数无关,能级只有1个原子轨道, 能级有
3个原子轨道,能级有5个原子轨道, 能级有7个原子轨道。
2.(2024山东烟台期末)电子跃迁伴随着能量的释放或吸收,下列与电子跃迁无关的是
( )
B
A.成都大运会燃放的焰火 B.铜丝可以导电
C.装饰建筑夜景的 灯光 D.从太阳光谱中发现氦
【解析】 燃放的焰火是金属的焰色试验的体现,焰色试验是因为金属离子吸收能
量,电子发生跃迁,形成激发态离子,激发态离子上的电子又跃迁回低能级,从而形成
不同颜色的光,与电子跃迁有关,不符合题意。
铜丝可以导电是因为自由电子的定向移动,与电子跃迁无关,符合题意。
灯发光是因为电子吸收能量,发生跃迁,从而发出光,与电子跃迁有关,不符
合题意。
从太阳光谱中发现氦是因为氦原子中的电子吸收能量,电子发生跃迁形成激发态,
激发态氦原子上的电子又跃迁回低能级释放能量,形成特殊颜色的光,与电子跃迁有关,
不符合题意。
3.(2024上海杨浦高级中学摸底考)下列有关原子轨道和核外电子排布的说法正确的是
( )
C
A.原子核外的电子像云雾一样笼罩在原子核周围,故称电子云
B.“ ”没有给出的信息是电子云在空间的伸展方向
C.原子轨道是一种描述核外电子运动状态的复杂函数
D.基态的核外电子排布式 违背的是泡利不相容原理
【解析】 电子云是电子在核外空间出现的概率密度分布图。
是指层轨道的 轴伸展方向。
原子轨道在量子力学中是用波函数表示的。
违背了能量最低原理,正确的电子排布式是 。
4.(2024河北石家庄一中月考)下列电子排布式中,表示激发态原子的是( )
C
A. B.
C. D.
【解析】 为9号元素 的基态原子电子排布式。
为20号元素 的基态原子电子排布式。
题给电子排布式表示的元素为,的基态原子电子排布式为 ,
为的轨道上的1个电子跃迁到轨道,表示 的激发态原子的电子排布
式。
为24号元素 的基态原子电子排布式。
5.(2024安徽皖中联考)以下表示钠原子结构的化学用语中,对电子运动状态描述最详
尽的是( )
D
A. B.
C. D.
【解析】 题图只能表示原子核外 轨道的电子云轮廓图,不能表示其他轨道的电
子云轮廓图,不符合题意。
原子结构示意图只表示核外电子的分层排布情况,不能表示电子的运动状态,不
符合题意。
电子式只能表示最外层电子数,不符合题意。
原子的轨道表示式包含了电子层、轨道及轨道内电子的自旋状态,对电子运动状
态描述最详尽,符合题意。
6.(2024湖北黄冈检测)下列元素性质的递变规律正确的是( )
C
A.原子半径:
B.第一电离能:
C.元素的电负性:
D.上述三个选项所涉及的元素全部位于 区
【解析】 、B、C、位于同一周期,且、B、C、 的原子序数
逐渐增大,根据核电荷数越小,原子半径越大,故原子半径 。
同周期,第一电离能按13246570依次增大,故第一电离能, ,同主
族,从上到下,第一电离能依次减小,则第一电离能 。
根据同周期(只针对主族元素) 一般从左到右,元素的电负性递增可知,电负性
,;同主族:一般自上而下,元素电负性递减可知,电负性 。则元素
的电负性 。
基态原子的价电子排布式为,基态原子的价电子排布式为,基态 原
子的价电子排布式为,电子最后填入的轨道均为轨道,故、、均位于 区;
同理,可判断B、C、、、、最后填入的轨道均为轨道,故这六种元素均位于 区。
7.(2024江苏苏州期末)下列各基态离子的电子排布式书写错误的是 ( )
C
A. B. C. D.
【解析】
A (√) 的原子序数为11 按核外电子排布式的书写规则写出基态 原子的核
外电子排布式:
是失去 轨道的1 个电子所得到的 的核外电子排布式为
B (√) 的原子序数为9 按核外电子排布式的书写规则写出基态 原子的核外
电子排布式:
是的 轨道得到1个 电子形成的 的核外电子排布式为
C ( ) 的原子序数为7 按核外电子排布式的书写规则写出基态 原子的核外
电子排布式:
C ( ) 是基态 原子失去3个 电子形成的 的核外电子排布式为
D (√) 的原子序数为8 按核外电子排布式的书写规则写出基态 原子的核外
电子排布式:
是的 轨道得到2 个电子形成的 的核外电子排布式为
8.(2024四川成都期末)下列关于元素周期表和周期律的叙述正确的是( )
A
A.卤族元素从上到下电负性依次减小
B.最外层1个电子的元素只能位于 区
C.0族元素的价电子排布均为
D.“对角线规则”指某些主族元素与左下方元素性质相似
【解析】 一般同主族,从上到下,元素电负性递减,则卤族元素从上
到下电负性依次减小。
第ⅠA族元素基态原子的最外层均只有1个电子,位于区;副族元素如基态 原子
核外电子排布为,最外层也只有1个电子,位于区;基态 原子核外电子排
布为,最外层也只有1个电子,位于 区。
族元素基态原子的价电子排布式除价电子排布为外,其余均为 。
“对角线规则”指某些主族元素与右下方元素性质相似,多位于金属元素与非金属元
素交界处。
9.(2024福建厦门阶段练习)用于检测室内空气中甲醛含量的一种常见试剂 的结
构如图所示。下列关于该材料组成元素的说法正确的是( )
D
A.电负性:
B.四种元素均位于 区
C.基态C原子的轨道表示式为
D.基态 原子核外电子有16种运动状态
【解析】 根据元素在周期表中的位置判断,越靠近 的电
负性越大,则电负性 。
元素位于区,C、、位于 区。
基态C原子的电子排布式为 ,其轨道表示式
基态原子核外有16个电子,根据等式2电子运动状态数 原子核外电
子数目,则基态 原子核外电子有16种运动状态。
为 。(【速解】题给轨道表示式中 轨道的三个轨道中两个电子
自旋状态相反,不符合洪特规则,直接排除)
10.(2024吉林白山期末)下列说法中,正确的个数是( )
①从空间的角度看,轨道比轨道大,其空间包含了
、、 轨道的轨道数依次增多
区全部是金属元素
④电负性的大小可以用作判断元素非金属性强弱的依据
⑤第一电离能的大小可以作为判断金属性强弱的依据
⑥共价化合物中,电负性大的成键元素表现为负价
⑦电负性越大,元素的非金属性越强,第一电离能也越大
⑧第4周期元素中,未成对电子数最多的元素位于钾元素后面第五位
⑨电负性大于1.8的一定为非金属元素,小于1.8的一定为金属元素
A
A.3 B.4 C.5 D.6
【解析】 ①轨道和 轨道属于不同的亚层,没有包含关系。
②、、均属于 能级,轨道数相同,都为3。
③区包含第ⅠA族和第ⅡA族元素,由于第ⅠA族有,所以 区不全是金属元素。
④ 元素电负性越大,原子对键合电子吸引力越大,则元素非金属性越强,电负性的
大小可以用作判断元素非金属性强弱的依据。
⑤ 第一电离能是气态基态电中性原子失去一个电子形成气态基态正离子时所吸收的
最低能量,金属性是金属原子失去电子的能力,二者是不同的概念,所以第一电离能的
大小不能作为判断元素金属性强弱的依据。
⑥ 电负性表示元素原子在分子中对成键电子的吸引能力,在共价化合物中,元素电
负性大的表现为负价。
元素电负性越大,原子对键合电子吸引力越大,则元素非金属性越强,一般同一
周期电负性从左到右依次增大;同一周期第一电离能从左到右呈增大趋势,但有两特例:
第ⅡA族、第ⅤA族,这两主族元素的第一电离能大于其相邻元素,故第一电离能与电负
性的变化并不完全相同。
⑧第4周期元素中,未成对电子数最多的元素的基态原子中价电子排布式为 ,
为元素,位于第4周期第族,、 元素之间有第ⅡA族、第ⅢB族、第ⅣB族、第
ⅤB族,所以位于 后面的第五位。
⑨ 电负性大于1.8的不一定是非金属,如铅元素为金属,电负性是1.9。
二、选择题(本题包括5小题,每小题有1个或2个选项符合题意)
11.(2024江西赣州期末)王翰《凉州词》中写道“葡萄美酒夜光杯,欲饮琵琶马上催。”
夜光杯的主要成分为 ,下列说法正确的是( )
C
A.基态 原子价电子的轨道表示式:
B.属于第3周期 区元素,其基态原子核外电子的空间运动状态有12种
C.由于硅处于金属与非金属的过渡位置,故硅可用作半导体材料
D.基态氧原子的电子由轨道跃迁至 轨道时,可通过光谱仪摄取其发射光谱
【解析】 题给轨道表示式违反洪特规则,基态原子的价电子排布式为 ,
正确的轨道表示式为 。
的原子序数为12,其基态原子的核外电子排布式为 ,
最后一个电子填充在轨道上,故属于第3周期 区元素。根据等式1空间运动状态数
电子占据的原子轨道数目可知,镁原子有12个电子,占据6个轨道,故 原子核外电
子的空间运动状态有6种。
因为硅在元素周期表中位于金属与非金属交界处,故可用作半导体材料。
通过光谱仪可摄取各种元素的吸收光谱或发射光谱,电子由能量低的 轨道跃迁
至能量高的 轨道,电子需要吸收能量,形成吸收光谱。
12. (2024福建宁德阶段练习)金属 溶解于液氨中形成氨合钠离子和氨合电子,
向该溶液中加入穴醚类配体,得到首个含碱金属阴离子的金黄色化合物 。
下列说法错误的是( )
BC
A.的半径比的大 B.的还原性比 的强
C.第一电离能: D.该事实说明 也可表现出非金属性
【解析】 核外有3个电子层, 核外有2个电子层,根据一看层:一般情况下,
层多径大可知,离子半径 。
比更容易失去电子,即还原性 。
同周期,第一电离能按13246570依次增大,故第一电离能
。
能得到电子形成 ,体现了非金属性。
13.(2024山东枣庄期末)2022年诺贝尔化学奖授予美国学者卡罗琳·贝尔托齐,丹麦学
者莫滕·梅尔达尔,美国学者卡尔·巴里·沙普利斯,以表彰他们对“点击化学和生物正交
化学的发展”的贡献。点击化学的代表反应为铜催化的叠氮-炔基环加成反应, 、
、 等均是点击化学中常用无机试剂。下列说法错误的是( )
AD
A.基态原子的最高电子层符号为
B.若将基态C原子的电子排布式写成 ,则违反了能量最低原理
C. 中含有离子键和非极性共价键
D.电负性:
【解析】 基态原子核外电子排布式为 ,
最高电子层为4,符号为 。
题给电子排布式违反能量最低原理:看到前面轨道未填满,就填入后面的轨道,
可直接判断该基态原子电子排布式书写错误,正确的电子排布式为 。
是离子化合物,和之间形成离子键,中与 之间形成非极性共价
键。
根据“富阳单绿秀,留电谭林清”可直接判断电负性: 。
14.(2024河北定州二中开学考)扑热息痛又叫对乙酰氨基酚
(结构如图所示),是重要的解热镇痛药,下列说法正确的
是( )
A
A.第一电离能:
B.基态碳原子的简化电子排布式为
C.对乙酰氨基酚结构中所有原子均满足8电子稳定结构
D.某同学将基态氧原子的轨道表示式表示为 ,其违背了泡利
不相容原理
【解析】 同周期,第一电离能按13246570依次增大,故第一电离能:
。
基态碳原子的简化电子排布式为 。
对乙酰氨基酚结构中 是2电子稳定结构,不满足8电子稳定结构。
对于 能级的3个简并轨道,电子优先单独分占1个轨道,故轨道表示式
违背了洪特规则。
15.(2024广东二模) 是一种分析试剂,所含的5种元素在前四周期均有分布,
基态的轨道半充满,基态原子价电子排布式为,和位于同一主族,
原子比 原子少1个电子。下列说法错误的是( )
A
A.第一电离能: B.简单离子半径:
C.的单质能与发生置换反应 D.简单氢化物的热稳定性:
【解析】 基态的轨道半充满,则基态 原子的核外电子排布为
(【点拨】区元素原子失去电子时先失去最外层 轨道上的电
子,再失去次外层轨道上的电子,原子失去3个电子后,轨道半充满,则先失去
轨道上的2个电子后再失去轨道上的1个电子,据此可写出 原子的核外电子排布),
为,基态原子价电子排布式为,当时,价电子排布式为,
为;当时,价电子排布式为,为。根据元素可与元素形成 结构
且和位于同一主族,推出为,则为;原子比原子少一个电子,则为 ;根
据五种元素在前四周期均有分布,则为第1周期的 。
“两特例” 同周期,第一电离能:第ⅡA族 第ⅢA族、第ⅤA族 第 族,则第
一电离能;同主族,第一电离能随原子序数递增而减小,则第一电离能 ,故
第一电离能 。
同主族,原子序数越大,离子半径越大,则 ;核外电子排布相同
时,核小径大,则。核外有3个电子层, 核外有2个电子层,不
同电子层时,根据一看层:一般情况下,层多径大,则离子半径 ,故
半径由大到小的顺序为 。
铁在高温条件下可与水蒸气反应生成四氧化三铁和氢气,属于置换反应。
非金属性,简单氢化物的热稳定性 。
三、非选择题(本题包括5小题)
16.(2024安徽合肥期末)原子是肉眼和一般仪器都看不到的微粒,科学家们根据可观
察、可测量的宏观实验事实,经过分析和推理,揭示了原子结构的奥秘。
(1) 下列说法中,正确的个数是___(填标号)。
①同一原子中,电子的能量总是低于 电子的能量
②任何 轨道形状均是球形,只是电子层不同、球的半径大小不同
、、 轨道的轨道数依次增多
④原子核外电子排布,先排满层再排层,排满层再排 层
⑤基态碳原子的轨道表示式:
⑥第ⅢB族到第ⅡB族的10个纵列的元素都是金属元素
⑦用电子式表示 的形成过程:
⑧基态钒原子的结构示意图为
A.2 B.3 C.4 D.5
√
【解析】 ①同一原子中,同一电子层的电子的能量低于 电子的能量,
但不同电子层的电子能量可能高于电子的能量,如轨道上电子的能量高于 轨道上
电子的能量。②电子云轮廓图都是球形,电子层数越大,球的半径越大。③ 每
个电子层的能级都有3个轨道。④根据能量级别电子层数轨道种类数可知,
的能量级别为,的能量级别为, 轨道的能量较低,对于第4周期的
部分元素来说,没有排满层就排了层。⑤ 基态碳原子的核外电子排布式为
,根据洪特规则, 轨道上的两个电子应排布在不同的轨道且自旋方向相同。
⑥ ⅢB族到ⅡB族的10个纵列的元素为过渡元素,过渡元素都是金属元素。⑦
形成过程中镁原子失去电子,氯原子得到电子。⑧ 基态钒原子的核外电子
排布式为 ,其原子结构示意图为 。
(2) 研究发现,正离子的颜色与未成对电子数有关,例如:、、 等。
呈无色,其原因是______________________________________________(从微粒结
构的角度进行描述)。
的核外电子排布式为,没有未成对电子
【解析】 的核外电子排布式为,没有未成对电子,故 无色。
(3) 钠在火焰上灼烧产生的黄光是一种原子______(填“发射”或“吸收”)光谱。
发射
【解析】 钠在火焰上灼烧时,原子中的电子吸收了能量,但处于能量较高轨道上的电
子是不稳定的,此时就将多余的能量以黄色光的形式放出。
17.(2024山东新泰中学月考)有、、、、 五种常见短
周期元素,其原子半径随着原子序数递增的变化如图所示。
已知:①基态原子 轨道的成对电子数与未成对电子数相等;
的简单离子带一个单位正电荷,其电子排布与 的简单离子
相同;
的最高价氧化物十分坚硬,能溶于烧碱溶液,但不溶于盐
酸;
的单质常温下是一种黄绿色气体,且、的最高价氧化物对应的水化物与 的氢化
物水溶液能两两发生反应。
回答下列问题:
(1) 基态 原子的核外电子排布式为_________________;
、、、 的简单离子半径由小到大的顺序为_____________
____________(用离子符号表示)。
【解析】 是,原子序数为13,根据构造原理可知,基态
原子核外电子排布式是。是,是, 是
,是,它们形成的简单离子、、 的核外电子
层结构相同,电子层数为2,离子的核电荷数越大,离子半径就越小; 核外电子层数
为3,离子核外电子层数越多,离子半径就越大,所以离子半径大小关系为
。
(2) 、按原子个数比 形成的化合物的电子式为
_ _______________,含有的化学键类型为________________。
离子键、共价键
【解析】 是,是,二者按原子个数比 形成的化合物
是离子化合物,2个与1个 通过离子键结合,在阴
离子中2个原子之间以共价键结合,故 的电子式为
。
(3) 某元素的电负性与第一电离能都大于 元素,则该元素
为___,其单质在加热条件下与等物质的量的烧碱完全反应,
生成钠盐、 和一种气体。反应的化学方程式为__________
___________________________。
【解析】 一般情况下元素的非金属性越强,其电负性就越大,
第一电离能也越大(第ⅡA、ⅤA族除外)。是 ,某元素的电
负性与第一电离能都大于,则该元素是,在加热条件下与 按等物质的量反应
产生、及一种气体物质,根据原子守恒,可知该气体是 ,该反应的化学方
程式为 。
(4) B的第一电离能,判断 ___
(填“ ”或“ ”) ,从电子排布的角度说明判
断理由:______________________________________________
______________________________________________________
_________________________________________。
B和的基态原子电子排布式分别为和,因为的轨道的能量高于轨道的能量,处于轨道的电子更容易失去,故
【解析】 B和的基态原子电子排布式分别为和,因为 的
轨道的能量高于轨道的能量,处于轨道的电子更容易失去,故 。
【解析】 结合题图关系,基态原子 轨道的成
对电子数与未成对电子数相等,可知基态 原子核外电子排布
式为,是。 的简单离子带一个单位正电荷,其
电子排布与的简单离子相同,则是。 的最高价氧化物
十分坚硬,能溶于烧碱溶液,但不溶于盐酸,是。 的单
质常温下是一种黄绿色气体,则是,且、 的最高价氧化
物对应的水化物与的氢化物水溶液能两两发生反应, 的最高价氧化物对应的水
化物为,可知的最高价氧化物对应的水化物具有两性,则是 。
18.(2024北京九中开学考)如表为元素周期表的一部分,请参照元素①~⑩在表中的位
置,回答下列问题:
(1) ①、②、③、④的电负性由大到小的顺序是_______________(用元素符号表示)。
【解析】 C、、属于同周期元素,从左到右,元素的电负性依次增大,而 中C显
负价,即C吸引电子的能力比强,C的电负性比 大,则电负性由大到小的顺序是
。
(2) 量子力学把电子在原子核外的一个空间运动状态称为一个原子轨道,基态③原子
的电子有___种空间运动状态。
5
【解析】 基态原子的核外电子排布式为,、、 能级的原子轨道数分
别为1、1、3,根据等式1空间运动状态数电子占据的原子轨道数目,则基态 原子的
电子有 种空间运动状态。
(3) ④、⑤、⑥的原子半径由大到小的顺序为____________(用元素符号表示)。
【解析】 位于第2周期,、位于第3周期,根据层多径大可知, 的原子半径最小,
同周期主族元素从左到右,原子半径依次减小,则 的原子半径最大,故原子半径由
大到小的顺序为 。
(4) ②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是_______________________
(用化学式表示)。
【解析】 非金属性: ,则最高价含氧酸的酸性由强到弱的顺序是
。
(5) ①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出
其中一种化合物的电子式:_ __________________________。
(或 )
【解析】 ①是、④是、⑤是、⑧是 ,形成的既含离子键又含极性共价键的化合
物有和, 的电子式为
, 的电子式为 。
(6) 第一电离能 ,原因是__________________________
____________________________________________________________________________
___________________。
、、位于同一主族,价电子数相同,自上而下,原子半径逐渐增大,原子核对外层电子的吸引作用逐渐减弱,第一电离能逐渐减小
【解析】 、、 位于同一主族,价电子数相同,自上而下,原子半径逐渐增大,
原子核对外层电子的吸引作用逐渐减弱,第一电离能逐渐减小,则第一电离能:
。
(7) 基态⑧原子占据的最高轨道的电子云轮廓图的形状是______形;基态⑨原子的价
电子轨道表示式为_ _______________________;元素⑩属于___区(填“”“”“ ”或“
”)。
哑铃
【解析】 基态原子的电子排布式为 ,则其电子占据的最高轨道为
,轨道电子云轮廓图的形状是哑铃形。⑨是,基态 原子的价电子排布式为
,其轨道表示式为 。⑩是,基态 原子的价电子排
布式为,位于 区。
【解析】
根据各元素在元素周期表中位置可知,①是、②是C、③是、④是、⑤是 、⑥是
、⑦是、⑧是、⑨是、⑩是 。
19.Ⅰ.(2024山东省实验中学月考)磷酸亚铁锂和锰酸锂 均可用作锂
离子电池正极材料。回答下列问题:
(1) 在元素周期表中,与 化学性质最相似的邻族元素是____(填元素符号),写出
基态原子的价电子轨道表示式:_ ________________。基态 原子电子占据的最高轨道
的电子云轮廓图形状为________。
哑铃形
【解析】 根据对角线规则,相邻主族元素之间,左上与右下相邻周期的两种元素化学
性质相似,所以与元素化学性质最相似的邻族元素应是第3周期第ⅡA族的元素。
的原子序数为8,核外电子排布式为,价电子排布式为 ,价电子的轨道
表示式为 。的原子序数为15,核外电子排布式为 ,
电子占据的最高轨道是 轨道,其电子云轮廓图形状为哑铃形。
(2) 原子核外电子有两种相反的自旋状态,分别用和 表示,称为电子的自旋磁
量子数。基态 原子的价电子自旋磁量子数的代数和为___________。
或
【解析】 的原子序数为25,位于第4周期族,其价电子排布式为 ,只有
轨道的五个轨道中分别含有1个单电子,电子自旋方向相同,所以价电子自旋磁量子
数代数和应为或 。
(3) 的第一电离能与同周期相邻元素相比由大到小的关系为__________(用元素符
号和“ ”表示),原因是_____________________________________________________
_______________________________________________________________________。
同周期从左到右,元素的第一电离能整体呈增大趋势;的轨道处于半充满状态,比较稳定,较难失去电子,第一电离能比相邻元素的高
【解析】 同周期元素,从左到右,第一电离能整体呈增大趋势,而基态 原子的电子排
布式是,轨道处于半充满状态,比较稳定,较难失去电子,所以 的第一
电离能比其同周期相邻元素的大,第一电离能大小顺序是 。
(4) 在元素周期表中的位置是_______________,位于周期表的___区,基态
的价电子排布式为_____。
已知:, 。第三电离能
,其主要原因是________________________________________________
____________________________________________________________________________
_______________________。
第4周期第族
的价电子排布是,为半充满稳定状态,较难再失电子,而失去上的一个电子,变为,轨道半充满时稳定性增强,故第三电离能
②与 元素同周期,基态原子有2个未成对电子的金属元素有___种,下列状态的铁中,
电离最外层一个电子所需能量最大的是__(填标号)。
3
【解析】 是26号元素,在元素周期表中的位置为第4周期第族,第 族元素均处
于元素周期表的区;基态原子的价电子排布式为,则基态 的价电子排布
式为。的价电子排布式为, 轨道处于半充满状态,较难失去电子,而
的价电子排布式为, 轨道再失去1个电子后处于半充满稳定状态,故相比于
,再失去1个电子相对来说较容易。②与 元素同周期,基态原子有2个未成
对电子的元素有、、、种,但金属元素只有、、种。 表示的是基态
原子,表示的是基态,表示的是基态,表示的是激发态原子, 的
电子排布式为, 轨道处于半充满稳定状态,不易失去电子,电离能较大,失
去最外层一个电子所需电离能最大的是 。
Ⅱ.(2024山东青岛期末)
(1) 随着科技的不断发展,人类对质量的要求也越来越高,各种新型材料、新型电池
等层出不穷。
①镍铬钢抗腐蚀性能强,基态铬原子的价电子排布式为________,镍元素在周期表中位
于___区。
②“玉兔二号”月球车通过砷化镓 太阳能电池提供能量进行工作。基态砷原子的电
子占据最高能级的电子云轮廓图为______形。砷的电负性比镓____(填“大”或“小”)。
哑铃
大
【解析】 ①铬的原子序数为24,基态铬原子价层电子排布式为 ;基
态原子的价层电子排布式为,轨道未排满,属于区。②基态 原子核外电
子排布式为,最高能级为,电子云轮廓图为哑铃形。和 属于同一
周期,同周期元素从左到右,元素的电负性依次增大,则电负性: 。
(2) 下表列出了第三周期几种元素的部分性质。
元素编号
电负性 3.0 2.5 1.4 0.9
主要化合价 , , ,
①预测 值的区间:________。
②第三周期中含3个未成对电子的元素,其基态原子最外层电子的轨道表示式为
_ ___________________________________________。
③表中五种元素的第一电离能由大到小的顺序是____________________(写元素符号)。
【解析】 ①根据题表中主要化合价可知,为,为,为,为,为 。根据同
周期元素,从左到右元素电负性逐渐增大,则的电负性大于,小于, 的取值范围
为。②第3周期中含3个未成对电子的元素,为元素,基态 原子核外电子的轨
道表示式为
。③同周期元素的第一电离能按13246570
依次增大,则第一电离能由大到小的顺序为 。
20.(2024山东临沂二中月考)、、、、 是原子序数依次增大的前四周期元素,
其元素性质或结构如下:
元素 元素性质或原子结构
电子只有一种自旋取向
核外只有一个未成对电子,且电子有三种空间运动状态
轨道电子数比 轨道多一个,且第一电离能大于同周期相邻元素
电负性是短周期中最小的
价基态离子能量最高的轨道处于半充满状态
回答下列问题:
(1) 写出元素的名称:____; 元素的元素符号:___。
硼
【解析】 由以上分析可知为B,名称为硼;元素为氮,元素符号为 。
(2) 写出元素基态 价离子的价电子排布式:_____。
【解析】 元素为铁元素,其基态原子的价电子排布式为,故其 价离子的价
电子排布式为 。
(3) 基态 元素原子核外电子占据的最高电子层包含的原子轨道数为___。
9
【解析】 钠的最高电子层为3,该电子层含有、、 三种轨道,分别含有1、3、5
个原子轨道,共9个原子轨道。
(4) 、、可形成强还原性物质,、、 三种元素电负性由大到小的顺序
是____________(用元素符号表示)。
【解析】 钠为活泼金属,其电负性最小,在该化合物中为价,电负性 ,则三
种元素的电负性: 。
(5) 中国的稀土储量世界第一。稀土元素是周期表ⅢB族中原子序数为、
的元素和镧系元素共17种化学元素的统称。其中钪 元素有____种运动状态不同的电
子,最高电子层符号是___;稀土元素分组方法之一是两分法(轻稀土和重稀土)。两
分法分组以(钆)划界的原因是从之后在 亚层上新增加电子的自旋方向改变
了。的价电子排布式为,则其 轨道电子轨道表示式为
_ ___________________________。
21
【解析】 钪有21个电子,根据等式2电子运动状态数 原子核外电子数
目,故有21种运动状态不同的电子,最高电子层是第四层,其符号是。基态 原子
的核外电子排布式为, 轨道电子轨道表示式
为 。
【解析】 、、、、是原子序数依次增大的前四周期元素。 元素
原子中的电子只有一种自旋取向,可知只有1个电子,为; 核外电子有3种空间运
动状态,且只有1个未成对电子,则其核外电子排布式为,为B; 的电负性
是短周期中最小的,为;的轨道电子数比 轨道多一个,第一电离能大于同周期
相邻元素,且的原子序数大于B,小于,则为;的 价基态离子能量最高的轨
道处于半充满状态,则为 。
