第3节 元素性质及其变化规律--2025年高考化学选择性必修第二册(鲁科版)(共48张PPT)
文档属性
| 名称 | 第3节 元素性质及其变化规律--2025年高考化学选择性必修第二册(鲁科版)(共48张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-07 00:00:00 | ||
图片预览









文档简介
(共48张PPT)
第1章 原子结构与元素性质
2025年高考化学一轮复习
选择性必修第二册鲁科版
第3节 元素性质及其变化规律
题型一 微粒半径大小比较与判断
1.(2023山东省实验中学月考)已知、、、 四种离子具有相同的电子层结
构。现有以下排列顺序:、 、
、 。四种元素的原子序数由大到小以及
离子的半径由大到小的顺序分别是( )
A
A.①④ B.①③ C.②③ D.②④
【解析】 原子得到电子形成阴离子,失去电子形成阳离子,设A、B、C、D四种
原子的原子序数分别为、、、,、、、 四种离子具有相同的电子层结
构,即四种离子的核外电子数相同,存在关系 ,则原子
序数: 。四种离子为具有相同电子层结构的简单离子,根据二看核:核
小径大。核外电子排布相同的阴、阳离子,核电荷数越小,粒子半径越大,故离子半
径: 。
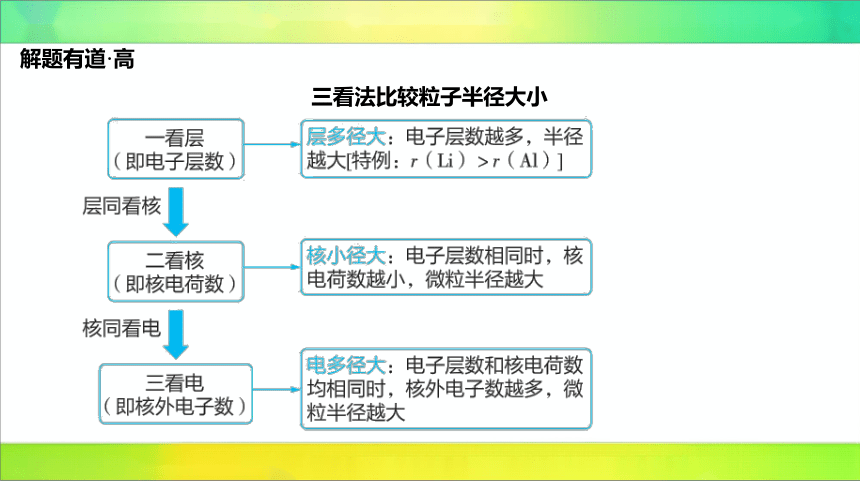
解题有道·高
三看法比较粒子半径大小
1.影响半径的因素:电子层数和核电荷数。电子层数越多,电子离核越远,粒子半径越
大;核电荷数越多,对电子的吸引能力越强,粒子半径越小。二者相互作用,得出半径
规律。
2.因为稀有气体元素与其他元素的原子半径的测定依据不同,一般不将其原子半径与其
他原子的半径相比较。
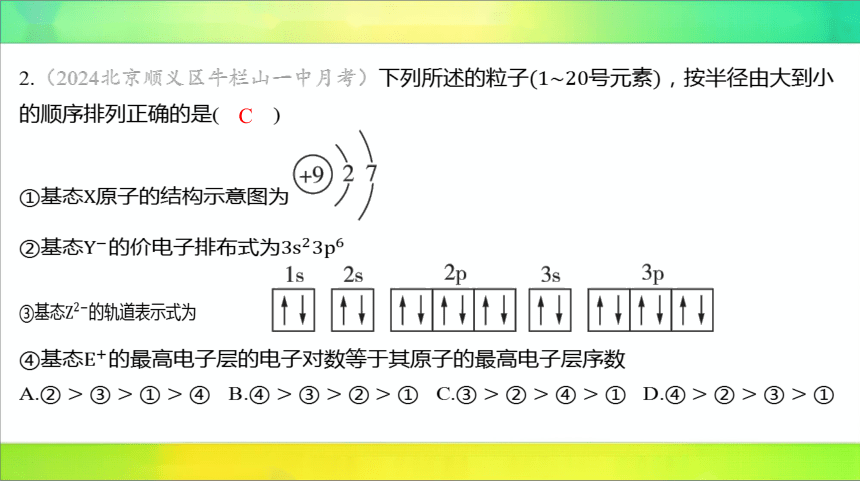
2.(2024北京顺义区牛栏山一中月考)下列所述的粒子号元素 ,按半径由大到小
的顺序排列正确的是( )
C
①基态 原子的结构示意图为
②基态的价电子排布式为
③基态 的轨道表示式为
④基态 的最高电子层的电子对数等于其原子的最高电子层序数
A. B. C. D.
【解析】 ①基态原子的结构示意图为 ,即 的原子序数为9,则
基态原子为 。
②基态的价电子排布式为,最高电子层序数为3,则 位于第3周期,价电子数
为7,则位于第族,故为,为 。
③由基态的轨道表示式知,基态的核外电子数为18,则为 。
④若原子的最高电子层序数为2,则的核外电子排布为 ,电子对数为1,二者不
相等,不符合题意;若原子的最高电子层序数为3, 的最高电子层的电子排布为
,电子对数为4,二者不相等,不符合题意;若原子的最高电子层序数为4,
的最高电子层的电子排布为,电子对数为4,二者相等,符合题意,则为 。
一看层:一般情况下,层多径大。原子核外电子层数为2,、和 的电子
层数均为3,则 的半径最小。二看核:核小径大。电子层排布相同的情况下,原子序数
越小,半径越大,则 ,故半径从大到小的关系为
。
题型二 元素的电离能及其变化规律
3.(2024山东青岛一中月考)下列关于元素电离能的说法不正确的是( )
B
A.钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠
B.因同周期元素的原子半径从左到右逐渐减小,故第一电离能一定依次增大
C.最外层电子排布式为(当时为 )的原子,第一电离能较大
D.对于同一元素而言,原子的电离能
【解析】 钾元素的第一电离能小于钠元素的第一电离能,说明钾失电子能力比钠
的强,所以钾的活泼性强于钠。
同周期元素,原子半径随着原子序数的增大而减小,第一电离能随着
原子序数的增大而呈增大趋势,但有两特例:第ⅡA族 第ⅢA族,第ⅤA族 第 族。
最外层电子排布为(当时为 )的原子达到全充满稳定结构,较难
失去电子,所以其第一电离能较大。
同一元素原子的核电荷数不变,随着失去的电子数增多,其失电子能力就越弱,
需要外力就越大,所以元素的电离能是逐级增大的,即 。
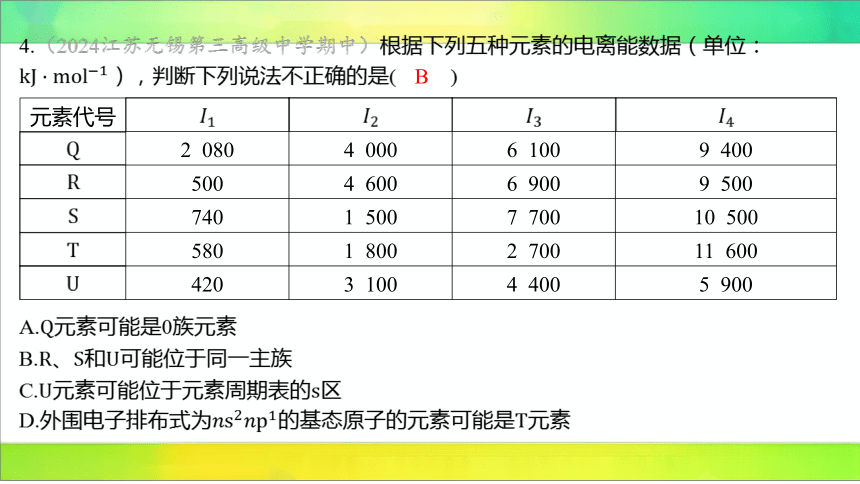
4.(2024江苏无锡第三高级中学期中)根据下列五种元素的电离能数据(单位:
),判断下列说法不正确的是( )
元素代号
2 080 4 000 6 100 9 400
500 4 600 6 900 9 500
740 1 500 7 700 10 500
580 1 800 2 700 11 600
420 3 100 4 400 5 900
B
A. 元素可能是0族元素
B.、和 可能位于同一主族
C.元素可能位于元素周期表的 区
D.外围电子排布式为的基态原子的元素可能是 元素
【解析】 由题表可知,与其他四种元素相比, 的第一电离能很大,
且逐级电离能没有出现剧增情况,则该元素原子不易失去电子,可能为0族元素。
根据同种元素的逐级电离能判断元素化合价:和 的第一电离能较小,第二电离
能剧增,故这两种元素易失去第一个电子,常表现价; 的第一、第二电离能较小,
第三电离能剧增,故易失去前两个电子,常表现价;和 的第一至第四电离能变化
规律相似,即和可能位于同一主族, 不可能与这两种元素位于同一主族。
的第一电离能较小,第二电离能剧增,常表现价,可能位于元素周期表的
区。
根据同种元素的逐级电离能判断元素化合价: 的第一、第二、第三电离能较小,
第四电离能剧增,元素易失去三个电子,常表现价,因此外围电子排布式为
的基态原子可能是 元素。
题型三 元素的电负性及其变化规律
5.(2024湖南郴州月考)下列对电负性的理解不正确的是( )
D
A.电负性是人为规定的一个相对数值,不是绝对标准
B.元素电负性的大小反映了元素原子对键合电子吸引力的大小
C.可在电负性1.8附近寻找半导体材料
D.元素的电负性是元素固有的性质,与原子结构无关
【解析】 电负性是以氟的电负性4.0作为标度计算出来的,是人为规
定的一个相对数值,不是绝对标准。
元素电负性的大小反映了元素原子对键合电子吸引力的大小。
根据两性 ,处于金属与非金属交界处的元素性质比较特殊,可在此处寻找半导
体材料。
一般,同周期,从左到右,主族元素的电负性递增;同主族,从上到下元素的电
负性递减,因此元素的电负性与原子结构有关。
6.(2024北京海淀区期末)元素、、、 的电负性如表所示。其中,最易形成离子
键的两种元素是( )
元素
电负性 3.5 2.5 2.1 0.9
A
A.和 B.和 C.和 D.和
【解析】 当两种元素原子的电负性相差大于1.7时,易形成离子键;
小于1.7时,易形成共价键。根据题给元素电负性数据可知,和 两种元素电负性差值
最大,最易形成离子键。
7.(2024上海松江区月考)8种常见元素的电负性数值如表所示,根据表中数据估算钙
元素的电负性的取值范围( )
元素
电负性 1.2 1.5 1.8 2.1 2.5 3.0 0.8
A
A.在0.8与1.2之间 B.小于0.8 C.大于1.2 D.在0.9与1.5之间
【解析】 元素的电负性越小,元素原子越易失去电子,元素的金属性
越强;元素的电负性越大,元素原子越难失去电子,元素的非金属性越强,金属性越弱。
依据金属活动性顺序表,钙的金属活动性比钾的弱,则钙的电负性大于钾;钙的金属活
动性比镁的强,则钙的电负性小于镁,所以钙的电负性介于钾和镁之间,即在0.8与1.2
之间。
8.[大招6、7](2024上海进才中学期末)下列关于电离能和电负性的说法不正确的是
( )
D
A.同族元素在性质上的相似性,取决于原子价电子排布的相似性
B.通常元素的第一电离能越小,元素的金属性越强
C.根据主族元素逐级电离能的数值可以确定其最高化合价
D.在形成化合物时,元素电负性大的显正价,电负性小的显负价
【解析】 同主族元素原子的最外层电子数相同,由结构决定性质可知,原子价电
子排布的相似性决定同族元素在性质上的相似性。
元素的第一电离能是指气态原子失去1个电子所需要的最低能量,则第一电离能越
小,表示气态时该原子越易失去电子,元素的金属性越强。
对于同一元素来说,失去该元素原子同一电子层上的电子需要的能量相近;失去不
同电子层上的电子需要的能量相差较大,故根据逐级电离能的数值可确定元素原子核外
电子的分层排布情况,主族元素的最高化合价等于其最外层电子数。
利用电负性判断元素化合价:在形成化合物时,元素电负性大的显负
价,电负性小的显正价。
9.(2024浙江舟山检测)和两元素的阳离子具有相同的电子层结构。 元素的阳离子
半径大于元素的阳离子半径。和两元素的原子核外电子层数相同, 元素的原子半
径小于元素的原子半径。则、、 三种元素原子序数的关系是( )
B
A. B. C. D.
【解析】 、两元素的阳离子具有相同的电子层结构, 元素的阳离子半径大于
元素的阳离子半径,根据二看核:核小径大,电子层结构相同的粒子,原子序数越小,
粒子半径越大,则原子序数大小关系为。和 两元素的原子核外电子层数相同,
则二者在同一周期,元素的原子半径小于 元素的原子半径,根据二看核:核小径大,
同周期原子序数越小,原子半径越大,则原子序数大小关系为,所以、、 三种
元素原子序数大小关系为 。
10.[大招6](2024河南许昌期末)下列各组元素,按原子半径依次减小、元素第一电
离能逐渐升高的顺序排列的是( )
B
A.、、C B.、、 C.、、 D.、、
【解析】 、 、C位于同一周期,根据二看核:核小径大,比较原
子半径,原子半径 。同周期,第一电离能按13246570依次增大,则第一电离
能 ,不符合题意。
、、 位于同一主族,根据一看层:一般情况下层多径大,比较原子半径,则
原子半径 。同主族:从上到下,第一电离能依次减小,则第一电离能
,符合题意。
、、 位于同一周期,根据二看核:核小径大,比较原子半径,原子半径
。同周期,第一电离能按13246570依次增大,则第一电离能 ,
不符合题意。
、、 位于同一周期,根据二看核:核小径大,比较原子半径,原子半径
。同周期,第一电离能按13246570依次增大,则第一电离能 ,不符
合题意。
11.[大招5、6、7](2024河北邢台四校联考)雌黄和雄黄 都是自然界
中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒功效也用来入药。下列说法正
确的是( )
C
A.元素属于区 B.电负性:
C.原子半径: D.酸性:
【解析】 为33号元素,价电子排布为,最后填入的能级是
能级,则位于 区。
根据元素在元素周期表中的位置进行判断:越靠近的元素电负性越大。由于 位
于右上方可知,则电负性 。(【另解】(1)找与这两种元素相关的第三种元
素进行比较,如,与 位于同一周期,一般同周期主族元素从左往右,电负性递增,
则电负性;与 位于同一主族,一般同主族元素从上到下,电负性递减,则电负
性,故电负性。(2)根据化合物判断,为价,为 价,结合
显负价的电负性大可知,电负性 )
一看层:一般情况下,层多径大。的电子层数为4, 的电子层数为3,则原子半
径 。
根据电负性判断元素的非金属性,元素的电负性越大,非金属性越强,由B项可知,
电负性,则非金属性 ,元素的最高价氧化物对应水化物的酸性
。
12.[大招6](2024福建三明一中月考)下表列出了某短周期元素 的各级电离能数据
(用、 表示,单位为 )。
……
740 1 500 7 700 10 500 ……
下列关于元素 的判断一定正确的是( )
B
的最高正价为 元素位于元素周期表中第ⅡA族
元素第一电离能大于同周期相邻元素 元素基态原子的电子排布式为
A.①② B.②③ C.③④ D.①④
【解析】 根据逐级电离能数据判断元素化合价: ,说明该原子易失
去2个电子,最高正价为 ,该元素处于第ⅡA族,该元素原子存在第五电离能,说明
其核外电子数目大于4,又为短周期元素,则为 。
①由上述分析知,的最高正价为 ,处于第ⅡA族。
根据同周期,第一电离能存在两特例:第ⅡA族 第ⅢA族,第ⅤA族 第 族。
故 的第一电离能大于其同周期相邻元素。
④为,其基态原子的核外电子排布式为 。
13.[大招5、6、7](2024江苏连云港阶段练习,双选)工业上电解熔融 和冰晶
石 的混合物可制得铝。下列说法正确的是( )
BC
A.电离能: B.电负性:
C.半径: D.碱性:
【解析】 和 位于不同周期不同主族,无法直接比较第一电离能
大小,可找与这两种元素均有联系的第三种元素,与 位于同一主族,同主族,从上
往下,元素的第一电离能呈减小趋势,则第一电离能;与 位于同一周期,同
周期,从左往右,元素的第一电离能呈增大趋势,则第一电离能 ,故电离能
。
一般,同周期从左到右,元素的电负性逐渐增大,故电负性 。
核外电子排布相同时,根据二看核:核小径大可知,离子半径 。
元素金属性越强,其最高价氧化物对应水化物的碱性越强,同周期从左到右,元
素的金属性逐渐减弱,故碱性 。
14.[大招7](2024广东广州二中月考)电负性用来描述不同元素的原子对键合电子吸
引力的大小,是元素的一种基本性质。下表为一些元素的电负性(已知两成键元素间电
负性差值大于1.7时,形成离子键,两成键元素间电负性差值小于1.7时,形成共价键,
且差值越大,键的极性越强)。
元素 B C
电负性 1.0 1.5 2.0 2.5 3.0 4.0 0.9 1.5 1.8 3.0 1.0
下列说法不正确的是( )
C
A.根据电负性变化规律,确定的最小范围为
B.中键的极性比中 键的极性强
C. 是一种可溶性盐,属于离子化合物
D.可以通过测定化合物在熔融状态下是否导电鉴别与
【解析】 同周期(只针对主族元素) 一般,从左到右,元素的电负
性递增,可知电负性,即 。同主族:一般,自上而下,元素
电负性递减除外,可知,即,故 的最小范围应为
。
由已知条件知,两种元素电负性差值越大,键的极性越强。根据题表中数值可
知,与的电负性差值大于与的电负性差值,则中键的极性比 中
键的极性强。
根据已知条件及题表中数值可知,中与的电负性差值为,小于 ,形
成共价键,则 为共价化合物。
是离子化合物,在熔融状态下以离子形式存在,可以导电, 是共价化合物,
熔融状态下不能导电,可以通过测定化合物在熔融状态下是否导电鉴别与 。
15.[大招6、7](2024上海南洋模范中学等级考)电离能是指由气态原子失去电子形
成阳离子需要的能量。从中性原子中失去第一个电子所需要的能量为第一电离能 ,
失去第二个电子所需要的能量为第二电离能,依次类推。如图为 号元素第一电
离能(单位为 )。回答下列问题:
(1) 同主族内不同元素的 变化的特点是______________________________________
___。各主族中 的这种变化特点体现了元素性质________变化规律。
同主族元素从上到下,第一电离能依次减小
周期性
【解析】 根据题图中数据,同主族元素从上到下,第一电离能依次减小。
(2) 同周期内,随原子序数增大,增大。但个别元素的 出现反常,预测下列关系
式中正确的是_____(填标号)。
AC
A. B. C. D.
【解析】 是第ⅤA族元素,(【提醒】也可直接根据价电子排
布式进行判断,基态原子的价电子排布为, 能级半充满,失去一个电子较
难,故第一电离能比同周期相邻元素的大)
根据同周期,随原子序数的递增,第一电离能呈增大趋势,但有两特例:第ⅡA族 第
ⅢA族、第ⅤA族 第族,则第一电离能 。
(3) 解释10号元素 较大的原因:____________________________________________
___________________。
的价电子排布式为,能级全充满,结构稳定,难失去电子
【解析】 10号元素是,基态原子的价电子排布式为, 能级全充满,结构
稳定,难失去电子,所以 的第一电离能较大。
(4) 请估计气态基态 原子失去最外层一个电子所需能量的范围:___________
_______。
【解析】 气态基态原子失去最外层一个电子所需能量即指 的第一电离能,根
据同周期,第一电离能随原子序数的递增呈增大趋势,则 ;同主
族,从上到下,元素的第一电离能减小,则 ;所以其范围是
。
(5) 、 均为第4周期过渡金属元素,两元素的部分电离能数据如表所示:
元素
电离能/ 717 759
1 509 1 561
3 248 2 957
锰元素位于第4周期第族。请写出基态
的价电子排布式:_____,比较两元素的、
可知,气态再失去1个电子比气态 再
失去1个电子难,对此你的解释是 ___________
_________________________________________
_________________________________________
_________________________________________
_________________________________________
__________ 。
由 转
化为时,能级由较稳定的 半充满状
态转变为不稳定的 状态需要的能量较多;
而转化为时,能级由不稳定的
状态转变为较稳定的 半充满状态需要的能
量相对要少
【解析】 为25号元素,基态
的价电子排布式为 ;由
转化为时, 能级由较稳
定的 半充满状态转变为不稳定的
状态需要的能量较多;而 为26
号元素,基态 的价电子排布式为
,转化为时, 能级由
不稳定的状态转变为较稳定的 半充满状态需要的能量相对要少。
(6) 短周期元素中符合“对角线规
则”的元素有和、B和 ,它们的
性质分别有一定的相似性,写出硼酸
加热至 时分解得到相
应氧化物的化学方程式:
__________________________。
【解析】 加热条件下,硅酸分解生成二氧化硅和水,根据对角线规则知,硼酸分解生
成氧化硼和水,反应的化学方程式为 。
16.[大招5、6、7](2024浙江宁波奉化区期末)嫦娥5号
月球探测器带回的月壤样品的元素分析结果如图,下列关于
含量前六位元素的说法正确的是( )
D
A.原子半径:
B.第一电离能:
C.位于元素周期表的 区
D.这六种元素中,电负性最大的是
【解析】 同周期元素,根据二看核:核小
径大,可知原子半径 。
根据同周期:随原子序数的递增,元素的第一电离能呈
增大趋势可知, ;根据同主族:从上到下,
元素的第一电离能依次减小可知, 。
则第一电离能 。
铁元素的原子序数为26,其基态原子的价电子排布式为 ,电子最后填入的
能级是能级,则位于元素周期表的 区。
根据元素在元素周期表中的位置进行判断:越靠近 的电负性越大可知,电负性最
大的是 。
17.[大招6、7](2024上海洋泾中学月考)
元素周期表有多种形式。下面分别是三种不
同形式元素周期表的局部区域。
(1) 图A中,元素的数值越大,则该元素
非金属性
【解析】 观察题图A中数据可知,的数值最大,为 ,且整体数值右上为最大,则题
图A表示元素的电负性。元素的电负性越大,说明该元素的非金属性越强,非金属性强
的单质可以将非金属性弱的单质置换出来,说明、 两元素非金属性强弱的化学方程
式为 。
的__________(填“金属性”或“非金属性”)越强,写出能说明、 两元素该性质强弱的
化学方程式:_______________________。
(2) 根据图B预测,整个元素周期表中位置最低的元素应位于第___周期第____族
(放射性元素除外)。图B所示第2周期主族元素中,某元素该性质反常偏高,则该元
素基态原子核外电子排布式为___________。
6
ⅠA
【解析】 观察题图B可知,同
周期位置高度呈增大趋势,稀有气体元素的
位置较高,且第ⅤA族元素比同周期相邻元
素的位置高,可知题图B描述的是元素的第
一电离能的变化情况。由同周期:第一电离能随原子序数的递增呈增大趋势;同主族:
从上到下,元素的第一电离能依次减小可知,元素第一电离能最小的元素应位于元素周
期表的左下角,除放射性元素外,整个元素周期表中位置最低(第一电离能最小)的元
素应位于第6周期ⅠA族。题图B所示第2周期主族元素中, 元素的第一电离能比同周期
相邻主族的大,的原子核外电子排布式为。(【点拨】的 能级处于半充
满稳定状态,较难失去电子,第一电离能较大)
(3) 图C表示的意义是____________________。
元素在地壳中的含量
【解析】 观察题图C可知,的含量最大,的含量第二, 的含量第三,根据已掌握
的知识可知,题图C表示的是元素在地壳中含量。
(4) 、、、 在元素周期表中的位置如下图所示。
① 铍的最高价氧化物对应的水化物是______(填“酸性”“碱性”或“两性”)化合物,能
证明这一结论的相关离子方程式是______________________________________________
__________________。
两性
、
【解析】 铍与铝位于对角线位置,二者性质相似,由 是两性化合物可知,铍的
最高价氧化物对应的水化物 也是两性化合物,两性化合物与强酸、强碱均能反
应生成盐和水。
② 根据在空气中的燃烧情况, 在空气中燃烧生成的产物为___________(填化学式)。
、
【解析】 和位于对角线位置,化学性质相似,在空气中燃烧生成和 ,
则在空气中燃烧生成和 。
第1章 原子结构与元素性质
2025年高考化学一轮复习
选择性必修第二册鲁科版
第3节 元素性质及其变化规律
题型一 微粒半径大小比较与判断
1.(2023山东省实验中学月考)已知、、、 四种离子具有相同的电子层结
构。现有以下排列顺序:、 、
、 。四种元素的原子序数由大到小以及
离子的半径由大到小的顺序分别是( )
A
A.①④ B.①③ C.②③ D.②④
【解析】 原子得到电子形成阴离子,失去电子形成阳离子,设A、B、C、D四种
原子的原子序数分别为、、、,、、、 四种离子具有相同的电子层结
构,即四种离子的核外电子数相同,存在关系 ,则原子
序数: 。四种离子为具有相同电子层结构的简单离子,根据二看核:核
小径大。核外电子排布相同的阴、阳离子,核电荷数越小,粒子半径越大,故离子半
径: 。
解题有道·高
三看法比较粒子半径大小
1.影响半径的因素:电子层数和核电荷数。电子层数越多,电子离核越远,粒子半径越
大;核电荷数越多,对电子的吸引能力越强,粒子半径越小。二者相互作用,得出半径
规律。
2.因为稀有气体元素与其他元素的原子半径的测定依据不同,一般不将其原子半径与其
他原子的半径相比较。
2.(2024北京顺义区牛栏山一中月考)下列所述的粒子号元素 ,按半径由大到小
的顺序排列正确的是( )
C
①基态 原子的结构示意图为
②基态的价电子排布式为
③基态 的轨道表示式为
④基态 的最高电子层的电子对数等于其原子的最高电子层序数
A. B. C. D.
【解析】 ①基态原子的结构示意图为 ,即 的原子序数为9,则
基态原子为 。
②基态的价电子排布式为,最高电子层序数为3,则 位于第3周期,价电子数
为7,则位于第族,故为,为 。
③由基态的轨道表示式知,基态的核外电子数为18,则为 。
④若原子的最高电子层序数为2,则的核外电子排布为 ,电子对数为1,二者不
相等,不符合题意;若原子的最高电子层序数为3, 的最高电子层的电子排布为
,电子对数为4,二者不相等,不符合题意;若原子的最高电子层序数为4,
的最高电子层的电子排布为,电子对数为4,二者相等,符合题意,则为 。
一看层:一般情况下,层多径大。原子核外电子层数为2,、和 的电子
层数均为3,则 的半径最小。二看核:核小径大。电子层排布相同的情况下,原子序数
越小,半径越大,则 ,故半径从大到小的关系为
。
题型二 元素的电离能及其变化规律
3.(2024山东青岛一中月考)下列关于元素电离能的说法不正确的是( )
B
A.钾元素的第一电离能小于钠元素的第一电离能,故钾的活泼性强于钠
B.因同周期元素的原子半径从左到右逐渐减小,故第一电离能一定依次增大
C.最外层电子排布式为(当时为 )的原子,第一电离能较大
D.对于同一元素而言,原子的电离能
【解析】 钾元素的第一电离能小于钠元素的第一电离能,说明钾失电子能力比钠
的强,所以钾的活泼性强于钠。
同周期元素,原子半径随着原子序数的增大而减小,第一电离能随着
原子序数的增大而呈增大趋势,但有两特例:第ⅡA族 第ⅢA族,第ⅤA族 第 族。
最外层电子排布为(当时为 )的原子达到全充满稳定结构,较难
失去电子,所以其第一电离能较大。
同一元素原子的核电荷数不变,随着失去的电子数增多,其失电子能力就越弱,
需要外力就越大,所以元素的电离能是逐级增大的,即 。
4.(2024江苏无锡第三高级中学期中)根据下列五种元素的电离能数据(单位:
),判断下列说法不正确的是( )
元素代号
2 080 4 000 6 100 9 400
500 4 600 6 900 9 500
740 1 500 7 700 10 500
580 1 800 2 700 11 600
420 3 100 4 400 5 900
B
A. 元素可能是0族元素
B.、和 可能位于同一主族
C.元素可能位于元素周期表的 区
D.外围电子排布式为的基态原子的元素可能是 元素
【解析】 由题表可知,与其他四种元素相比, 的第一电离能很大,
且逐级电离能没有出现剧增情况,则该元素原子不易失去电子,可能为0族元素。
根据同种元素的逐级电离能判断元素化合价:和 的第一电离能较小,第二电离
能剧增,故这两种元素易失去第一个电子,常表现价; 的第一、第二电离能较小,
第三电离能剧增,故易失去前两个电子,常表现价;和 的第一至第四电离能变化
规律相似,即和可能位于同一主族, 不可能与这两种元素位于同一主族。
的第一电离能较小,第二电离能剧增,常表现价,可能位于元素周期表的
区。
根据同种元素的逐级电离能判断元素化合价: 的第一、第二、第三电离能较小,
第四电离能剧增,元素易失去三个电子,常表现价,因此外围电子排布式为
的基态原子可能是 元素。
题型三 元素的电负性及其变化规律
5.(2024湖南郴州月考)下列对电负性的理解不正确的是( )
D
A.电负性是人为规定的一个相对数值,不是绝对标准
B.元素电负性的大小反映了元素原子对键合电子吸引力的大小
C.可在电负性1.8附近寻找半导体材料
D.元素的电负性是元素固有的性质,与原子结构无关
【解析】 电负性是以氟的电负性4.0作为标度计算出来的,是人为规
定的一个相对数值,不是绝对标准。
元素电负性的大小反映了元素原子对键合电子吸引力的大小。
根据两性 ,处于金属与非金属交界处的元素性质比较特殊,可在此处寻找半导
体材料。
一般,同周期,从左到右,主族元素的电负性递增;同主族,从上到下元素的电
负性递减,因此元素的电负性与原子结构有关。
6.(2024北京海淀区期末)元素、、、 的电负性如表所示。其中,最易形成离子
键的两种元素是( )
元素
电负性 3.5 2.5 2.1 0.9
A
A.和 B.和 C.和 D.和
【解析】 当两种元素原子的电负性相差大于1.7时,易形成离子键;
小于1.7时,易形成共价键。根据题给元素电负性数据可知,和 两种元素电负性差值
最大,最易形成离子键。
7.(2024上海松江区月考)8种常见元素的电负性数值如表所示,根据表中数据估算钙
元素的电负性的取值范围( )
元素
电负性 1.2 1.5 1.8 2.1 2.5 3.0 0.8
A
A.在0.8与1.2之间 B.小于0.8 C.大于1.2 D.在0.9与1.5之间
【解析】 元素的电负性越小,元素原子越易失去电子,元素的金属性
越强;元素的电负性越大,元素原子越难失去电子,元素的非金属性越强,金属性越弱。
依据金属活动性顺序表,钙的金属活动性比钾的弱,则钙的电负性大于钾;钙的金属活
动性比镁的强,则钙的电负性小于镁,所以钙的电负性介于钾和镁之间,即在0.8与1.2
之间。
8.[大招6、7](2024上海进才中学期末)下列关于电离能和电负性的说法不正确的是
( )
D
A.同族元素在性质上的相似性,取决于原子价电子排布的相似性
B.通常元素的第一电离能越小,元素的金属性越强
C.根据主族元素逐级电离能的数值可以确定其最高化合价
D.在形成化合物时,元素电负性大的显正价,电负性小的显负价
【解析】 同主族元素原子的最外层电子数相同,由结构决定性质可知,原子价电
子排布的相似性决定同族元素在性质上的相似性。
元素的第一电离能是指气态原子失去1个电子所需要的最低能量,则第一电离能越
小,表示气态时该原子越易失去电子,元素的金属性越强。
对于同一元素来说,失去该元素原子同一电子层上的电子需要的能量相近;失去不
同电子层上的电子需要的能量相差较大,故根据逐级电离能的数值可确定元素原子核外
电子的分层排布情况,主族元素的最高化合价等于其最外层电子数。
利用电负性判断元素化合价:在形成化合物时,元素电负性大的显负
价,电负性小的显正价。
9.(2024浙江舟山检测)和两元素的阳离子具有相同的电子层结构。 元素的阳离子
半径大于元素的阳离子半径。和两元素的原子核外电子层数相同, 元素的原子半
径小于元素的原子半径。则、、 三种元素原子序数的关系是( )
B
A. B. C. D.
【解析】 、两元素的阳离子具有相同的电子层结构, 元素的阳离子半径大于
元素的阳离子半径,根据二看核:核小径大,电子层结构相同的粒子,原子序数越小,
粒子半径越大,则原子序数大小关系为。和 两元素的原子核外电子层数相同,
则二者在同一周期,元素的原子半径小于 元素的原子半径,根据二看核:核小径大,
同周期原子序数越小,原子半径越大,则原子序数大小关系为,所以、、 三种
元素原子序数大小关系为 。
10.[大招6](2024河南许昌期末)下列各组元素,按原子半径依次减小、元素第一电
离能逐渐升高的顺序排列的是( )
B
A.、、C B.、、 C.、、 D.、、
【解析】 、 、C位于同一周期,根据二看核:核小径大,比较原
子半径,原子半径 。同周期,第一电离能按13246570依次增大,则第一电离
能 ,不符合题意。
、、 位于同一主族,根据一看层:一般情况下层多径大,比较原子半径,则
原子半径 。同主族:从上到下,第一电离能依次减小,则第一电离能
,符合题意。
、、 位于同一周期,根据二看核:核小径大,比较原子半径,原子半径
。同周期,第一电离能按13246570依次增大,则第一电离能 ,
不符合题意。
、、 位于同一周期,根据二看核:核小径大,比较原子半径,原子半径
。同周期,第一电离能按13246570依次增大,则第一电离能 ,不符
合题意。
11.[大招5、6、7](2024河北邢台四校联考)雌黄和雄黄 都是自然界
中常见的砷化物,早期都曾用作绘画颜料,因都有抗病毒功效也用来入药。下列说法正
确的是( )
C
A.元素属于区 B.电负性:
C.原子半径: D.酸性:
【解析】 为33号元素,价电子排布为,最后填入的能级是
能级,则位于 区。
根据元素在元素周期表中的位置进行判断:越靠近的元素电负性越大。由于 位
于右上方可知,则电负性 。(【另解】(1)找与这两种元素相关的第三种元
素进行比较,如,与 位于同一周期,一般同周期主族元素从左往右,电负性递增,
则电负性;与 位于同一主族,一般同主族元素从上到下,电负性递减,则电负
性,故电负性。(2)根据化合物判断,为价,为 价,结合
显负价的电负性大可知,电负性 )
一看层:一般情况下,层多径大。的电子层数为4, 的电子层数为3,则原子半
径 。
根据电负性判断元素的非金属性,元素的电负性越大,非金属性越强,由B项可知,
电负性,则非金属性 ,元素的最高价氧化物对应水化物的酸性
。
12.[大招6](2024福建三明一中月考)下表列出了某短周期元素 的各级电离能数据
(用、 表示,单位为 )。
……
740 1 500 7 700 10 500 ……
下列关于元素 的判断一定正确的是( )
B
的最高正价为 元素位于元素周期表中第ⅡA族
元素第一电离能大于同周期相邻元素 元素基态原子的电子排布式为
A.①② B.②③ C.③④ D.①④
【解析】 根据逐级电离能数据判断元素化合价: ,说明该原子易失
去2个电子,最高正价为 ,该元素处于第ⅡA族,该元素原子存在第五电离能,说明
其核外电子数目大于4,又为短周期元素,则为 。
①由上述分析知,的最高正价为 ,处于第ⅡA族。
根据同周期,第一电离能存在两特例:第ⅡA族 第ⅢA族,第ⅤA族 第 族。
故 的第一电离能大于其同周期相邻元素。
④为,其基态原子的核外电子排布式为 。
13.[大招5、6、7](2024江苏连云港阶段练习,双选)工业上电解熔融 和冰晶
石 的混合物可制得铝。下列说法正确的是( )
BC
A.电离能: B.电负性:
C.半径: D.碱性:
【解析】 和 位于不同周期不同主族,无法直接比较第一电离能
大小,可找与这两种元素均有联系的第三种元素,与 位于同一主族,同主族,从上
往下,元素的第一电离能呈减小趋势,则第一电离能;与 位于同一周期,同
周期,从左往右,元素的第一电离能呈增大趋势,则第一电离能 ,故电离能
。
一般,同周期从左到右,元素的电负性逐渐增大,故电负性 。
核外电子排布相同时,根据二看核:核小径大可知,离子半径 。
元素金属性越强,其最高价氧化物对应水化物的碱性越强,同周期从左到右,元
素的金属性逐渐减弱,故碱性 。
14.[大招7](2024广东广州二中月考)电负性用来描述不同元素的原子对键合电子吸
引力的大小,是元素的一种基本性质。下表为一些元素的电负性(已知两成键元素间电
负性差值大于1.7时,形成离子键,两成键元素间电负性差值小于1.7时,形成共价键,
且差值越大,键的极性越强)。
元素 B C
电负性 1.0 1.5 2.0 2.5 3.0 4.0 0.9 1.5 1.8 3.0 1.0
下列说法不正确的是( )
C
A.根据电负性变化规律,确定的最小范围为
B.中键的极性比中 键的极性强
C. 是一种可溶性盐,属于离子化合物
D.可以通过测定化合物在熔融状态下是否导电鉴别与
【解析】 同周期(只针对主族元素) 一般,从左到右,元素的电负
性递增,可知电负性,即 。同主族:一般,自上而下,元素
电负性递减除外,可知,即,故 的最小范围应为
。
由已知条件知,两种元素电负性差值越大,键的极性越强。根据题表中数值可
知,与的电负性差值大于与的电负性差值,则中键的极性比 中
键的极性强。
根据已知条件及题表中数值可知,中与的电负性差值为,小于 ,形
成共价键,则 为共价化合物。
是离子化合物,在熔融状态下以离子形式存在,可以导电, 是共价化合物,
熔融状态下不能导电,可以通过测定化合物在熔融状态下是否导电鉴别与 。
15.[大招6、7](2024上海南洋模范中学等级考)电离能是指由气态原子失去电子形
成阳离子需要的能量。从中性原子中失去第一个电子所需要的能量为第一电离能 ,
失去第二个电子所需要的能量为第二电离能,依次类推。如图为 号元素第一电
离能(单位为 )。回答下列问题:
(1) 同主族内不同元素的 变化的特点是______________________________________
___。各主族中 的这种变化特点体现了元素性质________变化规律。
同主族元素从上到下,第一电离能依次减小
周期性
【解析】 根据题图中数据,同主族元素从上到下,第一电离能依次减小。
(2) 同周期内,随原子序数增大,增大。但个别元素的 出现反常,预测下列关系
式中正确的是_____(填标号)。
AC
A. B. C. D.
【解析】 是第ⅤA族元素,(【提醒】也可直接根据价电子排
布式进行判断,基态原子的价电子排布为, 能级半充满,失去一个电子较
难,故第一电离能比同周期相邻元素的大)
根据同周期,随原子序数的递增,第一电离能呈增大趋势,但有两特例:第ⅡA族 第
ⅢA族、第ⅤA族 第族,则第一电离能 。
(3) 解释10号元素 较大的原因:____________________________________________
___________________。
的价电子排布式为,能级全充满,结构稳定,难失去电子
【解析】 10号元素是,基态原子的价电子排布式为, 能级全充满,结构
稳定,难失去电子,所以 的第一电离能较大。
(4) 请估计气态基态 原子失去最外层一个电子所需能量的范围:___________
_______。
【解析】 气态基态原子失去最外层一个电子所需能量即指 的第一电离能,根
据同周期,第一电离能随原子序数的递增呈增大趋势,则 ;同主
族,从上到下,元素的第一电离能减小,则 ;所以其范围是
。
(5) 、 均为第4周期过渡金属元素,两元素的部分电离能数据如表所示:
元素
电离能/ 717 759
1 509 1 561
3 248 2 957
锰元素位于第4周期第族。请写出基态
的价电子排布式:_____,比较两元素的、
可知,气态再失去1个电子比气态 再
失去1个电子难,对此你的解释是 ___________
_________________________________________
_________________________________________
_________________________________________
_________________________________________
__________ 。
由 转
化为时,能级由较稳定的 半充满状
态转变为不稳定的 状态需要的能量较多;
而转化为时,能级由不稳定的
状态转变为较稳定的 半充满状态需要的能
量相对要少
【解析】 为25号元素,基态
的价电子排布式为 ;由
转化为时, 能级由较稳
定的 半充满状态转变为不稳定的
状态需要的能量较多;而 为26
号元素,基态 的价电子排布式为
,转化为时, 能级由
不稳定的状态转变为较稳定的 半充满状态需要的能量相对要少。
(6) 短周期元素中符合“对角线规
则”的元素有和、B和 ,它们的
性质分别有一定的相似性,写出硼酸
加热至 时分解得到相
应氧化物的化学方程式:
__________________________。
【解析】 加热条件下,硅酸分解生成二氧化硅和水,根据对角线规则知,硼酸分解生
成氧化硼和水,反应的化学方程式为 。
16.[大招5、6、7](2024浙江宁波奉化区期末)嫦娥5号
月球探测器带回的月壤样品的元素分析结果如图,下列关于
含量前六位元素的说法正确的是( )
D
A.原子半径:
B.第一电离能:
C.位于元素周期表的 区
D.这六种元素中,电负性最大的是
【解析】 同周期元素,根据二看核:核小
径大,可知原子半径 。
根据同周期:随原子序数的递增,元素的第一电离能呈
增大趋势可知, ;根据同主族:从上到下,
元素的第一电离能依次减小可知, 。
则第一电离能 。
铁元素的原子序数为26,其基态原子的价电子排布式为 ,电子最后填入的
能级是能级,则位于元素周期表的 区。
根据元素在元素周期表中的位置进行判断:越靠近 的电负性越大可知,电负性最
大的是 。
17.[大招6、7](2024上海洋泾中学月考)
元素周期表有多种形式。下面分别是三种不
同形式元素周期表的局部区域。
(1) 图A中,元素的数值越大,则该元素
非金属性
【解析】 观察题图A中数据可知,的数值最大,为 ,且整体数值右上为最大,则题
图A表示元素的电负性。元素的电负性越大,说明该元素的非金属性越强,非金属性强
的单质可以将非金属性弱的单质置换出来,说明、 两元素非金属性强弱的化学方程
式为 。
的__________(填“金属性”或“非金属性”)越强,写出能说明、 两元素该性质强弱的
化学方程式:_______________________。
(2) 根据图B预测,整个元素周期表中位置最低的元素应位于第___周期第____族
(放射性元素除外)。图B所示第2周期主族元素中,某元素该性质反常偏高,则该元
素基态原子核外电子排布式为___________。
6
ⅠA
【解析】 观察题图B可知,同
周期位置高度呈增大趋势,稀有气体元素的
位置较高,且第ⅤA族元素比同周期相邻元
素的位置高,可知题图B描述的是元素的第
一电离能的变化情况。由同周期:第一电离能随原子序数的递增呈增大趋势;同主族:
从上到下,元素的第一电离能依次减小可知,元素第一电离能最小的元素应位于元素周
期表的左下角,除放射性元素外,整个元素周期表中位置最低(第一电离能最小)的元
素应位于第6周期ⅠA族。题图B所示第2周期主族元素中, 元素的第一电离能比同周期
相邻主族的大,的原子核外电子排布式为。(【点拨】的 能级处于半充
满稳定状态,较难失去电子,第一电离能较大)
(3) 图C表示的意义是____________________。
元素在地壳中的含量
【解析】 观察题图C可知,的含量最大,的含量第二, 的含量第三,根据已掌握
的知识可知,题图C表示的是元素在地壳中含量。
(4) 、、、 在元素周期表中的位置如下图所示。
① 铍的最高价氧化物对应的水化物是______(填“酸性”“碱性”或“两性”)化合物,能
证明这一结论的相关离子方程式是______________________________________________
__________________。
两性
、
【解析】 铍与铝位于对角线位置,二者性质相似,由 是两性化合物可知,铍的
最高价氧化物对应的水化物 也是两性化合物,两性化合物与强酸、强碱均能反
应生成盐和水。
② 根据在空气中的燃烧情况, 在空气中燃烧生成的产物为___________(填化学式)。
、
【解析】 和位于对角线位置,化学性质相似,在空气中燃烧生成和 ,
则在空气中燃烧生成和 。
