1.1 课时3 物质的转化 课件 (共15张PPT)2024-2025学年高一化学人教版(2019)必修一
文档属性
| 名称 | 1.1 课时3 物质的转化 课件 (共15张PPT)2024-2025学年高一化学人教版(2019)必修一 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-07 21:09:08 | ||
图片预览




文档简介
(共15张PPT)
物质的转化
第一章 物质及其变化
1.从宏观上复习物质的分类,理解同一类物质的化学性质的相似性;从微观上体会同一类别物质的化学性质的相似性是由其含有相同微观粒子决定的。
2.根据同类物质具有相似的性质,探究在一定条件下各类物质之间相互转化的基本规律,提高分析问题和解决问题的能力。
3.通过归纳相关物质间的化学反应关系,建立物质转化模型,认识物质的变化规律。
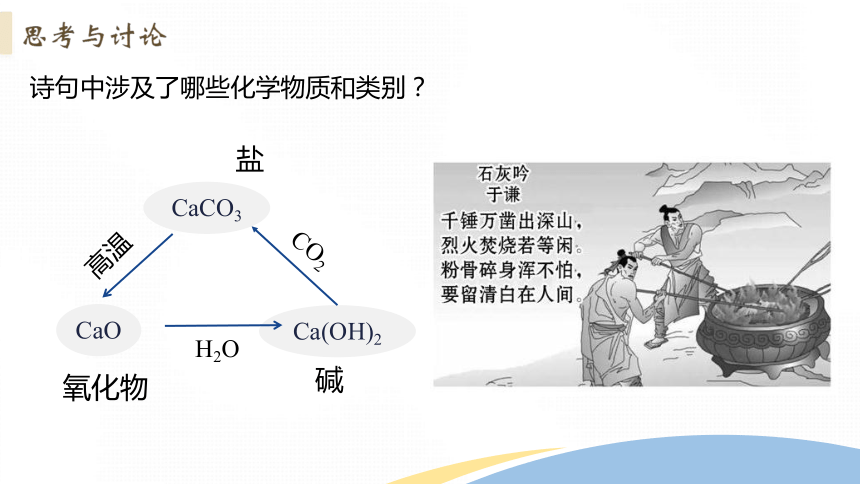
古诗词中蕴含着丰富的化学变化,明朝的诗人于谦的《石灰吟》是一首托物言志诗。作者以石灰作比喻,表达自己为国尽忠、不怕牺牲的意愿和坚守高洁情操的决心。
诗句中涉及了哪些化学物质和类别?
CaCO3
CaO
Ca(OH)2
盐
氧化物
碱
高温
H2O
CO2
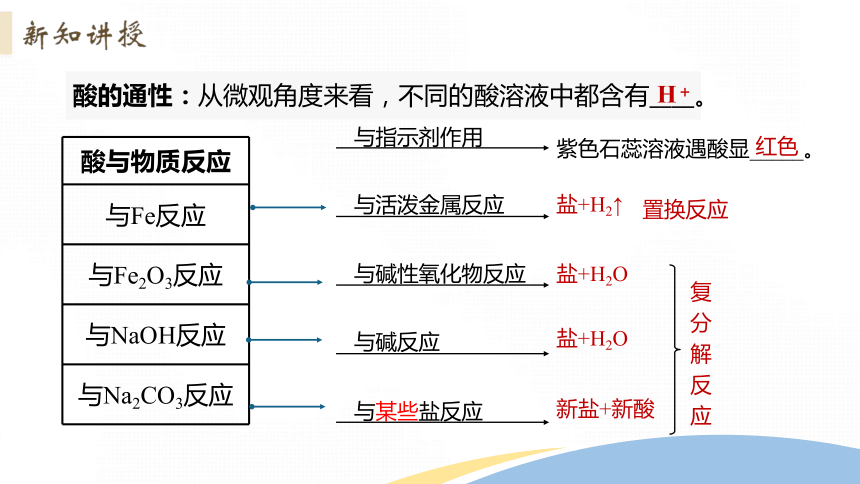
结合教材P10“思考与讨论”,回忆初中所学知识回答酸、碱、盐以及氧化物有哪些通性?请写出下列方程式并归纳
HCl H2SO4
与Fe反应
与Fe2O3反应
与NaOH反应
与Na2CO3反应
2HCl+Fe=FeCl2+H2↑
H2SO4+Fe=FeSO4+H2↑
6HCl+Fe2O3=2FeCl3+3H2O
HCl+NaOH=NaCl+H2O
2HCl+Na2CO3=2NaCl+H2O+CO2↑
3H2SO4+Fe2O3=Fe2(SO4)3+3H2O
H2SO4+2NaOH=Na2SO4+H2O
H2SO4+Na2CO3= Na2SO4 +H2O+CO2↑
与指示剂作用
紫色石蕊溶液遇酸显_____。
红色
置换反应
与活泼金属反应
与碱性氧化物反应
与碱反应
与某些盐反应
盐+H2↑
盐+H2O
盐+H2O
新盐+新酸
复分解反应
酸的通性:从微观角度来看,不同的酸溶液中都含有____。
H+
酸与物质反应
与Fe反应
与Fe2O3反应
与NaOH反应
与Na2CO3反应
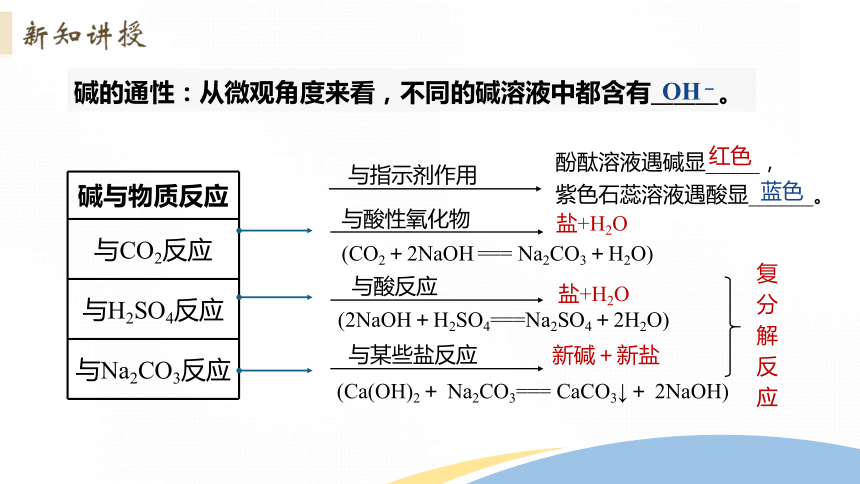
与指示剂作用
酚酞溶液遇碱显_____,
红色
紫色石蕊溶液遇酸显______。
(CO2+2NaOH === Na2CO3+H2O)
与酸反应
与某些盐反应
(2NaOH+H2SO4===Na2SO4+2H2O)
(Ca(OH)2+ Na2CO3=== CaCO3↓+ 2NaOH)
盐+H2O
新碱+新盐
与酸性氧化物
盐+H2O
蓝色
复分解反应
碱的通性:从微观角度来看,不同的碱溶液中都含有______。
OH-
碱与物质反应
与CO2反应
与H2SO4反应
与Na2CO3反应
盐
酸
碱
新盐+新盐
新碱+新盐
新酸+新盐
复分解反应
(Na2CO3+H2SO4===Na2SO4+H2CO3)
CO2↑+H2O
(Na2CO3+Ca(OH)2=== CaCO3 ↓+ 2NaOH)
(Na2CO3+BaCl2=== BaCO3 ↓+ 2NaCl)
盐的通性:从微观角度来看,组成上含有相同阴离子或阳离子。
盐与物质反应
与H2SO4反应
与Ca(OH)2反应
与BaCl2反应
酸性氧化物
碱(易溶)
水
碱性氧化物
酸性氧化物+碱(可溶)→盐+水 CO2+2NaOH=Na2CO3+H2O
酸性氧化物+碱性氧化物→含氧酸盐
易溶于水
SO3+H2O=H2SO4 P2O5+3H2O=2H3PO4
Na2O+SO3=Na2SO4
碱性氧化物
酸
水
酸性氧化物
碱性氧化物+酸→含氧酸盐+水 CuO+2HNO3=Cu(NO3)2+H2O
碱性氧化物+酸性氧化物→含氧酸盐
易溶于水
K2O+H2O=2KOH CaO+H2O=Ca(OH)2
Na2O+SO3=Na2SO4
氧化物的通性
Ca
【阅读课本P10的思考与讨论,完成(1)的化学方程式的书写】
CaO
Ca(OH)2
CaSO4
C
CO2
H2CO3
CaCO3
2Ca+O2=2CaO
CaO+H2O=Ca(OH)2
Ca(OH)2+H2SO4=CaSO4+2H2O
①
②
③
Ca(OH)2+CuSO4=Cu(OH)2↓+CaSO4↓
①
②
③
Ca(OH)2+SO3=CaSO4↓+H2O
C+O2====CO2
CO2+H2O=H2CO3
Ca(OH)2+H2CO3=CaCO3↓+2H2O
CaO+H2CO3=CaCO3+H2O
④
⑤
⑥
Ca+H2CO3= CaCO3+H2↑
④
⑤
⑥
点燃
物质的转化关系:
金属
+O2
金属氧化物
+H2O
碱
盐
非金属
+O2
非金属氧化物
+H2O
酸
盐
盐+水
新碱+新盐
新酸+新盐
两种新盐
盐 + 氢 气
新 盐 + 新 金 属
盐
从物质转化的角度
理解一类物质的转化关系
注意:上述反应规律仅具有一般性,不具有普遍性;反应发生需要的条件。
工业生产
反应进行的可行性
原料来源
成本高低
设备要求
工业生产中制取NaOH ,是怎么做的呢?
2NaCl + 2H2O ==== 2NaOH + H2↑ + Cl2↑
通电
工业上制取NaOH一般不采用Na2O与H2O反应,而主要采用电解饱和食盐水的方法
Na+H2O
Na2O+H2O
安全、产率、污染...
物质的转化
酸的性质
物质的转化及其应用
物理变化和化学变化的判断方法
有无新物质产生
碱的性质
盐的性质
指示剂、金属、金属氧化物、碱、盐
指示剂、酸性氧化物、酸、盐
金属、酸、碱、盐
酸性、碱性氧化物的性质
物质的制备
1.根据所学知识,下列物质不能通过一步反应实现的是( )
A. Fe → FeCl2 B. Fe(OH)2 → Fe(OH)3
C. Fe(OH)3 → FeO D. FeO → FeCl2
解析: Fe(OH)3→FeO不能通过一步反应实现,C符合题意。
C
物质间转化的5个常见易错点
(1)S燃烧不能直接生成SO3而是生成SO2。
(2)Al2O3、SiO2、Fe2O3与H2O不反应,不能直接转化为Al(OH)3、H2SiO3、Fe(OH)3。
(3)NH3催化氧化不能直接生成NO2。
(4)Fe与Cl2反应不能直接生成FeCl2。
(5)Fe与H+、Cu2+、S、I2反应不能直接生成Fe3+。
物质的转化
第一章 物质及其变化
1.从宏观上复习物质的分类,理解同一类物质的化学性质的相似性;从微观上体会同一类别物质的化学性质的相似性是由其含有相同微观粒子决定的。
2.根据同类物质具有相似的性质,探究在一定条件下各类物质之间相互转化的基本规律,提高分析问题和解决问题的能力。
3.通过归纳相关物质间的化学反应关系,建立物质转化模型,认识物质的变化规律。
古诗词中蕴含着丰富的化学变化,明朝的诗人于谦的《石灰吟》是一首托物言志诗。作者以石灰作比喻,表达自己为国尽忠、不怕牺牲的意愿和坚守高洁情操的决心。
诗句中涉及了哪些化学物质和类别?
CaCO3
CaO
Ca(OH)2
盐
氧化物
碱
高温
H2O
CO2
结合教材P10“思考与讨论”,回忆初中所学知识回答酸、碱、盐以及氧化物有哪些通性?请写出下列方程式并归纳
HCl H2SO4
与Fe反应
与Fe2O3反应
与NaOH反应
与Na2CO3反应
2HCl+Fe=FeCl2+H2↑
H2SO4+Fe=FeSO4+H2↑
6HCl+Fe2O3=2FeCl3+3H2O
HCl+NaOH=NaCl+H2O
2HCl+Na2CO3=2NaCl+H2O+CO2↑
3H2SO4+Fe2O3=Fe2(SO4)3+3H2O
H2SO4+2NaOH=Na2SO4+H2O
H2SO4+Na2CO3= Na2SO4 +H2O+CO2↑
与指示剂作用
紫色石蕊溶液遇酸显_____。
红色
置换反应
与活泼金属反应
与碱性氧化物反应
与碱反应
与某些盐反应
盐+H2↑
盐+H2O
盐+H2O
新盐+新酸
复分解反应
酸的通性:从微观角度来看,不同的酸溶液中都含有____。
H+
酸与物质反应
与Fe反应
与Fe2O3反应
与NaOH反应
与Na2CO3反应
与指示剂作用
酚酞溶液遇碱显_____,
红色
紫色石蕊溶液遇酸显______。
(CO2+2NaOH === Na2CO3+H2O)
与酸反应
与某些盐反应
(2NaOH+H2SO4===Na2SO4+2H2O)
(Ca(OH)2+ Na2CO3=== CaCO3↓+ 2NaOH)
盐+H2O
新碱+新盐
与酸性氧化物
盐+H2O
蓝色
复分解反应
碱的通性:从微观角度来看,不同的碱溶液中都含有______。
OH-
碱与物质反应
与CO2反应
与H2SO4反应
与Na2CO3反应
盐
酸
碱
新盐+新盐
新碱+新盐
新酸+新盐
复分解反应
(Na2CO3+H2SO4===Na2SO4+H2CO3)
CO2↑+H2O
(Na2CO3+Ca(OH)2=== CaCO3 ↓+ 2NaOH)
(Na2CO3+BaCl2=== BaCO3 ↓+ 2NaCl)
盐的通性:从微观角度来看,组成上含有相同阴离子或阳离子。
盐与物质反应
与H2SO4反应
与Ca(OH)2反应
与BaCl2反应
酸性氧化物
碱(易溶)
水
碱性氧化物
酸性氧化物+碱(可溶)→盐+水 CO2+2NaOH=Na2CO3+H2O
酸性氧化物+碱性氧化物→含氧酸盐
易溶于水
SO3+H2O=H2SO4 P2O5+3H2O=2H3PO4
Na2O+SO3=Na2SO4
碱性氧化物
酸
水
酸性氧化物
碱性氧化物+酸→含氧酸盐+水 CuO+2HNO3=Cu(NO3)2+H2O
碱性氧化物+酸性氧化物→含氧酸盐
易溶于水
K2O+H2O=2KOH CaO+H2O=Ca(OH)2
Na2O+SO3=Na2SO4
氧化物的通性
Ca
【阅读课本P10的思考与讨论,完成(1)的化学方程式的书写】
CaO
Ca(OH)2
CaSO4
C
CO2
H2CO3
CaCO3
2Ca+O2=2CaO
CaO+H2O=Ca(OH)2
Ca(OH)2+H2SO4=CaSO4+2H2O
①
②
③
Ca(OH)2+CuSO4=Cu(OH)2↓+CaSO4↓
①
②
③
Ca(OH)2+SO3=CaSO4↓+H2O
C+O2====CO2
CO2+H2O=H2CO3
Ca(OH)2+H2CO3=CaCO3↓+2H2O
CaO+H2CO3=CaCO3+H2O
④
⑤
⑥
Ca+H2CO3= CaCO3+H2↑
④
⑤
⑥
点燃
物质的转化关系:
金属
+O2
金属氧化物
+H2O
碱
盐
非金属
+O2
非金属氧化物
+H2O
酸
盐
盐+水
新碱+新盐
新酸+新盐
两种新盐
盐 + 氢 气
新 盐 + 新 金 属
盐
从物质转化的角度
理解一类物质的转化关系
注意:上述反应规律仅具有一般性,不具有普遍性;反应发生需要的条件。
工业生产
反应进行的可行性
原料来源
成本高低
设备要求
工业生产中制取NaOH ,是怎么做的呢?
2NaCl + 2H2O ==== 2NaOH + H2↑ + Cl2↑
通电
工业上制取NaOH一般不采用Na2O与H2O反应,而主要采用电解饱和食盐水的方法
Na+H2O
Na2O+H2O
安全、产率、污染...
物质的转化
酸的性质
物质的转化及其应用
物理变化和化学变化的判断方法
有无新物质产生
碱的性质
盐的性质
指示剂、金属、金属氧化物、碱、盐
指示剂、酸性氧化物、酸、盐
金属、酸、碱、盐
酸性、碱性氧化物的性质
物质的制备
1.根据所学知识,下列物质不能通过一步反应实现的是( )
A. Fe → FeCl2 B. Fe(OH)2 → Fe(OH)3
C. Fe(OH)3 → FeO D. FeO → FeCl2
解析: Fe(OH)3→FeO不能通过一步反应实现,C符合题意。
C
物质间转化的5个常见易错点
(1)S燃烧不能直接生成SO3而是生成SO2。
(2)Al2O3、SiO2、Fe2O3与H2O不反应,不能直接转化为Al(OH)3、H2SiO3、Fe(OH)3。
(3)NH3催化氧化不能直接生成NO2。
(4)Fe与Cl2反应不能直接生成FeCl2。
(5)Fe与H+、Cu2+、S、I2反应不能直接生成Fe3+。
