2024-2025学年高一化学苏教版必修二课时作业 化学能与电能的 转化(含答案)
文档属性
| 名称 | 2024-2025学年高一化学苏教版必修二课时作业 化学能与电能的 转化(含答案) |
|
|
| 格式 | doc | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-09 18:13:08 | ||
图片预览


文档简介
中小学教育资源及组卷应用平台
2024-2025学年高一化学苏教版必修二课时作业 化学能与电能的 转化
一、单选题
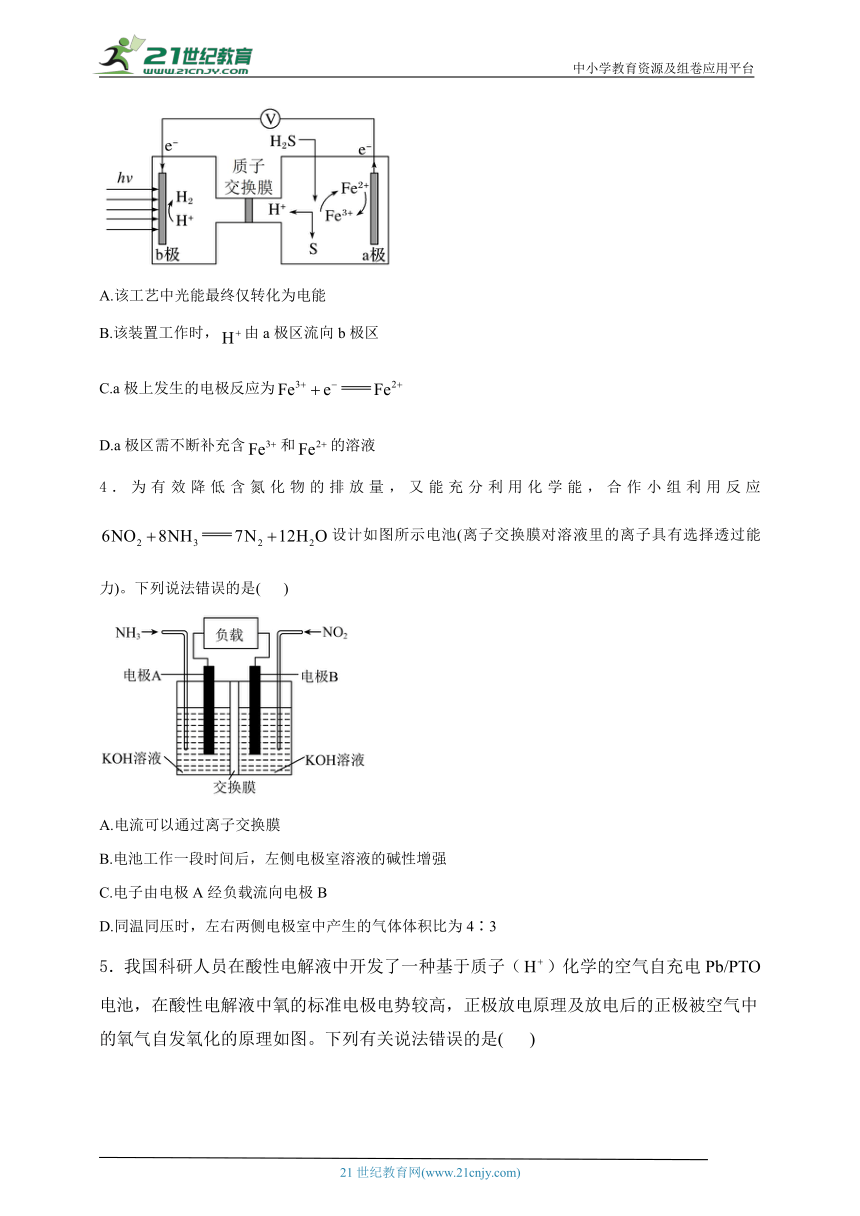
1.如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
A.A是Zn,B是Cu,C为稀硫酸
B.A是Cu,B是Zn,C为稀硫酸
C.A是Fe,B是Ag,C为稀溶液
D.A是Ag,B是Fe,C为稀溶液
2.如下图所示的八个装置中,属于原电池的是( )
A.全部 B.④⑥⑦ C.③④⑤⑥⑦⑧ D.除①②③外
3.我国最近在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是( )
A.该工艺中光能最终仅转化为电能
B.该装置工作时,由a极区流向b极区
C.a极上发生的电极反应为
D.a极区需不断补充含和的溶液
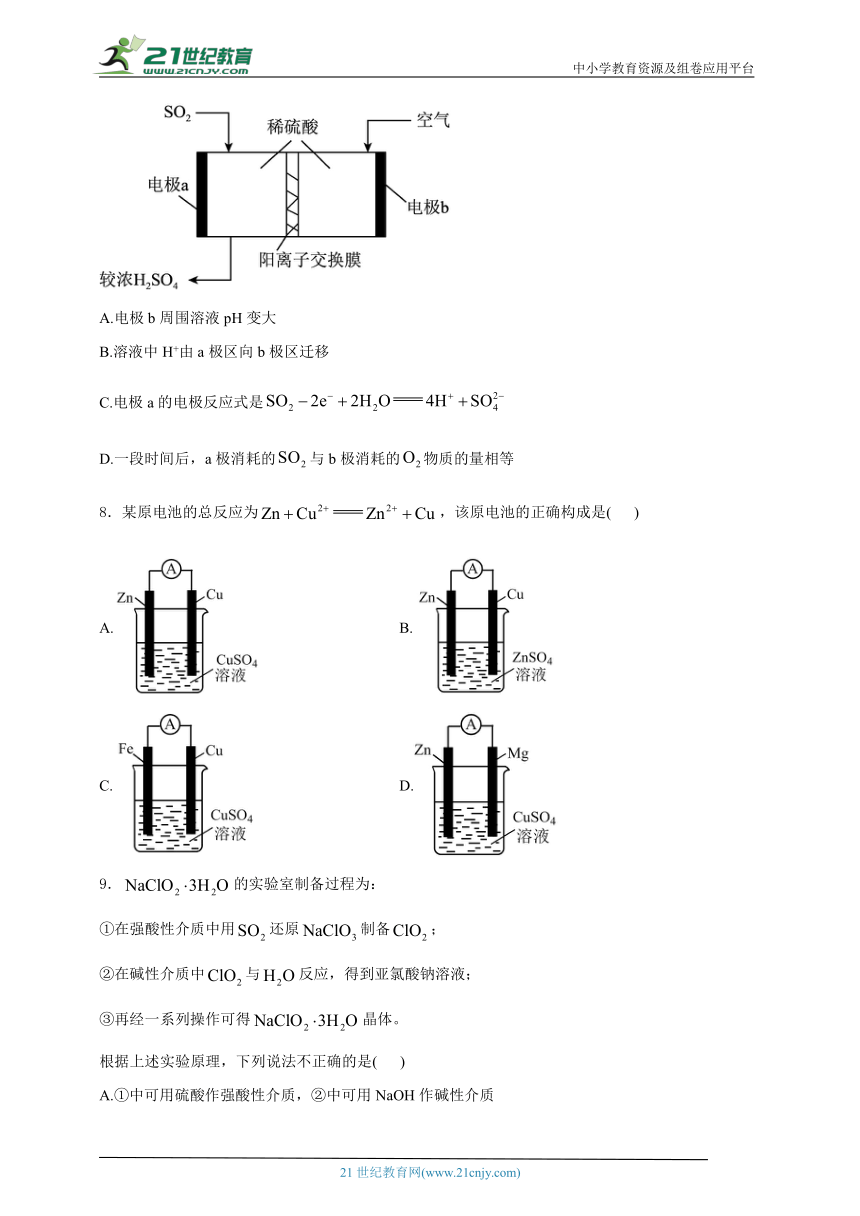
4.为有效降低含氮化物的排放量,又能充分利用化学能,合作小组利用反应设计如图所示电池(离子交换膜对溶液里的离子具有选择透过能力)。下列说法错误的是( )
A.电流可以通过离子交换膜
B.电池工作一段时间后,左侧电极室溶液的碱性增强
C.电子由电极A经负载流向电极B
D.同温同压时,左右两侧电极室中产生的气体体积比为4∶3
5.我国科研人员在酸性电解液中开发了一种基于质子()化学的空气自充电Pb/PTO电池,在酸性电解液中氧的标准电极电势较高,正极放电原理及放电后的正极被空气中的氧气自发氧化的原理如图。下列有关说法错误的是( )
A.该电池的电解质溶液的溶剂可为水
B.放电时,电子移动方向:Pb电极→用电器→PTO电极
C.充电时,Pb电极的电极反应式:
D.放电时,PTO电极的电极反应式:
6.用一种具有“榫卯”结构的双极膜组装的电解池可实现大电流催化电解氯化铵废水,同时制得盐酸和氨水。工作时,在双极膜界面处被催化解离成和,有利于电解反应顺利进行,装置如图所示(M、N均为惰性电极)。下列说法正确的是( )
A.a膜是阳离子交换膜,b膜是阴离子交换膜
B.Ⅰ室生成氨水,Ⅱ室生成盐酸
C.每生成0.1 mol HCl,双极膜处共有解离
D.与平面结构相比,“榫卯”结构双极膜表面积大,更有利于电子通过
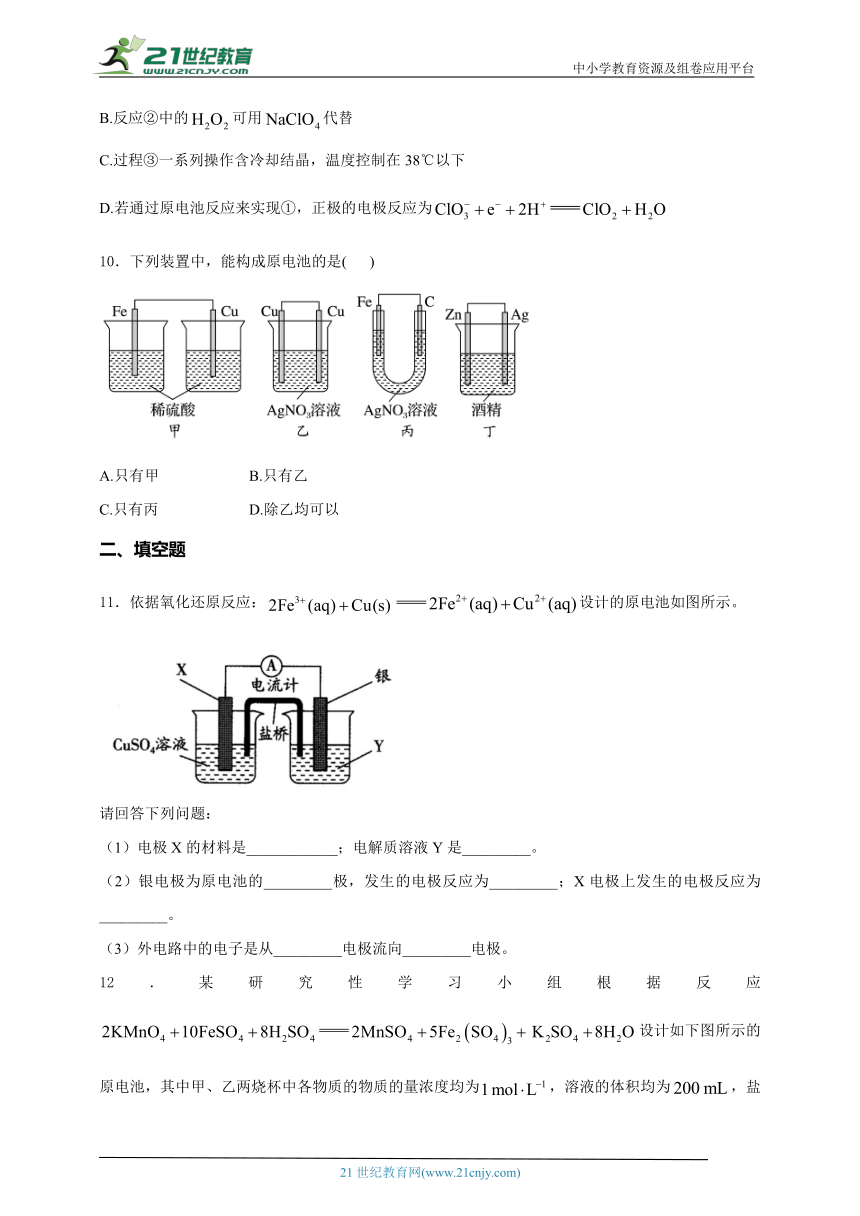
7.热电厂尾气经处理得到较纯的,可用于原电池法生产硫酸。下列说法不正确的是( )
A.电极b周围溶液pH变大
B.溶液中H+由a极区向b极区迁移
C.电极a的电极反应式是
D.一段时间后,a极消耗的与b极消耗的物质的量相等
8.某原电池的总反应为,该原电池的正确构成是( )
A. B.
C. D.
9.的实验室制备过程为:
①在强酸性介质中用还原制备;
②在碱性介质中与反应,得到亚氯酸钠溶液;
③再经一系列操作可得晶体。
根据上述实验原理,下列说法不正确的是( )
A.①中可用硫酸作强酸性介质,②中可用NaOH作碱性介质
B.反应②中的可用代替
C.过程③一系列操作含冷却结晶,温度控制在38℃以下
D.若通过原电池反应来实现①,正极的电极反应为
10.下列装置中,能构成原电池的是( )
A.只有甲 B.只有乙
C.只有丙 D.除乙均可以
二、填空题
11.依据氧化还原反应:设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是____________;电解质溶液Y是_________。
(2)银电极为原电池的_________极,发生的电极反应为_________;X电极上发生的电极反应为_________。
(3)外电路中的电子是从_________电极流向_________电极。
12.某研究性学习小组根据反应设计如下图所示的原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为,溶液的体积均为,盐桥中装有饱和溶液。
回答下列问题。
(1)此原电池的正极是石墨_________(选填“a”或“b”),发生_________反应。
(2)电池工作时,盐桥中的移向_________(选填“甲”或“乙”)烧杯。
(3)两烧杯中的电极反应分别为甲:_________;乙:_________。
(4)若不考虑溶液的体积变化,的浓度由变为时,反应中转移_________mol电子。
13.科学家利用氧化锆锌作催化剂,在一定温度下将和转化为重要有机原料甲醇,其原理为: (即正反应为放热反应)。在容积为2L的恒温密闭容器中,充入和发生上述反应。和的物质的量随时间变化如图所示。回答下列问题:
(1)图中a_____。
(2)0-3min内,的反应速率为_______。
(3)下列叙述正确的是_______(填序号)。
a.3min时的生成速率等于其分解速率
b.由保持不变,可判断该反应达到平衡状态
c.当时,该反应一定达到平衡状态
d.当的体积分数不再变化,可判断该反应达到平衡状态
(4)该温度下达到平衡时,混合气体中的体积分数为________,此时体系压强与开始时的压强之比为_____。
(5)其他条件不变时,下列措施不能使生成的反应速率增大的是_______(填序号)。
a.增大的浓度 b.将容器的容积变为
c.恒容条件下充入一定量 d.将恒温恒容容器改为绝热恒容容器
(6)已知升高温度,平衡向吸热方向移动。降低温度,此反应再次达到平衡时体系中混合气体的平均摩尔质量____(填“增大”“减小”或“不变”)。
(7)燃料电池的工作原理如图所示,a、b均为铂电极,A、B为燃料或氧气入口。
请写出A入口处电极反应方程式____。
三、实验题
14.图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。请回答下列问题:
(1)以下叙述中,正确的是_________________。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液的均增大
D.乙中电子从铜片经导线流向锌片
E.乙溶液中向锌片方向移动
(2)变化过程中能量转化的形式主要是:甲为_________________(填写选项字母)。
A.将化学能转化成热能 B.将电能转化成为化学能 C.将化学能转化成电能
(3)若反应过程中有电子发生转移,则生成的氢气在标况下的体积为________________L。
(4)下列反应可以作为原电池工作时发生的反应的是:_________。
A.
B.
C.
D.
(5)乙中负极电极反应方程式为:___________________________________________________。
参考答案
1.答案:D
解析:该原电池中,A极逐渐变粗,说明A上发生还原反应,A作正极;B极逐渐变细,说明B失电子发生氧化反应,B作负极,则B的活泼性大于A的活泼性,所以排除AC选项;A极逐渐变粗,说明有金属析出,B选项析出氢气不是金属,D选项析出金属银,所以D符合题意;
答案选D。
2.答案:B
解析:根据原电池的构成条件:两个活泼性不同的电极,电解质溶液,闭合电路。
①②③⑧不符合两个活泼性不同的电极,不属于原电池;⑤酒精不属于电解质,不符合电解质溶液的条件,不属于原电池;④⑥⑦符合构成原电池的条件;
故B正确;
3.答案:B
解析:A.该制氢工艺实质是,该制氢工艺中光能最终转化为化学能,A错误;
B.该装置工作时,由b极区放电生成氢气,a极区流向b极区,B正确;
C.a极上发生氧化反应,失电子,所以b极上发生的电极反应为,C错误;
D.a极区涉及两个反应,发生,所以a极区不需要补充含和的溶液,D错误;
故答案为:B。
4.答案:B
解析:A.电流通过离子交换膜才能形成闭合回路,A正确;
B.负极反应式为,消耗氢氧根离子的同时生成水,因此电池工作一段时间后,左侧电极室溶液的碱性减弱,B错误;
C.电极A为负极,电极B为正极,电子从电极A经负载流向电极B,C正确;
D.正极反应式为,负极反应式为,转移相同数量的电子时,正极上产生的气体与负极上产生的气体体积比为3∶4,即左右两侧电极室产生的气体体积比为4∶3,D正确;
故选B。
5.答案:C
解析:该电池的PTO电极通过对吸收/脱离来实现放电/充电,故该电池的电解质溶液的溶剂可为水,A项正确;放电时,Pb电极为负极,PTO电极为正极,电子移动方向为Pb电极→用电器→PTO电极,B项正确;充电时,Pb电极为阴极,发生还原反应,C项错误;放电时,PTO电极为正极,电极反应式为,D项正确。
6.答案:C
解析:电解池中,阳离子向阴极移动、阴离子向阳极移动,氯离子通过a膜进入Ⅰ室,铵根离子通过b膜进入Ⅱ室,可知a膜是阴离子交换膜、b膜是阳离子交换膜,在Ⅰ、Ⅱ两室分别得到盐酸和氨水,错误;生成0.1 mol HCl,Ⅰ室处双极膜有解离、Ⅱ室处双极膜有解离,所以双极膜处共有解离,C正确;与平面结构相比,“榫卯”结构增大双极膜面积,可提高产品生成速率,电子不能进入溶液,故不能通过双极膜,D错误。
7.答案:D
解析:由题干图示可知,电极a作负极,发生的电极反应为:,b电极为正极,发生的电极反应为:,左侧区域产生的经过阳离子交换膜进入右侧区域,据此分析解题。
A.由分析可知,b电极为正极,发生的电极反应为:,则电极b周围溶液pH变大,A正确;
B.由分析可知,溶液中由a极区向b极区迁移,B正确;
C.由分析可知,电极a的电极反应式是,C正确;
D.根据得失电子总数相等可知,一段时间后,a极消耗的与b极消耗的物质的量的2倍,D错误;
故答案为:D。
8.答案:A
解析:由题干某原电池的总反应为可知,Zn在反应中由0价转化为+2价,化合价升高,发生氧化反应,故Zn作负极,在反应中化合价由+2价降低为0价,化合价降低,发生还原反应,故在正极上发生该反应,据此分析解题。
A.由于Zn比Cu活泼,故Zn作负极,Cu为正极,电解质中的被还原,A符合题意;
B.装置中没有自发的发生氧化还原反应,B不合题意;
C.装置中发生的电池总反应为,C不合题意;
D.由于Mg比Zn活泼,故Mg作负极,Zn作正极,D不合题意;
故答案为:A。
9.答案:B
解析:A.①中可用硫酸作强酸性介质,提供氢离子,硫酸根对反应无影响,②中可用NaOH作碱性介质,提供氢氧根离子,钠离子对反应无影响,故A正确;
B.在碱性介质中与反应生成,Cl的化合价由+4价降低为+3价,作还原剂,不能代替过氧化氢,故B错误;
C.过程③一系列操作含冷却结晶,为防止分解,温度应控制在38℃以下,故C正确;
D.用原电池实现反应①,根据原电池工作原理,正极上得电子,化合价降低,即电极反应式为,故D正确;
故选:B。
10.答案:C
解析:甲装置不能构成闭合回路,所以不能形成原电池;
乙装置中电极材料相同,所以不能形成原电池;
丙装置中失电子作负极,氢离子得电子,在正极上发生还原反应,符合原电池的构成条件,所以能形成原电池;
丁装置中酒精为非电解质,该装置中不能发生自发的氧化还原反应,所以不能形成原电池:由上述分析可知,能构成原电池的只有丙,故C正确。
11.答案:(1)铜;[或]溶液
(2)正;;
(3)铜;银
解析:(1)由反应可知,在反应中,Cu被氧化,失电子,应为原电池的负极,因此电极X为铜;在正极上得电子被还原,电极反应为,电解质溶液为[或]溶液。
(2)银为电池的正极,在正极上得电子被还原,电极反应为;X为负极,电极反应为。
(3)原电池中,电子从负极经外电路流向正极,本题中电子由Cu极经外电路流向Ag极。
12.答案:(1)a;还原
(2)乙
(3);
(4)0.5
解析:(1)由题给总反应可知,作氧化剂,发生还原反应,故石墨a是正极。
(2)电池工作时,向负极移动,即向乙烧杯移动。
(3)甲烧杯中的电极发生还原反应,其电极反应为;乙烧杯中的电极发生氧化反应,其电极反应为。
(4)溶液中的的浓度由变为,由于溶液的体积不变,反应过程中生成的的物质的量为,转移的电子的物质的量为。
13.答案:(1)0.25
(2)0.25mol·L-1·min-1
(3)bd
(4)30%;5:8
(5)bc
(6)增大
(7)
解析:根据电子转移的方向,a为负极,b为正极,所以A通入,B为氧气或者空气,A入口处电极反应方程式:。
(1)根据题意,可列“三段式”如下:
a为的平衡物质的量,根据分析得a=0.25;
(2)3min时,参加反应的为0.5mol,则的反应速率为;
(3)a. 3min时,平衡向正方向进行,的生成速率大于其分解速率,a错误;
b.随反应进行,增大,当保持不变时,反应到达平衡,b正确;
c.任意情况下,均存在v,因此不能判断平衡,c错误;
d.的体积分数不再变化说明反应已达平衡,d正确;答案选bd。
(4)①平衡时,水的体积分数
②反应前后的压强之比-气体物质的量之比=气体物质的量之比=;
(5)a.增大反应物浓度,反应速率增大,a正确;
b.增大容器体积,相当于减小压强,反应速率减小,b错误;
c.恒容充入Ne,各物质浓度不变,反应速率不变,c错误;
d.该反应为放热反应,绝热容器中,随反应进行,温度升高,反应速率增大,d正确;故答案选bc。
(6)该反应放热,降低温度,平衡正移,气体的物质的量减小,平均摩尔质量增大;
(7)根据分析可知,A入口处电极反应方程式:
。
14.答案:(1)CE
(2)A
(3)
(4)AD
(5)
解析:(1)A.甲中锌铜没有形成闭合电路,没有构成原电池,故A错误;B.甲中锌铜没有形成闭合电路,甲中铜片表面没有气泡产生,故B错误;C.两烧杯中均发生反应,氢离子浓度降低,溶液的均增大,故C正确;D.已构成原电池,锌是负极、铜是正极,电子从锌片经导线流向铜片,故D错误;E.已构成原电池,锌是负极、铜是正极,乙溶液中向锌片方向移动,故E正确;选CE。
(2)甲没有构成原电池,将化学能转化成热能,选A;乙为原电池,将化学能转化成电能,选C。
(3)根据,Zn元素化合价由0升高为+2,氢元素化合价由+1降低为0,若反应过程中有电子发生转移,反应消耗1molZn、生成1mol氢气,则生成的氢气在标况下的体积为22.4L。
(4)A.是氧化还原反应,有电子转移,可以作为原电池工作时发生的反应,故选A;B.不是氧化还原反应,没有电子转移,不能可以作为原电池工作时发生的反应,故不选B;C.不是氧化还原反应,没有电子转移,不能可以作为原电池工作时发生的反应,故不选C;D.是氧化还原反应,有电子转移,可以作为原电池工作时发生的反应,故选D;选AD。
(5)锌的活泼性大于铜,乙中锌为负极,负极电极反应方程式为。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
2024-2025学年高一化学苏教版必修二课时作业 化学能与电能的 转化
一、单选题
1.如图所示装置,电流表指针发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的( )
A.A是Zn,B是Cu,C为稀硫酸
B.A是Cu,B是Zn,C为稀硫酸
C.A是Fe,B是Ag,C为稀溶液
D.A是Ag,B是Fe,C为稀溶液
2.如下图所示的八个装置中,属于原电池的是( )
A.全部 B.④⑥⑦ C.③④⑤⑥⑦⑧ D.除①②③外
3.我国最近在太阳能光电催化-化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说法正确的是( )
A.该工艺中光能最终仅转化为电能
B.该装置工作时,由a极区流向b极区
C.a极上发生的电极反应为
D.a极区需不断补充含和的溶液
4.为有效降低含氮化物的排放量,又能充分利用化学能,合作小组利用反应设计如图所示电池(离子交换膜对溶液里的离子具有选择透过能力)。下列说法错误的是( )
A.电流可以通过离子交换膜
B.电池工作一段时间后,左侧电极室溶液的碱性增强
C.电子由电极A经负载流向电极B
D.同温同压时,左右两侧电极室中产生的气体体积比为4∶3
5.我国科研人员在酸性电解液中开发了一种基于质子()化学的空气自充电Pb/PTO电池,在酸性电解液中氧的标准电极电势较高,正极放电原理及放电后的正极被空气中的氧气自发氧化的原理如图。下列有关说法错误的是( )
A.该电池的电解质溶液的溶剂可为水
B.放电时,电子移动方向:Pb电极→用电器→PTO电极
C.充电时,Pb电极的电极反应式:
D.放电时,PTO电极的电极反应式:
6.用一种具有“榫卯”结构的双极膜组装的电解池可实现大电流催化电解氯化铵废水,同时制得盐酸和氨水。工作时,在双极膜界面处被催化解离成和,有利于电解反应顺利进行,装置如图所示(M、N均为惰性电极)。下列说法正确的是( )
A.a膜是阳离子交换膜,b膜是阴离子交换膜
B.Ⅰ室生成氨水,Ⅱ室生成盐酸
C.每生成0.1 mol HCl,双极膜处共有解离
D.与平面结构相比,“榫卯”结构双极膜表面积大,更有利于电子通过
7.热电厂尾气经处理得到较纯的,可用于原电池法生产硫酸。下列说法不正确的是( )
A.电极b周围溶液pH变大
B.溶液中H+由a极区向b极区迁移
C.电极a的电极反应式是
D.一段时间后,a极消耗的与b极消耗的物质的量相等
8.某原电池的总反应为,该原电池的正确构成是( )
A. B.
C. D.
9.的实验室制备过程为:
①在强酸性介质中用还原制备;
②在碱性介质中与反应,得到亚氯酸钠溶液;
③再经一系列操作可得晶体。
根据上述实验原理,下列说法不正确的是( )
A.①中可用硫酸作强酸性介质,②中可用NaOH作碱性介质
B.反应②中的可用代替
C.过程③一系列操作含冷却结晶,温度控制在38℃以下
D.若通过原电池反应来实现①,正极的电极反应为
10.下列装置中,能构成原电池的是( )
A.只有甲 B.只有乙
C.只有丙 D.除乙均可以
二、填空题
11.依据氧化还原反应:设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是____________;电解质溶液Y是_________。
(2)银电极为原电池的_________极,发生的电极反应为_________;X电极上发生的电极反应为_________。
(3)外电路中的电子是从_________电极流向_________电极。
12.某研究性学习小组根据反应设计如下图所示的原电池,其中甲、乙两烧杯中各物质的物质的量浓度均为,溶液的体积均为,盐桥中装有饱和溶液。
回答下列问题。
(1)此原电池的正极是石墨_________(选填“a”或“b”),发生_________反应。
(2)电池工作时,盐桥中的移向_________(选填“甲”或“乙”)烧杯。
(3)两烧杯中的电极反应分别为甲:_________;乙:_________。
(4)若不考虑溶液的体积变化,的浓度由变为时,反应中转移_________mol电子。
13.科学家利用氧化锆锌作催化剂,在一定温度下将和转化为重要有机原料甲醇,其原理为: (即正反应为放热反应)。在容积为2L的恒温密闭容器中,充入和发生上述反应。和的物质的量随时间变化如图所示。回答下列问题:
(1)图中a_____。
(2)0-3min内,的反应速率为_______。
(3)下列叙述正确的是_______(填序号)。
a.3min时的生成速率等于其分解速率
b.由保持不变,可判断该反应达到平衡状态
c.当时,该反应一定达到平衡状态
d.当的体积分数不再变化,可判断该反应达到平衡状态
(4)该温度下达到平衡时,混合气体中的体积分数为________,此时体系压强与开始时的压强之比为_____。
(5)其他条件不变时,下列措施不能使生成的反应速率增大的是_______(填序号)。
a.增大的浓度 b.将容器的容积变为
c.恒容条件下充入一定量 d.将恒温恒容容器改为绝热恒容容器
(6)已知升高温度,平衡向吸热方向移动。降低温度,此反应再次达到平衡时体系中混合气体的平均摩尔质量____(填“增大”“减小”或“不变”)。
(7)燃料电池的工作原理如图所示,a、b均为铂电极,A、B为燃料或氧气入口。
请写出A入口处电极反应方程式____。
三、实验题
14.图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计。请回答下列问题:
(1)以下叙述中,正确的是_________________。
A.甲中锌片是负极,乙中铜片是正极
B.两烧杯中铜片表面均有气泡产生
C.两烧杯中溶液的均增大
D.乙中电子从铜片经导线流向锌片
E.乙溶液中向锌片方向移动
(2)变化过程中能量转化的形式主要是:甲为_________________(填写选项字母)。
A.将化学能转化成热能 B.将电能转化成为化学能 C.将化学能转化成电能
(3)若反应过程中有电子发生转移,则生成的氢气在标况下的体积为________________L。
(4)下列反应可以作为原电池工作时发生的反应的是:_________。
A.
B.
C.
D.
(5)乙中负极电极反应方程式为:___________________________________________________。
参考答案
1.答案:D
解析:该原电池中,A极逐渐变粗,说明A上发生还原反应,A作正极;B极逐渐变细,说明B失电子发生氧化反应,B作负极,则B的活泼性大于A的活泼性,所以排除AC选项;A极逐渐变粗,说明有金属析出,B选项析出氢气不是金属,D选项析出金属银,所以D符合题意;
答案选D。
2.答案:B
解析:根据原电池的构成条件:两个活泼性不同的电极,电解质溶液,闭合电路。
①②③⑧不符合两个活泼性不同的电极,不属于原电池;⑤酒精不属于电解质,不符合电解质溶液的条件,不属于原电池;④⑥⑦符合构成原电池的条件;
故B正确;
3.答案:B
解析:A.该制氢工艺实质是,该制氢工艺中光能最终转化为化学能,A错误;
B.该装置工作时,由b极区放电生成氢气,a极区流向b极区,B正确;
C.a极上发生氧化反应,失电子,所以b极上发生的电极反应为,C错误;
D.a极区涉及两个反应,发生,所以a极区不需要补充含和的溶液,D错误;
故答案为:B。
4.答案:B
解析:A.电流通过离子交换膜才能形成闭合回路,A正确;
B.负极反应式为,消耗氢氧根离子的同时生成水,因此电池工作一段时间后,左侧电极室溶液的碱性减弱,B错误;
C.电极A为负极,电极B为正极,电子从电极A经负载流向电极B,C正确;
D.正极反应式为,负极反应式为,转移相同数量的电子时,正极上产生的气体与负极上产生的气体体积比为3∶4,即左右两侧电极室产生的气体体积比为4∶3,D正确;
故选B。
5.答案:C
解析:该电池的PTO电极通过对吸收/脱离来实现放电/充电,故该电池的电解质溶液的溶剂可为水,A项正确;放电时,Pb电极为负极,PTO电极为正极,电子移动方向为Pb电极→用电器→PTO电极,B项正确;充电时,Pb电极为阴极,发生还原反应,C项错误;放电时,PTO电极为正极,电极反应式为,D项正确。
6.答案:C
解析:电解池中,阳离子向阴极移动、阴离子向阳极移动,氯离子通过a膜进入Ⅰ室,铵根离子通过b膜进入Ⅱ室,可知a膜是阴离子交换膜、b膜是阳离子交换膜,在Ⅰ、Ⅱ两室分别得到盐酸和氨水,错误;生成0.1 mol HCl,Ⅰ室处双极膜有解离、Ⅱ室处双极膜有解离,所以双极膜处共有解离,C正确;与平面结构相比,“榫卯”结构增大双极膜面积,可提高产品生成速率,电子不能进入溶液,故不能通过双极膜,D错误。
7.答案:D
解析:由题干图示可知,电极a作负极,发生的电极反应为:,b电极为正极,发生的电极反应为:,左侧区域产生的经过阳离子交换膜进入右侧区域,据此分析解题。
A.由分析可知,b电极为正极,发生的电极反应为:,则电极b周围溶液pH变大,A正确;
B.由分析可知,溶液中由a极区向b极区迁移,B正确;
C.由分析可知,电极a的电极反应式是,C正确;
D.根据得失电子总数相等可知,一段时间后,a极消耗的与b极消耗的物质的量的2倍,D错误;
故答案为:D。
8.答案:A
解析:由题干某原电池的总反应为可知,Zn在反应中由0价转化为+2价,化合价升高,发生氧化反应,故Zn作负极,在反应中化合价由+2价降低为0价,化合价降低,发生还原反应,故在正极上发生该反应,据此分析解题。
A.由于Zn比Cu活泼,故Zn作负极,Cu为正极,电解质中的被还原,A符合题意;
B.装置中没有自发的发生氧化还原反应,B不合题意;
C.装置中发生的电池总反应为,C不合题意;
D.由于Mg比Zn活泼,故Mg作负极,Zn作正极,D不合题意;
故答案为:A。
9.答案:B
解析:A.①中可用硫酸作强酸性介质,提供氢离子,硫酸根对反应无影响,②中可用NaOH作碱性介质,提供氢氧根离子,钠离子对反应无影响,故A正确;
B.在碱性介质中与反应生成,Cl的化合价由+4价降低为+3价,作还原剂,不能代替过氧化氢,故B错误;
C.过程③一系列操作含冷却结晶,为防止分解,温度应控制在38℃以下,故C正确;
D.用原电池实现反应①,根据原电池工作原理,正极上得电子,化合价降低,即电极反应式为,故D正确;
故选:B。
10.答案:C
解析:甲装置不能构成闭合回路,所以不能形成原电池;
乙装置中电极材料相同,所以不能形成原电池;
丙装置中失电子作负极,氢离子得电子,在正极上发生还原反应,符合原电池的构成条件,所以能形成原电池;
丁装置中酒精为非电解质,该装置中不能发生自发的氧化还原反应,所以不能形成原电池:由上述分析可知,能构成原电池的只有丙,故C正确。
11.答案:(1)铜;[或]溶液
(2)正;;
(3)铜;银
解析:(1)由反应可知,在反应中,Cu被氧化,失电子,应为原电池的负极,因此电极X为铜;在正极上得电子被还原,电极反应为,电解质溶液为[或]溶液。
(2)银为电池的正极,在正极上得电子被还原,电极反应为;X为负极,电极反应为。
(3)原电池中,电子从负极经外电路流向正极,本题中电子由Cu极经外电路流向Ag极。
12.答案:(1)a;还原
(2)乙
(3);
(4)0.5
解析:(1)由题给总反应可知,作氧化剂,发生还原反应,故石墨a是正极。
(2)电池工作时,向负极移动,即向乙烧杯移动。
(3)甲烧杯中的电极发生还原反应,其电极反应为;乙烧杯中的电极发生氧化反应,其电极反应为。
(4)溶液中的的浓度由变为,由于溶液的体积不变,反应过程中生成的的物质的量为,转移的电子的物质的量为。
13.答案:(1)0.25
(2)0.25mol·L-1·min-1
(3)bd
(4)30%;5:8
(5)bc
(6)增大
(7)
解析:根据电子转移的方向,a为负极,b为正极,所以A通入,B为氧气或者空气,A入口处电极反应方程式:。
(1)根据题意,可列“三段式”如下:
a为的平衡物质的量,根据分析得a=0.25;
(2)3min时,参加反应的为0.5mol,则的反应速率为;
(3)a. 3min时,平衡向正方向进行,的生成速率大于其分解速率,a错误;
b.随反应进行,增大,当保持不变时,反应到达平衡,b正确;
c.任意情况下,均存在v,因此不能判断平衡,c错误;
d.的体积分数不再变化说明反应已达平衡,d正确;答案选bd。
(4)①平衡时,水的体积分数
②反应前后的压强之比-气体物质的量之比=气体物质的量之比=;
(5)a.增大反应物浓度,反应速率增大,a正确;
b.增大容器体积,相当于减小压强,反应速率减小,b错误;
c.恒容充入Ne,各物质浓度不变,反应速率不变,c错误;
d.该反应为放热反应,绝热容器中,随反应进行,温度升高,反应速率增大,d正确;故答案选bc。
(6)该反应放热,降低温度,平衡正移,气体的物质的量减小,平均摩尔质量增大;
(7)根据分析可知,A入口处电极反应方程式:
。
14.答案:(1)CE
(2)A
(3)
(4)AD
(5)
解析:(1)A.甲中锌铜没有形成闭合电路,没有构成原电池,故A错误;B.甲中锌铜没有形成闭合电路,甲中铜片表面没有气泡产生,故B错误;C.两烧杯中均发生反应,氢离子浓度降低,溶液的均增大,故C正确;D.已构成原电池,锌是负极、铜是正极,电子从锌片经导线流向铜片,故D错误;E.已构成原电池,锌是负极、铜是正极,乙溶液中向锌片方向移动,故E正确;选CE。
(2)甲没有构成原电池,将化学能转化成热能,选A;乙为原电池,将化学能转化成电能,选C。
(3)根据,Zn元素化合价由0升高为+2,氢元素化合价由+1降低为0,若反应过程中有电子发生转移,反应消耗1molZn、生成1mol氢气,则生成的氢气在标况下的体积为22.4L。
(4)A.是氧化还原反应,有电子转移,可以作为原电池工作时发生的反应,故选A;B.不是氧化还原反应,没有电子转移,不能可以作为原电池工作时发生的反应,故不选B;C.不是氧化还原反应,没有电子转移,不能可以作为原电池工作时发生的反应,故不选C;D.是氧化还原反应,有电子转移,可以作为原电池工作时发生的反应,故选D;选AD。
(5)锌的活泼性大于铜,乙中锌为负极,负极电极反应方程式为。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
