2024-2025学年高一化学苏教版必修二课时作业 人工合成有机化合物(含答案)
文档属性
| 名称 | 2024-2025学年高一化学苏教版必修二课时作业 人工合成有机化合物(含答案) |

|
|
| 格式 | doc | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-10-09 18:17:48 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2024-2025学年高一化学苏教版必修二课时作业 人工合成有机化合物
一、单选题
1.中国科学院大连化学物理研究所和西湖大学合作合成出一种新的高分子材料(如图所示,硫原子连接的波浪线代表键延长)。下列叙述错误的是( )
A.X中的含氧官能团是酯基
B.X的水解产物之一是
C.Y是线型结构高分子材料,具有热塑性
D.Y在碱性介质中能降解
2.新型材料的不断发展和应用,能够推动新质生产力的提升。下列新型材料主要成分属于有机物的是( )
A.砷化镓太阳能电池 B.形状记忆合金
C.高温结构陶瓷 D.超高分子量聚乙烯纤维
3.我国在科技上不断取得重大成果。下列各项使用的材料属于有机高分子材料的是( )
Ⅰ“福建”舰飞行甲板所用的特种钢材 Ⅱ用于吊装港珠澳大桥的聚乙烯纤维吊绳 Ⅲ“嫦娥六号”探测器使用的砷化镓太阳能电池板 Ⅳ用于海水淡化的三维石墨烯气凝胶材料
A.Ⅰ B.Ⅱ C.Ⅲ D.Ⅳ
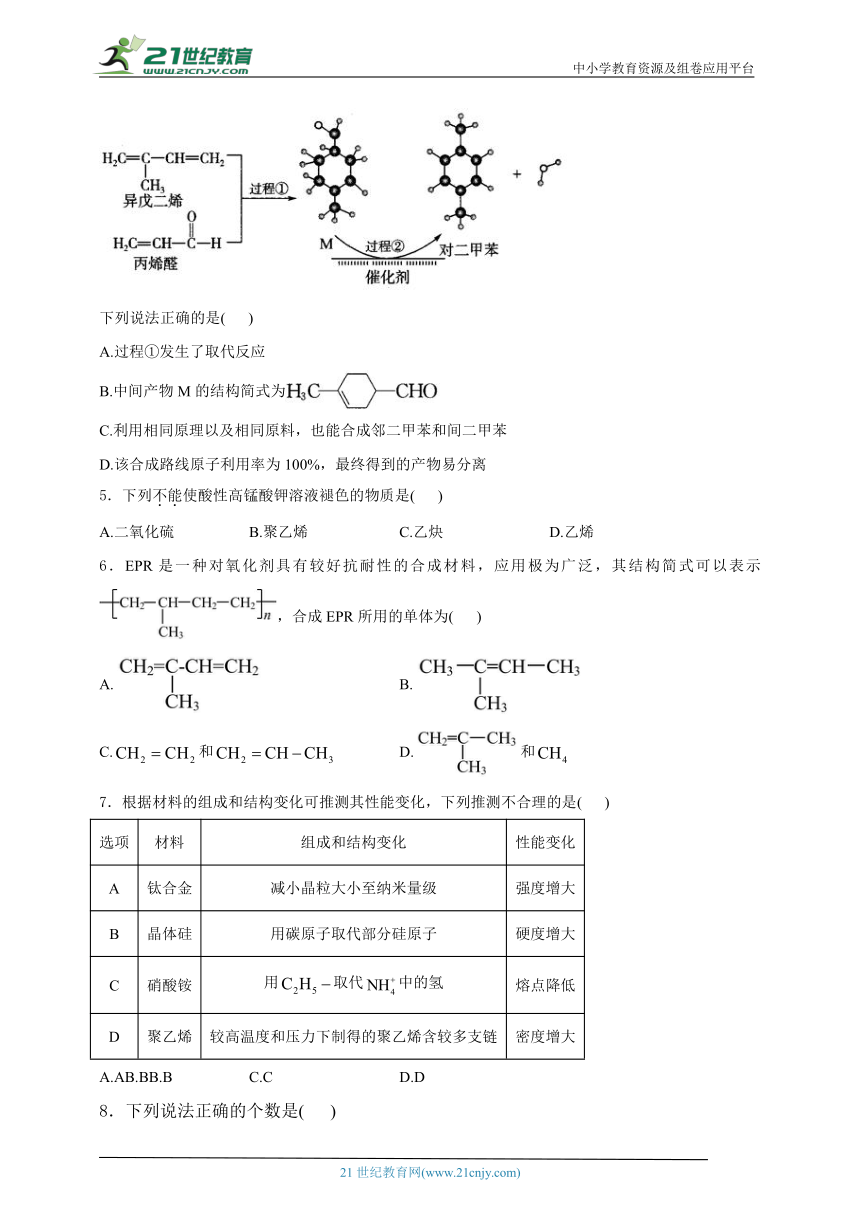
4.我国自主研发对二甲苯的绿色合成路线取得新进展,其合成示意图如图所示。
下列说法正确的是( )
A.过程①发生了取代反应
B.中间产物M的结构简式为
C.利用相同原理以及相同原料,也能合成邻二甲苯和间二甲苯
D.该合成路线原子利用率为100%,最终得到的产物易分离
5.下列不能使酸性高锰酸钾溶液褪色的物质是( )
A.二氧化硫 B.聚乙烯 C.乙炔 D.乙烯
6.EPR是一种对氧化剂具有较好抗耐性的合成材料,应用极为广泛,其结构简式可以表示,合成EPR所用的单体为( )
A. B.
C.和 D.和
7.根据材料的组成和结构变化可推测其性能变化,下列推测不合理的是( )
选项 材料 组成和结构变化 性能变化
A 钛合金 减小晶粒大小至纳米量级 强度增大
B 晶体硅 用碳原子取代部分硅原子 硬度增大
C 硝酸铵 用取代中的氢 熔点降低
D 聚乙烯 较高温度和压力下制得的聚乙烯含较多支链 密度增大
A.AB.BB.B C.C D.D
8.下列说法正确的个数是( )
①含有金属元素的化合物一定是离子化合物
②过氧化钠与水反应,生成氧气转移的电子数为
③根据能否发生丁达尔效应可以将分散系分为溶液、胶体和独液
④聚乙烯分子能使高锰酸钾溶液褪色
⑤冰的密度比水小,是因为水分子之间存在氢键
⑥四氯化碳又叫氯仿
⑦纯碱和烧碱熔化时克服的化学键类型相同
⑧有机玻璃属于传统无机非金属材料
A.2个 B.3个 C.4个 D.5个
9.聚丁二烯(英文缩写为PB)是一种有机物,结构简式为,用于制备轮胎、胶管、胶板等。下列有关聚丁二烯的说法中错误的是( )
A.聚丁二烯属于纯净物
B.聚丁二烯的链节为
C.聚丁二烯的单体为
D.聚丁二烯能使酸性高锰酸钾溶液褪色
10.下列关于各种材料的说法不正确的是( )
A.二氧化硅可用来生产光导纤维,实现光一电转化
B.被誉为“21世纪金属”的钛形成的合金可作为人造骨的材料
C.氧化铁常用作油漆、涂料、油墨和橡胶的红色颜料
D.不粘锅内壁涂敷的聚四氟乙烯,被誉为“塑料王”
二、填空题
11.请按要求回答下列问题:
(1)系统命名为_______;已知手性碳原子是指与四个各不相同原子或基团相连的碳原子,则上述物质中含有的手性碳原子个数为_______。
(2)A的化学式为,已知A只有一种化学环境的氢原子;则A的结构简式为_______。
(3)某烃的分子式为,其能使酸性高锰酸钾溶液褪色,写出该物质生成高分子化合物的反应方程式_______,此反应类型为_______。
(4)1,3-丁二烯与一定量溴水发生加成反应可能生成的产物有_______种(不考虑立体异构),请任写出其中一种的结构简式_______。
12.“以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为)吸收烟气中的,得到亚硫酸钠()粗品。其流程如下。
(1)为加快工业废碱渣中的溶解,可采取的措施是________________(写出一种即可)。
(2)过程①进行的操作是________,若在实验室进行该实验,使用的玻璃仪器除了烧杯和玻璃棒外,还需要________。
(3)上述流程中,加入后,发生反应的化学方程式为________________________________________。
(4)亚硫酸钠粗品中含有少量,原因是______________________________(用化学方程式表示)。
(5)设计实验证明亚硫酸钠粗品含有少量的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,________________________________________________,出现白色沉淀,则证明含有。
(6)具有强还原性,可用于处理酸性废水中的(转化为),写出该反应的离子方程式:________________________________________________。
13.乳酸乙酯是白酒的香气成分之一,广泛用于食品香精。适量添加可增加白酒中酯的浓度,增加白酒的香气,是清香型白酒的主体香成分。乳酸乙酯发生如图变化(已知烃A是衡量一个国家石油化工发展水平的重要标志)
(1)B中含氧官能团的名称是________________;反应②的反应类型是________________。
(2)A分子的空间构型是________________________。
(3)写出下列反应的化学方程式
反应③:________________________________________________________________________________。
反应⑤:________________________________________________________________________________。
(4)C的同系物中,符合下列条件的同分异构体有________种。
ⅰ.含有三个碳原子
ⅱ.与C具有相同的官能团
(5)绿色化学的核心内容之一是“原子经济性”。下列转化符合绿色化学要求的是________(填字母)。
a.乙醇制取乙醛
b.乙烷制备
c.
参考答案
1.答案:C
解析:A.由题干有机物X的结构简式可知,X中的含氧官能团是酯基-COO-,A正确;
B.由题干有机物X的结构简式可知,X分子中的3个酯基完全水解之后可知,X的水解产物之一是,B正确;
C.由题干有机物Y的结构简式可知,Y是体型结构即空间网状结构的高分子材料,不具有热塑性,而具有热固性,C错误;
D.由题干有机物Y的结构简式可知,Y中含有酯基,故Y在碱性介质中能降解,生成小分子物质,D正确;
故答案为:C。
2.答案:D
解析:A.砷化镓是无机物,故A不选;
B.Ti-Ni形状记忆合金是金属材料,故B不选;
C.陶瓷是硅酸盐材料,故C不选;
D.聚乙烯纤维是有机高分子化合物,故D选。
3.答案:B
解析:A.钢材属于金属材料,A错误;
B.聚乙烯纤维属于有机高分子材料,B正确;
C.砷化镓属于无机非金属材料,C错误;
D.石墨烯是由碳原子构成的只有一层原子厚度的二维晶体。因此不属于高分子材料,D错误;
故选择B。
4.答案:B
解析:过程①中,异戊二烯与丙烯醛发生加成反应,生成六元环中间产物M,A错误;通过中间产物M的球棍模型可知,中间产物M的结构简式为,B正确;由题给原料,只能合成两种中间产物:、,故不能合成邻二甲苯,C错误;该合成路线第一步发生加成反应,第二步发生脱水反应,因此第二步的原子利用率不是100%,D错误。
5.答案:B
解析:
A.二氧化硫能使酸性高锰酸钾溶液褪色,二氧化硫被氧化为硫酸根,A不符合题意;
B.聚乙烯没有碳碳双键,不能使酸性高锰酸钾溶液褪色,B符合题意;
C.乙炔含有碳碳三键,能使酸性高锰酸钾溶液褪色,C不符合题意;
D.乙烯含有碳碳双键,能使酸性高锰酸钾溶液褪色,D不符合题意;
故选B。
6.答案:C
解析:此聚合物链节中无双键,则两个碳原子为一组,取链节断开中间的单键后加双键即得高聚物的单体,故C项正确。
7.答案:D
解析:A.纳米晶体在声、光、电、磁、热、熔点、强度等性能上会呈现新的特性,熔点会下降,强度会增强,A正确;
B.用碳原子取代部分硅原子,导致晶体结构改变,硬度会增大,B正确;
C.用取代中的氢后得到离子液体,熔点降低,C正确;
D.较高温度和压力下制得的聚乙烯含较多支链,密度减小,D错误;
故选D。
8.答案:B
解析:①氯化铝是共价化合物,③分散系的分类按粒子的直径大小分类,④聚乙烯无碳碳双键,⑥氯仿是三氯甲烷,⑧有机玻璃是有机高分子材料
9.答案:A
解析:
10.答案:A
解析:芯片的主要成分是高纯硅,实现了光—电转化,光导纤维是传递光的。
11.答案:(1)3,3,6-三甲基辛烷1
(2)
(3)加聚反应
(4) 3;或或
解析:(1)根据烷烃的系统命名法可知,系统命名为3,3,6-三甲基辛烷,已知手性碳原子是指与四个各不相同原子或基团相连的碳原子,则上述物质中含有的手性碳原子个数为1个,如图所示:,故答案为:3,3,6-三甲基辛烷;1;
(2)A的化学式为,已知A只有一种化学环境的氢原子,即分子中的9个H均为等效,则A的结构简式为,故答案为:;
(3)某烃的分子式为,其能使酸性高锰酸钾溶液褪色,说明该化合物含有碳碳双键,则该物质的结构简式为:,故该物质生成高分子化合物的反应方程式为: ,此反应类型为加聚反应,故答案为: ;加聚反应;
(4)1,3-丁二烯与一定量溴水发生加成反应可能生成的产物有:、、共3种,故答案为:3;或或。
12.答案:(1)搅拌(粉碎、加热)
(2)溶解、过滤;漏斗
(3)
(4)
(5)加入过量稀盐酸,再加入溶液
(6)
解析:由流程可知:将工业废碱渣溶于水,过滤可得碳酸钠溶液和废渣,将含有的烟气通入碳酸钠溶液中,形成了亚硫酸氢钠溶液,加入烧碱,与发生反应产生,得到亚硫酸钠溶液,隔绝空气加热浓缩、降温结晶、过滤可得亚硫酸钠粗品。
(1)为加快工业废碱渣中的溶解,可采取的措施是搅拌(粉碎、加热);
(2)由上述分析可知:过程①进行的操作是溶解、过滤;若在实验室进行该实验,使用的玻璃仪器除了烧杯和玻璃棒外,还需要漏斗:
(3)上述流程中,加入后,与发生反应产生、,发生反应的化学方程式为
(4)亚硫酸钠粗品中含有少量,这是由于含价硫的具有较强还原性,易被空气中的氧化产生,反应的化学方程式为
(5)亚硫酸钠粗品中含有少量,设计实验证明亚硫酸钠粗品含有少量的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,加入过量稀盐酸酸化,再加入溶液,若出现白色沉淀,则证明含有;
(6)具有强还原性,可用于处理酸性废水中的(转化为),二者发生氧化还原反应产生、及,根据电子守恒、电荷守恒、原子守恒,可得该反应的离子方程式为。
13.答案:(1)羟基、羧基;加成反应
(2)平面结构;
(3);
(4)2
(5)c
解析:烃A是衡量一个国家化工发展水平的重要标志,则A为乙烯;乳酸乙酯在酸性条件下水解,生成乳酸和乙醇,乙烯与水在催化剂的作用下生成C,则C为乙醇,B为乳酸();乙醇与氧气在铜的催化作用下,生成D为乙醛;乙醛在氧气的催化作用下,生成E为乙酸;乙酸与乳酸在浓硫酸的催化作用下,生成F为,据此分析作答。
(1)B为乳酸(),其中含氧官能团的名称是羟基、羧基;反应②为乙烯与水在催化剂的作用下生成乙醇,反应类型是加成反应。
(2)A为乙烯,空间构型是平面结构。
(3)反应③是乙醇与氧气在铜的催化作用下,生成乙醛,化学方程式为
反应⑤是乙酸与乳酸在浓硫酸的催化作用下,生成和水,化学方程式为
(4)C为乙醇,含有三个碳原子的醇为丙醇,与C具有相同的官能团,则有2种同分异构体
(5)a.乙醇经过催化氧化,生成乙醛和水,原子的理论利用率不是100%,a项不符合题意;
b.乙烷和氯气在光照下生成和,原子的理论利用率不是100%,b项不符合题意;
e.,原子的理论利用率为100%,c项符合题意。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
2024-2025学年高一化学苏教版必修二课时作业 人工合成有机化合物
一、单选题
1.中国科学院大连化学物理研究所和西湖大学合作合成出一种新的高分子材料(如图所示,硫原子连接的波浪线代表键延长)。下列叙述错误的是( )
A.X中的含氧官能团是酯基
B.X的水解产物之一是
C.Y是线型结构高分子材料,具有热塑性
D.Y在碱性介质中能降解
2.新型材料的不断发展和应用,能够推动新质生产力的提升。下列新型材料主要成分属于有机物的是( )
A.砷化镓太阳能电池 B.形状记忆合金
C.高温结构陶瓷 D.超高分子量聚乙烯纤维
3.我国在科技上不断取得重大成果。下列各项使用的材料属于有机高分子材料的是( )
Ⅰ“福建”舰飞行甲板所用的特种钢材 Ⅱ用于吊装港珠澳大桥的聚乙烯纤维吊绳 Ⅲ“嫦娥六号”探测器使用的砷化镓太阳能电池板 Ⅳ用于海水淡化的三维石墨烯气凝胶材料
A.Ⅰ B.Ⅱ C.Ⅲ D.Ⅳ
4.我国自主研发对二甲苯的绿色合成路线取得新进展,其合成示意图如图所示。
下列说法正确的是( )
A.过程①发生了取代反应
B.中间产物M的结构简式为
C.利用相同原理以及相同原料,也能合成邻二甲苯和间二甲苯
D.该合成路线原子利用率为100%,最终得到的产物易分离
5.下列不能使酸性高锰酸钾溶液褪色的物质是( )
A.二氧化硫 B.聚乙烯 C.乙炔 D.乙烯
6.EPR是一种对氧化剂具有较好抗耐性的合成材料,应用极为广泛,其结构简式可以表示,合成EPR所用的单体为( )
A. B.
C.和 D.和
7.根据材料的组成和结构变化可推测其性能变化,下列推测不合理的是( )
选项 材料 组成和结构变化 性能变化
A 钛合金 减小晶粒大小至纳米量级 强度增大
B 晶体硅 用碳原子取代部分硅原子 硬度增大
C 硝酸铵 用取代中的氢 熔点降低
D 聚乙烯 较高温度和压力下制得的聚乙烯含较多支链 密度增大
A.AB.BB.B C.C D.D
8.下列说法正确的个数是( )
①含有金属元素的化合物一定是离子化合物
②过氧化钠与水反应,生成氧气转移的电子数为
③根据能否发生丁达尔效应可以将分散系分为溶液、胶体和独液
④聚乙烯分子能使高锰酸钾溶液褪色
⑤冰的密度比水小,是因为水分子之间存在氢键
⑥四氯化碳又叫氯仿
⑦纯碱和烧碱熔化时克服的化学键类型相同
⑧有机玻璃属于传统无机非金属材料
A.2个 B.3个 C.4个 D.5个
9.聚丁二烯(英文缩写为PB)是一种有机物,结构简式为,用于制备轮胎、胶管、胶板等。下列有关聚丁二烯的说法中错误的是( )
A.聚丁二烯属于纯净物
B.聚丁二烯的链节为
C.聚丁二烯的单体为
D.聚丁二烯能使酸性高锰酸钾溶液褪色
10.下列关于各种材料的说法不正确的是( )
A.二氧化硅可用来生产光导纤维,实现光一电转化
B.被誉为“21世纪金属”的钛形成的合金可作为人造骨的材料
C.氧化铁常用作油漆、涂料、油墨和橡胶的红色颜料
D.不粘锅内壁涂敷的聚四氟乙烯,被誉为“塑料王”
二、填空题
11.请按要求回答下列问题:
(1)系统命名为_______;已知手性碳原子是指与四个各不相同原子或基团相连的碳原子,则上述物质中含有的手性碳原子个数为_______。
(2)A的化学式为,已知A只有一种化学环境的氢原子;则A的结构简式为_______。
(3)某烃的分子式为,其能使酸性高锰酸钾溶液褪色,写出该物质生成高分子化合物的反应方程式_______,此反应类型为_______。
(4)1,3-丁二烯与一定量溴水发生加成反应可能生成的产物有_______种(不考虑立体异构),请任写出其中一种的结构简式_______。
12.“以废治废”是基于“绿色化学”观念治理污染的思路。用工业废碱渣(主要成分为)吸收烟气中的,得到亚硫酸钠()粗品。其流程如下。
(1)为加快工业废碱渣中的溶解,可采取的措施是________________(写出一种即可)。
(2)过程①进行的操作是________,若在实验室进行该实验,使用的玻璃仪器除了烧杯和玻璃棒外,还需要________。
(3)上述流程中,加入后,发生反应的化学方程式为________________________________________。
(4)亚硫酸钠粗品中含有少量,原因是______________________________(用化学方程式表示)。
(5)设计实验证明亚硫酸钠粗品含有少量的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,________________________________________________,出现白色沉淀,则证明含有。
(6)具有强还原性,可用于处理酸性废水中的(转化为),写出该反应的离子方程式:________________________________________________。
13.乳酸乙酯是白酒的香气成分之一,广泛用于食品香精。适量添加可增加白酒中酯的浓度,增加白酒的香气,是清香型白酒的主体香成分。乳酸乙酯发生如图变化(已知烃A是衡量一个国家石油化工发展水平的重要标志)
(1)B中含氧官能团的名称是________________;反应②的反应类型是________________。
(2)A分子的空间构型是________________________。
(3)写出下列反应的化学方程式
反应③:________________________________________________________________________________。
反应⑤:________________________________________________________________________________。
(4)C的同系物中,符合下列条件的同分异构体有________种。
ⅰ.含有三个碳原子
ⅱ.与C具有相同的官能团
(5)绿色化学的核心内容之一是“原子经济性”。下列转化符合绿色化学要求的是________(填字母)。
a.乙醇制取乙醛
b.乙烷制备
c.
参考答案
1.答案:C
解析:A.由题干有机物X的结构简式可知,X中的含氧官能团是酯基-COO-,A正确;
B.由题干有机物X的结构简式可知,X分子中的3个酯基完全水解之后可知,X的水解产物之一是,B正确;
C.由题干有机物Y的结构简式可知,Y是体型结构即空间网状结构的高分子材料,不具有热塑性,而具有热固性,C错误;
D.由题干有机物Y的结构简式可知,Y中含有酯基,故Y在碱性介质中能降解,生成小分子物质,D正确;
故答案为:C。
2.答案:D
解析:A.砷化镓是无机物,故A不选;
B.Ti-Ni形状记忆合金是金属材料,故B不选;
C.陶瓷是硅酸盐材料,故C不选;
D.聚乙烯纤维是有机高分子化合物,故D选。
3.答案:B
解析:A.钢材属于金属材料,A错误;
B.聚乙烯纤维属于有机高分子材料,B正确;
C.砷化镓属于无机非金属材料,C错误;
D.石墨烯是由碳原子构成的只有一层原子厚度的二维晶体。因此不属于高分子材料,D错误;
故选择B。
4.答案:B
解析:过程①中,异戊二烯与丙烯醛发生加成反应,生成六元环中间产物M,A错误;通过中间产物M的球棍模型可知,中间产物M的结构简式为,B正确;由题给原料,只能合成两种中间产物:、,故不能合成邻二甲苯,C错误;该合成路线第一步发生加成反应,第二步发生脱水反应,因此第二步的原子利用率不是100%,D错误。
5.答案:B
解析:
A.二氧化硫能使酸性高锰酸钾溶液褪色,二氧化硫被氧化为硫酸根,A不符合题意;
B.聚乙烯没有碳碳双键,不能使酸性高锰酸钾溶液褪色,B符合题意;
C.乙炔含有碳碳三键,能使酸性高锰酸钾溶液褪色,C不符合题意;
D.乙烯含有碳碳双键,能使酸性高锰酸钾溶液褪色,D不符合题意;
故选B。
6.答案:C
解析:此聚合物链节中无双键,则两个碳原子为一组,取链节断开中间的单键后加双键即得高聚物的单体,故C项正确。
7.答案:D
解析:A.纳米晶体在声、光、电、磁、热、熔点、强度等性能上会呈现新的特性,熔点会下降,强度会增强,A正确;
B.用碳原子取代部分硅原子,导致晶体结构改变,硬度会增大,B正确;
C.用取代中的氢后得到离子液体,熔点降低,C正确;
D.较高温度和压力下制得的聚乙烯含较多支链,密度减小,D错误;
故选D。
8.答案:B
解析:①氯化铝是共价化合物,③分散系的分类按粒子的直径大小分类,④聚乙烯无碳碳双键,⑥氯仿是三氯甲烷,⑧有机玻璃是有机高分子材料
9.答案:A
解析:
10.答案:A
解析:芯片的主要成分是高纯硅,实现了光—电转化,光导纤维是传递光的。
11.答案:(1)3,3,6-三甲基辛烷1
(2)
(3)加聚反应
(4) 3;或或
解析:(1)根据烷烃的系统命名法可知,系统命名为3,3,6-三甲基辛烷,已知手性碳原子是指与四个各不相同原子或基团相连的碳原子,则上述物质中含有的手性碳原子个数为1个,如图所示:,故答案为:3,3,6-三甲基辛烷;1;
(2)A的化学式为,已知A只有一种化学环境的氢原子,即分子中的9个H均为等效,则A的结构简式为,故答案为:;
(3)某烃的分子式为,其能使酸性高锰酸钾溶液褪色,说明该化合物含有碳碳双键,则该物质的结构简式为:,故该物质生成高分子化合物的反应方程式为: ,此反应类型为加聚反应,故答案为: ;加聚反应;
(4)1,3-丁二烯与一定量溴水发生加成反应可能生成的产物有:、、共3种,故答案为:3;或或。
12.答案:(1)搅拌(粉碎、加热)
(2)溶解、过滤;漏斗
(3)
(4)
(5)加入过量稀盐酸,再加入溶液
(6)
解析:由流程可知:将工业废碱渣溶于水,过滤可得碳酸钠溶液和废渣,将含有的烟气通入碳酸钠溶液中,形成了亚硫酸氢钠溶液,加入烧碱,与发生反应产生,得到亚硫酸钠溶液,隔绝空气加热浓缩、降温结晶、过滤可得亚硫酸钠粗品。
(1)为加快工业废碱渣中的溶解,可采取的措施是搅拌(粉碎、加热);
(2)由上述分析可知:过程①进行的操作是溶解、过滤;若在实验室进行该实验,使用的玻璃仪器除了烧杯和玻璃棒外,还需要漏斗:
(3)上述流程中,加入后,与发生反应产生、,发生反应的化学方程式为
(4)亚硫酸钠粗品中含有少量,这是由于含价硫的具有较强还原性,易被空气中的氧化产生,反应的化学方程式为
(5)亚硫酸钠粗品中含有少量,设计实验证明亚硫酸钠粗品含有少量的方案是:在一支试管中,加入少量亚硫酸钠粗品,用适量蒸馏水溶解,加入过量稀盐酸酸化,再加入溶液,若出现白色沉淀,则证明含有;
(6)具有强还原性,可用于处理酸性废水中的(转化为),二者发生氧化还原反应产生、及,根据电子守恒、电荷守恒、原子守恒,可得该反应的离子方程式为。
13.答案:(1)羟基、羧基;加成反应
(2)平面结构;
(3);
(4)2
(5)c
解析:烃A是衡量一个国家化工发展水平的重要标志,则A为乙烯;乳酸乙酯在酸性条件下水解,生成乳酸和乙醇,乙烯与水在催化剂的作用下生成C,则C为乙醇,B为乳酸();乙醇与氧气在铜的催化作用下,生成D为乙醛;乙醛在氧气的催化作用下,生成E为乙酸;乙酸与乳酸在浓硫酸的催化作用下,生成F为,据此分析作答。
(1)B为乳酸(),其中含氧官能团的名称是羟基、羧基;反应②为乙烯与水在催化剂的作用下生成乙醇,反应类型是加成反应。
(2)A为乙烯,空间构型是平面结构。
(3)反应③是乙醇与氧气在铜的催化作用下,生成乙醛,化学方程式为
反应⑤是乙酸与乳酸在浓硫酸的催化作用下,生成和水,化学方程式为
(4)C为乙醇,含有三个碳原子的醇为丙醇,与C具有相同的官能团,则有2种同分异构体
(5)a.乙醇经过催化氧化,生成乙醛和水,原子的理论利用率不是100%,a项不符合题意;
b.乙烷和氯气在光照下生成和,原子的理论利用率不是100%,b项不符合题意;
e.,原子的理论利用率为100%,c项符合题意。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
